Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Plantas Medicinales
versión On-line ISSN 1028-4796
Rev Cubana Plant Med v.14 n.4 Ciudad de la Habana oct.-dic. 2009
ARTÍCULO ORIGINAL
Clasificación toxicológica aguda del fruto seco pulverizado de Morinda citrifolia L. (NONI-C)® en ratas Cenp:SPRD
Acute toxicity classification of powdered dry fruit of Morinda citrifolia L. (NONI-C)® in Cenp:SPRD rats
María Elena Arteaga PérezI; José Luís Pérez AlejoII; Consuelo González TrianaIII; Ana M. Bada BarroI ; Bárbara O. González NavarroIV
I Máster en Ciencias en Toxicología Experimental. Investigadora Auxiliar. Centro de Toxicología Experimental (CETEX). Centro Nacional para la Producción de Animales de Laboratorio (CENPALAB). La Habana, Cuba.
II Doctor en Ciencias. Investigador Titular. Instituto Superior de Medicina Militar "Dr. Luis Díaz Soto". Ciudad de La Habana, Cuba.
III Máster en Ciencias en Química. Investigadora Auxiliar. Centro de Toxicología Experimental (CETEX). Centro Nacional para la Producción de Animales de Laboratorio (CENPALAB). La Habana, Cuba.
IV Doctor en Ciencias en Veterinaria. Investigadora Auxiliar. Centro de Toxicología Experimental (CETEX). Centro Nacional para la Producción de Animales de Laboratorio (CENPALAB). La Habana, Cuba.
RESUMEN
INTRODUCCIÓN: Morinda citrifolia L. se ha usado en la medicina tradicional para reducir dolores crónicos, regular la presión arterial, aliviar dolores artríticos, eliminar tóxicos del organismo, estados de alergias y asma.
OBJETIVOS: clasificar el polvo del fruto seco de M. citrifolia NONI-C® según el método de las clases de toxicidad aguda (CTA).
MÉTODOS: se evaluó el NONI-C® mediante el ensayo de las clases de toxicidad, que permite clasificar la sustancia en un rango de toxicidad. Se utilizaron 6 hembras de la sublínea Cenp:SPRD, procedentes del Centro Nacional para la Producción de Animales de Laboratorio (CENPALAB). Se les administró una dosis única de 2 g de material vegetal seco/kg de peso corporal de NONI-C® por vía oral, previo ayuno. El período de observación fue de 14 d, en el cual se monitorearon las condiciones ambientales diariamente, la aparición de signos de toxicidad y muerte, así como el peso corporal en los días 0, 7 y 14 del ensayo.
RESULTADOS: los animales alcanzaron 100 % de supervivencia. No se observaron signos de toxicidad, tras la administración de la sustancia ensayo en la dosis máxima de 2 g/kg. En la evaluación anatomopatológica no se observaron alteraciones macroscópicas en la superficie externa de los animales y en ninguna de sus cavidades, órganos y tejidos.
CONCLUSIONES: de acuerdo con el método de toxicidad de clases, el producto NONI-C® resultó no clasificado, DL50 aguda es mayor que 2 g/kg.
Palabras clave: clases tóxicas agudas, ratas, Morinda citrifolia.
ABSTRACT
INTRODUCTION: Morinda citrifolia L. has been used in the traditional medicine to reduce the chronic pains, to regulate the blood pressure, to relieve arthritic pains, to eliminate the toxic agents of organism, allergy states and asthma.
OBJECTIVES: to classify the dry fruit powder of M. citrifolia NONI-C®according the different acute toxicity kinds.
METHODS: we used 6 female rats of Cenp:SPRD subspecies from The National Center for the Production of Laboratory Animals (NCPLA). A 2 g single dose of dry vegetal material/kg of body weight of NONI-C® was administered per os before breakfast. Observation period was of 14 days to monitoring the daily environmental conditions, appearance of toxicity signs, and death, as well as the body weight at 0, 7 and 14 days from assay.
RESULTS: animals had a 100 % survival. There were not toxicity signs after assayed substance administration it maximal 2 g/kg dose. In anatomical and pathological evaluation there were neither macroscopic alterations in external surface of animals nor in its cavities, organs and tissues.
CONCLUSIONS: accordint to toxicity kinds method, NONI-C® was not classified, acute DL50 is higher than 2 g/kg.
Key words: acute toxic clases, rats, Morinda citrifolia.
INTRODUCCIÓN
Morinda citrifolia L. (noni) ha llamado la atención de muchos investigadores y científicos al nivel mundial. Estudios realizados confirman las propiedades y cualidades excepcionales, algunas de estas propiedades se supone estén asociadas a la xeronina, que es un alcaloide algo pequeño, fisiológicamente muy activo e importante para el funcionamiento adecuado de las células;1 actúa al nivel celular y tiene un efecto notable sobre el sistema inmunológico al activar enzimas, lo que ha permitido su uso en la medicina tradicional para reducir dolores crónicos, regular la presión arterial, aliviar dolores artríticos y desintoxicar al organismo.2
Estudios de toxicidad aguda por vía oral a un producto obtenido de noni (Juice concentrate®),3 realizados en el Ecuador, demostraron que el noni no produjo toxicidad observable en las ratas de experimentación utilizando un volumen de 20 mL/kg; este estudio demostró la inocuidad del producto.
La realización de un estudio de toxicidad oral a dosis repetida del extracto acuoso de M. citrifolia, tras la administración diaria de 1 000 mg/kg de peso corporal a ratas Sprague Dawley durante 28 d en Cuba, no evidenció alteraciones o modificaciones en el biomodelo experimental que pudieran ser interpretadas como signos tóxicos o de daño biológico.4
En Cuba se elabora a partir de fruto de noni un nuevo producto denominado NONI-C® (polvo), por lo que resulta de vital importancia efectuar los ensayos toxicológicos preclínicos para evaluar los posibles efectos adversos que pueda ocasionar su consumo. Para tener un producto en el mercado es necesario realizar diferentes estudios, dentro de los que se incluyen los estudios toxicológicos que determinan la seguridad de su uso.5
El objetivo de este ensayo fue clasificar al NONI-C® según el método de las clases de toxicidad aguda.
MÉTODOS
Sustancia ensayo
Morinda citrifolia L. (noni) se recolectó en la Agropecuaria el MININT y de las FAR, Ciudad de La Habana. Un ejemplar de la especie se conserva en el Herbario del Jardín Botánico Nacional con el número HAJB-8603019.
El procesamiento del fruto del noni se realizó en la Planta Procesadora Especial Carretera del Dique s/n, Rotonda Naval, Habana del Este.6 Este fruto es sometido a un proceso de secado al sol, colocándolos sobre mesas o tendales durante 4 a 5 d, el producto seco se fragmenta y pulveriza. Se presenta en frascos plásticos PEAD 250 mL con cierre hermético, contienen 90 g del producto NONI-C® con color carmelita y olor característico, sólidos totales 94,82 %, pH de una solución a 10 %: 3,91, pH de una solución a 1 %: 4,08, temperatura de conservación: 25 y 34 ºC.
Animales
Se empleó un lote de 6 ratas hembras Cenp:SPRD de 5 a 6 semanas de edad, peso entre 140 y 150 g; la diferencia de peso entre los animales no excedió ± 20 % del valor promedio, con su correspondiente certificado de salud procedente del Centro Nacional para la Producción de Animales de Laboratorio (CENPALAB, La Habana, Cuba). Los animales se alojaron individualmente en cajas plásticas de policarbonato (makrolón) TECNIPLAST7 tipo T4, mantenidos en condiciones ambientales controladas (temperatura 20,6 ± 1,8 ºC, humedad relativa 59,8 ± 5,2 % y fotoperíodo 12 x 12 h luz/oscuridad), cumplieron un período de readaptación de 5 d.8 Se alimentaron con la fórmula peletizada EMO:1002® y agua, ambos esterilizados y suministrados a voluntad. La identificación de los animales se realizó mediante tarjetas, con un número único para cada animal.
Método de las clases de toxicidad aguda
El ensayo se realizó según lo establecido en la Organización para la Cooperación y el Desarrollo Económico (OCDE)9 y lo determinado en las Buenas Prácticas de Laboratorio.10 El producto NONI-C® se administró por vía oral mediante intubación intragástrica, utilizando una cánula curva metálica, previo ayuno de los animales antes de la administración de la sustancia, en dosis única de 2 g de material vegetal seco/kg.
Observaciones
Los animales se observaron de forma individual luego de 4 h de la administración, teniendo especial atención los primeros 30 min, y periódicamente durante las primeras 24 h; las observaciones se continuaron efectuando a diario hasta completar los 14 d. Se registraron a diario los signos clínicos, así como el peso individual de los animales en los días 0, 7 y 14 del ensayo.
Signos de toxicidad
Las observaciones incluyeron con especial atención a los signos de temblores, convulsiones, salivación, diarrea, letargo, sueño, coma y muerte.
Examen anatomopatológico
Al culminar el ensayo las ratas fueron sacrificadas por el método de eutanasia de dislocación cervical. Se realizó la necropsia y se procedió a la observación macroscópica de las superficies externas del cuerpo, todos los orificios y cavidades (craneal, torácica y abdominal) y sus contenidos. El estudio fue aprobado por el Comité de Ética Institucional del CENPALAB.
Análisis estadístico
El análisis estadístico se realizó con la ayuda del paquete estadístico SPSS, para un nivel de significación de p< 0,05 en la aceptación e interpretación de los resultados. Se determinó media y desviación estándar de los pesos corporales a los días 0, 7 y 14 del ensayo. Se realizó un ANOVA de una vía para determinar diferencias entre los días experimentales.
RESULTADOS
Los animales alcanzaron 100 % de supervivencia. No se observaron signos de toxicidad, tras la administración del producto en la dosis máxima de 2 g/kg.
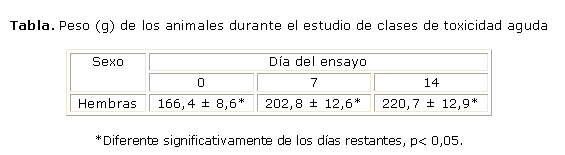
Los valores de peso corporal obtenidos en los días 0, 7 y 14 del ensayo se exponen en la tabla.
En la evaluación anatomopatológica no se observaron alteraciones macroscópicas en la superficie externa de los animales y en ninguna de sus cavidades, órganos y tejidos.
DISCUSIÓN
El amplio uso del noni ha permitido evaluar su utilización como suplemento nutritivo, con elevados niveles de sustancias que estimulan el sistema inmunológico.2 El conocimiento de su composición química y sus efectos avalan la inocuidad, dada por los ensayos farmacológicos tanto in vitro como in vivo, y los ensayos clínicos; de esta forma queda atrás el uso que se ha venido haciendo de una forma empírica y basada en la tradición de las especies vegetales.11,12
El peso corporal es un parámetro de gran valor en la evaluación toxicológica de una sustancia y su disminución pudiera considerarse como un efecto de toxicidad al organismo. Este indicador en el estudio mostró estadísticamente diferencias entre los días del ensayo, con una tendencia al aumento continuo; tuvo un comportamiento similar a lo publicado para esta especie,13 lo cual demostró la inocuidad de este producto en ese sentido.
Esto tuvo como fundamento la clasificación mediante el estudio del ensayo de toxicidad de clases (CTA), que reduce el número de animales y la consecuente reducción del número de muertes, lo cual permite clasificar las sustancias dentro de rangos de toxicidad en muy tóxica, tóxica, nociva y no clasificada.9
En este trabajo se muestran los resultados de un estudio toxicológico realizado al polvo elaborado a partir de fruto de noni (NONI-C®), proveniente de una planta de amplia localización y uso tradicional en Cuba; constituye un estudio novedoso porque brinda una información inicial sobre la clasificación del producto. Se puede concluir que el polvo elaborado a partir de fruto de noni (NONI-C®), se encuentra dentro de los rangos de toxicidad, como se reporta en la regulación del método de las clases de toxicidad aguda, que lo clasificó en la categoría 5 (no clasificada).9
REFERENCIAS BIBLIOGRÁFICAS
1. Heinicke R. Scientific Research Studies on Morinda citrifolia (Noni Fruit): Xeronine and Cell Regeneration. 1972 [Cited 20 Ene 2002]. Available in: http://www.geocities.com/Hotsprings /7514/ studies.htm
2. Solomon N. Noni: Nature's Amazing Healer. Woodland Books. 1998 [Cited 7 Ago 2007]. Disponible en: http://www.amazon.com/Noni-Natures-Amazing-Neil-Solomon/dp/1580540368
3. Herrera W. Estudio de la toxicidad aguda por la vía oral del Noni Juice Concentrate procedente de los Laboratorios. Informe Final. Ecuador; Universidad de Guayaquil Facultad de Ciencias Químicas; 2005.
4. Mancebo A, Scull I, González Y, Arteaga ME, González BO, Fuentes D, et al. Ensayo de toxicidad a dosis repetidas (28 días) por vía oral del extracto acuoso de Morinda citrifolia en ratas Sprague Dawley. Rev Toxicol. 2002;19:73-8.
5. Zbinden G. Predictive value of animal studies in toxicology. Regul Toxicol Pharm. 1991;14:167-77.
6. Datos contenidos en Instrucciones a los Proveedores: NONI-C. Ciudad de La Habana: Instituto Superior de Medicina Militar "Dr. Luis Díaz Soto"; 2007.
7. TECNIPLAST. Equipment for small animals. Italy: TECNIPLAST GAZZADAS. a.r.l.; 2000.
8. Guía para el cuidado, uso y reproducción de los animales para la experimentación en el CENPALAB. Edición 01/00. Ciudad de La Habana: CENPALAB; 2000.
9. Organization for Economic Cooperation and Development (OECD). Guidelines for the Testing of Chemicals. Section 4, "Health effects". Nº 423 "Acute Toxic Class Method". Paris; 2001.
10. Principios de las Buenas Prácticas de Laboratorio no Clínico de Seguridad Sanitaria y Medio Ambiental. Buró Regulatorio para la Protección de la Salud Pública. República de Cuba: MINSAP. Regulación 39. 2004.
11. Villar AM. Farmacognosia General. Madrid: Ed. Síntesis; 1999.
12. Bruneton J. Elementos de fitoquímica y farmacognosia. España: Ed. Acribia Zaragoza; 1991.
13. Product Guide Effective Harlan outbred rats Sprague Dawley® TM, Indianapolis, 2006 [Cited 20 Ene 2009]. Disponible en: http://www.harlan.com/research_models_and_services/research_models_by_product_type/outbred_rats
Recibido: 23 de junio de 2009.
Aprobado: 12 de noviembre de 2009.
M. C. María Elena Arteaga Pérez. Centro de Toxicología Experimental (CETEX). Centro Nacional para la Producción de Animales de Laboratorio (CENPALAB). La Habana, Cuba. Correo electrónico: melena@cenpalab.inf.cu