Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Plantas Medicinales
versión On-line ISSN 1028-4796
Rev Cubana Plant Med v.15 n.2 Ciudad de la Habana abr.-jun. 2010
ARTÍCULO ORIGINAL
Actividad antioxidante y contenido de fenoles totales de algunas especies del género Calophyllum
Antioxidant activity and total phenols content from some species of Calophyllum genus
Ana M. Mesa-VanegasI; Carlos A. GaviriaII; Felipe CardonaIII; Jairo A. Sáez-Vega IV; Silvia Blair TrujilloV; Benjamín A. RojanoVI
IQuímica. Grupo de Investigación Malaria. Sede de Investigación Universitaria (SIU). Facultad de Medicina, Universidad de Antioquia. Medellín, Colombia.
IIIngeniero Químico. Grupo de Investigación en Ciencias de los Alimentos. Universidad Nacional Sede Medellín. Medellín, Colombia.
IIIMáster en Ciencias en Sistemática Vegetal. Biólogo. Grupo de Estudios Botánicos. Director Herbario Universidad de Antioquia. Medellín, Colombia
IVDoctor en Ciencias Farmacéuticas. Grupo Química de Plantas Colombianas, Instituto de Química, Universidad de Antioquia. Medellín, Colombia.
VMáster en Ciencias en Historia de la Ciencias. Médica. Grupo de Investigación Malaria. Sede de Investigación Universitaria (SIU). Facultad de Medicina, Universidad de Antioquia. Medellín, Colombia.
VIDoctor en Ciencias Químicas. Laboratorio de Ciencias de los Alimentos. Escuela de Química. Universidad Nacional de Colombia Sede Medellín. Medellín, Colombia.
RESUMEN
INTRODUCCIÓN: la búsqueda de nuevos compuestos antioxidantes naturales ha sido de gran interés para la investigación dado que interrumpen el proceso de oxidación por vía radicalaria de lípidos, proteínas, ADN y enzimas. El género Calophyllum perteneciente a la familia Clusiaceae, produce una gran variedad de metabolitos secundarios con características antioxidantes; los flavonoides, las coumarinas y las xantonas resultan los compuestos más reportados. Las especies de este género pueden ser una fuente de antioxidantes potenciales.
OBJETIVO: determinar la actividad antioxidante de extractos de diferente polaridad de las especies Calophyllum cf. brasiliense Cambess, Calophyllum inophyllum L., Calophyllum sp.
MÉTODOS: se realizó un proceso de extracción del material vegetal por percolación con solventes de diferente polaridad: hexano, diclorometano, acetato de etilo y metanol, se concentró a presión reducida y se monitoreó por cromatografía en capa delgada. La evaluación de la capacidad antioxidante se determinó con diferentes metodologías: fenoles totales, ABTS (2,2-azinobis-[3 etilbenzotiazolin-6-sulfónico]), DPPH (1,1-difenil2-picrilhidracil), FRAP (ferric reducing/antioxidant power) y en algunas muestras seleccionadas ORAC (oxygen radical absorbance capacity).
RESULTADOS: las muestras que contienen compuestos fenólicos con una alta capacidad reductora fueron CBTExtM, CNHTExtM, CRHTExtA, CRHTExtM, CBHExtA y CBHExtM, que además, poseen valores ORAC muy altos comparados con otros sustratos, el extracto que presentó mejores valores fue CBTExtM. La técnica FRAP describe muy bien el fenómeno oxidativo en los extractos CSHTExtA, CBHExtA, CIHTExtM, CSHTExtM y CIHTExtM; en (DPPH•) el extracto que presentó altos valores de TEAC fue CSHTExtA. El extracto CBTExtM presentó los mejores valores de inhibición del radical ABTS.
CONCLUSIONES: los extractos polares y medianamente polares de las tres especies de Calophyllum presentaron alta actividad antioxidante en las metodologías evaluadas.
Palabras clave: actividad antioxidante, radicales libres, Calophyllum.
ABSTRACT
INTRODUCTION: the search of new natural antioxidant compounds has been of great interest for research since they interrupt the oxidation process via radical pathway of lipid, proteins, DNA and enzymes. The Calophyllum genus belongs to Clusiaceae family producing a great variety of secondary metabolites with antioxidant features; the flavonoids, the coumarins and the xanthones are the more reported compounds. The species from this genus may be a potential antioxidant source.
OBJECTIVE: to determine the antioxidant activity of extracts from different polarity of Calophyllum cf. brasiliense Cambess, Calophyllum inophyllum L., Calophyllum sp.
METHODS: a percolation process was carried out from the vegetal material by decoction using solvent of different polarity: hexane, dichloromethane, and ethyl acetate and methanol, concentrated at decreased pressure and monitored by thin layer chromatography (TLC). The antioxidant capacity assessment was determined using different methodologies: total phenols, ABTS (2,2-azinobis-[3 ethylbenzothiazolin-6-sulphoni]), FRAP (ferric reducing/antioxidant power) and in some selected ORAC samples (oxygen radical absorbance capacity).
RESULTS: the samples containing phenol compounds with a high reducing capacity were CBTExtM, CNHTExtM, CRHTExtA, CRHTExtM, CBHExtA and CBHExtM, which also have very high ORAC values compared with other substrates; the extract with better values was the CBTExtM. The FRAP technique describes very well the oxidative phenomenon in extracts CHSTExtA, CBHExtA, CIHTExtM, CSHTExtM and CIHTExtM: in DPPH•) the extract showing TEAC high values was the CSHTExtA. The CBTExtM extract showed the better inhibition values of ABTS radical.
CONCLUSIONS: the polar and moderately polar extracts from the three species of Calophyllum showed a high antioxidant activity in the assessed methodologies.
Key words: antioxidant activity, free radicals, Calophyllum.
INTRODUCCIÓN
El estrés oxidativo surge en sistemas biológicos después de una prolongada exposición a oxidantes, o a una disminución de la capacidad antioxidante del sistema, o a ambas; y está frecuentemente asociado con la generación de radicales libres como las especies reactivas oxigenadas (EROs), las cuales están fuertemente implicadas en la patología de enfermedades como el cáncer, enfermedades cardiacas, arterosclerosis; enfermedades cerebrales y el envejecimiento prematuro, entre otras.1,2 Cuando un exceso de radicales libres se forma, puede causar la inhibición de enzimas como la superóxido dismutasa, catalasas y peroxidasas. Esto genera efectos letales en las células por la oxidación de lípidos, proteínas, DNA y enzimas; ocasionando reacciones en cadena que perpetúan la producción de más radicales libres y aumenta el daño de tejidos. Sin embargo, los compuestos antioxidantes tienen la capacidad de inhibir o interrumpir las reacciones de transformación que causan daños a las mencionadas biomoléculas.3
En los últimos años, los antioxidantes naturales provenientes de plantas han sido frecuentemente usados en diferentes campos de la industria farmacéutica como preservantes en alimentos y en medicina. Muchos de estos compuestos como la quercetina, a-tocoferol y el b-caroteno, entre otros, son antioxidantes naturales, que presentan una actividad comparable con antioxidantes sintéticos de mayor uso como el 2-terbutil-hidroxitolueno (BHT) y el 2-terbutil-hidroxianisol (BHA); los cuales sin embargo, pese a sus propiedades antioxidantes presentan la desventaja de ser tóxicos.4
El género Calophyllum tiene alrededor de 200 especies, con una distribución pantropical; muchas especies con propiedades medicinales. Son empleadas para tratar enfermedades como ulceras gástricas, infecciones patológicas, procesos inflamatorios.5 De algunas plantas del género Calophyllum existen reportes sobre compuestos tipo xantonas, esteroides, triterpenos, biflavonoides, piranocumarinas y benzopiranos.6 Calophyllum brasiliense Cambess, es una planta empleada en la medicina popular para el tratamiento de varias enfermedades, a la cual se han realizado diferentes estudios fitoquímicos y farmacológicos; además, es la especie más conocida y empleada como producto maderable por las constructoras, para pisos e inmobiliarias. Las hojas, los tallos y las raíces de C. brasiliense se emplean para el tratamiento del reumatismo, hemorragias, úlceras, inflamaciones y se ha confirmado su actividad biológica en reportes con actividad analgésica, antiviral, antifúngica, citotóxica antiulcerogénico, antitumoral, antibacteriana, moluscicida.7 Respecto a la actividad antioxidante, solo un reporte de C. brasiliense de los extractos acuoso, metanólico y etanólico fueron determinados con 110,56, 99,17 y 99,57 % de inhibición, respectivamente, a una concentración de 100 mg/mL, mediante el método de captación de radicales libres DPPH.8 Calophyllum inophyllum es empleada como planta medicinal y ornamental, se reconoce por sus propiedades terapéuticas: reumatismo, blenorragia y sarna, úlceras y fiebres, con reportes de actividad antitumoral, antiviral, antibacteriana.9 Se han reportado moléculas de tipo triterpenoides como la friedelina y la secofriedelina con potente inhibición de HIV-1. No hay reporte sobre actividad antioxidante de esta especie.
En este estudio se pretende determinar la capacidad antioxidante de extractos de diferente polaridad de las especies Calophyllum cf. brasiliense Cambess, Calophyllum inophyllum L. y Calophyllum sp., midiendo la actividad antioxidante por diferentes metodologías: fenoles totales, ABTS, DPPH, FRAP y en algunas muestras seleccionadas el método ORAC, con el fin de caracterizar el potencial reductor de los diferentes extractos de estas tres plantas y poder ampliar su uso en diferentes enfermedades donde los procesos oxidativos sean relevantes.10,11
MÉTODOS
Reactivos y equipos
El radical libre DPPH (1,1-difenil2-picrilhidracil), fosfato ácido de sodio, MeOH, tricloruro de hierro, 2,4,6-tri(2-piridil)triazina (TPTZ), 2,2-azinobis-(3 etilbenzotiazolin-6-sulfónico) (ABTS), AAPH [2,20-azo-bis(2-amidinopropano) dihydrochlorido] usado como una fuente de radicales peroxilos, Trolox (ácido 6-hidroxi- 2,5,8-tetrametilchromano-2-carboxílico), fluoresceinato de sodio, ácido ascórbico fueron obtenidos de Sigma Chemical Co. (St. Louis, MO), Folin-Ciocalteau fue obtenido de Merck (Darmstadt, Germany). El agua usada en los experimentos es grado HPLC. Los ensayos ORAC se realizaron en un espectrofotómetro de fluorescencia, Perkin Elmer LS55; los ensayos de absorción UV- Vis se hicieron en un espectrofotómetro Jenway 6405.
Material vegetal y elaboración de los extractos: se obtuvieron tres tipos de muestras a partir del material vegetal; muestras para especímenes de herbario con el fin de lograr una clasificación taxonómica clara de cada especie y como testigos de los especímenes colectados, así como muestras de hojas y tallos para la obtención de extractos. Los especímenes de herbario fueron procesados y depositados en el herbario Universidad de Antioquia (HUA), y se determinaron como Calophyllum cf. brasiliense Cambess colectado en el departamento de Antioquia (voucher 162,467), Calophyllum inophyllum L. colectado en el departamento de Caldas (voucher 149,140) y Calophyllum sp. colectado en el departamento de Risaralda (voucher 167,392).
El material vegetal [hojas de C. brasiliense (CBH), tallos de C. brasiliense (CBT), hojas y tallos C. inophyllum L. (CIHT), hojas y tallos de Calophyllum sp. (CSHT) seco, molido de cada una de las especies], se extrajo sucesivamente por percolación con hexano (CBTExtH, CBHExtH CIHTExtH y CSHTExtH), diclorometano (CBTExtD, CBHExtD CIHTExtD y CSHTExtD), acetato de etilo (CBTExtAE, CBHExtAE CIHTExtAE y CSHTExtAE) y metanol (CBTExtM, CBHExtM CIHTExtM y CSHTExtM), concentrados a presión reducida en un rotaevaporador y posteriormente pesados. Los extractos se monitorearon por cromatografía de capa delgada con fase estacionaria de sílica gel 60 GF254 Merck®, mediante diferentes sistemas de elución y revelando con solución etanólica (5 % de ácido sulfúrico en etanol y 1 % de vainillina) para determinar la presencia de cumarinas y solución de DPPH (200 mg/L) y así determinar la decoloración de posibles compuestos antioxidantes.
Contenido de fenoles totales (CFT): la determinación de fenoles se realizó por el método colorimétrico de Folin-Ciocalteu.12 Se construyó una curva patrón usando como estándar ácido gálico. Se diluyó el extracto a una concentración en la cual el contenido de fenoles se encontraba dentro del intervalo de la curva patrón. Los resultados se expresaron como mg de ácido gálico/100 g de extracto. Las lecturas se realizaron a 760 nm.
Evaluación de la actividad antioxidante
Ensayo de decoloración del catión radical a-a-difenil-ß-picrilhidrazilo (DPPH·): para cuantificar la capacidad captadora de radicales libres de los extractos se determina el grado de decoloración que provocan sus componentes a una solución metanólica de DPPH mediante el método de Brand-Williams, con algunas modificaciones.13,14 Se preparó una solución madre de DPPH aproximadamente 20 mg/L del radical en metanol, 990 mL de esta solución se mezclaron con 10 mL de solución de extracto (a diferentes concentraciones). Se preparó un blanco de muestra que contenía 990 mL MeOH con 10 mL de muestra y un blanco de referencia con 990 mL DPPH y 10 mL de solvente. Se incubó a temperatura ambiente durante 30 min en la oscuridad y se midió la absorbancia a 517 nm. Los resultados se expresaron como valores TEAC (trolox equivalent antioxidant capacity) mediante la construcción de una curva patrón usando como antioxidante TROLOX®.
Ensayo de decoloración con el radical catiónico ABTS•+: se fundamenta en la cuantificación de la decoloración del radical ABTS•+, debido a la interacción con especies donantes de hidrógeno o de electrones.15 El radical catiónico ABTS•+ es un cromóforo que absorbe a una longitud de onda de 734 nm y se genera por una reacción de oxidación del ABTS (2,2'-azino-bis- (3-etil benzotiazolin-6-sulfonato de amonio) con persulfato de potasio. Las mediciones se realizaron a una longitud de onda de 734 nm.15 En la evaluación se utilizaron 10 mL de extracto y 990 mL de la solución del radical ABTS•+. A los 30 min de reacción a temperatura ambiente y en la oscuridad, se leyó el cambio en la absorbancia respecto a la referencia del reactivo, a una longitud de onda de 734 nm. La referencia del reactivo consistió en una solución del radical ABTS•+ con el solvente de la muestra. Los resultados se expresaron como valores TEAC (trolox equivalent antioxidant capacity) mediante la construcción de una curva patrón usando como antioxidante TROLOX®.
Ensayo FRAP (ferric reducing/antioxidant power): este método evaluó la capacidad antioxidante de una muestra de acuerdo con su capacidad para reducir el hierro férrico (Fe+3) presente en un complejo con la 2,4,6-tri(2-piridil)-s-triazina (TPTZ) hasta la forma ferrosa (Fe+2), que tuvo un máximo de absorbancia a una longitud de onda entre 590-595 nm.16 Este ensayo se llevó a cabo en un buffer ácido acético-acetato de sodio (pH 3,4), que contenía TPTZ y FeCl3. Se utilizaron 900 mL de esta solución, 50 mL de muestra y 50 mL de agua destilada. Luego de 60 min de reacción se determinó la absorbancia a una longitud de onda de 593 nm. Para cada muestra se tuvo en cuenta la lectura de la absorbancia del blanco sin cromóforo, de la misma manera que en las pruebas anteriores. La curva de referencia se construyó usando ácido ascórbico como patrón primario Las actividades de las muestras se expresaron como AEAC (ascorbic acid equivalent antioxidant capacity: mg de ácido ascórbico/100 g extracto).
Ensayo ORAC (oxygen radical absorbance capacity): el procedimiento experimental estuvo basado en reportes previos de Ou y otros,17-19 en el cual se empleaba Trolox como estándar y condiciones controladas de temperatura a 37 °C y pH 7,4. Las lecturas se realizaron a una l de excitación 493 nm y slit de excitación 5, l de emisión 515 nm y slit de emisión 13, con atenuador de 1 % y sin placa atenuadora. Para el desarrollo de la técnica se utilizaron soluciones de fluoresceína 1x10-2 M en PBS (75 mM), AAPH 0,6 M en PBS (75 mM). La muestra contenía 21 mL de fluoresceína, 2,899 mL de PBS, 30 mL del extracto ensayado y 50 mL de AAPH. Como referencia se uso Trolox. El efecto protector del antioxidante fue calculado usando las diferencias de áreas bajo la curva de decaimiento de la fluoresceína entre el blanco y la muestra, se comparó contra la curva del Trolox y se expresó en micromoles equivalentes de Trolox por gramo de muestra (mmol Tx/g muestra), de acuerdo con la ecuación siguiente:
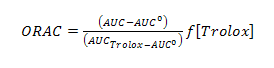
Donde AUC es el área bajo la curva de la muestra, AUC° área bajo la curva para el control, AUCTrolox área bajo la curva para el Trolox, f es el factor de dilución de los extractos.18,19
Análisis estadístico
Las mediciones se realizaron por triplicado y los resultados se presentaron como la media y su desviación estándar (DE). Todos los cálculos se realizaron en el programa estadístico STATGRAPHICS Plus 2.0.
RESULTADOS
Los rendimientos de la extracción provenientes de las tres diferentes especies de Calophyllum se presentan en la tabla 1.
Los porcentajes de material extractable con los diferentes solventes mostraron mejores rendimientos para CBH y los rendimientos máximos de extracción se obtuvieron para los extractos metanólicos de todas las especies siendo el porcentaje en peso con respecto al material vegetal seco resultó de 3,72 % para CBH, 2,61 % para CBT, 3,59 % para CIHT y 8,14 % para CSHT.
Los resultados obtenidos con el empleo de 4 metodologías diferentes para las 16 muestras analizadas, en la tabla 2 se presentan.
Tabla 2. Resultados de cuatro ensayos para los 16 extractos
| Muestra | DPPH | ABTS | FRAP | Fenoles totales |
| TEAC μmol Trolox/g de extracto | TEAC μmol Trolox/g de extracto | mg a.a./100 g muestra | Fenoles totales mg de ácido gálico/g de extracto | |
| CBTExtH | 80 ± 6,3 | 1 199 ± 136,9 | 1 310 ± 144,7 | 59 ± 5,5 |
| CBTExtD | 209 ± 11,4 | 1 088 ± 125,9 | 3 024 ± 185,5 | 55 ± 0,7 |
| CBTExtA | 836 ± 3,5 | 3 310 ± 89,5 | 9 647 ± 333,3 | 198 ± 5,8 |
| CBTExtM | 2 651 ± 93,5 | 8 492 ± 568,7 | 47 261 ± 595,0 | 249 ± 15,4 |
| CBHExtH | 45 ± 2,9 | 7 077 ± 504,2 | 1 100 ± 72,3 | 56 ± 0,7 |
| CBHExtD | 205 ± 30,1 | 1 424 ± 18,0 | 3 846 ± 59,0 | 46 ± 3,4 |
| CBHExtA | 1 946 ± 109,0 | 4 613 ± 88,7 | 57 458 ± 2474,0 | 493 ± 19,6 |
| CBHExtM | 1 507± 86,2 | 3 939 ± 27,7 | 30 473 ± 906,1 | 245 ± 10,4 |
| CIHTExtH | 62 ± 2,5 | 265 ± 3,7 | -----* | 35 ± 2,6 |
| CIHTExtD | 211 ± 14,9 | 1190 ± 16,2 | 3 439 ± 392,2 | 57 ± 2,4 |
| CIHTExtA | 799 ± 18,3 | 2 608 ± 208,8 | 12 377 ± 673,0 | 175 ± 5,9 |
| CIHTExtM | 2 554 ± 45,9 | 7 153 ± 167,1 | 43 266 ± 974,6 | 266 ± 12,8 |
| CSHTExtH | 31 ± 5,0 | 2 033 ± 50,0 | 1 214 ± 77,3 | 54 ± 2,6 |
| CSHTExtD | 262 ± 7,7 | 1 749 ± 98,7 | 6 059 ± 76,4 | 66 ± 1,6 |
| CSHTExtA | 2 737 ± 95,0 | 6 791 ± 368,1 | 79 416 ± 2 133,3 | 518 ± 7,6 |
| CSHTExtM | 2 325 ± 177,7 | 5 573 ± 84,9 | 45 076 ± 857,3 | 248 ± 8,7 |
Todos los resultados fueron realizados por triplicado, y los datos son expresados con la desviación estándar (± DE), *No hay solubilidad
Contenido de fenoles totales: el método Folin-Ciocalteau se empleó para evaluar los grupos fenólicos presentes en cada uno de los extractos obtenidos a partir de las tres especies del genero Calophyllum. Las muestras evaluadas que presentaron un mayor contenido de fenoles (expresados en mg de ácido gálico/g de extracto) fueron los extractos de acetato de etilo y metanol de las tres especies, especialmente las codificadas como CSHTExtA, CBHExtA, CIHTExtM, CSHTExtM, CBTExtM, CBHExtM, CBTExtA, CIHTExtA, con valores de 518 ± 7,6, 493 ± 19,6, 266 ± 12,8, 248 ± 8,7, 249 ± 15,4, 245 ± 10,4, 198 ± 5,8 y 17 ± 5,9, respectivamente. Las muestras con más bajo contenido de fenoles se presentaron en los extractos de hexano y diclorometano de las tres especies de Calophyllum, CBTExtH, CBTExtD, CBHExtH, CBHExtD, CIHTExtH, CIHTExtD, CSHTExtH, CSHTExtD.
Ensayo de decoloración del catión radical a-a-difenil-ß-picrilhidrazilo (DPPH•): una notable capacidad de inhibición del DPPH presentaron todas las muestras analizadas (expresados en mmol Trolox/g de extracto). Las muestras con altos valores de TEAC fueron CSHTExtA (2 737 ± 95,0), CBTExtM (2 651 ± 93,5), CIHTExtM (2 554 ± 45,9), CSHTExtM (2 325 ± 177,7), CBHExtA (1 946 ±109,0), CBHExtM (1 507 ± 86,2).
Ensayo de decoloración con el radical catiónico ABTS•+: la cuantificación de la decoloración del radical ABTS•+ se genera debido a la interacción con especies donantes de hidrógeno o de electrones. El extracto metanólico de los tallos de Calophyllum cf. brasiliense Cambess (CBTExtM) presentó los valores más altos de inhibición del radical ABTS (8 492 ± 568,7), seguido de los extractos codificados como CIHTExtM (7 153 ± 167,1), CBHExtH (7 077 ± 93,5) y CSHTExtA (6 791 ± 368,1).
Ensayo FRAP (ferric reducing/antioxidant power): los valores más altos como reductores lo poseen los extractos de acetato de etilo y metanólico; específicamente las muestras CSHTExtA (79416 ± 2133,3) seguido de CBHExtA (57458 ± 2474,0), CIHTExtM (47261 ± 595,0), CSHTExtM (45076 ± 857,3) y finalmente CIHTExtM (43266 ± 974,6).
Ensayo ORAC (oxygen radical absorbance capacity): en la tabla 3 se presentan los valores ORAC expresados como mmoles Trolox/g de los extractos de las muestras CBTExtM, CIHTExtM, CSHTExtA, CSHTExtM, CBHExtA y CBHExtM. El más alto valor de ORAC fue para la muestra CBHExtM con valores de 11 644 ± 1 902, y el más bajo encontrado fue para la muestra CBHExtA con un valor de 3 491 ± 400.
Los 5 extractos seleccionados en este trabajo están muy por encima de esos valores; de tal manera que los extractos medianamente polares y polares de las especies estudiadas del género Calophyllum tienen una alta capacidad reductora y pueden tener un gran potencial para ser usados en diferentes eventos biológicos donde los mecanismos redox sean los más relevantes.
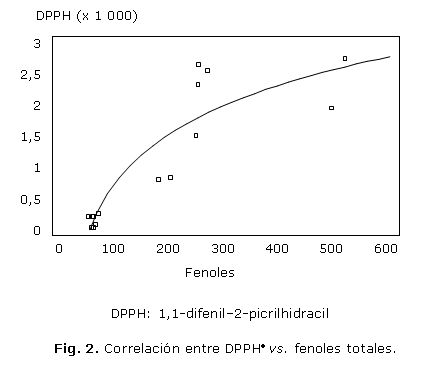
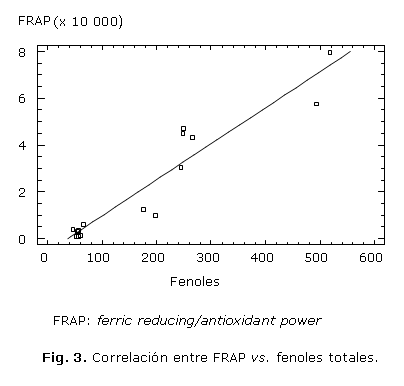
Se realizan correlaciones entre las diferentes técnicas de evaluación antioxidante: en la figura 1 se presentan los valores TEAC de ABTS•+ vs. fenoles totales con R2= 9,82, en la figura 2 los valores TEAC de DPPH• vs. fenoles totales con R2= 81,0, en la figura 3 los valores FRAP vs. fenoles totales con R2= 89,5, y en la figura 4 el ensayo FRAP vs. DPPH con R2= 88,9, como parámetro descriptivo para entender el mecanismo oxidativo de las muestras evaluadas.
DISCUSIÓN
Los extractos polares y medianamente polares de las tres especies de Calophyllum presentaron una promisoria actividad antioxidante en las metodologías evaluadas y un alto contenido de fenoles. Ninguna asociación se encontró entre los rendimientos de extracción, el contenido de fenoles totales y las demás pruebas que se realizaron. Sin embargo, se hicieron correlaciones entre las diferentes pruebas para discutir los resultados y tener una idea del mecanismo de acción de los antioxidantes presentes en las muestras analizadas.
Correlaciones entre los fenoles totales y las actividades antioxidantes: un buen antioxidante, para su correcta evaluación debe cumplir con muchos requisitos como: alta solubilidad en el medio, correcta orientación para interactuar con los radicales libres, proteger los lípidos oxidables, ser un buen reductor y funcionar con alta reactividad, tener efectividad a diferentes pH. Sin embargo, ninguna técnica de medición de la actividad antioxidante satisface las condiciones anteriores, y para tener una idea del mecanismo de acción de los antioxidantes se deben establecer correlaciones entre el contenido de fenoles y los diversos ensayos antioxidantes.20
Las medidas de los valores TEAC por la técnica ABTS son muy altos; sin embargo, es una técnica que no permite discriminar extractos que contienen compuestos buenos antioxidantes como la gran mayoría de este trabajo; esto se debe a la labilidad del reactivo ABTS•+, una estructura completamente plana que reacciona fácilmente con reductores mediante un mecanismo SET y(o) HAT,21 lo anterior se refleja en la poca correlación entre los valores TEAC de ABTS•+ vs. fenoles totales (R2= 9,82).
La concentración de fenoles totales contra la actividad antioxidante, expresada como TEAC por el ensayo DPPH tienen una correlación de 81 %. Mientras que la regresión lineal entre FRAP y fenoles totales describe en 89,5 % el fenómeno oxidativo; de tal manera, que la mayoría de los compuestos fenólicos contenidos en los extractos de las especies de Calophyllum son buenos antioxidantes y, en su mayor parte, se expresan muy bien como agentes reductores que reaccionan fundamentalmente mediante un mecanismo de transferencia de electrones SET. Los valores TEAC por el ensayo DPPH y AEAC FRAP, tienen una alta correlación entre ellos (R2= 88,9), por lo tanto, ambas técnicas describen de igual forma el mecanismo oxidativo, que resultó más significativo estadísticamente el ensayo FRAP.22
Para concluir, los diferentes extractos obtenidos a partir de las tres especies de Calophyllum contienen compuestos fenólicos reductores, especialmente en los extractos CBTExtM, CNHTExtM, CRHTExtA, CRHTExtM, CBHExtA y CBHExtM, que además, poseen valores ORAC muy altos comparados con otros sustratos conocidos como las especies del género Vaccinium. La técnica FRAP describe muy bien el fenómeno oxidativo en los extractos CSHTExtA, CBHExtA, CIHTExtM, CSHTExtM y CIHTExtM; en el ensayo de decoloración del catión radical a-a-difenil-ß-picrilhidrazilo (DPPH•), el extracto que presentó los valores más altos de TEAC por ambas metodologías, fue el extracto de acetato de etilo Calophyllum sp. (CSHTExtA). El extracto metanólico de los tallos de Calophyllum cf. brasiliense Cambess (CBTExtM) presentó los mejores valores de inhibición del radical ABTS. En el método ORAC que generalmente es considerado de alto nivel, debido al uso de los radicales libres de importancia biológica, el extracto que presentó mejores valores fue el extracto metanólico de los tallos de Calophyllum cf. brasiliense Cambess (CBTExtM). Las mediciones de la actividad antioxidante por diferentes técnicas, ofrecen ventajas en términos de la predicción de la capacidad antioxidante in vitro.22
AGRADECIMIENTOS
Al apoyo financiero brindado por el Ministerio de Agricultura de Colombia proyecto (No. 009-2007-V7552-38-07): Caracterización y actividad antimalarica de metabolitos secundarios de algunas especies de plantas medicinales nativas de los géneros Piper y Calophyllum, para el desarrollo de productos farmacéuticos con actividad antimalarica. A la Universidad de Antioquia y a la Universidad Nacional de Colombia, sede Medellín.
REFERENCIAS BIBLIOGRÁFICAS
1. Kohen R, Nyska A. Oxidation of biological systems: Oxidative stress phenomena, antioxidants, redox reactions, and methods for their quantification. Toxicologic Pathology. 2002;30(6): 620-50.
2. Kohen R, Chevion S, Schartz R, Berry EM. Evaluation of the total low molecular weight antioxidant activity of plasma in health and diseases: a new approach. Cell Pharmacol. 1996;3:335-59.
3. Halliwell B. Antioxidants in human health and disease. Annual Review Nutrition. 1996;16(1):33-50.
4. Ito N, Fukushima S, Hagiwara A, Shibata M, Ogiso T. Carcinogenecity of butylated hydroxyanisole in F344 rats. J Natl Cancer Inst. 1983;70(2):343-52.
Noldin VF, Isaias DB, Cechinel Filho VC. Calophyllum Genus: Chemical and pharmacological importance. Quim Nova. 2006;29(3):549-54.
5. Dharmaratne HR, Napagoda MT, Tennakoon SB. Xanthones from roots of Calophyllum thwaitesii and their bioactivity. Part A: Structure and Synthesis. Natural Product Research. 2009;23(6):539-45.
6. Isaias DB, Niero R, Noldin VF, De Campos-Buzzi F, Yunes RA, Delle-Monache F, et al. Pharmacological and phytochemical investigations of different parts of Calophyllum brasiliense (Clusiaceae). Pharmazie. 2004;59:879-81.
7. Flores W, Fuentes R, Galindo D, Gonzáles F, Hernández G, Hernández M, et al. Evaluación de los efectos antioxidante, antibacteriano y antifúngico de Calophyllum brasiliense Cambess (Lagarto Caspi). Revista Horizonte Médico. 2008;8(2):7-16.
8. Itoigawa M, Ito C, Tan H, Kuchide M, Tokuda H, Nishino H, et al. Cancer chemopreventive agents, 4-phenylcoumarins from Calophyllum inophyllum. Cancer Lett. 2001;169(1):15-9.
9. Laure F, Herbette G, Faure R, Bianchini JP, Raharivelomanana P, Fogliani B. Structures of new secofriedelane and friedelane acids from Calophyllum inophyllum of French Polynesia. Magn Reson Chem. 2004;43(1):65-8.
10. Rojano A, Gaviria C, Gil M, Sáez J, Schinella G, Tournier H. Actividad antioxidante del isoespintanol en diferentes medios. Vitae. 2008;15(1):169-77.
11. Rojano B, Saez J, Schinella G, Quijano J, Notario R, Vélez E, et al. Experimental and theoretical determination of the antioxidant properties of isoespintanol (2-Isopropyl-3,6-dimethoxy- 5-methylphenol). J Mol Struct. 2008;877(1-3):1-6.
12. Peyrat-Maillard MN, Bonnely S, Berset C. Determination of the antioxidant activity of phenolic compounds by coulometric detection. Talanta. 2000;51(4):709-16.
13. Brand-Williams W, Cuvelier ME, Berset C. Use a of free radical method to evaluate antioxidant activity. Food Sci.Tecnol. 1995;28(1):25-30.
14. Puertas M, Mesa AM, Saez J. In Vitro radical scavenging activity of two Columbian Magnoliaceae. Naturwissenschaften. 2005;92(8):381-4.
15. Re R, Pellegrini N, Proteggente A, Pannala A, Yang M, Rice-Evans C. Antioxidant activity applying an improved ABTS radical cation decolorization assay. Free Radic Biol Med. 1999;26(9-10):1231-7.
16. Benzie IF, Strain JJ. The ferric reducing ability of plasma (FRAP) as a measure of antioxidant power: the FRAP assay. Anal Biochem. 1996;239(1):70-6.
17. Ou B, Hampsch-Woodill M, Prior R. Development and validation of an improved oxygen radical absorbance capacity assay using fluorescein as the fluorescent probe. J Agr Food Chem. 2001;49(10),4619-26.
18. Atala E, Vásquez L, Speisky H, Lissi E, López-Alarcón C. Ascorbic acid contribution to ORAC values in berry extracts: An evaluation by the ORAC-pyrogallol red methodology. Food Chemistry. 2009;113(1):331-5.
19. Alarcón E, Campos AM, Edwards AM, Lissi E, López-Alarcón C. Antioxidant capacity of herbal infusions and tea extracts: A comparison of ORAC-fluorescein and ORAC-pyrogallol red methodologies. Food Chemistry. 2008;107(3):1114-9.
20. Moon JK, Shibamoto T. Antioxidant assays for plant and food components. J Agr Food Chem. 2009;57:1655-66.
21. Rojano A, Gaviria CA, Ochoa CI, Sánchez N, Medina C, Lobo M, et al. Propiedades antioxidantes de los frutos de agraz o mortiño (Vaccinium meridionale Swartz). En: Perspectivas del cultivo de agraz o mortiño en la zona altoandina de Colombia. Bogotá, Colombia: Gente Nueva Editorial; 2009. p. 95-112.
22. Al-Duais M, Muller L, Bohm V, Jetschke G. Antioxidant capacity and total phenolics of Cyphostemma digitatum before and after processing: use of different assays. Eur Food Res Technol. 2009;228:813-2.
Recibido: 27 de octubre de 2009.
Aprobado: 30 de mayo de 2009.
Dr. Benjamín A. Rojano. Laboratorio de Ciencias de los Alimentos. Escuela de Química. Universidad Nacional de Colombia Sede Medellín. A.A 3840. Medellín, Colombia. Teléf.: +57(4) 430 9381; Fax: +57(4) 430 9347. Correo electrónico: brojano@unal.edu.co