My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Cubana de Plantas Medicinales
On-line version ISSN 1028-4796
Rev Cubana Plant Med vol.15 no.3 Ciudad de la Habana July-Sept. 2010
ARTÍCULO ORIGINAL
Efecto sedante del triterpeno cicloartanol obtenido de las hojas de Pedilanthus tithymaloides (L.) Poit.
Sedative effect of cycloartanol triterpene obtained from Pedilanthus tithymaloides (L.) Poit. leaves
Hiran Cabrera SuárezI, Yanier Núñez FigueredoII
IMáster en Ciencias en Química Farmacéutica. Investigador Agregado. Laboratorio Central de Farmacología. Facultad de Ciencias Médicas "Salvador Allende". Ciudad de La Habana, Cuba.
IIMáster en Ciencias en Farmacología. Investigador Agregado. Centro de Investigación y Desarrollo de Medicamentos. Ciudad de La Habana, Cuba.
RESUMEN
INTRODUCCIÓN: Pedilanthus tithymaloides (L.) Poit. (ítamo real) es una planta ampliamente distribuida en Cuba y constituye una fuente sustentable para la obtención de principios activos.
OBJETIVO: evaluar el efecto neurosedante del triterpeno cicloartanol, obtenido a partir del extracto diclorometano de las hojas de esta planta.
MÉTODOS: se emplearon los modelos de conducta exploratoria, sueño barbitúrico, convulsiones inducidas por pentilenotetrazol y estereotipias inducidas por anfetamina. El cicloartanol fue administrado por vía oral 30 min antes de cada ensayo.
RESULTADOS: se obtuvo inhibición de la conducta exploratoria a dosis superiores a 100 mg/kg, inhibición de las estereotipias inducidas por anfetamina a dosis de 200 mg/kg, se potenció el sueño inducido por tiopental a dosis superiores a 50 mg/kg y no se observó protección frente a las convulsiones inducidas por pentilenotetrazol.
CONCLUSIONES: los resultados obtenidos en los diferentes ensayos muestran un efecto depresor del sistema nervioso central en animales tratados con cicloartanol, sin embargo, el efecto sedante no parece estar mediado por el sistema GABAérgico, tampoco se observaron efectos antidepresivos.
Palabras clave: cicloartanol, Pedilanthus tithymaloides, sedante, triterpeno, ítamo real, extracto diclorometano, plantas medicinales, fitofarmacología, productos naturales.
ABSTRACT
INTRODUCTION: Pedilanthus tithymaloides (L.) Poit. (known as ítamo real) is a widely distributed plant in Cuba and at the same time a sustainable source of active principles.
OBJECTIVE: to evaluate the neurosedative effect of cycloartanol triterpene from dichlorometane extract obtained from Pedilanthus tithymaloides (L.) Poit. leaves.
METHODS: models based on exploratory behaviour, barbiturate-induced sleep, pentilenotetrazol-induced seizures and amphetamine-induced stereotyped behaviours were used. Cyclocartanol was orally administered 30 minutes before every test.
RESULTS: exploratory behaviour was inhibited at over 50 mg/kg dose; amphetamine-induced stereotyped behaviours were inhibited at 200 mg/kg dose; thiopental-induced sleep was potentiated at over 50 mg/kg dose, however, protection against pentilenotetrazole-induced seizures was not observed.
CONCLUSIONS: the results of several tests indicate a depressing effect on the central nervous system of laboratory animal treated with Cycloartanal; however, the sedative effect does not seem to be mediated by the GABAergic system. Anti-depressive effects were not observed either.
Key words: cycloartanol, Pedilanthus tithymaloides, sedative, triterpene, itamo real, dichlorometane extract, medicinal plants, phytopharmacology, natural products.
INTRODUCCIÓN
El estudio de los productos naturales representa una prioridad del estado cubano, comprobar las propiedades que se atribuyen a las plantas medicinales reviste una importancia trascendental como alternativa en la terapéutica médica y como una fuente de obtención de nuevos fármacos. Ítamo real es el nombre que popularmente se le asigna en Cuba a Pedilanthus tithymaloides (L.) Poit., perteneciente a la familia Euforbiaceae. Comúnmente se emplea como planta ornamental por su porte y por formar macizos. Además ha sido muy utilizada como planta medicinal, se le atribuyen propiedades eméticas, antiblenorrágicas, pectorales, odontálgicas, antiherpéticas y se usa también en el tratamiento de la bronquitis y la laringitis. El látex que produce es muy usado en tratamientos de carcinomas y verrugas, en tanto que la raíz ha sido considerada como abortiva.1-4
La extracción con diclorometano permitió la obtención de triterpenos a partir de las hojas de la especie estudiada y los reportes en la literatura relacionados con la actividad neuroactiva de estos compuestos,5-8 justificaron la realización de un estudio para determinar el perfil neurofarmacológico del cicloartanol, uno de los triterpenos mayoritarios obtenidos de las hojas de esta especie.
En la literatura consultada no se ha tenido resultado en cuanto a trabajos que relacionen la estructura química de los triterpenos con esta actividad biológica, sin embargo, existe abundante documentación en cuanto a estudios farmacológicos realizados que demuestran el efecto antiinflamatorio de algunos de estos compuestos, los cuales guardan una estrecha relación estructural con los esteroides; también se han publicado procedimientos para el aislamiento, análisis y caracterización de los triterpenos, dentro de ellos se encuentra el cicloartanol, quien es uno de los triterpenos que aparece con gran cantidad de publicaciones al respecto, donde también se refleja en una gran variedad de plantas medicinales que sirven de fuente de obtención de este triterpeno.
En tal sentido el objetivo de este trabajo es evaluar la actividad neurosedante del triterpeno cicloartanol obtenido del extracto diclorometano de las hojas de P. tithymaloides.
MÉTODOS
Animales
Se emplearon ratas Wistar, machos de 200 a 250 g de masa corporal para la evaluación de las estereotipias inducidas por anfetamina y ratones albinos suizos 18-22 g para el resto de los ensayos; todos procedentes de la colonia de la UCTB Control Biológico del Centro de Investigación y Desarrollo de Medicamentos (CIDEM). Se alojaron en sala con condiciones de temperatura controlada de 22 ± 2 °C, cama con viruta con cambio cada 48 h y un ciclo de luz-oscuridad de 12/12 h. El pienso peletizado CMO 1000, dieta proveniente del Centro Nacional para la Producción de Animales de Laboratorio (CENPALAB), y el agua acidulada fueron administradas a libre demanda.
Sustancia de ensayo
El cicloartanol fue suministrado por el laboratorio de fitoquímica del laboratorio Central de Farmacología de la Facultad de Ciencias Médicas Dr. Salvador Allende. Se suspendió en carboximetilcelulosa 0,05 %.
Como controles positivos y reactivos químicos se usaron diazepam (DZP) (QUIMEFA, Cuba), tiopental (QUIMEFA, Cuba), pentilenotetrazol (PTZ) haloperidol (Esteve SA, España) y sulfato de anfetamina. Los solventes fueron calidad grado analítico y todos los compuestos y soluciones se prepararon inmediatamente antes del uso.
Todas las sustancias de ensayo se administraron por vía oral 30 min antes del experimento y las dosis empleadas fueron de 200, 100 y 50 mg/kg para los ensayos de conducta exploratoria y sueño barbitúrico y 200 mg/kg para los ensayos de convulsiones inducidas por pentilenotetrazol y estereotipias inducidas por anfetamina. En todos los experimentos se emplearon 10 animales por grupo.
Actividad exploratoria
Después de 30 min de la administración del compuesto de ensayo cada animal fue colocado en el centro de una caja de actividad exploratoria y se determinó durante 6 min el número de cruces y empinamientos.9,10
Sueño inducido por tiopental
Los animales fueron administrados con la sustancia de ensayo 30 min antes del agente inductor del sueño. Se utilizaron grupos controles negativos administrados solo con tiopental sódico y agua destilada y controles positivos que recibieron DZP a la dosis de 1 mg/kg pc en lugar de la sustancia de ensayo.11 A partir de la administración del tiopental sódico se registraron los tiempos de inicio del sueño y tiempo total de este; así como el porcentaje de animales que se durmieron, el experimento concluyó a los 40 min de administrado el agente inductor del sueño.
Convulsiones inducidas por PTZ 85 mg/kg
Los animales fueron administrados con los diferentes tratamientos 30 min antes de la inducción de las convulsiones con 85 mg/kg de PTZ por vía subcutánea. Los animales se observaron a partir de la administración del agente proconvulsivante por un período de 30 min durante el cual se registró el tiempo de la primera convulsión (T1C), tiempo de la primera convulsión tónico-clónica (T1CTC) y tiempo de muerte (TM) de los animales. Fue determinado el porcentaje de animales que presentaron convulsiones tónico-clónicas (CTC) y porcentaje de animales muertos.12
Esteriotipias inducidas por anfetamina 1,5 mg/kg
Los animales fueron administrados con los diferentes tratamientos 30 min antes de la inducción de estereotipias con 1,5 mg/kg pc de anfetamina por vía subcutánea. Se colocaron en cajas individuales para observar las estereotipias cada 5 min durante 1 h.13-15 Se utilizaron animales como control positivo administrados con 5 mg/kg pc de haloperidol por vía oral.
Procesamiento estadístico
Los resultados de los diferentes ensayos se expresaron por la media ± desviación estándar. Se procesaron mediante un análisis de varianza de una vía y posteriormente se realizó un test de Duncan con un nivel de significación de p< 0,05.16
RESULTADOS
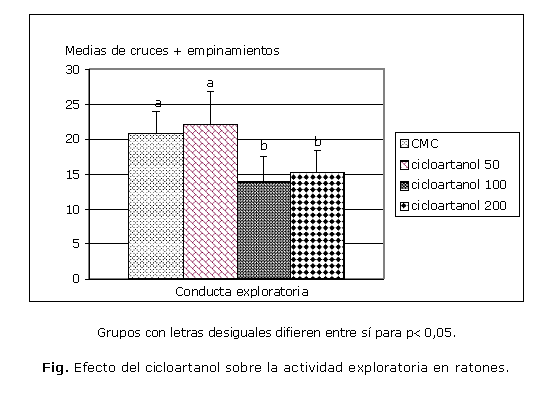
Los resultados de la prueba de conducta exploratoria muestran un efecto dependiente de la dosis sobre la disminución de esta en ratones (Fig.), ese comportamiento se corresponde con el perfil neurofarmacológico de los fármacos sedantes en sentido general.
En las condiciones experimentales del presente estudio, la dosis empleada de tiopental sódico (30 mg/kg) se encontró por debajo de la dosis necesaria para alcanzar el umbral medio de sueño en los animales, es por ello que solo 30 % de los animales administrados con tiopental presentaron los signos propios de este agente barbitúrico.
Sin embargo, en los animales que recibieron coadministración con las diferentes dosis de cicloartanol, se observó un aumento del número de animales dormidos, así como una prolongación del tiempo de sueño (tabla 1).
Los resultados de la actividad anticonvulsivante frente a convulsiones inducidas por PTZ se muestran en la tabla 2, donde se aprecia que el cicloartanol a la dosis ensayada no disminuyó el número de animales que presentaron convulsiones, ni el tiempo de aparición de estas cuando se les administró PTZ 85 mg/kg, por vía subcutánea, con respecto al grupo control que no recibió tratamiento; tampoco se apreciaron diferencias en el tiempo de aparición de la muerte entre el grupo que recibió tratamiento con cicloartanol y el control negativo.
Los resultados obtenidos indican que el cicloartanol disminuye la acción estimulante producida por la administración subcutánea de 1,5 mg/kg de anfetamina, ya sea por un antagonismo de la transmisión dopaminérgica, por una inhibición de su liberación o por bloqueo del receptor possináptico de esta o por una potenciación de alguna transmisión inhibitoria, con disminución de la excitación provocada por la dosis de anfetamina empleada (tabla 3).
DISCUSIÓN
Es conocido que la coadministración de tiopental con agentes sedantes potencia el efecto de somnolencia producido por barbitúricos.17
Existe una gran cantidad de agentes químicos capaces de provocar convulsión en animales de experimentación por diferentes vías; el pentilenotetrazol es uno de ellos, que ejerce sus efectos proconvulsivantes por mediación del receptor GABAA; esta es la razón por la cual animales pretratados con agonistas GABAergicos disminuyen las convulsiones inducidas por este agente químico.18
La anfetamina provoca la liberación de dopamina de sus sitios de almacenamiento en los nervios simpáticos, de ahí que reciban el nombre de aminas simpaticomiméticas de acción indirecta y que sus efectos sean similares a los de las catecolaminas en general, y al de la dopamina en particular en dependencia de las dosis y el modelo empleado.19
La inducción de estereotipias por anfetamina constituye un modelo clásico para la evaluación de drogas con propiedades antidepresivas, la administración de esta amina simpaticomimética a animales de experimentación, aumenta el comportamiento esteriotipado de estos, ese comportamiento se incrementa cuando los animales son pretratados con antidepresivos y disminuye cuando los animales se pretratan con antipsicóticos o con otros fármacos que deprimen el sistema nervioso central.19
El cicloartarnol es un triterpeno tetracíclico presente en muchos extractos obtenidos de plantas medicinales, al cual se le ha evaluado además su efecto antiinfflamatorio en el modelo de inducción por inyección de carragenia en rata. Se obtuvieron resultados entre las 3 y 5 h de administrado el producto, se destacó el cicloartanol como el principal responsable que al parecer inhibe la fosfolipasa A2 según estudios in vitro.20
Estudios refieren el efecto relajante de la musculatura lisa que producen la mezcla de los triterpenos cicloartanol y cicloeucadenol obtenido de Herissanthia tiubae perteneciente a la familia Malváceas, sobre el músculo liso de íleon y tráquea de cerdo, así como en los ensayos realizados en la musculatura lisa de la aorta de ratas.21
Los resultados en los diferentes ensayos muestran un efecto depresor del sistema nervioso central en animales tratados con cicloartanol, sin embargo no se observó efecto protector sobre las convulsiones inducidas por PTZ, lo cual indica que el efecto sedante no parece estar mediado por el sistema GABAérgico. Tampoco se observaron efectos antidepresivos.
REFERENCIAS BIBLIOGRÁFICAS
1. Cuba. Ministerio de Salud Pública. Plantas Medicinales (Fitomed III). La Habana: Editorial Ciencias Médicas; 1994. p. 34-5.
2. Roig JT. Diccionario botánico de nombres vulgares cubanos. La Habana: Editorial Científico-Técnica; 1974.
3. Beltrán A, Cuéllar A. Evaluación antitumoral del látex de la planta ítamo real [Tesis de Diploma]. IFAL: Universidad de La Habana; 1999.
4. Roig JT. Diccionario Botánico de nombres vulgares cubanos. 3ra Edición. La Habana; 1962. p.1092-3.
5. Rojas G, Aranda E, Navarro V, Zamilpa A, Tortoriello J. In vitro propagation of Galphimia glauca and content of the sedative compound galphimine-B in wild and micropropagated plants. Planta Med. 2005;71(11):1076-8.
6. Amos S, Orisadipe A, Binda L, Emeje M, Adesomoju A, Okogun J, et al. Behavioural effects in rodents of methyl angolensate: a triterpenoid isolated from Entandrophragma angolense. Pharmacol Toxicol. 2002;91(2):71-6.
7. Osuna L, Pereda-Miranda R, Tortoriello J, Villarreal ML. Production of the sedative triterpene galphimine B in Galphimia glauca tissue culture. Planta Med. 1999;65(2):149-52.
8. Tortoriello J, Ortega A. Sedative effect of galphimine B, a nor-seco-triterpenoid from Galphimia glauca. Planta Med. 1993;59(5):398-400.
9. Tyler CB, Miczed KA. Effects of phencyclidine on aggressive behavior in mice. Pharmacol Biochem Behav. 1982;17:503-10.
10. Palanza P. Animal models of anxiety and depression: how are females different? Neuroscience Biobehavioral Reviews. 2001;25:219-33.
11. Carlini EA, Contar JDP, Silva Filho AR, Silveira-Filho NG, Frochtengarten ML, Bueno OFA. Pharmacology of lemongrass (Cymbopogon citratus Stapf.). I. Effects of teas prepared from the leaves on laboratory animals. J Ethnopharmacol. 1986;17:37-64.
12. Costa E, Greengard P. Mechanism of action of benzodiazepines. New York: Adv Biochem Psychopharmacol, Raven Press; 1975. p. 14.
13. Lyon M, Robbins T. The action stimulant drugs: a general theory concerning amphetamine effects. En: Essmann W, Valselli L, editors. Current development in psychopharmacology. New York: Spectrum Publications; 1975. p. 81-163.
14. Kuczenski R, Segal DS. Sensitization of amphetamine-induced stereotyped behaviors during the acute response. J Pharmacol Exp Ther. 1999;288(2):699-709.
15. Kuo DY, Liu CN, Tsay JC, Chang CL, Cheng JT. Effects of nicotine on spontaneous and amphetamine-induced motor behaviors: the differences between nicotine tolerant and non-tolerant rats. Chin J Phisiol. 1998;41(2):93-9.
16. Sigarroa A. Biometría y Diseño Experimental. La Habana: Editorial Pueblo y Educación; 1985. p. 430.
17. Litter M. Farmacología experimental y clínica. 7ª ed. Buenos Aires: El Ateneo; 1986. p. 226-9, 301, 708.
18. De Deyn PP, D'Hooge R, Marescau B, Pei Y. Chemical models of epilepsy with some reference to their applicability in the development of anticonvulsants. Epilepsy Research. 1992;12:87-110.
19. Goodman y Gilman. Las bases farmacológicas de la terapéutica. 11th ed. Editorial Médica Panamericana S.A.; 2006. p. 153-449.
20. Ahumada C, Sáenz T, García D. Puerta R. de la, Fernández A, Martínez E. The effects of a triterpene fraction isolated from Crataegus monogyna Jacq. on different acute inflammation models in rats and mice. Leucocyte migration and phospholipase A2 inhibition. J Pharmacy Pharmacol. 1997;49(3)329-31.
21. Gomes AYS, Souza M de FV. Cortes SF, Lemos VS. Mechanism involved in the spasmolytic effect of a mixture of two triterpenes, cycloartenol and cycloeucalenol, isolated from Herissanthia tiubae in the guinea-pig ileum Planta Medica. 2005;71(11):1025-9.
Recibido: 10 de mayo de 2010.
Aprobado: 26 de septiembre de 2010.
MSc. Hiran Cabrera Suárez. Laboratorio Central de Farmacología. Facultad de Ciencias Médicas "Salvador Allende". Carvajal s/n y Agua Dulce, Cerro. Ciudad de La Habana, Cuba. Teléf.: 8776661 Ext. 1048. Correo electrónico: irancs@infomed.sld.cu