Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Plantas Medicinales
versión On-line ISSN 1028-4796
Rev Cubana Plant Med vol.16 no.3 Ciudad de la Habana jul.-set. 2011
ARTÍCULO ORIGINAL
Actividad antiséptica de vinagre de Guadua angustifolia Kunth
Antiseptic activity of Guadua angustifolia Kunth vinegar
Dra. Amanda Inés Mejía Gallón, Dra. Elizabeth Cadavid Torres, Dra. Cecilia Gallardo Cabrera
Universidad de Antioquia. Medellín. Antioquia, Colombia.
RESUMEN
Introducción: los vinagres de bambú se utilizan en los países orientales en aplicaciones farmacéuticas, con la especie Guadua angustifolia Kunth no se han encontrado investigaciones similares. Evaluar la actividad antiséptica del vinagre de guadua permitiría avanzar en estos desarrollos.
Objetivo: determinar la sensibilidad de las bacterias Pseudomona aeruginosa y Staphylococcus aureus frente al vinagre de guadua, los cambios con la concentración y el pH.
Métodos: la actividad antimicrobiana se midió por difusión en agar en medio Muller Hinton. Se ensayaron vinagres a concentraciones entre 100, 80, 60, 40 y 20 % a pH entre 3 y 6. Se estableció la concentración mínima inhibitoria.
Resultados: el vinagre de guadua presenta actividad antiséptica a concentraciones superiores a 12 mg/mL en base seca, rango de pH 2 a 6, reduce en 4 log la concentración de microorganismos y muestra mayor actividad antiséptica contra S. aureus.
Conclusiones: la actividad antiséptica del vinagre de bambú comparado con el de otra especie, obtenido en condiciones similares a las que se realizaron en este estudio, se obtiene una mayor actividad para el vinagre de G. angustifolia, lo cual permite demostrar el gran potencial de este para el desarrollo de formulaciones con actividad antiséptica.
Palabras clave: Pseudomona aeruginosa, Staphylococcus aureus, ácido acético, vinagre de Guadua angustifolia Kunth, actividad antiséptica.
ABSTRACT
Introduction: bamboo vinegars are used in the Asian countries for pharmaceutical applications, but the Guadua angustifolia Kunth species has not been similarly researched in this field. The assessment of the antiseptic activity of guadua vinegar would allow moving forward in this direction.
Objective: to determine the antiseptic action of guadua vinegar against Pseudomona aeruginosa and Staphylococcus aureus bacteria, with several changes in concentration and the pH.
Methods: the antimicrobial activity was measured through the agar diffusion in Muller Hinton medium. Guadua vinegars were tested at 100, 80, 60, 40, and 20 % concentrations and the pH ranged 3 to 6. The minimum inhibitory concentration was set.
Results: guadua vinegar showed antiseptic properties at concentrations over 12 mg/mL, on dry weight and pH range of 2 to 6; it reduced by 4 log the final microorganism concentration and exhibited greater antibacterial activity against S. aureus.
Conclusions: comparing the antiseptic activity of bamboo vinegar with that of another species, under conditions similar to those in this study, results in greater activity for Guadua angustifolia vinegar, which can prove its great potential for the development of antiseptic formulations.
Key words: Pseudomona aeruginosa, Staphylococcus aureus, acetic acid, Guadua angustifolia Kunth vinegar, antiseptic activity.
INTRODUCCIÓN
Guadua angustifolia Kunth es una planta ampliamente utilizada en Colombia en el sector de la construcción, por ser una especie autóctona que se encuentra natural en muchas de las zonas rurales de Colombia. Por sus buenas propiedades mecánicas, se utiliza en especial por los campesinos para construir viviendas, pero en el proceso de cosecha y transformación solo se emplea 40 %,1 lo demás se convierte en residuo. Uno de los usos que se está investigando en Colombia a este residuo es la transformación en vinagre de guadua, el cual se obtiene durante las etapas preliminares de la producción de carbón a partir de estos residuos, a temperaturas alrededor de 200 °C. Se obtiene un líquido algo amarillo, con olor a humo, pH alrededor de 3,9; alto contenido de compuestos fenólicos y casi 90 % de agua.2 Los vinagres de bambú contienen compuestos fenólicos como el siringol, el guayacol y ácidos orgánicos como el ácido propiónico y el ácido acético.3-5 Estas moléculas ejercen diferentes mecanismos de acción, las cuales hacen que las bacterias que generan resistencia a moléculas específicas, sean atacadas de modo simultáneo por otros puntos blancos, amplía el espectro de acción antibacterial de los vinagres.6,7
En esta investigación se estudia el efecto biocida del vinagre de guadua frente a bacterias que han mostrado resistencia a antibióticos y que son patogénicas, como el bacilo gramnegativo Pseudomona aeruginosa y el coco grampositivo Staphylococcus aureus. La alta resistencia de estos microorganismos se debe a su capacidad de sintetizar enzimas, que les permiten adaptarse a condiciones extremas de pH y a medios escasos en fuentes de carbono,8 y también les permiten defenderse de moléculas como penicilinas, meticilinas y demás antibióticos. Este hecho ha originado en la comunidad científica la necesidad de buscar de continuo moléculas o matrices que actúen como bactericidas para ser utilizadas como conservantes, antibióticos o desinfectantes,3,9 de manera que permitan reemplazar los actuales, a los cuales las bacterias han generado resistencia, o simplemente ofrecer una mayor variedad de compuestos;10 de manera que se evite el uso continuo del mismo antibiótico, para no estimular mecanismos de resistencia en los microorganismos.11
MÉTODOS
Preparación de la muestra
Se filtraron 200 mL de vinagre de guadua en reposo mínimo de 6 meses.
Cultivo de microorganismos
Cepas Pseudomona aeruginosa ATCC 9027 y Staphylococcus aureus ATCC 6538. Se mantuvieron en medio sólido Centrimide y Baird Parker, respectivamente. De cada medio se tomaron 5 colonias y se inocularon en medio líquido Muller Hinton, se incubaron por 48 h a 37 °C. La turbidez del medio se ajustó a una absorbancia de 0,2 UA a longitud de onda 540 nm en un espectrofotómetro VARIAN® CARY 50 BIO UV/VIS. Esta absorción resultó equivalente a una concentración específica de 107 UFC/mL.
Determinación de la sensibilidad del vinagre de guadua y del ácido acético, contra los microorganismos S. aureus y P. aureuginosa
Se realizó por el método de difusión en agar6 en medio sólido Muller Hinton, con vinagres a 100, 80, 60, 40 y 20 %; pH en el rango de 3 a 6, que se ajusta con sulfato de sodio dibásico 97 %. Para comparar la sensibilidad de estos microorganismos al ácido acético, se analizaron simultáneamente soluciones de ácido acético a 9, 6, 4 y 2 % (a las cuales se encuentra este ácido en el vinagre de guadua a 100, 60, 40 y 20 %, respectivamente). Se utilizaron pozuelos de 4,6 mm de diámetro, se depositó en cado uno 15 µL de muestra. La medición del diámetro total de los halos de inhibición se realizó con un calibrador de resolución máxima de 0,01 mm.
Determinación de la sensibilidad de las bacterias S. aureus y P. aureuginosa al ácido acético y al vinagre de guadua
Influencia del pH: como el ácido acético es el principal componente del vinagre de guadua, se estudió su influencia en solución acuosa 9 % a diferentes pH ácidos. Se realizó la prueba de sensibilidad con el vinagre de guadua, utilizando los mismos pH.
Interacción de componentes: se evaluó la sensibilidad de 3 compuestos presentes en el vinagre de guadua: el ácido acético, el fenol y el metanol, a concentraciones de 9, 1,3 y 0,5 %, respectivamente; concentraciones similares a las reportadas en los vinagres obtenidos a partir de residuos ligninocelulósicos, con el fin de determinar si existe interacción entre los componentes y evaluar su sensibilidad a estas bacterias individualmente. Se utilizó un diseño factorial 2.3
Concentración mínima inhibitoria (CMI): se efectuó por el método descrito en Society for Microbiology, 2007,12 con medio líquido Muller Hinton. Se utilizó un volumen total de 3 mL. La muestra de vinagre se proporcionó a pH 5,5 con fosfato de sodio dibásico. El medio con microorganismos se ajustó a una absorbancia de 0,2 UA a longitud de onda de 540 nm en un espectrofotómetro VARIAN® CARY 50 BIO UV/VIS, equivalente a una concentración de 107 UFC/mL.
Cuantificación de microorganismos: se realizó por método de inmersión en placa, con medio sólido Casoy.
Análisis estadístico: se hizo por medio del programa Design-Expert® 6.
RESULTADOS
Pruebas de sensibilidad a diferentes concentraciones y a diferentes pH
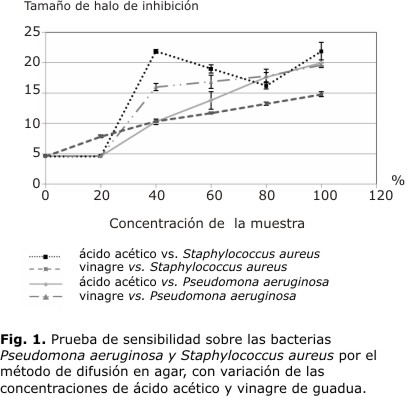
En la figura 1 se muestra la sensibilidad del ácido acético y del vinagre de guadua sobre P. aeruginosa y S. aureus, a diferentes concentraciones.
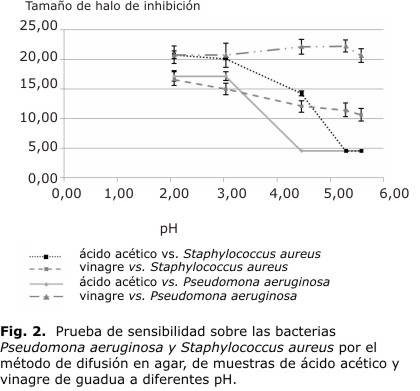
En la figura 2 se muestra la sensibilidad del ácido acético y del vinagre de guadua con la variación del pH. En la figura 1 se observa que S. aureus presenta halos de inhibición de mayor diámetro que P. aeruginosa, en todas las concentraciones de vinagre de guadua. La P. aeruginosa presenta halos de inhibición menores en todas las concentraciones estudiadas. Esto indica que la bacteria S. aureus es más sensible al vinagre de guadua que la bacteria P. aeruginosa. Sobre el ácido acético, a concentraciones bajas S. aureus es menos sensible, presenta halos de inhibición de menor diámetro; mientras que a concentraciones mayores, 6 y 9 %, S. aureus tiene una sensibilidad muy similar a la que se presenta con el vinagre de guadua a las mayores concentraciones (Fig. 1). Con P. aeruginosa, se presentan halos de inhibición de mayor diámetro con todas las concentraciones de ácido acético comparados con los obtenidos con el vinagre de guadua. Sin embargo, también se presenta variabilidad en el comportamiento frente al ácido acético, porque disminuye y aumenta a diferentes concentraciones; no se presenta un claro efecto de la sensibilidad de este microorganismo frente a las concentraciones crecientes de soluciones de ácido acético (Fig. 1).
En la figura 2, al comparar la sensibilidad al ácido acético (9 %, a pH entre 2 y 6), a pH superiores a 4,46, las 2 bacterias pierden sensibilidad frente al ácido acético. Frente a las muestras de vinagre de guadua a los mismos pH, la bacteria P. aureuginosa presenta halos de inhibición de menor diámetro que S. aureus en el rango de pH estudiado. Sin embargo, los halos de inhibición que se obtienen con el vinagre de guadua tienen mayor diámetro que los obtenidos con ácido acético, para ambas bacterias a pH superiores a 4,46, pH a los cuales perdían sensibilidad frente a soluciones de ácido acético solas. Por lo tanto, ambas bacterias son sensibles al vinagre de guadua en el rango de pH entre 2 y 6, sin embargo, es mucho más sensible la bacteria S. aureus que la bacteria P. aureuginosa.
Concentración mínima inhibitoria: en la tabla 1 se presentan las concentraciones finales de microorganismos halladas en las siembras por inmersión en placa, de cada uno de los tubos en los cuales no se presento turbidez.
En medio líquido se evidencia una concentración mínima inferior que la encontrada por el método de sensibilidad por difusión en agar 20 % v/v, debido a la mayor vulnerabilidad de los microorganismos en medio líquido; porque aumentan la permeabilidad de sus membranas y además tienen mayor superficie de contacto con el biocida.
Los resultados evidencian que en medio líquido las bacterias P. aeruginosa y S. aureus son sensibles al vinagre de guadua y tienen sensibilidad similar. La concentración mínima a la cual se reduce como mínimo en 4 log la concentración de microorganismos es 12 mg/mL en base seca, equivalente a 12 % de vinagre de guadua v/v para las 2 bacterias.
Interacción de los componentes del vinagre de guadua frente a S. aureus y P. aeruginosa: para determinar el porcentaje de contribución de diferentes componentes, se utilizó el estudio de interacción de componentes y el porcentaje de contribución de cada uno, que se presenta en la tabla 2. El análisis estadístico obtenido es:
- Modelo lineal (Lack of fit 4, error puro 16) para S. aureus: R2 0,9992; R-ajustado 0,9989; R2 predicho 0,9982; p< 0,0001-significativo.
- Modelo lineal (Lack of fit 4, error puro 136) para P. aeruginosa: R2 0,9942; R-ajustado 0,9939; R2 predicho 0,9935; p< 0,0001-significativo.
Frente a S. aureus, el componente que más explica la sensibilidad, a pH inferiores de 4, es el ácido acético: porcentaje de contribución 98,99 %. El fenol ofrece un efecto sinérgico con el ácido acético, evidenciado en el aumento del tamaño del halo de inhibición, contribución 0,25 %. Cuando se evalúa la sensibilidad del fenol solo, no presenta efecto biocida. El metanol con contribución de 0,1 %, no tiene influencia significativa en el aumento de sensibilidad y no muestra sensibilidad por sí solo. El componente que presenta mayor actividad frente a la bacteria P. aeruginosa a pH inferiores de 4 es el ácido acético, contribución 94,39 %. El fenol tiene efecto sinérgico con contribución de 0,12 %, con menor influencia que frente a la bacteria S. aureus. Cuando se evalúa su sensibilidad solo, no evidencia efecto biocida. El metanol con contribución de 0,056 % no tiene influencia significativa en el aumento del actividad del ácido acético. Tampoco demuestra actividad por sí solo (tabla 2).
DISCUSION
El componente que más contribuye a la sensibilidad de las bacterias S. aureus y P. aeruginosa, frente al vinagre de guadua a pH inferiores de 4, es el ácido acético, debido a la contribución que este hace a la actividad en 98,9 % y 94,39 %, respectivamente. Sin embargo, es la interacción del fenol con el ácido acético la que aumenta la sensibilidad de estas bacterias frente al vinagre de guadua a pH inferiores a 4,46, según los porcentajes de contribución hallados. La P. aeruginosa es menos sensible al vinagre de guadua que al ácido acético 9 %. Esto puede ser debido que la P. aeruginosa, frente al vinagre de guadua, puede iniciar mecanismos de defensa inducidos por la presencia de los compuestos fenólicos, dando como consecuencia resistencia. Esta resistencia ha sido demostrada experimentalmente con fenol y triclosan.13,14 Sin embargo, aun así, se logra obtener la reducción logarítmica de 4 en la concentración de microorganismos a concentraciones mayores que 12 mg/mL (tabla 1) con el vinagre de guadua, por lo cual se puede calificar como un bactericida.15
La alta sensibilidad del S. aureus puede deberse a su membrana compuesta de péptido glucano y ácidos teicoicos, que permiten la permeabilidad de los biocidas.16 En caso contrario la membrana externa de la P. aeruginosa es la responsable de su resistencia,13 porque está compuesta principalmente por lipo-polisacáridos (LPSs) que hacen la pared celular más resistente a moléculas hidrofóbicas, y su elevado contenido de magnesio hace una fuerte unión con los LPSs, que dificulta el paso de los biocidas a través de la membrana.15
La concentración mínima activa con efecto antimicrobiano del vinagre de guadua es de 12 % v/v o en base seca de 12 mg/mL. Su rango de pH de acción está entre pH 2 y 6. Bajo estas condiciones de concentración y pH se logra como mínimo una reducción en el número de microorganismos de 4 log. La actividad del vinagre de guadua en este amplio pH es una gran una ventaja porque la mayoría de los conservantes está condicionado a pH más estrechos. Su uso como conservante de productos farmacéuticos no será limitado por el pH, porque se puede usar a un amplio rango de pH entre 3 y 6.
Comparando la actividad antiséptica del vinagre de bambú de la especie Gigantochlo ascortechinii,16 que se ha obtenido en condiciones similares a las de este estudio, se reportó un halo de inhibición (medido desde el borde) de 3,78 mm. Para el vinagre de guadua se obtiene 5.09 mm de inhibición a la misma concentración. Es decir, que se obtiene una mayor actividad para el vinagre de Guadua angustifolia, lo cual permite demostrar el gran potencial de este para el desarrollo de formulaciones con actividad antiséptica.
AGRADECIMIENTOS
Al Ministerio de Agricultura y Desarrollo Rural, a la Universidad de Antioquia, a la empresa Kosmein y a la Escuela de Administración y Mercadotecnia del Quindío por la financiación de esta investigación CÓDIGO: 2007M3674-892.
REFERENCIAS BIBLIOGRÁFICAS
1. Espinal CF, Martínez HJ, Pinzón N, Espinosa D. Documento de trabajo Nº 65. La cadena de la guadua en Colombia una mirada global de su estructura y dinámica 1991-2005. Colombia. Bogotá: Ministerio de Agricultura y Desarrollo Rural-Observatorio Agrocadenas; Marzo de 2005.
2. Mejía AI, Gallardo C, Vallejo J. Plantas del género Bambusa: Importancia y aplicaciones en la industria farmacéutica, cosmética y alimentaria. Vitae. 2009;16(3):396-405.
3. Akakabe Y, Tamura Y, Iwamoto S. Volatile organic compounds with characteristic odor in bamboo vinegar. Biosci Biotechnol Biochem. 2006;70(11):2797-9.
4. Phil S, Sub C. Pyrolysis GC-MS analysis of tars formed during the aging of wood and bamboo crude vinegars. J Wood Sci. 2009;56:47-52.
5. Mu J, Uehara T, Furuno T. Effect of bamboo vinegar on regulation of germination and radical growth of seed plants II: composition of moso bamboo vinegar at different collection temperature and its effects. J Wood Sciences. 2004;50:470-6.
6. Shan B, Cai Y, Brooks J, Corke H. The in vitro antibacterial activity of dietary spice and medicinal herb extracts. International J Food Microbiol. 2007;117:111-9.
7. Hernandez A. Aportaciones al estudio de la actividad antimicrobiana de los antisépticos y desinfectantes [Tesis Doctoral]. Barcelona, España: Universidad Autónoma de Barcelona; 2009. p. 14.
8. Riverón F, Hernández J, Ponce L, Machado C. Resistencia bacteriana. Rev Cubana Med Milit. 2003;32(1):44-8.
9. Jun M, Zhi-ming Y, Wen-qiang W, Qing-li Wu. Preliminary study of application effect of bamboo vinegar on vegetable growth. For Stud China. 2006;8(3):43-7.
10. Lin FH. Bamboo vinegar shampoo for pets and manufacturing process of the same. Patente US 2008/0096783 A1.
11. Yoshihiko A, Yuka T, Soota I, Miho T, Takeshi N. Volatile Organic compounds with characteristic odor in bamboo vinegar. Biosci Biotechnol Biochem. 2006;70(11):2797-9.
12. Counts JM, Astles JR, Tenover FC, Hindler J. Systems Approach to Improving Antimicrobial Susceptibility Testing in Clinical Laboratories in the United States. J Clin Microbiol. 2007;45(7):2230-4.
13. Chitiva R, Dussan J. Evaluación de matrices para la inmovilización de Pseudomonas spp. en biorremediación de fenol. Rev Colombiana Biotecnol. 2003;5(2):5-10.
14. Chuanchuen R, Karkhoff-Schweizer, Schweizer H. High-level triclosan resistance in Pseudomonas aeruginosa is solely a result of efflux. Am J Infect Control. 2003;31:124-7.
15. Madigan M, Martinko J, Parker J. Biología de los microorganismos, 10 ed. México: Pearson Alhambra; 2004. p. 66-79.
16. Sulaiman O, Murphy RJ, Hashim R, Sanchis G. The inhibition of microbial growth by bamboo vinegar. J Bamboo Rattan. 2005;4:71-80.
Recibido: 25 de noviembre de 2010.
Aprobado: 14 de marzo de 2011.
Amanda Inés Mejía Gallón. Grupo de investigación BIOPOLIMER. Universidad de Antioquia. Carrera 50 A Nº 63-85. Tel: 57-4-2198332. Ext. 2310 Medellín. Antioquia. Colombia. Teléf.: 57-4-2198332. Ext. 2310. Correo electrónico: amejia@quimbaya.udea.edu.co