Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Plantas Medicinales
versión On-line ISSN 1028-4796
Rev Cubana Plant Med vol.17 no.2 Ciudad de la Habana abr.-jun. 2012
ARTÍCULO ORIGINAL
Influencia del tratamiento con extractos de plantas de Cuba sobre el tumor ascítico de Erlich
Influence of the treatment with Cuban plant extracts on the Erlich ascitic carcinoma
Dra. Yamila Colom Loo, Lic. Mairely Azcue Ferrera, Lic. Rita M. Pérez Gil, Dra. Mabel Respall, MSc. Janet Cepero Cañas, MSc. Waldo Quesada
Instituto de Oncología y Radiobiología. La Habana, Cuba.
RESUMEN
Introducción: hoy día los científicos recurren con mayor frecuencia a la naturaleza para desarrollar fármacos contra enfermedades como el cáncer. Los productos naturales son diversos en cuanto a su origen y estructuralmente complejos; pueden ser capaces a partir de un efecto indirecto de inhibir el desarrollo del tumor por medio de la estimulación de los mecanismos de defensa del organismo.
Objetivo: evaluar la actividad antitumoral indirecta de extractos de plantas en el tumor ascítico de Erlich.
Métodos: se seleccionaron 50 ratones de la línea NMRI, a los cuales se les hizo un pretratamiento por vía intraperitoneal con los extractos obtenidos de plantas durante 5 d; a las 48 h después del tratamiento se trasplantaron las células del tumor ascítico de Erlich. A otro grupo de animales utilizados como control se les realizó el pretratamiento con solución salina fisiológica 0,9 % y a las 48 h se efectuó el trasplante con las mismas células tumorales. La actividad antitumoral se determinó comparando el grupo control con el tratado mediante los extractos, por rechazo al implante del tumor. Se consideró que el producto era activo si provocaba un valor igual o mayor que 60 % de inhibición del crecimiento tumoral de los animales tratados.
Resultados: de los extractos evaluados, 5 mostraron en una de las dosis ensayadas un valor mayor que 60 % de animales vivos, sin signos de presencia del tumor a los 30 d de observación. Esto demuestra que esos extractos son activos.
Conclusiones: los 5 extractos podrían ser probables productos estimuladores de la respuesta inmune, lo que los hace candidatos a continuar las investigaciones.
Palabras clave: actividad antitumoral indirecta, cáncer, extracto de plantas, ratón, tumor ascítico de Erlich.
ABSTRACT
Introduction: at present, scientists are resorting more frequently to nature in order to develop drugs against various illnesses such as cancer. The origin of natural products is diverse and their structure is very complex with the capacity of inhibiting through indirect effect the development of tumors by stimulating the defense mechanisms of the body.
Objective: to evaluate the indirect antitumor action of plant extracts in Erlich ascitic tumor cells.
Methods: a group of 50 NMRI-line mice was interperitoneally pretreated with plant extracts during 5 days. After 48 hours, Erlich ascitic tumor cells were transplanted into the mice. Another control group of mice was pretreated with 0.9 % physiological saline solution; at 48 hours they were also implanted the same tumor cells. The antitumor activity was determined by comparing the control group with the group of mice treated with extracts in terms of tumor implant rejection. The product was considered to be active if it caused 60 % tumor growth inhibition or more.
Results: of the evaluated extracts, 5 obtained more than 60 percent of survival in animals at one of the tested doses, with no signs of tumor after observation during 30 days. It proved that these extracts were active.
Conclusions: it was proved that these 5 extracts could be potential products in stimulating immune response, so they should be further studied in the future.
Key words: indirect antitumor activity, cancer, plant extracts, mice, Erlich ascitic tumor.
INTRODUCCIÓN
Cada día toma auge la búsqueda de fármacos procedentes de la naturaleza. Se estima que 40 % de los fármacos modernos provienen de fuentes silvestres.1,2
Hacia finales de 1950 se comenzó una intensiva revisión de plantas, microorganismos y animales marinos respecto a su actividad antitumoral. Los estudios de tamizaje han dado como resultado la identificación y el aislamiento de muchas nuevas sustancias naturales dotadas de actividad antitumoral que se consideran suficientemente activas como para comenzar estudios clínicos entre ellos se encuentra el Taxol® y otros, pero aún son insuficientes.3-5
Una de las investigaciones que se lleva a cabo es la búsqueda de agentes antitumorales de origen natural pero de un ángulo distinto a los citostáticos ya conocidos, se introducen pruebas para la detección de actividades antitumorales indirectas que influyan sobre la proliferación maligna como modificadores de la respuesta biológica.6 Entre el primer grupo de reguladores de la respuesta biológica que se usa en oncología se encuentran los inmunomoduladores, los cuales actúan estimulando el sistema inmune.7,8
El interés en tales "reguladores biológicos" procede en primer lugar, del reconocimiento de las limitaciones de la quimioterapia clásica, que no ha sido capaz de modificar cifras de supervivencia en neoplasias tan frecuentes como tumores de pulmón y del aparato digestivo y, en segundo lugar, la aparición de datos en la literatura que indican la posibilidad real de controlar el crecimiento de tumores por medio de mecanismos biológicos. En la década de los ochenta en el Instituto de Oncología y Radiobiología (INOR) se evaluó la inducción del rechazo del tumor ascítico de Erlich (TAE) en animales de experimentación, mediante la obtención de compuestos a partir de polisacáridos de algas con actividad antitumoral, probablemente por mecanismos de inmunoestimulación.9
También se han encontrado especies de bacidiomicetos, en las cuales se han aislado polisacáridos con acción antitumoral, relacionada esta con la activación que provocan esas sustancias en la respuesta inmunológica del hospedero.10 Por esta razón continúa siendo un objetivo de interés la búsqueda de productos naturales que de una forma u otra impidan el prendimiento y desarrollo del tumor, y es de interés aquellos productos que inhiban el desarrollo tumoral indirectamente.
En este trabajo se evalúa la probable actividad inmunoestimulante de 32 extractos de plantas de la flora cubana en ratones inoculados con en el TAE, para obtener nuevos compuestos que estimulen el organismo e inhiban de esta forma el desarrollo tumoral.
MÉTODOS
Especie animal y línea: se emplearon ratones machos de la línea NMR1 entre 18 y 20 g de peso corporal, procedentes del Centro Nacional para la Producción de Animales de Laboratorio (CENPALAB). Todos los animales fueron mantenidos en condiciones controladas de temperatura (21-25 °C), humedad relativa (50-70 %) y ciclos de luz de 12 h/d, alimentados a voluntad con pienso en forma de pelotillas suministrado por CENPALAB y agua acidulada.
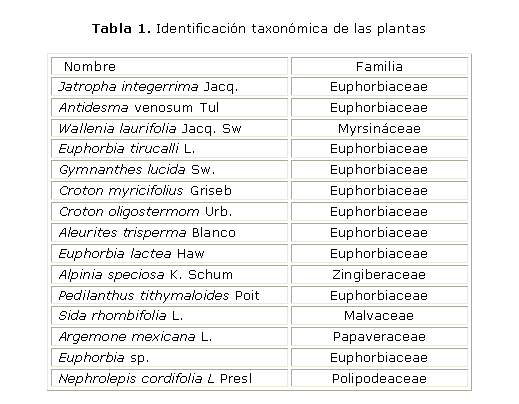
Preparación de los extractos: se evaluaron 32 extractos de las familias Euphorbiaceae, Malvaceae, Myrsinaceae, Papaveraceae, Polipodeaceae y Zingiberaceae, los cuales se obtuvieron de las hojas y los frutos de las plantas recolectadas del Jardín Botánico Nacional y otras zonas de La Habana. Su identificación taxonómica se realizó en el Herbario del Jardín Botánico Nacional (La Habana, Cuba) con la colaboración de la Dra. C. Cristina Panfet (tabla 1). Los extractos se codificaron según las normas regidas por el Laboratorio de Oncofarmacología del INOR (tabla 2).
Tabla 2. Datos de los extractos ensayados
| Extracto codificado | Familia | Zona de colecta | Parte de la planta | Tipo de extracto | Toxicidad | Dosis utilizadas |
| QT2B01 | Euphorbiaceae | Centro Habana | hojas | APM | No tóxico | 100, 200, 400 |
| QT2B02 | Euphorbiaceae | Centro Habana | hojas | APM | No tóxico | 6,25, 12,5, 25 y 50 |
| QT2B07 | Zingiberaceae | Plaza | hojas | BPM | Tóxico en dosis | 50, 100 y 200 |
| QT2B08 | Euphorbiaceae | Víbora | hojas | BPM | Tóxico en dosis | 12,5, 25 y 50 |
| QT2B12 | Malvaceae | Guanaba-coa | hojas | APM | tóxico en dosis | 12,5, 25 y 50 |
| QT2B13 | Papaveraceae | Plaza | hojas | APM | Ligeramente tóxico | 6,25, 12,5, 25 y 50 |
| QT2B14 | Zingiberaceae | Plaza | hojas | APM | Tóxico en dosis | 12,5, 25 y 50 |
| QT2B15 | Euphorbiaceae | Centro Habana | hojas | APM | No tóxico | 75, 150 y 300 |
| QT2B16 | Euphorbiaceae | Víbora | hojas | APM | No tóxico | 100,200 y 400 |
| QT2B18 | Polipodeaceae | Vedado | hojas | APM | Tóxico en dosis | 12,5, 25 y 50 |
| QT2B21 | Polipodeaceae | JBN | hojas | APM | Tóxico en dosis | 12,5, 25 y 50 |
| QT2B23 | Euphorbiaceae | JBN | frutos | APM | Tóxico en la dosis | 12,5, 25 y 50 |
| QT2B27 | Euphorbiaceae | JBN | hojas | APM | Tóxico en la dosis | 12,5, 25 y 50 |
| QT2B28 | Euphorbiaceae | JBN | hojas | APM | Ligeramente | 200, 100 y 50 |
| QT2B30 | Euphorbiaceae | JBN | hojas | BPM | Tóxico en dosis | 25, 50 y 100 |
| QT2B31 | Euphorbiaceae | JBN | hojas | APM | Tóxico en dosis | 12,5, 25 y 50 |
QT2B32 | Euphorbiaceae | JBN | hojas y frutos | BPM | Tóxico en dosis | 25, 50 y 100 |
| QT2B33 | Myrsinaceae | JBN | hojas | APM | No tóxico | 100, 200 y 400 |
| QT2B34 | Euphorbiaceae | JBN | hojas | APM | No tóxico | 100, 200 y 400 |
| QT2B35 | Euphorbiaceae | JBN | hojas | BPM | No tóxico | 100, 200 y 400 |
APM: alto peso molecular, BPM: bajo peso molecular, JBN: jardín botánico nacional. No se indican las especies por posibilidad de patente.
Extractos de bajo peso molecular (BPM)
El material vegetal previamente lavado se secó en una estufa bajo corriente de aire a una temperatura < 40 oC, se molió en un molino de cuchillas y se pesó. El material molido se extrajo previamente con éter de petróleo en una relación 1:2 (p:v) a temperatura ambiente con agitación durante 24 h. Se filtró este extracto etéreo y se procedió a secar a temperatura ambiente el material vegetal. El material seco se extrajo con etanol 95 % en una relación 1:10 (p:v) mediante agitación en una zaranda. Los extractos previamente filtrados se concentraron a sequedad bajo presión reducida en un rotoevaporador a temperatura < 40 °C.
Extractos de alto peso molecular (APM)
El material vegetal se cortó finamente y se pesó. El material se lavó 2 veces, primero con agua y después con agua destilada. Se procedió a secar antes al aire. El material seco se extrajo con agua destilada 10 % (p:v) durante 24 h a temperatura ambiente con agitación en una zaranda. Esta extracción se realizó 2 veces. Los extractos se filtraron y se unieron, se concentraron por rotoevaporación hasta un volumen de 1 L a temperatura < 40 °C. La eliminación del agua restante se realizó por liofilización.
Selección de las dosis
Se realizó un estudio previo de toxicidad de cada extracto utilizando las dosis de 400, 200 y 100 mg/kg definidas por el Laboratorio de Oncofarmacología del INOR; excepto en los extractos QT2B02, QT2B015 y QT2B38, en los cuales se emplearon niveles de dosis inferiores por dificultades con la solubilidad del extracto en la solución de cloruro sodio 0,9 % (NaCl). A partir de los resultados obtenidos en los estudios de toxicidad de cada extracto (tabla 2) se seleccionaron las dosis, las cuales se usaron en la evaluación de la actividad antitumoral. Para cada uno de los extractos se utilizaron 3 dosis y como solvente NaCl 0,9 % (tabla 2).
Diseño experimental
Se tomaron 50 ratones de la línea NMRI machos y se distribuyeron al azar en 4 grupos de 10 animales, los cuales fueron pretratados con los 3 niveles de dosis de los extractos por la vía intraperitoneal durante 5 días de tratamiento. Además se trabajó con un grupo control negativo de 20 ratones, en el cual se procedió de forma similar pero se le administró NaCl al 0.9 %. A las 48 h de finalizado el tratamiento, se inocularon las células tumorales del TAE, donde se le inoculó a cada animal 2 x 106 células. Los animales se mantuvieron en observación durante 30 d. La actividad indirecta se determinó por rechazo al implante del tumor (TAE) de los animales tratados con los extractos evaluados en presencia de un grupo control tratado con solución salina fisiológica 0,9 % e inoculado con el tumor (TAE) en las mismas condiciones. Se consideró que el producto era activo si provocaba un rechazo a la implantación del tumor mayor o igual que 50 % de los animales tratados con el extracto.
RESULTADOS
De los 18 extractos acuosos de alto peso molecular (APM) estudiados manifestaron actividad antitumoral indirecta 3 de ellos, el QT2B18 (12,5 mg/kg) perteneciente a una especie de la familia Polipodeaceae y los extractos QT2B35 (25 mg/kg) y QT2B41 (100 mg/kg) procedentes de especies de la familia Euphorbeaceae. Estos extractos inhibieron en una de sus dosis ensayadas el desarrollo del TAE. En la tabla 3 se muestra el valor en porcentaje de animales vivos y sin signos de presencia del tumor al cabo de los 30 d de observación, lo cual demuestra que son activos porque al final del experimento más de 60 % de los animales tratados con el extracto no presentaron crecimiento tumoral.
En la tabla 4 se muestra que de los 14 extractos de bajo peso molecular (BPM) en estudio mostraron un rechazo al prendimiento del TAE 60 % de los animales tratados con los extractos QT2B07 (200 mg/kg) y QT2B42 (100 mg/kg) pertenecientes a la familia Zingibericeae y Euphorbeaceae, respectivamente. Por lo cual pueden considerarse activos en esas dosis ensayadas mientras que en el grupo control negativo todos los animales presentaron tumor.
DISCUSIÓN
El análisis de los resultados obtenidos en la actividad antitumoral indirecta de los extractos procedentes de productos naturales indica que provocan un aumento de la resistencia al crecimiento del TAE, al ser administrados previamente de la inoculación del tumor, resultado similar a lo descrito por Pérez y otros11 y para otros productos de origen marino como por ejemplo el Coralán y extractos de algas, los cuales dadas las mismas condiciones inhibieron en 70 % el TAE en pretratamiento.12,13
Estos resultados apuntan que la acción de los extractos estudiados sobre las células tumorales puede estar relacionada con la estimulación de los mecanismos de defensa del organismo, aunque esta hipótesis debe ser confirmada con otras pruebas efectoras del sistema inmune, como se describe para otros productos inmunomoduladores.14-19
El extracto QT2B18 reviste importancia porque mostró una estimulación del organismo en pretratamiento y se han obtenido también valores de supervivencia favorables en otro modelo de tumor de forma ascítica cuando ya se encuentra en desarrollo.20
En la literatura revisada no se encuentran muchos extractos procedentes de plantas que presenten actividad antitumoral indirecta in vivo, pero sí se han obtenido de origen bacteriano o fungoso, principalmente polisacáridos antitumorales obtenidos de basidiomicetos.21-23 Un ejemplo de ello es cómo en China se han aislado polisacáridos de un hongo comestible y medicinal, donde se logró una formulación (LENTINAN), la cual en estudios biológicos contra varios tumores experimentales prolonga la vida y reduce el tamaño del tumor; y en estudios clínicos, combinado con otras drogas incrementa la reducción del tumor y prolonga la vida en pacientes con cáncer gástrico.24-26
De los 32 extractos evaluados procedentes de especies de la flora cubana solo 5 de ellos manifestaron un efecto sobre la inhibición del crecimiento tumoral en pretratamiento, lo que pudiera atribuirse a su posible efecto sobre el sistema inmune de los animales, aunque esta hipótesis debe ser confirmada con otras pruebas biológicas efectoras del sistema inmune.
AGRADECIMIENTOS
Por su participación en este trabajo, a los técnicos, Miguel José Acuña, Melba Betancourt, Lisbet Pimienta, Madelin Cruz, y María Luisa Acevedo del Laboratorio de Oncofarmacología y del Laboratorio de Química y Toxicología, de la Unidad de Evaluación de Productos Antitumorales.
REFERENCIAS BIBLIOGRÁFICAS
1. Valladares Cisneros MG. Las plantas medicinales fuentes de mezclas y compuestos. Hypatia-Revista Científico de Divulgación Científica- Tecnología del Estado de Morelos. 2011;17:18. Disponible en: http://hypatia.morelos.gob.mx
2. Liu EH, Qi LW, Wu Q, Peng YB, Li P. Anticancer agents derived from natural products. Mini Rev Medical Chemical. 2009;13:1547-55.
3. Quiroga M. Los productos naturales como antitumorales. Monografías; 2004. Disponible en: http://www.monografias.com/trabajos16/productos-naturales-antitumorales/productos-naturales-antitumorales.shtmlo
4. Gonzaga ML, Bezerra DP, Alves AP, de Alencar NM, Mesquita R de O, Lima MW et. al. In vivo growth-inhibition of Sarcoma 180 by an alpha-(1—>4)-glucan-beta-(1—>6)-glucan -protein complex polysaccharide obtained from Agaricus blazei Murill. J Nat Med. 2009;63(1):32-40.
5. Gurgel AP, da Silva JG, Grangeiro AR, Oliveira DC, Lima CM, da Silva AC, et al. In vivo study of the anti-inflammatory and antitumor activities of leaves from Plectranthus amboinicus (Lour) Spreng (Lamiaceae). J Ethnopharmacol. 2009;125(2):361-3.
6. Fidler IJ, Berendt M, Oldham RK. The rationale for and desing of a screening procedure for the assessment of biological response modifiers for cancer treatment. J Biol Resp Modif. 1982;1:15-26.
7. Benny KH, Tan. J. Vanitha. Immunomodulatory and antimicrobial effects of some traditional chinese medicinal herbs. A Review. Current Medicinal Chemistry. 2004;11:1423-30.
8. Kanestski RG. Interacción del tumor y el organismo. Kiev: Naukova Dunska; 1977.
9. Lage A. Evolución y estado actual de programa de tamizaje. Rev Cubana Oncol. 1985;1(2):164-75.
10. Yun-Hee S, Kyung-Soo N. Antimutagenicity and induction of anticarcinogenic phase II enzymes by basidiomicetes. J Ethnopharmacol. 2001;77:103-9.
11. Pérez RP, Ávila AD, Edgill R, Colom Y, Quesada W, Bello JL, et al. Actividad antitumoral de una mezcla de polisacáridos obtenida de la especie Argemone mexicana L. Rev Cubana Plant Med. 2005;10(3-4).
12. Bello JL, Pereda CM, Silva JP, Mainardi JV, Fernández LE. Influencia del tratamiento con polisacáridos de origen marino sobre el prendimiento del tumor ascítico de Ehrlich. Rev Cubana Oncol. 1985;1:200-7.
13. Bello JL. Estudio antitumoral indirecto. Rev Cubana Oncol. 1991;7(1):34-3.
14. Pereda CM. Actividad biológica de biopolímeros de origen marino. Influencia sobre la actividad de macrófagos provenientes de ratón. Rev Cubana Oncol. 1990;6(2):270-1.
15. Pereda CM. Actividad biológica de biopolímeros de origen marino. Influencia sobre la actividad asesina NK en el ratón. Rev Cubana Oncol. 1990;6(2):265-9.
16. Pereda CM. Actividad biológica de biopolímeros de origen marino. Influencia sobre la metastización pulmonar. Rev Cubana Oncol. 1990;6(2):275-80.
17. Itoh H. Antitumor activity and immunological properties of marine algae polysaccharides. Anticancer Research. 1993;13:475-80.
18. Song JV, Yang HO, Pyo SN, Jung IS. Inmunomodulatory activity of protein-bound polisaccaharide extracted from Chelidonium majus. Arch Pharmacology Research. 2002;25(2):158-64.
19. Pandey R, Maurya R, Singh G, Sathiamoorthy B, Naik S. Inmunosupressive properties of flavonoids isolated from Boerhaavia diffusa Linn. Int Inmunopharmacol. 2005;5(3):541-53.
20. Colom Y, Azcue M, Pérez R, Respall M, Ruiz R, Quesada W. Evaluación antitumoral de extractos de plantas de la flora cubana en el tumor experimental leucemia linfocítica P388. Rev Cubana Plant Med. 2005;10(2).
21. Ito H, Hidaka H, Sugiura M. Effects of Coriolan, an antitumor polysaccharide, produced by Coriolus versicolor. Iwade Jap J Pharmacol. 1979;29:953-7.
22. Fidler I, Berendt M, Oldham RK. The nationale from design of screening procedure for assessment of biological response modifiers for cancer treatment. J Biological Response Modifiers. 1982;1(1).
23. Mizuno T, Ohsawa K, Hagiwara N, Kuboyama R. Fractionation and characterization of antitumor polysaccharides from Maitake, Grifola frondosa. Agric Biol Chem. 1986;50:1679-88.
24. Chihara G, Maeda Y, Hamuro J, Sasaki T, Fukuoka F. Inhibition of mouse sarcoma-180 by polysaccharides from Lentinus edodes (Berk.) Sing. Nature (Lond). 1969;222:687-8.
25. Furue H, Itoh I, Kimura T. Phase III study on Lentinan. Jap J Cáncer Chemother. 1981;8:944-82.
26. Taguchi T, Furue H, Kimura T, Kondo T, Hattori T, Itoh T, et al. Endpoint results of phase III study of Lentinan. Jap J Cáncer Chemother. 1985;12:366-80.
Recibido: 11 de mayo de 2011.
Aprobado: 25 de enero de 2012.
Yamila Colom Loo. Instituto de Oncología y Radiobiología (INOR). Unidad de Evaluación e Investigación de Productos Antitumorales. Departamento de Ensayos Preclínicos. Calle 29 y E, Vedado. La Habana, Cuba. CP 10400. Teléf.: (537) 55-25-89. Correo electrónico: yamilacolom@yahoo.es; mairelyazcue@infomed.sld.cu