Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Plantas Medicinales
versión On-line ISSN 1028-4796
Rev Cubana Plant Med vol.17 no.2 Ciudad de la Habana abr.-jun. 2012
ARTÍCULO ORIGINAL
Efeitos citotóxico, genotóxico e mutagênico da tintura de Matricaria chamomilla L. in vivo
Efectos citotóxico, genotóxico y mutagénico in vivo de la tintura de Matricaria chamomilla L.
The cytotoxic, genotoxic and mutagenic effects of Matricaria chamomilla L. tincture in vivo
MSc. Juliana Macedo Delarmelina, Dra. C. Maria do Carmo Pimentel Batitucci, Lic. Jefferson Luiz de Oliveira Gonçalves
Universidade Federal do Espírito Santo, Vitória, ES. Brasil.
RESUMEN
Introdução: Matricaria chamomilla L. é uma planta pertencente à família Asteraceae cujo nome popular é camomila branca. Suas flores possuem diversas substâncias com propriedades terapêuticas para cura e prevenção de diversos males, dentre eles, desconforto gastrointestinal, inflamações, estresse e hipertensão.
Objetivos: avaliar a atividade citotóxica, genotóxica e mutagênica in vivo da tintura vegetal de Matricaria chamomilla utilizando o ensaio de micronúcleo em medula óssea de roedores, n= 6/grupo e o teste em Allium cepa L.
Métodos: para a realização do ensaio de micronúcleo foram determinados 6 grupos experimentais, os quais foram administrados: cisplatina (controle positivo), solução salina 0,9 % (controle negativo), álcool etílico 64 % (controle solvente da droga), tintura de Matricaria chamomilla 0,02 e 0,1 µL/g/d proporcionais a 20 e 100 gotas diárias, respectivamente, considerando-se um indivíduo adulto de 75 kg, e dosagem supra-clínica (400 µL/d). Os animais foram expostos a 5 d de tratamento e sacrificados no sexto, com exceção do controle positivo. Para a realização do teste em Allium cepa foram determinados 5 grupos experimentais, os quais foram administrados: água destilada (controle negativo), tintura de Matricaria chamomilla nas concentrações de 1 e 5 mg/mL e álcool 64 % diluído nas mesmas proporções que a tintura (controle solvente da droga 1 e 2).
Resultados: os resultados demonstraram que a tintura de Matricaria chamomilla não foi mutagênica, genotóxica e citotóxica nas concentrações testadas, com exceção da dosagem supra-clínica, que apresentou mutagenicidade.
Conclusões: a tintura de Matricaria chamomilla quando administrada em dosagens proporcionais às preconizadas para humanos, não demonstrou citotoxicidade e mutagenicidade para camundongos e genotoxicidade em Allium cepa, chamando atenção para seu uso sob cautela em elevadas quantidades.
Palavras chave: tintura, Matricaria chamomilla L., citotoxicidade, genotoxicidade, mutagenicidade, micronúcleo, Allium cepa L.
RESUMEN
Introducción: Matricaria chamomilla L. es una planta perteneciente a la familia Asteraceae, cuyo nombre popular es camomila blanca. Sus flores poseen diversas sustancias con propiedades terapéuticas para la cura y prevención de diversos males, entre ellos, malestar gastrointestinal, inflamaciones, estrés e hipertensión.
Objetivos: evaluar la actividad citotóxica, genotóxica y mutagénica in vivo de la tintura vegetal de Matricaria chamomilla utilizando el ensayo de micronúcleo en médula ósea de roedores, n= 6/grupo y la prueba en cepa Allium L.
Métodos: para la realización del ensayo de micronúcleo fueron determinados grupos experimentales, a los cuales se les administró: cisplatina (control positivo), solución salina 0,9 % (control negativo), alcohol etílico 64 % (control solvente de la droga), tintura de Matricaria chamomilla 0,02 y 0,1 µL/g/d proporcionales a 20 y 100 gotas diarias, respectivamente, partiendo de un individuo adulto de 75 kg y dosificación supraclínica (400 µL/d). Los animales fueron expuestos a 5 d de tratamiento y sacrificados en el sexto, con excepción del control positivo. Para la realización de la prueba en cepa Allium, se determinaron 5 grupos experimentales, a los cuales se les administró agua destilada (control negativo), tintura de Matricaria chamomilla en concentraciones de 1 y 5 mg/L, y alcohol 64 % diluido en las mismas proporciones que la tintura (control solvente de la droga 1 y 2).
Resultados: la tintura de Matricaria chamomilla no fue mutagénuca, genotóxica ni citotóxica en las concentraciones probadas, con excepción de la dosificación supraclínica que presentó mutagenicidad.
Conclusiones: la tintura de Matricaria chamomilla cuando se administra en dosificaciones proporcionales como las indicadas para humanos, no demostró citotoxicidad ni mutagenicidad en pequeños ratones domésticos ni genotoxicidad en cepa Allium, aunque se recomienda su uso con precaución en elevadas cantidades.
Palabras clave: tintura, Matricaria chamomilla L., citotoxicidad, genotoxicidad, mutagenicidad, micronúcleo, cepa Allium L.
ABSTRACT
Introduction: Matricaria chamomilla L. is one plant of Asteraceae family, whose common name is white chamomille. Its flowers have different substances with therapeutic properties for healing and prevention of various ailments, among them, gastrointestinal upset, inflammation, stress and hypertension.
Objectives: to in vivo evaluate the cytotoxic, genotoxic and mutagenic activity of Matricaria chamomilla vegetal tincture, using the micronucleus assay in rodent bone marrow (n= 6/group) and the Allium cepa L. test.
Methods: for the carrying out of micronucleaus assay, 6 experimental groups were formed and administered: cisplatin (positive control), 0.9 % saline solution (negative control), 64 % alcohol (solvent control drug), Matricaria chamomilla tincture at 0,02 and 0,1 µL/g/d doses, equivalent to 20 and 100 drops daily, respectively, considering an adult (75 kg) and the above-clinical dose (400 µL/d). The animals were exposed to 5 days of treatment, and slaughtered on the sixth, with the exception of positive controls. As for the test in Allium cepa, 5 experimental groups were determined, and administered distilled water (negative control), Matricaria chamomilla in concentrations of 1 and 5 mg/mL and 64 % diluted alcohol in the same proportions as the tincture (solvent control drug 1 and 2).
Results: the results demonstrated that Matricaria chamomilla tincture was neither mutagenic, genotoxic nor citotoxic at tested concentrations, with the exception of the above-clinical dose, which showed mutagenicity.
Conclusions: Matricaria chamomile tincture when administered in concentrations proportional to those prescribed to humans, showed neither cytotoxicity nor mutagenicity in mice and just genotoxicity in Allium cepa, paying attention to its careful use in high quantities.
Key words: tincture, Matricaria chamomilla L., cytotoxicity, genotoxicity, mutagenicity, micronucleus, Allium cepa L.
INTRODUÇÃO
Matricaria chamomilla L. (sin. Chamomilla recutita L. e Matricaria recutita L. Rauschert) conhecida popularmente como camomila branca, é uma planta herbácea, anual, aromática, pertencente à família Asteraceae, nativa dos campos da Europa e aclimatada em algumas regiões da Ásia e nos países latinos.1 Goza de notada importância pelo seu valor medicinal, sendo utilizada na medicina popular principalmente pelas suas propriedades carminativas, espasmolíticas, anti-inflamatórias, ansiolíticas, contra ferida estomacal e síndrome do intestino irritado.2-4 Dentre as atividades farmacológicas testadas até o momento foram relatadas sua eficácia na diminuição do estresse, na aceleração da cicatrização de feridas em animais, benefícios em animais com diabetes, potencial in vitro contra o câncer e eficaz inibição da abstinência e dependência de morfina em ratos.5-9
A parte da planta utilizada para fins terapêuticos é constituída dos seus capítulos florais secos de onde se obtém óleo essencial e flavonóides.1
Apesar da atividade antioxidante da tintura de M. chamomilla ser comprovada,10 estudos científicos que corroborem com seu uso ainda são escassos, principalmente os que envolvem sua avaliação em sistema teste in vivo, para verificação de efeitos tóxicos.
Dentre os testes de avaliação toxicológica preconizados pelas agências internacionais e instituições governamentais, o teste de micronúcleo em medula óssea de roedores in vivo é amplamente recomendado para avaliação e registro de novos produtos químicos e farmacêuticos que entram anualmente no mercado mundial.11-13 Outro sistema teste útil é o realizado em células meristemáticas de Allium cepa devido à sua sensibilidade e sua boa correlação com outros sistemas-teste, principalmente com de mamíferos.14-17
Sendo assim, este estudo teve como foco avaliar os potenciais efeitos citotóxico, genotóxico e mutagênico in vivo da tintura vegetal de M. chamomilla.
MÉTODOS
Tintura vegetal
As amostras da tintura vegetal de M. chamomilla foram adquiridas na farmácia com manipulação Essência, localizada em Vitória, Espírito Santo, Brasil na concentração de 20 mg/mL (álcool 64 %).
Ensaio in vivo em medula óssea de roedores
Foram utilizados camundongos Swiss (Mus musculus), machos e fêmeas, com idade entre 7 a 12 semanas, selecionados aleatoriamente e fornecidos pelo biotério da Universidade Federal do Espírito Santo, Brasil. Os animais foram mantidos agrupados em gaiolas plásticas, em sala climatizada sob temperatura constante, com ciclo claro-escuro de 12 h. O regime alimentar foi o clássico, com ração comercial padrão e água fornecida ad libitum. Determinaram-se seis grupos experimentais, cada qual com 6 animais (3 machos e 3 fêmeas), como demonstrado na Tabela 1.
Os tratamentos, com exceção do Grupo I, foram realizados por gavage. Cada grupo foi tratado durante cinco dias, com exceção do Grupo I, que recebeu uma dose única e foi sacrificado após 24 h. Os ensaios foram realizados de acordo com os princípios éticos de experimentação animal do Comitê de Ética no Uso de Animais da Universidade Federal do Espírito Santo (CEUA/UFES).
O sacrifício foi feito por deslocamento cervical, com posterior retirada de ambos os fêmures de cada camundongo. As lâminas foram confeccionadas e coradas com eozina azul de metileno segmento Leishman (Cromoline Brasil), para a diferenciação das células sanguíneas, principalmente os eritrócitos policromáticos (PCE), eritrócitos normocromáticos (NCE) e eritrócitos policromáticos micronucleados (MNPCE).12 Para a determinação da mutagenicidade, um total de 2 000 PCEs foram analisados/animal (1 000/lâmina), para o registro da freqüência de MNPCEs. Para a determinação da citotoxicidade, um total de 400 eritrócitos (PCE+ENC) foram contados por animal (200/lâmina) e o registro da frequência de PCEs foi calculado (PCE/PCE+NCE). As lâminas foram analisadas em teste cego, utilizando microscópio óptico com aumento de 1.000x.18
Ensaio in vivo em sistema teste Allium cepa L.
As sementes de A. cepa foram submetidas à germinação em água destilada até que as raízes atingissem aproximadamente 0,5 cm. Posteriormente, cerca de 30 raízes foram transferidas para 5 placas de Petri, cada qual com uma substância teste, totalizando 5 grupos experimentais, como demonstrado na Tabela 2.
Vinte e quatro horas após o início do tratamento, as sementes foram coletadas e fixadas em carnoy acético e posteriormente as lâminas foram confeccionadas19 para análise em microscópio óptico. Foram analisadas 5.000 células por tratamento, considerando-se como parâmetros os índices mitótico (IM), de efeito clastogênico (IEC) e de efeito aneugênico (IEA).
Análise estatística
A análise estatística utilizou o método de Análise de Variância (ANOVA) e o teste a posteriori de Tukey, com p< 0,05 (5 %) para as diferenças estatísticas significativas, em ambos os sistemas-teste.
RESULTADOS
Ensaio in vivo em medula óssea de roedores
Os testes in vivo em medula óssea revelaram que a tintura vegetal de M. chamomilla não apresenta efeito citotóxico e mutagênico quando administrada nas dosagens de 0,02 e 0,1 µL/g/d (correspondente a 20 e 100 gotas diárias, respectivamente) e que a dosagem supra-clínica apesar de não promover um efeito citotóxico, apresenta um efeito mutagênico quando comparado ao controle negativo, sem, no entanto, alcançar os níveis de mutagenicidade apresentados pela ação da cisplatina (controle positivo), como demonstrado nas tabelas 3 e 4.
O grupo controle solvente da droga não foi utilizado para análises estatísticas, uma vez que as fêmeas não sobreviveram ao tratamento de 5 d.
Ensaio in vivo em sistema teste Allium cepa L.
Os testes in vivo em A. cepa revelaram que a tintura não apresenta efeito citotóxico quando administrada nas dosagens de 1 e 5 mg/mL como demonstrado na figura 1.
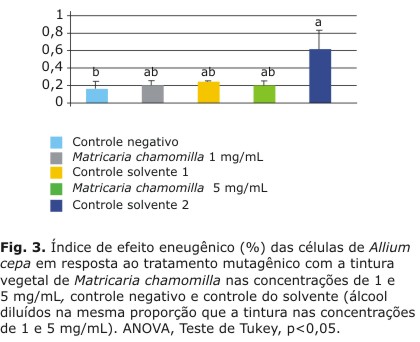
Além disso, as concentrações testadas não apresentaram efeito clastogênico e aneugênico, não apresentando, portanto, efeito genotóxico, como demonstrado nas figuras 2 e 3.
Como observado, o controle solvente da droga 2 apresentou um maior índice de efeito aneugênico, demonstrando-se estatisticamente diferente ao controle negativo.
DISCUSSÃO
Os resultados obtidos são comparáveis a estudos também realizados com tinturas, em que testes in vitro e in vivo não detectaram dano citotóxico significativo nem a ocorrência de efeitos genotóxico e mutagênico.20,21
Muitos estudos com plantas da família Asteraceae demonstram, como no presente estudo, a ausência de mutagenicidade e/ou citotoxicidade.22-24 Por outro lado, muitos produtos derivados de plantas tidas como medicinais podem apresentar efeito nocivo.25 Podemos considerar aqui algumas plantas que já possuem a sua ação tóxica comprovada, como a Braccharis trimera (Less.) DC., conhecida popularmente como carqueja e que seu chá apresenta efeito mutagênico26 e a própria M. chamomilla, que em outros estudos realizados no sistema teste Allium cepa demonstrou-se genotóxica nas concentrações testadas.27
A dosagem supra-clínica, por sua vez, aumentou significativamente a quantidade de micronúcleos ao ponto de ser estatisticamente diferente ao controle negativo no teste em medula óssea de roedores, porém não induziu tantos danos como a cisplatina (controle positivo). Muitos compostos que fazem parte da composição química das plantas utilizadas como medicinais, podem ser mutagênicos e até carcinogênicos quando ingeridos de forma indiscriminada, situação que pode ser alcançada rapidamente com o aumento da dose.23 A segurança ou toxicidade na utilização dos produtos de origem natural dependem do tempo de exposição ou da dose utilizada,28 esta afirmação nos faz refletir quanto ao limite de segurança para o uso de uma tintura, mesmo que ela não exponha ações danosas em baixas concentrações.
Apesar de aumentar a frequência de micronúcleos, a dosagem supra-clínica não apresentou citotoxicidade. Essa informação não exclui a possibilidade de ocorrência de danos ao DNA como abordado anteriormente, somente determina que os efeitos não foram suficientes para uma morte rápida da célula.
Como já esperávamos, nossos resultados corroboram os dados da literatura demonstrando o efeito mutagênico da cisplatina, expresso pelo aumento significativo da freqüência de micronúcleos e seu efeito citotóxico, expresso pela redução do número de PCEs no total de eritrócitos, quando comparado ao grupo controle sem exposição (p< 0,05; ANOVA, teste de Tukey). Alguns agentes antineoplásicos, como a cisplatina, apresentam propriedades alquilantes, complexando-se com o DNA, de forma indiscriminada, tanto em células normais quanto nas cancerosas. Desta forma, paradoxalmente, inúmeros relatos na literatura apontam para seu potencial carcinogênico.29
A utilização do grupo III, no teste de micronúcleo, ficou inviável nesta pesquisa, uma vez que o grupo amostral, devido ao óbito de 50 %, ficou pequeno para cálculos estatísticos. Entretanto, outros estudos com tinturas vegetais demonstram que o etanol administrado como controle do solvente da droga não afeta o parâmetro que indica dano genético (%MNPCE),20 justificando assim a baixa incidência de micronúcleos observada quando administrada em dosagens baixas (0,02 e 0,1 µL/g/d). Somente em doses elevadas, o álcool aumenta a quantidade de danos ao DNA, o que justifica o óbito da metade do grupo, demonstrando seu efeito tóxico quando ingerido em elevada quantidade.5 O óbito somente de camundongos fêmeas pode ser decorrente de outros fatores associados, como por exemplo, sua regulação hormonal. Resultados de uma pesquisa realizada pela Oregon Health & Science University e Portland Veterans Affairs Medical Center sugerem que as fêmeas são mais vulneráveis aos efeitos neurotóxicos do álcool.30
Uma possibilidade de comparação dos nossos dados com os anteriormente descritos na literatura seria a administração do álcool, nas mesmas concentrações que as testadas com a tintura no teste de micronúcleo (0,02 e 0,1 µL/g/d), o que será proposto futuramente.
Os resultados observados utilizando-se o sistema teste A. cepa, reforçam os resultados obtidos no ensaio de micronúcleo, uma vez que as concentrações testadas não apresentaram citotoxicidade e genotoxicidade.
Considerando-se o uso da tintura de M. chamomilla como fitoterápico, o presente estudo contribuiu para um melhor entendimento de sua ação sobre a célula e o material genético, podendo ser utilizada de maneira mais segura, uma vez que quando administrada em dosagens proporcionais às preconizadas para humanos, não demonstrou efeito citotóxico, genotóxico e/ou mutagênico, chamando atenção para seu uso sob cautela.
AGRADECIMENTOS
A Luciano Becavello pela colaboração no desenvolvimento desta investigação. A William M. Delarmelina pelo auxílio estatístico.
REFERÊNCIAS
1. Souza JRP, Rocha JN, Melo JM, Nixdorf SL. Ação do estresse térmico na sobrevivência de mudas e produção de camomila originadas de sementes importadas e nacionais. Hortic Bras. 2006;24(2):233-6.
2. Robbers JE, Speedie MK, Tyler VE. Pharmacognosy and Pharmacobiotechnology-International Edition. London: Ed. Williams & Wilkins; 1996; p.87.
3. Viola H, Wasowski C, Levi SM, Wolfman C, Silveira R, Dajas F, et al. Apigenin, a component of Matricaria recutita flowers, is a central benzodiazopine receptor-ligand with anxiolytic effects. Planta Med. 1995;61(3):213-6.
4. Achterrath-Tuckermann U, Kunde R, Flaskamp E, Isaac O, Thiemer K. Pharmacological investigations with compounds of chamomile. V. Investigations on the spasmolytic effect of compounds of chamomile and Kamillosan on the isolated guinea pig ileum. Planta Med. 1980;39(1):38-50.
5. Reis LSLS, Pardo PE, Oba E, Kronka SN, Frazatti-Gallina NM. Matricaria chamomilla CH12 decreases handling stress in Nelore calves. J Vet Sci. 2006;7(2):189-92.
6. Jarrahi M. An experimental study of the effects of Matricaria chamomilla extract on cutaneous burn wound healing in albino rats. Nat Prod Res. 2008;22(5):422-27.
7. Cemek M, Kaga S, Simsek N, Büyükokuroglu ME, Konuk M. Antihyperglycemic and antioxidative potential of Matricaria chamomilla L. in streptozotocin-induced diabetic rats. J Nat Med. 2008;62(3):284-93.
8. Srivastava JK, Gupta S. Antiproliferative and apoptotic effects of chamomile extract in various human cancer cells. J Agric Food Chem. 2007;55(23): 9470-78.
9. Gomaa A, Hashem T, Mohamed M, Ashry E. Matricaria chamomilla extract inhibts both development of morphine dependence and expression of abstinence syndrome in rats. J Pharmacol Sci. 2003;92(1):50-5.
10. Vicentino ARR, Menezes FS. Atividade antioxidante de tinturas vegetais, vendidas em farmácias com manipulação e indicadas para diversos tipos de doenças pela metodologia do DPPH. Rev Bras Farmacogn. 2007;17(3):384-7.
11 Choy WN, Dekker M. Regulatory genetic toxicology tests. New York: Genetic Toxicology and Cancer Risk Assessment; 2001. p. 93-113.
12 Ribeiro LR, Salvadori DMF, Marques EK. Mutagênese Ambiental. Canoas: Ed. Ulbra; 2003. p. 173-200.
13 Fagundes FA, Oliveira LB, Cunha LC, Valadares MC. Annona coriacea induz efeito genotóxico em camundongos. Rev Eletrônica Farmácia. 2005;2(1):24-9.
14.Bagatini MD, Silva ACF, Tedesco SB. Uso do sistema teste de Allium cepa como bioindicador de genotoxicidade de infusões de plantas medicinais. Rev Bras Farmacogn. 2007;17(3):444-7.
15. Grant WF. Chromosome aberrations in plants as amonitoring system. Environ Health Persp. 1978;27:37-43.
16. Fiskesjo G. The Allium test. In: wastewater monitoring. Environ Toxicol Water Qual. 1993;8(3):291-8.
17. Teixeira RO, Camparoto ML, Mantovani MS, Vicentini VEP. Assessment of two medicinal plants, Psidium guajava L. and Achillea millefolium L., in in vitro and in vivo assays. Genet Mol Biol. 2003;26(4):551-5.
18. Krishna G, Hayashi M. In vivo rodent micronucleus assay: protocol, conduct and data interpretation. Mutat Res. 2000;455(1-2):155-66.
19. Fiskejö G. The Allium-test as a standard in environmental monitoring. Hereditas. 1982;102(1):99-112.
20. Parra AV, Ruiz AR, González AV, Michalena MD, Badell JB. Centro de investigaciones y desarrollo de medicamentos: estudio genotoxico in vitro e in vivo en tinturas de Mellissa officinalis L. (toronjil) y Mentha piperita L. (toronjil de menta). Rev Cubana Plant Med. 1997;2(1):06-11.
21. Valsa JO, Felzenszwalb I. Genotoxic evaluation of the effect of Thuya occidentalys tinctures. Rev Bras Biol. 2001;61(2):329-32.
22. Ramos A, Rivero R, Victoria A, Piloto J, Garcia A. Assessment of mutagenicity in Parthenium hysterophorus L. J Ethnopharmacol. 2001;77(1):25-30.
23. Peron AP, Felipes J, Mattge GI, Cantagalli LB, Mariucci RG, Vicentini VEP. Avaliação mutagênica das plantas medicinais Baccharis trimera Less. e Solanum melongena L. em células de medula óssea de ratos Wistar. Rev Bras Bioci. 2008;6(2):127-30.
24. Macedo MFS, Sisenando Herbert AAACN, Queiroz JDF, Argolo ACC, Saturnino ACRD, Coelho LCBB, et al. Determining the genotoxicity of an aqueous infusion of Bauhinia monandra leaves. Rev Bras Farmacogn. 2008;18(4):509-16.
25. Varanda EA. Atividade mutagênica de plantas medicinais. Rev Ciênc Farm Básica Apl. 2006;27(1):1-7.
26. Pinho DS, Sturbelle RT, Martinho-Roth MG, Garcias GL. Avaliação da atividade mutagênica da infusão de Baccharis trimera (Less.) DC. em teste de Allium cepa e teste de aberrações cromossômicas em linfócitos humanos. Rev Bras Farmacogn. 2010;20(2):165-70.
27. Vieira A, Guimarães MA, David GQ, Karsburg IV, Campos ANR. Efeito genotóxico da infusão de capítulos florais de camomila. Rev Trópica Ciências Agrárias Biológicas. 2009;3(1):13.
28. SchimittaE, Manfred M, Jonasa R, Dekanta W, Stopper H. Genotoxic activity of four metabolites of the soy isoflavone daidzein. Mutat Res. 2003;542(1-2):43-8.
29. Valadares MC, Castro NC, Cunha LC. Synadenium umbellatum: citotoxicidade e danos ao DNA de células da medula óssea de camundongos. Rev Bras Ciên Farm. 2007;43(4):631-6.
30. Modie J. Females more prone to brain damage from alcohol abuse. Oregon Health & Science University e Portland Veterans Affairs Medical Center-OHSU; 2007. Disponível em: http://www.ohsu.edu/ohsuedu/newspub/071807alcohol.cfm
Recibido: 2 de agosto de 2011.
Aprobado: 5 de noviembre de 2011.
Juliana Macedo Delarmelina. Laboratório de Citogenética Vegetal, Molecular e Toxicológica. Departamento de Ciências Biológicas. Universidade Federal do Espírito Santo. Av. Marechal Campos, S/N Maruípe, Vitória, Espírito Santo. Brasil. CEP: 29040-091. E-mail: judelarmelina@yahoo.com.br Telefone: (55) 27- 98099586 e (55) 27- 33357495