Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Plantas Medicinales
versión On-line ISSN 1028-4796
Rev Cubana Plant Med vol.17 no.4 Ciudad de la Habana oct.-dic. 2012
ARTÍCULO ORIGINAL
Validación preclínica de la actividad analgésica y antiinflamatoria de la decocción de partes aéreas frescas de Phania matricarioides (Spreng.) Griseb.
Preclinical validation of the analgesic and anti-inflammatory activity of decoction of fresh aerial parts of Phania matricaroides (Spreng.) Griseb.
MSc. Ana Ibis García Hernández,I MSc. María del Carmen Victoria Amador,I Prof. Dr. Francisco Morón Rodríguez,I MSc. Hirán Cabrera Suárez,I MSc. Ana Iris Frías Vázquez,II Lic. Marisol López Barreiro,I Lic. Elisa Boucourt Rodríguez,I Lic. Zulema Morejón Rodríguez,I Lic. María J. Martínez GuerraI
I Laboratorio Central de Farmacología. La Habana, Cuba.
II Universidad de La Habana. La Habana, Cuba.
RESUMEN
Introducción: Phania matricarioides (Spreng.) Griseb (manzanilla de la tierra) es una planta que se encuentra en toda Cuba y se cultiva en jardines. La decocción o infusión de sus partes aéreas frescas se emplea de forma tradicional para tratar problemas de salud digestivos y dermatológicos. En las bases PubMed, LILACS, NAPRALERT y CUMED, no se encontró ningún estudio publicado sobre esta especie o el género.
Objetivos: evaluar la actividad analgésica y antiinflamatoria preclínica de la decocción de partes aéreas frescas de Phania matricarioides.
Métodos: se colectaron las partes aéreas frescas de P. matricarioides y se realizó la decocción. Se hicieron estudios farmacológicos de contorciones inducidas por ácido acético 0,75 %, (0,1 mL/10 g, intraperitoneal); retirada de la cola por inmersión en agua 55 oC en ratones, en dosis de 1 y 5 g de material vegetal/kg de peso corporal; edema de oreja inducido por aceite de Croton, vía oral (0,1 y 1g/kg); tópica (20 mL/10 g de decocción al 10, 30, y 50 %) en ratones y granuloma inducido por algodón en ratas.
Resultados: la decocción inhibió de forma significativa a dosis dependiente (5 g/kg) la respuesta dolorosa inducida por ácido acético, pero no la retirada de cola, ni la respuesta inflamatoria en el granuloma por algodón; en edema de oreja se inhibió la inflamación por vía oral y tópica.
Conclusiones: los resultados permiten realizar la validación preclínica de la actividad analgésica y antiinflamatoria de la decocción de partes aéreas frescas para afecciones digestivas y dermatológicas.
Palabras clave: Phania matricarioides, manzanilla de la tierra, antiinflamatoria, analgésica.
ABSTRACT
Introduction: Phania matricarioides (Spreng.) Griseb (manzanilla de la tierra) is a plant that can be found throughout Cuba and is grown in gardens. The decoction or infusion from the fresh aerial parts is traditionally used to treat digestive and dermatologic problems. However, there was no published study on this species or genre in PubMed, LILACS, NAPRALERT AND CUMED databases.
Objective: to evaluate the preclinical analgesic and anti-inflammatory action of the decoction of fresh aerial parts of Phania matricarioides.
Methods: the fresh aerial parts of Phania matricarioides were picked up to make decoction. Several pharmacological studies on the 0.75 % acetic acid-induced contortions (0.1 mL/10 g, intraperitoneally administered); tail immersed in water at 55 oC in mice, being the dose of 1 and 5 g of vegetal material/kg of body weight; Croton oil-induced ear edema, orally (0.1 and 1 g/l g) and topically (20 mL/10 g of decoction at 10, 30 and 50 % concentrations) in mice, and finally cotton-induced granuloma in rats.
Results: the decoction significantly inhibited the painful response induced by acetic acid, depending on dose (5 g/kg), but did not affect either the tail withdrawal in immersion or the inflammatory response to cotton-induced granuloma; the inflammation treated orally and topically was inhibited in the ear edema.
Conclusions: the results allowed performing the preclinical validation of the analgesic and anti-inflammatory action of the decoction of fresh aerial parts of the plant in digestive and dermatological diseases.
Key words: Phania matricarioides, manzanilla de la tierra, anti-inflammatory, analgesic.
INTRODUCCIÓN
Phania matricarioides (Spreng.) Griseb aparece clasificada por primera vez en el Catalogus plantarum cubensium (p. 145) del año 1866.1 Como nombre sinónimo, tiene Hymenopappus matricarioides Spreng. pertenece a la familia Asteraceae Bercht. & J. Presl, y al género Phania DC;1 es conocida comúnmente en Cuba por el nombre de manzanilla, manzanilla de jardín o manzanilla de la tierra
Otras especies del mismo género presentes en Cuba son Phania cajalbanica Borhidi, Phania domingensis Griseb.: Ageratum domingense Spreng.2
P. matricarioides (manzanilla de la tierra.) es una planta sufruticosa, ramosa, tomentosa a glabra; con hojas de contorno aovado a oblongo, dentadas o lobuladas, o 3-folioladas, de 0,5-4 x 0,5-3,5 cm, mayormente redondeadas en el ápice y truncadas a subacorazonadas en la base, a veces obtusas o algo agudas; capítulos en cimas laxas: invólucro de 2-3 mm, brácteas oblongas a lineares, agudas; corolas blancas, de 1-1,5 mm; aquenios oblongos, de 1 mm; escamas del vilano 5, mayormente glandulíferas.3,4 Esta planta se encuentra en toda Cuba y es cultivada en jardines, existe además en otros países de América continental y el Caribe.3,5
Entre sus usos medicinales populares se citan varios relacionados con el posible efecto beneficioso de la decocción o infusión de las partes aéreas frescas para afecciones digestivas y dermatológicas,6,7 como son dolor de estómago, malas digestiones, diarreas, salpullido y picazón. Estos usos resultaron significativos (más de 20 %) en la encuesta TRAMIL5,6 y en la realizada por el Laboratorio Central de Farmacología (Morón F y otros, Encuesta TRAMIL sobre usos de plantas medicinales en Ciudad de La Habana, 2007). Es popularmente nombrada como manzanilla, manzanilla de jardín o manzanilla de la tierra. La población tiende a confundirse o la considera similar a la especie Matricaria recutita L. (manzanilla, manzanilla dulce o manzanilla alemana), lo cual puede deberse al parecido de las partes aéreas de ambas, que aunque son de la familia Asteraceae, pertenecen a géneros y especies completamente diferentes.
Las partes aéreas frescas son usadas por la población en forma de decocción o infusión para solucionar estos problemas de salud y debido a la ausencia de información en la literatura científica nacional e internacional (no se encontraron estudios publicados sobre la especie o el género Phania en las bases PubMed, LILACS, NAPRALERT y CUMED), nos planteamos realizar este trabajo que es parte de un proyecto destinado a estudiar la farmacognosia, fitoquímica, farmacodinamia y toxicología de Phania matricarioides (Spreng.) Griseb, en el cual en su composición fitoquímica se obtuvo que los principales componentes de las partes aéreas frescas de P. matricariodes son compuestos fenólicos, taninos, flavonoides, alcaloides, compuestos lactónicos, triterpenos o esteroides, terpenos y ácidos orgánicos.7 El objetivo radicó en evaluar los efectos analgésico y antiinflamatorio preclínicos de la decocción de partes aéreas frescas P. matricarioides.
MÉTODOS
Material vegetal y extracto
Se colectaron las partes aéreas frescas de Phania matricarioides (Spreng.) Griseb (manzanilla de la tierra) y se realizó la identificación botánica con número de voucher ROIG 4752; se guardó una copia para el herbario de nuestro laboratorio.
Se preparó una decocción al 10, 30 o 50 % (10, 30 o 50 g de partes aéreas frescas lavadas y cortadas en pequeños pedazos en 100 mL de agua destilada), en recipiente de cristal tapado, con ebullición a fuego bajo durante 5 min, se retiró del calor, se dejó refrescar, se filtró y enrasó para lograr el porcentaje deseado de 10, 30 o 50 %.
Estudios farmacológicos
Analgesia periférica en respuesta nociceptiva inducida por ácido acético intraperitoneal (writhing test)
Se utilizaron ratones machos, convencionales, no isogénicos OF-1 (18-20 g), que fueron seleccionados al azar, en grupos de 10 ratones.
Los animales del grupo control negativo recibieron agua destilada de manera isovolumétrica con respecto a la dosis mayor administrada de extracto. A los animales de los grupos tratados se les administró la decocción (30 %) de manzanilla en dosis equivalente a 1,0 y 5,0 g de material vegetal fresco/kg de peso corporal (pc).
Las administraciones, de agua o decocción, fueron por vía oral (po) mediante sonda orogástrica.
A los 60 min de haber recibido el tratamiento correspondiente, se inyectó ácido acético 0,75 % (0,1 mL/10 g pc) por vía intraperitoneal (ip) y se dejó al animal en reposo en su jaula y se midió la variable contorciones/15 min (número total de contorciones durante 15 min).8
Analgesia central en respuesta nociceptiva inducida por inmersión de la cola en agua caliente (tail flick)
Se utilizaron ratones machos, convencionales, no isogénicos OF-1 (18-20 g), que fueron seleccionados al azar, en grupos de 10 ratones.
Los animales del grupo control negativo recibieron agua destilada de manera isovolumétrica con la dosis mayor administrada de extracto. A los animales de los grupos tratados se les administró la decocción (30 %) de manzanilla en dosis equivalente a 1,0 y 5,0 g de material vegetal fresco/kg de peso corporal (pc).
Las administraciones, de agua o decocción, se hicieron por vía oral (po) mediante sonda orogástrica.
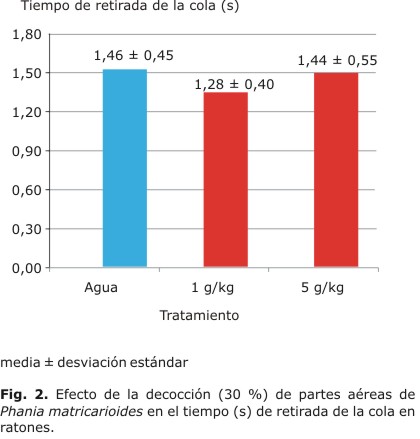
A los 60 min de haber recibido el tratamiento correspondiente, se introdujo al animal en una caja para limitar su movimiento, sumergiendo el tercio distal de su cola en agua a 55 oC con total libertad para retirarla tan pronto sintiese el calor; se repitió 2 veces la inmersión de la cola, pero solo se tomó la segunda retirada de la cola, con el fin de descartar la reacción al tacto y medir la respuesta dolorosa que se produjo,8 que da la variable tiempo de retirada de la cola (segundos), lo cual se efectuó mediante un cronómetro.
Modelo de granuloma inducido por algodón
Se utilizaron ratas machos, no isogénicas, convencionales, de la línea Wistar (150-200 g). Los animales se seleccionaron al azar en grupos de 10 ratas cada uno. Los animales del grupo control negativo recibieron agua destilada de manera isovolumétrica con la dosis mayor administrada de extracto.
Esta técnica consistió en hacer una incisión a cada lado de la línea media del dorso del tórax de cada animal, para introducir subcutáneamente 1 pellet de algodón de 50 mg, previo decolado de la piel; de esta forma quedan situados aproximadamente a 3 cm de la herida. Se suturó con agrafes Mitchel y se añadió antibiótico (sulfato de estreptomicina 1 % 0,5 mL) en la herida para evitar las infecciones.8,9
El grupo tratado recibió la decocción (30 %) de manzanilla (5,0 g de material vegetal/kg pc), y el grupo control negativo recibió agua destilada en dosis única diaria por 4 d. Al quinto día, se procedió al sacrificio de los animales y a la exéresis de los granulomas, estos se llevaron a peso seco constante en un horno con ventilación a temperatura de 150 ± 10 oC durante 3 h. Los granulomas se pesaron, previa tara de la cápsula de porcelana, antes y después de este proceder, determinando las variables contenido acuoso del granuloma (peso húmedo-peso seco= contenido acuoso) y contenido fibrogranuloso (peso seco - peso del pellet de algodón) en gramos.
Modelo de edema de oreja inducido por aceite de Croton por vía oral y tópica10
Se utilizaron ratones machos, convencionales, no isogénicos OF-1 (18-20 g), seleccionados al azar, distribuidos en grupos de 6 animales cada uno. El extracto y los fármacos de referencia se administraron por vía oral y tópica según el esquema siguiente:
Vía oral: a los animales del grupo tratado se les administró la decocción al 30 % en una dosis de 0,1 y 1,0 g/kg pc (0,38 µL/10g). Los animales del grupo control negativo recibieron agua destilada de manera isovolumétrica con respecto a la dosis mayor administrada del extracto. A los 60 min de haber recibido el tratamiento correspondiente se les aplicó 2,5 µg de aceite de Croton (20 µL de una solución 125 µg/mL en acetona) en la oreja derecha, la oreja izquierda recibió 20 µL de acetona. Los tratamientos de los grupos control o con extracto fueron administrados por vía oral (po) mediante sonda orogástrica.
Vía tópica: a todos los animales se le aplicó 2,5 µg de aceite de Croton (20 µL de una solución 125 µg/mL en acetona) en la oreja derecha, la oreja izquierda recibió 20 µL de acetona. A los grupos tratados se les aplicó 20 µL/10 g de decocción al 10, 30, y 50 %, 1 min después del aceite de Croton. Al grupo control negativo se le aplicó 20 µL/10g de agua destilada.
Todos los animales se sacrificaron por tracción cervical, a las 4 h después de la aplicación del aceite de Croton.
La magnitud del edema se determinó por la diferencia de peso entre un disco de 7 mm de diámetro procedente de la oreja inflamada y otro de igual magnitud procedente de la oreja no inflamada. La actividad antiinflamatoria se midió como porcentaje de reducción del edema en las ratas tratadas respecto a los controles.
Procedencia y atención a los animales
Todos los animales empleados en este estudio fueron suministrados por el Centro Nacional para la Producción de Animales de Laboratorio (CENPALAB) y mantenidos en cajas de poliuretano-T4 en el bioterio del Laboratorio Central de Farmacología, a temperatura de 23 oC, humedad relativa de 50 a 60 %, un período de luz-oscuridad de 12 h cada uno, con libre acceso a pienso para ratones y ratas ALYCO® CMO 1000 y al agua. Se mantuvieron sin alimento, pero con libre acceso al agua, durante las 12 h antes del estudio. Los estudios se realizaron cumpliendo las guías de buenas prácticas11 para el cuidado y uso de animales de laboratorio.12
Análisis estadístico
Los resultados se sometieron a prueba de hipótesis de distribución normal de las variables estudiadas, utilizando el estadígrafo W y se encontró que se distribuyen normalmente, se aplicó el análisis de varianza de una vía (ANOVA) para determinar si existían diferencias significativas entre las medias de los grupos.
La comparación de medias entre 2 grupos se hizo mediante la prueba t de Student.
El nivel de significación fue de 5 % (p< 0,05).
RESULTADOS
Analgesia periférica en respuesta nociceptiva inducida por ácido acético intraperitoneal (writhing test)
La decocción al 30 % de partes aéreas frescas disminuyó significativamente (F= 3,530; p= 0,0381) y de manera dosis dependiente, a 5,0 g/kg el número de contorciones durante 15 min inducidas por ácido acético intraperitoneal en ratones. Las medias de los animales tratados con la decocción, a la dosis de 1,0 g/kg (t= 1,2416; p= 0,1123) no fue significativa y a la dosis de 5,0 g/kg (t= 2,4401; p= 0,0106) sí resultó significativa con relación al grupo control que recibió agua destilada por la misma vía (Fig. 1).
Analgesia central en respuesta nociceptiva inducida por inmersión de la cola en agua caliente (tail flick)
La decocción 30 % de partes aéreas frescas con las dosis 1,0 y 5,0 g/kg no modificó de manera significativa el tiempo de retirada de la cola (F= 0,805; p= 0,4968) (Fig. 2).
Modelo de granuloma inducido por algodón
La decocción al 30 % de partes aéreas frescas con la dosis de 5,0 g/kg no disminuyó significativamente el contenido acuoso (Cont. AC), (F1= 0,161; p = 0,8521), ni el contenido fibrogranuloso, (F1 = 2,373; p= 0,108) en la respuesta inflamatoria inducida por algodón en ratas. La comparación de las medias entre el grupo tratado con decocción (0,5 g/kg p o) y el control negativo con agua destilada no fue significativa. Contenido acuoso: H2O vs. 5 g/kg; t= 1,0084; p= 0,1658. Contenido fibrogranuloso: H2O vs. 5 g/kg; t= 1,3745; p= 0,0963 (Fig. 3).
Edema de oreja inducido por aceite de Croton por vía oral y tópica
Vía oral
La decocción al 30 % de partes aéreas frescas por vía oral en dosis de 0,1 y 1 g/kg disminuyó significativamente (F= 10,350; p= 4,986e-04) y de manera dosis dependiente el edema inducido por aceite de Croton en ratones. El porcentaje de inhibición del edema en los animales tratados con la decocción, con dosis de 0,1 y 1 g/kg fue significativo con relación al grupo control que recibió agua destilada por la misma vía con 49,7 % y 62,3 % de inhibición, respectivamente (Fig. 4).
Vía tópica
La decocción al 10, 30, y 50 % de partes aéreas frescas por vía tópica en dosis de 20 µL/10 g disminuyó significativamente (F= 15,408; p= 4,882e-06) el edema inducido por aceite de Croton en ratones, disminución que fue inversamente proporcional a la concentración de la decocción. El porcentaje de inhibición del edema en los animales tratados con la decocción al 10, 30 y 50 % fue significativo con relación al grupo control que recibió agua destilada por la misma vía con 78,2, 63,3 y 56,6 % de inhibición, respectivamente (Fig. 5).
DISCUSIÓN
Los estudios preclínicos destinados a validar los usos tradicionales de partes y extractos de plantas medicinales son necesarios e importantes, porque aportan evidencias científicas que acreditan sus actividades biológicas13 y permiten avalar su empleo por la población.
Nuestros estudios farmacológicos mostraron que la decocción al 30 % de partes aéreas frescas de P. matricarioides inhibió significativamente y de manera dosis dependiente, a 5,0 g/kg la respuesta dolorosa inducida por la administración de ácido acético intraperitoneal en ratones, lo que está en correspondencia con un efecto analgésico de característica similar al que producen los analgésicos-antiinflamatorios no esteroideos (AINE), que pueden tener actividad sobre la respuesta dolorosa tanto periférica como central, pero preferentemente, a nivel periférico,14 esto se evalúa con el modelo de las contorciones inducidas por ácido acético intraperitoneal.15,16 No se modificó en cambio la respuesta dolorosa en el modelo de retirada de la cola; resultado esperado, porque los fármacos analgésicos y antiinflamatorios no esteroideos actúan a menores dosis en el modelo de contorciones y pueden inhibir la respuesta nociceptiva solo a dosis mucho más elevadas en el modelo de retirada de la cola.
La ausencia de efecto sobre la inflamación provocada en el modelo de granuloma inducido por algodón en ratas no es sorprendente, puesto que este modelo experimental está más correlacionado con las drogas que muestran efectividad clínica en el tratamiento de enfermedades articulares degenerativas;8 es más representativo de la fase subcrónica de la respuesta inflamatoria. Entre los usos tradicionales de la decocción de P. matricarioides no se reportan este tipo de afecciones de evolución crónica y no todos los AINE tienen igual intensidad de actividad analgésica y antiinflamatoria.14 Nuestros resultados coinciden con otros estudios que evalúan la actividad antiinflamatoria de decocciones al 30 % de plantas medicinales a través de este modelo.17
En contraste con la ausencia de efecto en el modelo de granuloma inducido por algodón en ratas, se obtuvo una respuesta antiinflamatoria significativa y dosis dependiente en el modelo de edema inducido por aceite de Croton tanto por vía oral como tópica, lo que puede deberse a que este modelo es más representativo de la fase aguda de la respuesta inflamatoria, eso es consistente con los usos tradicionales reportados para afecciones agudas digestivas y dermatológicas como dolor de estómago, picazón y salpullido. En nuestro estudio se obtuvo por vía oral 49,7 y 62,3 % de inhibición del edema, lo que se considera como una buena respuesta antiinflamatoria y la dosis más alta administrada (1 g/kg) resultó la de mayor respuesta antiinflamatoria; a su vez, los valores de inhibición del edema la decocción al 10, 30 y 50 % por vía tópica fueron superiores (78,2, 63,3 y 56,6 %) e inversamente proporcional a la concentración de la decocción. Esto puede estar dado porque las decocciones extraen compuestos muy polares (productos de polimerización o degradación de lignanos, glicósidos, polisacáridos y otros), y al incrementar la concentración de la decocción, aumenta la cantidad de estas sustancias inactivas, por ende, el efecto decrece; no obstante, la respuesta antiinflamatoria por las dos vías, oral y tópica, a las dosis y concentraciones estudiadas, fueron satisfactorias, resultados estos que inducen a pensar que el efecto antiinflamatorio de la decocción debe estar mediado, entre otras acciones, por la inhibición de la enzima COX, lo que impide la síntesis de prostaglandinas y prostaciclina, similar a los AINE con los que se obtiene alivio sintomático del dolor y la inflamación que surgen con la enfermedad, y no detienen la evolución del cuadro patológico en los tejidos.18 se deduce además la presencia en la decocción de compuestos químicos con actividad antiinflamatoria, porque con las dosis estudiadas por las dos vías se obtuvieron altos porcentajes de inhibición del proceso inflamatorio.
Los metabolitos detectados en la decocción, de los que se reportan diversas acciones farmacológicas como la analgésica, antiinflamatoria y antioxidante,19-21 entre otras, que se pueden correlacionar con las actividades biológicas encontradas están los flavonoides, fenoles, triterpenos o esteroides, alcaloides y taninos.7
Los resultados experimentales permiten la validación preclínica de la actividad analgésica y antiinflamatoria de la decocción de partes aéreas frescas de Phania matricarioides (manzanilla), así como su empleo tradicional para afecciones dermatológicas y digestivas.
AGRADECIMIENTOS
A los compañeros Yunier Bacallao Elguea, por el trabajo técnico; a la Dra. C. Lérida Acosta por la recolección del material vegetal, y al Dr. C. Biológicas Víctor Fuentes Fiallo por la identificación del material vegetal.
REFERENCIAS BIBLIOGRÁFICAS
1. Missouri Botanical Garden - w3TROPICOS. Phania matricarioides (Spreng.) Griseb. Nomenclatural Data Base [en línea]. [Citada 7 Nov 2011]. Disponible en: http://www.tropicos.org/namesearch.aspx
2. Herrera Oliver P. Asteraceae. Centro Nacional de Biodiversidad (CeNBio) IES. [en línea] [Citada 15 Nov 2011]. Disponible en: http://www.ecosis.cu/cenbio/publicacionescenbio.htm
3. Roig JT. Plantas Medicinales, Aromáticas y Venenosas de Cuba. 2da ed. La Habana: Editorial Científico-Técnica;1992. p. 619-21.
4. Plantas de Viñales. Guía Ilustrada. Phania matricarioides (Spreng.) Griseb. Nomenclatural [en línea]. [Citada 8 Sep 2011]. Disponible en: http://www.cybertruffle.org.uk/vinales/esp/phania_matricarioides.htm
5. Carballo A. Listado las Encuestas TRAMIL 1990. Topes de Collantes, Trinidad, Cuba. En: TRAMIL. Farmacopea Vegetal Caribeña. 2da ed. [CD-ROM]. León, Nicaragua: Editorial Universitaria UNAN-León; 2005 p. 486. ISBN 99924-56-25-6.
6. Robineau L. Hacia una Farmacopea Caribeña. TRAMIL 7. Santo Domingo, República Dominicana: Editorial BUHO; 1995.
7. Cabrera H, Morón F, Victoria MC, García AI, Acosta de la Luz L. Composición fitoquímica de partes aéreas frescas de Phania matricarioides. Rev Cubana Plant Med [revista en la Internet]. 2012 Abr; 17(3). En prensa.
7. Longuefosse JL, Nossin E. Association pour la valorisation des plantes médicinales de la Caraïbe. Enquête TRAMIL 1990-95, Martinique. En: TRAMIL. Farmacopea Vegetal Caribeña. 2da Ed. [CD-ROM]. León, Nicaragua: Editorial Universitaria UNAN-León; 2005 p. 486. ISBN 99924-56-25-6.
8. Morón F, Furones JA, Pinedo Z. Ausencia de efectos antiinflamatorio y analgésico del extracto fluido de Cymbopogon citratus al 30 % por vía oral. Rev Cubana Plant Med [revista en la Internet]. 1996;Ago[citado 2011 Nov 18]1(2):3-6. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1028-47961996000200001&lng=es&nrm=iso&tlng=es
9. Victoria MC, Morón F, Morejón Z, Martínez MJ, López M. Tamizaje fitoquímico, actividad antiinflamatoria y toxicidad aguda de extractos de hojas de Annona squamosa L. Rev Cubana Plant Med [revista en la Internet]. 2006 Abr[citado 2011 Dic 09]; 11(1). Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1028-47962006000100002&lng=es&nrm=iso&tlng=es
10. Programa Iberoamericano de Ciencia y Tecnología para el desarrollo. Edema Auricular. Curso para Investigadores en el descubrimiento de nuevos medicamentos. Subprograma X: Química Fina Farmacéutica. Proyecto X-2: Síntesis de Moléculas bioactivas Análogos de productos naturales de origen Iberoamericano. Lima: Editorial CYTED; 1996. p. 83.
11. Cuba. Para la Protección de la Salud Pública. Principios de las Buenas Prácticas de Laboratorio no Clínico de Seguridad Sanitaria y Medioambiental: Regulación 39/2004. La Habana: El Buró Regulatorio; 2004.
12. EE. UU. National Research Council. Guide for the care and use of laboratory animals. Washington DC: National Academy Press; 2001.p. 21-79.
13. Morón F. Necesidad de investigaciones sobre plantas medicinales. Rev Cubana Plant Med [revista en la Internet]. 2007 Dic [citado 2011 nov 09];12(4): Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1028-47962007000400001&lng=es&nrm=iso&tlng=es
14. Burke A, Smyth E, FitzGerald GA. Analgesic-antipyretic agents; pharmacotherapy of gout - In: Goodman & Gilman's the Pharmacological Basis of Therapeutics,11th Ed; [CD-ROM]. New York: McGraw-Hill Medical Publishing Division; 2006.
15. Lapa AJ, Monteiro de Lima TC. Métodos farmacológicos para el estudio de la actividad analgésica/antiinflamatoria. En: Lapa AJ, Souccar C, Lima-Landman, editors MTR. Métodos de Evaluación de la Actividad Farmacológica de Plantas Medicinales. Sao Paulo: CYTED/CNPq; 2002. p. 60-71.
16. Furones JA, Morón F, Pinedo Z. Acción analgésica de un extracto acuoso liofilizado de Aloe vera L. en ratones. Rev Cubana Plant Med [revista en la Internet]. 1996 Ago [citado 2011 Dic 11];1(2):15-7. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1028-47961996000200004&lng=es&nrm=iso&tlng=es
17. Morón F, Victoria MC, Morejón Z, López M, García AI, Fuentes V, et al. Tamizaje fitoquímico, actividad analgésica y antiinflamatoria de decocción de Costus pictus D. Don. Rev Cubana Plant Med. 2008;13(4). Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1028-47962008000400013&lng=es&nrm=iso&tlng=es
18. Wagner W, Khanna P and Furst DE. Nonsteroidal antinflamnatory drugs no opiod analgesics drugs used in gout. En: Katzung BG, editor. Basis Clinical Pharmacology. McGraw-Hill-Lange; 2007. p. 576-603.
19. World Health Organization. Quality control methods for medicinal plant materials. Geneva: WHO; 1998. ISBN 92 4 154510 0
20. Matricaria recutita L. Gemosén-Robineau L, Delens M, García-González M, Herrera J, Morón F, Sáenz-Campos D, Solís P, editores. Farmacopea Vegetal Caribeña 2da ed. [CD-ROM]. León (Nicaragua): Editorial Universitaria UNAN-León; 2005. p. 280-5.
21. Vanaclocha B, Cañigueral S, Vila R, Risco E, Pérez F, Portillo A, et al. Ulmaria. Monografías de Plantas Medicinales. En: Vanaclocha B, Cañigueral S, editores. Fitoterapia. Vademécum de Prescripción. 4ª ed. Barcelona: MASSON, S.A.; 2003. p. 487-8.
Recibido: 12 de junio de 2012.
Aprobado: 19 de junio de 2012.
Ana Ibis García Hernández. Facultad de Ciencias Médicas "Dr. Salvador Allende". Laboratorio Central de Farmacología. Carvajal s/n e/ Agua Dulce y A. Cerro, La Habana 12000, Cuba. Teléf.: (53-7) 8776661 Ext. 1049 Correo electrónico: anaibisgar@infomed.sld.cu