Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Plantas Medicinales
versión On-line ISSN 1028-4796
Rev Cubana Plant Med vol.17 no.4 Ciudad de la Habana oct.-dic. 2012
ARTÍCULO ORIGINAL
Efecto del extracto de Anethum graveolens, Melissa officinalis y Calendula officinalis sobre espermatozoides humanos
Effect of extracts from Anethum graveolens, Melissa officinalis y Calendula officinalis on the human spermatozoa
Jenniffer Puerta Suárez, Daniela Cardona Duque, Ángela Álvarez Gómez, Víctor Arango, Ángela Cadavid, Walter Cardona Maya
Universidad de Antioquia, Medellín, Colombia.
RESUMEN
Introducción: aunque existe una amplia disponibilidad de métodos anticonceptivos, la tasa de embarazos no deseados parece no disminuir. Uno de los métodos contraconceptivos empleados son los espermicidas.
Objetivo: evaluar el efecto del extracto de tres plantas: Anethum graveolens L. (Apiaceae), Calendula officinalis L. (Asteraceae) y Melissa officinalis L. (Lamiaceae) sobre la movilidad y la viabilidad de los espermatozoides humanos.
Métodos: las muestras de semen de voluntarios sanos se incubaron con el extracto de cada planta a diferentes concentraciones, posteriormente se evaluó su efecto sobre la movilidad y la viabilidad espermática.
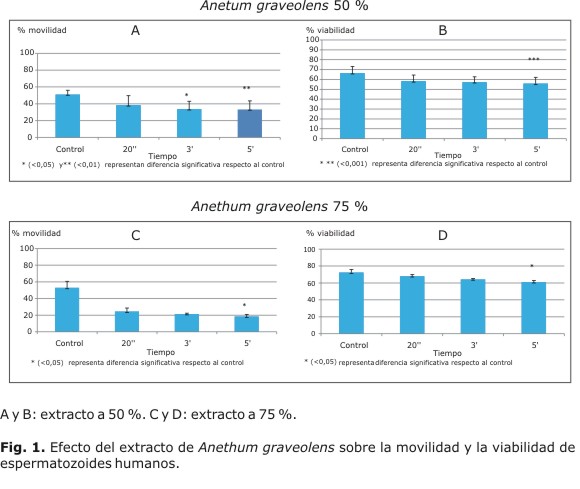
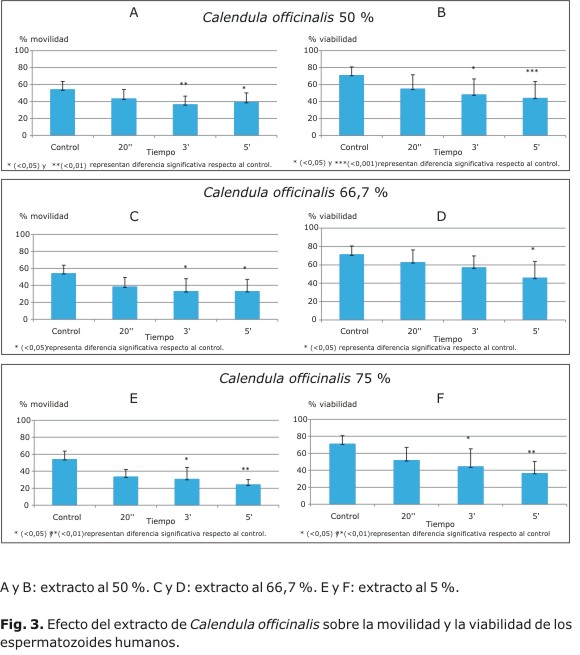
Resultados: el extracto de Anethum graveolens redujo la movilidad y la viabilidad en 65,3 % y 16 % (p< 0,05, 5 min vs. control), respectivamente; el extracto de Melissa officinalis generó un descenso en la movilidad de 78,2 % y 22,3 % en la viabilidad (p< 0,05, 5 min vs. control). Por último, el extracto de Calendula officinalis redujo la movilidad y la viabilidad en 55,3 y 48,4 % (p< 0,05, 5 min vs. control), respectivamente.
Conclusión: ninguno de los extractos de las plantas a las concentraciones empleadas en este ensayo tiene efecto espermicida sobre los espermatozoides humanos.
Palabras clave: Anethum graveolens, Melissa officinalis, Calendula officinalis, espermicida, saponinas, espermatozoide, anticoncepción.
ABSTRACT
Introduction: there is wide availability of contraceptives; however unwanted pregnancy rate is not decreasing. One of the contraceptive methods employed are spermicides.
Objective: the objective of this study was to evaluate the effect of extracts from three plants extract: Anethum graveolens L. (Apiaceae), Calendula officinalis L. (Asteraceae), and Melissa officinalis L. (Lamiaceae) on the motility and viability of the human spermatozoon.
Methods: semen samples from healthy volunteers were incubated with each plant extract at different concentrations, and the effects on spermatozoon motility and viability were evaluated.
Results: Anethum graveolens extract reduced motility and viability by 65.3 and 16 % (p< 0.05, 5 min vs. control), respectively; Melissa officinalis extract decreased motility by 78.2 % and viability by 22.3 % (p< 0.05, 5 min vs. control). Finally, Calendula officinalis extract reduced motility and viability by 55.3 and 48.4 %, respectively (p< 0.05, 5 min vs. control).
Conclusions: none of the plant extracts at concentrations used in this assay has spermicidal effect on human sperm.
Key words: Anethum graveolens, Melissa officinalis, Calendula officinalis, spermicide, saponins, spermatozoa, contraception.
INTRODUCCIÓN
La planificación familiar, entendida como el conjunto de actividades, procedimientos e intervenciones dirigidas a hombres y mujeres en edad fértil, dentro de las cuales se encuentra la información, educación, consejería y anticoncepción, incluida la entrega de suministros para que las personas o parejas ejerzan el derecho a decidir libre y responsablemente si quieren o no tener hijos, así como su número y el espaciamiento entre ellos,1 es considerada de gran importancia para cumplir con el quinto de los Objetivos de Desarrollo del Milenio.2
En la actualidad existe una gran variedad de métodos anticonceptivos destinados a regular la fertilidad; estos suelen clasificarse en hormonales y de barrera, pero existen varias opciones tanto en su presentación como en su forma de uso. Sin embargo, cada año, alrededor de 87 millones de mujeres en el mundo quedan embarazadas de manera involuntaria y 46 millones de estos embarazos acaban en abortos inducidos, según la Organización Mundial de la Salud (OMS).3 Esta situación es claramente observada en los adolescentes, entre quienes se reporta poco uso de métodos anticonceptivos por varias razones; entre las que se encuentran falta de acceso, poca percepción del riesgo de embarazo, miedo a efectos secundarios y el costo. Lo anterior genera la necesidad de fomentar el uso de métodos anticonceptivos y mejorar sus propiedades.
Entre las opciones anticonceptivas de bajo costo se encuentra el condón y los espermicidas, los cuales tienen efecto protector contra algunas infecciones de transmisión sexual (ITS) y a diferencia de los métodos hormonales no requieren de un uso continuo para ejercer su efecto de inhibición del embarazo. Los espermicidas, que incluso favorecen la lubricación durante el acto sexual, están elaborados en su gran mayoría sobre la base de nonoxinol 9 (N-9), compuesto que actúa en la reducción de la tensión superficial de la membrana del espermatozoide, que causa la pérdida de la movilidad, disminuye el poder fructolítico, altera la permeabilidad y disuelve el contenido lipídico;4 sin embargo, su efecto tóxico no es selectivo contra la membrana de las células y por lo tanto es irritante para el epitelio vaginal.5Tradicionalmente, las plantas han sido usadas desde períodos prehistóricos para la cura de varias enfermedades, por lo que el conocimiento de los valores medicinales de estas es reconocido por casi todas las sociedades de la tierra.6 Además, la OMS reporta que entre 70 y 80 % de la población mundial confía en la medicina tradicional para el cuidado primario de la salud, sobre todo en países en vía de desarrollo y debido a que quienes la practican se sienten más seguros y familiarizados con las plantas.7 De los numerosos compuestos identificados en diversas plantas, se encuentran las saponinas, moléculas que se comportan como detergentes,8 las cuales pueden generar daños en la membrana de los espermatozoides y alterar su composición lipídica.
El objetivo de esta investigación es evaluar el efecto de tres plantas: Anethum graveolens, Melissa officinalis y Calendula officinalis conocidas popularmente como eneldo, toronjil y caléndula, respectivamente, sobre los espermatozoides humanos.
MÉTODOS
Las flores de Calendula officinalis L. (Asteraceae) y las hojas, flores y tallos de Anethum graveolens L. (Apiaceae) y Melissa officinalis L. (Lamiaceae) se obtuvieron en un mercado de la ciudad de Medellín, se clasificaron por un biólogo experto y se identificaron con los vouchers: Alzate-4217 (Anethum graveolens), Alzate-4218 (Melissa officinalis) y Alzate-4219 (Calendula officinalis), cuyas colecciones testigo están disponibles en el herbario de la Universidad de Antioquia (HUA, Medellín, Colombia).
Las partes de las plantas se secaron en un horno, y se mezclaron con 200 mL de solución salina (Novalab, Medellín, Colombia). Se utilizaron 20,2 g de Melissa officinalis, 29 g de Anethum graveolens y 8,65 g de flores de Calendula officinalis. El producto obtenido de cada planta se filtró varias veces con gasa estéril, algodón y con papel filtro (Munktell #3, Estocolmo, Suecia). Adicionalmente, el extracto de Calendula officinalis se concentró empleando un rotoevaporador durante 30 min. Los extractos obtenidos se centrifugaron a 460 g por 5 min, se filtró de nuevo el sobrenadante y se almacenó a - 20 ºC hasta su uso.
Recolección de las muestras
Se usaron 9 muestras de semen de voluntarios aparentemente sanos de edades entre 20 y 27 años, cada muestra fue obtenida por masturbación después de 2 a 5 d de abstinencia sexual. Posterior al proceso de licuefacción se les determinó el pH, la movilidad y la viabilidad, siguiendo los lineamientos establecidos por la OMS en su manual de procesamiento de semen de 2010;9 la concentración espermática se determinó mediante la cámara de Makler.10 Cada individuo entendió el objetivo del proyecto y aceptó la participación en el estudio.
Ensayo sobre la movilidad y viabilidad espermática
El efecto del extracto de las plantas sobre la movilidad fue evaluado a diferentes concentraciones para los tres extractos. Para el caso de Anethum graveolens y Melissa officinalis se realizaron ensayos con concentraciones del extracto al 50 y 75 %, y concentraciones de 50, 66,7 y 75 % para los ensayos con Calendula officinalis. Se tomaron 10 µL de semen en un portaobjetos y se evaluó la movilidad de los espermatozoides, clasificándolos así: tipo I (movimiento progresivo), tipo II (movimiento no progresivo) y tipo III (inmóviles), a 40x en un microscopio óptico (Nikon eclipse E200) a los 20 s, 3 min y 5 min. La viabilidad se evaluó a las mismas concentraciones empleadas para evaluar la movilidad; se tomaron 10 µL de cada mezcla extracto-semen y se les agregó 10 µL de eosina-Y a 0,5 % (IHR Diagnóstica, Cali, Colombia) sobre un portaobjetos; se clasificaron como espermatozoides muertos aquellos que tomaron un color rojo. Tanto las evaluaciones de la movilidad como las de viabilidad se realizaron por duplicado teniendo en cuenta los valores de diferencia aceptables entre las repeticiones según el manual de la OMS de 2010.
Análisis estadístico
Para evaluar el efecto de los extractos sobre los espermatozoides humanos, se realizó un análisis estadístico mediante una prueba ANOVA no paramétrica (Friedman) y el postest de Dunns empleando el software Prism 5.0.
RESULTADOS
El pH, el volumen, la concentración, la movilidad y la viabilidad de las muestras de semen fueron evaluadas de manera previa a los tratamientos con los extractos y todas presentaron valores superiores a los reportados como límite de referencia en el manual de 2010 de la OMS (las muestras presentaron parámetros seminales de movilidad tipo I y II mayor que 40 % y viabilidad mayor que 58 %).
Al incubar el extracto de Anethum graveolens con los espermatozoides humanos a una concentración de 50 %, se observó una reducción de 34,1 % de la movilidad respecto al control a los 3 min (p< 0,05) y de 34,8 a los 5 min con p< 0,01 (Fig. 1A); además de una reducción de la viabilidad de 16 % a los 5 min con p< 0,001 (Fig. 1B); a una concentración del 75 % se redujo la movilidad en 65,3 % (p< 0,05) y la viabilidad en 15,7 % (p< 0,05) a los 5 min (Figs. 1C y 1D).
En la figura 2 se muestra el efecto del extracto de Melissa officinalis sobre los espermatozoides humanos, se observó una reducción de 27,6 % en la movilidad con el extracto a una concentración de 50 % a los 5 min con p< 0,05 (Fig. 2A) y una reducción de 18,8 y de 22,2 % de la viabilidad a los 3 min (p< 0,05) y a los 5 min (p< 0,001), respectivamente, frente al control (Fig. 2B). Al incubar este extracto a una concentración de 75 % se reduce la movilidad en 78,2 % con p< 0,05 (Fig. 2C) y la viabilidad en 22,3 % (p< 0,05), ambas a los 5 min (Fig. 2D).
Al incubar los espermatozoides con el extracto de Calendula officinalis a una concentración de 50 % se observó una disminución de 32,4 % de la movilidad respecto al control a los 3 min (p< 0,01) (Fig. 3A). En cuanto a la viabilidad, el extracto disminuyó esta en 32,2 % a los 3 min (p< 0,05) y en 37,9 % a los 5 min (p< 0,001) respecto al control (Fig. 3B). Usando la concentración 66,7 % se observó una reducción de 38,8 % de la movilidad a los 3 min y a los 5 min (p< 0,05) (Fig. 3C); adicionalmente a esta concentración se observa una reducción de la viabilidad de 35,6 % (p< 0,05) con respecto al control (Fig. 3D). Por último, se evaluó la acción de este extracto a una concentración de 75 % sobre los espermatozoides y se evidenció que este reduce la movilidad en 43 % a los 3 min (p< 0,05) y en 55,3 % (p< 0,01) a los 5 min (Fig. 3E); los valores de viabilidad disminuyeron en 37,7 % a los 3 min (p< 0,05) y en 48,4 % a los 5 min con p< 0,01 (Fig. 3F).
DISCUSIÓN
De forma reiterada se ha afirmado que el uso continuo de espermicidas genera efectos secundarios inherentes al mecanismo de acción de su principal componente (N-9), como son la alteración de la flora bacteriana, efectos irritantes en el epitelio vaginal11 y susceptibilidad a infecciones urogenitales.12,13
Con la finalidad de disminuir estos efectos adversos y haciendo uso del conocimiento popular acerca de la utilidad de las plantas con fines terapéuticos, varias investigaciones han surgido en búsqueda de generar nuevos espermicidas, así como los estudios que han evaluado la acción de extractos de plantas sobre la fertilidad,14-17 sus acciones sobre el control de ITS18 y los cambios en la flora normal de la vagina.12 Por ejemplo, se han realizado estudios con extractos de plantas como Passiflora edulis,19 la cual tuvo un efecto inmediato en la movilidad de los espermatozoides, y el aceite esencial de Trachyspermum ammi20 que afectaba la integridad de la membrana y causaba una rápida pérdida de su movilidad y viabilidad.
Otros artículos reportan reducción total de la movilidad de los espermatozoides al incubarlos con extractos de Achyrantes aspera y Stephania hernandifolia, en una proporción 1:3 a los 2 min.21 Empleando un extracto crudo de Polygala tenuifolia se demostró que este causó inmovilización de 100 % de los espermatozoides a los 20 s a una concentración mínima de 10 µg/mL.16
Similar a lo realizado en este ensayo, otros autores recientemente22 han evaluado la acción de compuestos disulfuros no detergentes y encontraron que N,N'ditiobisftalimida es un potente inmovilizador de los espermatozoides humanos, cuyo efecto es irreversible y además no es tóxico para células epiteliales (probadas sobre la línea celular HeLa) ni para microorganismos pertenecientes a la flora normal vaginal como Lactobacillus acidophilus, responsables de mantener un ambiente estéril en la vagina mediante la producción de peróxido de hidrógeno. Sin embargo, no solo se han realizado estudios in vitro sobre el uso de las plantas como espermicidas; otros estudios in vivo en modelos murinos han encontrado que la administración de extractos de Sarcostemma acidum interfiere en la reproducción y causa la disminución del número de células de Leydig maduras;23 así mismo extractos de semillas de Carica papaya causan hipertrofia de las gonadotropinas pituitarias y degeneración en las células de Leydig.24
Adicional a lo ya descrito, en el Grupo Reproducción se han realizado ensayos in vitro con extractos de plantas como Pasiflora edulis,19 Sapindus saponaria (Ospina L, en proceso de publicación), Ananas comosus (Uribe Clavijo M, en proceso de publicación), Bocconia frutescens, Bomarea setaceas, Muehlenbeckia platycada, Zanthoxylum lenticulare y Piper subpedale.25 En esta ocasión se evaluó la acción de extractos de Anethum graveolens, Melissa officinalis y Calendula officinalis sobre espermatozoides humanos; la elección de estas especies se realizó sobre la base de las propiedades atribuidas, en especial a las relacionadas con su uso como posibles espermicidas13 por poseer saponinas, las cuales son glucósidos de esteroides o triterpenoides, con propiedades similares al jabón que les permite disolver lípidos de la membrana del espermatozoide.
En el caso de Calendula officinalis, originaria de Egipto, extendida por todo el mundo y motivo de investigaciones por su amplia gama de propiedades: sus flores han sido utilizadas en la industria como colorante,26 se le atribuyen efectos antivirales como la inhibición de la replicación del VIH-127 y para el cuidado dermatológico en personas que padecen cáncer de piel;28 contiene sustancias como flavonoides, carotenoides, saponinas, triterpenos, ácidos fenólicos, cumarinas y taninos.26 En este estudio se realizó un extracto de flores de la planta y se mezcló en distintas proporciones con muestras de semen de voluntarios aparentemente sanos. Se pudo observar una disminución estadísticamente significativa de 31 % en la movilidad y de 33 % en la viabilidad de los espermatozoides humanos.
Por su parte, Anethum graveolens, conocida como eneldo y originaria de Egipto que crece en Colombia en climas fríos, se usa como sedante y calmante digestivo. El aceite obtenido de las semillas de esta planta posee actividad antifúngica in vivo e in vitro sobre especies del género Candida spp.,29 lo que ayudaría a reducir la prevalencia de candidiasis vulvovaginal, la cual afecta alrededor de 70 a 75 % de las mujeres al menos una vez en su vida.30 Posee alcaloides, flavonoides, taninos y saponinas;31 estas últimas de interés en el estudio por estar relacionadas con la inmovilización de los espermatozoides humanos. Con los tallos, las flores y hojas de esta planta se realizó un extracto y se evaluó su acción sobre los espermatozoides de muestras de semen, se encontró una reducción de hasta 48 % en la movilidad, sin tener gran impacto sobre la viabilidad.
Similar a lo ocurrido con Anethum graveolens, Melissa officinalis redujo en 45 % la movilidad y en 17 % la viabilidad de los espermatozoides (en muestras de semen) incubados con el extracto obtenido a partir de hojas y tallos de la planta a diferentes concentraciones. Esta planta, denominada "cidreira" por su aroma a limón, es usada como antifúngico, anticonvulsivante y espasmolítico; posee glucósidos, flavonoides, taninos y saponinas.32
Las plantas evaluadas en este ensayo: Anethum graveolens, Melissa officinalis y Calendula officinalis, tienen en común la presencia de saponinas pero en contraste con Sapindus saponaria que también las contiene, estas no poseen acción espermicida; sin embargo, otros estudios son requeridos para evaluar el mecanismo de acción de estos extractos, posiblemente mediante el aislamiento de saponinas y otros compuestos puros. Se puede concluir que, pese a los resultados de disminución de la movilidad, ninguna de las tres plantas puede considerarse útil para la elaboración de métodos anticonceptivos como espermicidas a las concentraciones empleadas en este artículo. Quizás si se aumentan las concentraciones de los extractos obtenidos se podría obtener mejores resultados y evaluar su acción sobre las células del epitelio vaginal y sobre la flora microbiana; sin embargo la relevancia de este estudio radica en explorar sustancias naturales para reducir los efectos adversos hasta ahora reportados para los productos disponibles como anticonceptivos actualmente.
AGRADECIMIENTOS
A la Universidad de Antioquia y al Instituto Tecnológico Metropolitano (ITM) por su apoyo económico. Walter Cardona Maya y Ángela Álvarez recibieron apoyo económico de Colciencias.
REFERENCIAS BIBLIOGRÁFICAS
1. Ministerio de la Salud. Norma técnica para la atención en planificación familiar a hombres y mujeres en Resolución número 412 de 2000. Colombia. Disponible en: http://www.nacer.udea.edu.co/pdf/capacitaciones/hc/05pfamiliar.pdf
2. Conpes Social 91. Metas y estrategias de Colombia para el logro de los Objetivos de Desarrollo del Milenio 2015. República de Colombia; 2005.
3. OMS. Informe sobre la salud en el mundo. Cap. 3; 2005. Disponible en: http://www.who.int/whr/2005/chapter3/es/index3.html
4. Grimes DA, López l, Raymond EG, Halpern V, Nanda K, Schulz KF. Uso de espermicida solo para anticoncepción. Biblioteca Cochrane Plus 2008, número 2. Disponible en: http://www.update-software.com/pdf/CD005218.pdf
5. Organización Mundial de la Salud. Reunión consultiva técnica sobre el uso del Nonoxinol 9, Ginebra; 2004. Disponible en: http://whqlibdoc.who.int/hq/2004/WHO_RHR_03.08_spa.pdf
6. Marwat SK, Rehman FU, Khan MA, Ahmad M, Zafar M, Ghulam S. Medicinal folk recipes used as traditional phytotherapies in district Dera Ismail Khan, KPK, Pakistan. Pak J Bot. 2011;43(3):1453-62.
7. Ogbuewu IP, Unamba-Oparah IC, Odoemenam VU, Etuk IF, Okoli IC. The potentiality of medicinal plants as the source of new contraceptive principles in males. North Am J Med Sci. 2011;3:255-63.
8. Sparg SG, Light ME, van Staden J. Biological activities and distribution of plant saponins. J Ethnopharmacol. 2004;94(2-3):219-43.
9. WHO. Laboratory manual for the examination and processing of human semen. Fifth ed.; 2010.
10. Cardona-Maya W, Berdugo J, Cadavid A. Comparación de la concentración espermática usando la cámara de Makler y la cámara de Neubauer. Actas Urol Esp. 2008; 32(4),443-5.
11. Roddy RE, Cordero M, Cordero C, Fortney JA. A dosing study of nonoxynol-9 and genital irritation. Int J Std AIDS. 1993;4(3):165-70.
12. Ojha P, Maikhuri JP, Gupta G. Effect of spermicides on Lactobacillus acidophilus in vitro nonoxynol-9 vs. Sapindus saponins. Contraception. 2003;68(2):135-8.
13. Álvarez Gómez AM, Cardona Maya WD, Castro Álvarez JF, Jiménez S, Cadavid A. Nuevas opciones en anticoncepción: posible uso espermicida de plantas colombianas. Actas Urol Esp. 2007;31(4):372-81.
14. Talwar GP, Raghuvanshi P, Misra R, Mukherjee S, Shah S. Plant immunomodulators for termination of unwanted pregnancy and for contraception and reproductive health. Immunol Cell Biol. 1997;75(2):190-2.
15. Das N, Chandran P, Chakraborty S. Potent spermicidal effect of oleanolic acid 3-beta-D-glucuronide, an active principle isolated from the plant Sesbania sesban Merrill. Contraception. 2011;83(2):167-75.
16. Qiu Y, Wang LG, Jia YF, Yang DT, Zhang MH, Zhang YP, et al. Effects of the crude extract of Polygala tenuifolia Willd on human sperm in vitro. J Zhejiang Univ Sci B. 2006;12(6):448-54.
17. Khillare B, Shrivastav TG. Spermicidal activity of Azadirachta indica (neem) leaf extract. Contraception. 2003;68(3):225-9.
18. Tiwari P, Singh D, Singh MM. Anti-Trichomonas activity of Sapindus saponins, a candidate for development as microbicidal contraceptive. J Antimicrob Chemother. 2008;62:526-34.
19. Alvarez Gomez A, Cardona Maya W, Forero J, Cadavid A. Human Spermicidal Activity of Passiflora edulis Extract. J Reproduction. 2010;21(2):95-100.
20. Paul S, Kang SC. In vitro determination of the contraceptive spermicidal activity of essential oil of Trachyspermum ammi (L.) Sprague ex Turrill fruits. N Biotechnol. 2011;28(6):684-90.
21. Paul D, Bera S, Jana D, Maiti R, Ghosh D. In vitro determination of the contraceptive spermicidal activity of a composite extract of Achyranthes aspera and Stephania hernandifolia on human semen. Contraception. 2006;73(3):284-8.
22. Florez M, Díaz ES, Brito I, González J, Morales P. N,N'-Dithiobisphthalimide, a disulfide aromatic compound, is a potent spermicide agent in humans. Syst Biol Reprod Med. 2011;57(6):309-17.
23. Ogbuewu IP, Unamba-Oparah IC, Odoemenam VU, Etuk IF, Okoli IC. The potentiality of medicinal plants as the source of new contraceptive principles in males. North Am J Med Sci. 2011;3:255-63.
24. Udoh P, Essie I, Udoh F. Effects of Carica papaya (paw paw) seeds extract on the morphology of pituitary-gonadal axis of male Wistar rats. Phytother Res. 2005;19:1065-8.
25. Gallego G, Henao D, Ospina L, Álvarez Gómez A, Arango V, Cardona Maya W, et al. Evaluación del efecto de cinco extractos de plantas colombianas sobre espermatozoides humanos. Rev Cubana Plant Med. 2012:17(1).
26. Águila Gil B, Menéndez Castillo R, González Roque C, Fernández Fernández D. Extracto acuoso de Calendula officinalis. Estudio preliminar de sus propiedades. Rev Cubana Plant Med. 2000;5(1):30-1.
27. Kalvatchev Z, Walder R, Garzaro D. Anti-HIV activity of extracts from Calendula officinalis flowers. Biomed Pharmacother. 1997;51:176-80.
28. Radiation Medicine Program, Princess Margaret Hospital, Toronto, Ontario, Canada. Evidence-based skin care management in radiation therapy: clinical update. Semin Oncol Nurs. 2011;27(2):e1-17.
29. Zeng H, Tian J, Zheng Y, Ban X, Zeng J, Mao Y, et al. in vitro and in vivo activities of essential oil from the seed of Anethum graveolens L. against Candida spp. Evid Based Complement Alternat Med. 2011:659-704.
30. Weissenbacher TM, Witkin SS, Gingelmaier A, Scholz C, Friese K, Mylonas I. Relationship between recurrent vulvovaginal candidosis and immune mediators in vaginal fluid. Eur J Obstet Gynecol Reprod Biol. 2009;144(1):59-6.
31. Kaur GJ, Arora DS. Antibacterial and phytochemical screening of Anethum graveolens, Foeniculum vulgare and Trachyspermum ammi. BMC Complement Altern Med. 2009;9:30.
32. Gazola R, Machado D, Ruggiero C, Singi G, Macedo Alexandre M. Lippia alba, Melissa officinalis and Cymbopogon citratus: effects of the aqueous extracts on the isolated hearts of rats. Pharmacol Res. 2004;50(5):477-80.
Recibido: 14 de diciembre de 2011.
Aprobado: 15 de junio de 2012.
Walter Cardona Maya. Grupo Reproducción, Facultad de Medicina, Universidad de Antioquia, Calle 52 # 61-30, Laboratorio 534. Teléf.: 57 4 2196476, Correo electrónico: wdcmaya@medicina.udea.edu.co