Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Plantas Medicinales
versión On-line ISSN 1028-4796
Rev Cubana Plant Med vol.18 no.4 Ciudad de la Habana oct.-dic. 2013
ARTÍCULO ORIGINAL
Estudio fitoquímico preliminar de Cecropia membranacea Trécul. y Cecropia metensis Cuatrec.
Preliminary phytochemical study of Cecropia membranacea Trécul. and Cecropia metensis Cuatrec.
Lic. Jorge Enrique Hernández Carvajal, QF. Pilar Ester Luengas Caicedo
Universidad Nacional de Colombia. Ciudad Universitaria, Bogotá D.C., Colombia.
RESUMEN
Introducción: las plantas del género Cecropia se distribuyen en Suramérica, incluidas diferentes zonas de Colombia, donde son conocidas popularmente como "yarumos". Estas especies se asocian con actividades farmacológicas como: hipoglicemiante, analgésica, antiulcerosa, cicatrizante y antimalárica. Son escasos los reportes de estudios fitoquímicos de Cecropia metensis Cuatrec. y Cecropia membranacea Trécul.
Objetivo: contribuir al estudio fitoquímico del extracto etanólico de hojas de Cecropia metensis (sin. Cecropia peltata var. candida Velasquez) y Cecropia membranacea.
Métodos: se realizó el estudio fitoquímico preliminar del extracto etanólico de hojas con peciolo de Cecropia metensis y Cecropia membranacea, colectadas en época lluviosa en el departamento del Meta (Colombia), empleando pruebas clásicas de tubo y cromatografía en capa delgada. Se elaboraron además, perfiles por cromatografía en capa delgada y por cromatografía líquida de alta eficiencia.
Resultados: los extractos etanólicos de hojas con pecíolo de Cecropia metensis y Cecropia membranacea colectadas en época de lluvia se caracterizaron por presentar flavonoides, taninos, esteroides y terpenos; así como, ausencia de alcaloides, saponinas, derivados antracénicos, cumarinas y lactonas terpénicas. Los perfiles cromatográficos por cromatografía líquida de alta eficiencia evidenciaron alta complejidad con presencia de compuestos de alta, mediana y baja polaridad, y apreciable absortividad a 210 y 220 nm.
Conclusiones: los extractos etanólicos de hojas de Cecropia metensis y Cecropia membranacea, colectadas en la época lluviosa, presentaron moderada variedad de metabolitos secundarios, correspondiente a terpenos, esteroides, flavonoides y taninos; compuestos reportados para diferentes especies del género Cecropia y que podrían tener interés farmacológico. Además, los perfiles cromatográficos evidenciaron que las dos especies estudiadas presentan amplia similitud en su composición fitoquímica.
Palabras clave: Cecropia metensis Cuatrec., Cecropia peltata var. candida Velasquez, Cecropia membranacea Trécul., fitoquímica, metabolitos secundarios, flavonoides, esteroides, terpenos.
ABSTRACT
Introduction: plant species of the genus Cecropia are widely distributed in South America, including several areas in Colombia, where they are popularly known as "yarumos". These plants have been reported to have hypoglycemic, analgesic, antiulcer, wound-healing and antimalarial properties. There are few reports on phytochemical studies of Cecropia metensis Cuatrec. and Cecropia membranacea Trécul.
Objective: contribute to the phytochemical study of the ethanolic extract obtained from leaves of Cecropia metensis (syn. Cecropia peltata var. candida Velasquez) and Cecropia membranacea.
Methods: a preliminary phytochemical study was conducted of ethanolic extract from petiolate leaves of Cecropia metensis and Cecropia membranacea collected during the rainy season in the Department of Meta in Colombia, using conventional tube assays and thin-layer chromatography. Profiles were also developed using thin-layer chromatography and high performance liquid chromatography (HPLC).
Results: ethanolic extracts from petiolate leaves of Cecropia metensis and Cecropia membranacea collected during the rainy season were characterized by the presence of flavonoids, tannins, steroids and terpenes, and the absence of alkaloids, saponins, anthracene derivatives, coumarins and terpene lactones. HPLC profiles revealed the great complexity of the extract, with compounds of high, medium and low polarity, as well as appreciable absorptivity at 210 and 220 nm.
Conclusions: ethanolic extracts from leaves of Cecropia metensis and Cecropia membranacea collected in the rainy season contained a moderate variety of secondary metabolites: terpenes, steroids, flavonoids and tannins. Reported for various species of the genus Cecropia, these compounds could be of interest for pharmacological purposes. Chromatographic profiles also revealed that the two species studied are very similar in their phytochemical composition.
Key words: Cecropia metensis Cuatrec., Cecropia peltata var. candida Velasquez, Cecropia membranacea Trécul., phytochemistry, secondary metabolites, flavonoids, steroids, terpenes.
INTRODUCCIÓN
Se han descrito alrededor de 75 especies del género Cecropia, las cuales se caracterizan por ser árboles nativos de crecimiento rápido y de vida corta en regiones tropicales de Centroamérica y América del Sur.1 Estas plantas hacen parte de la medicina tradicional de diferentes países. Para Cecropia obtusifolia se ha reportado efecto hipoglicemiante,2 antiinflamatorio, analgésico,3 y es utilizada en el tratamiento de la diabetes.3-5 C. pachystachya presentó actividad cardiotónica, sedante6 y antimalárica.7 C. glaziovii mostró actividad antiúlcera y antisecretora de ácido gástrico1. Entre las especies nativas del Brasil está C. hololeuca, la cual es utilizada en el tratamiento del cancer.8 Para C. peltata se han indicado diferentes actividades farmacológicas: actividad cicatrizante,9 efecto laxante,10 acción hipoglicemiante,11 además de la actividad bactericida;12 y C. membranacea mostró actividad sobre el sistema nervioso central.13 No se encontraron reportes de actividad biológica para Cecropia metensis (sin. Cecropia peltata var. candida Velasquez).
Se han realizado pocos estudios fitoquímicos de C. metensis y de C. membranacea. Para C. peltata se sugiere la presencia de saponinas, flavonoides, taninos, triterpenos y esteroides.14,15 En cuanto a C. membranacea se reportan flavonoides y esteroides.13
Teniendo en cuenta que la composición fitoquímica de las hojas de C. metensis y C. membranacea ha sido poco descrita, y que las especies de este género presentan diferentes actividades farmacológicas, se decidió realizar en este trabajo el estudio fitoquímico de estas especies del género Cecropia, como una contribución a su conocimiento.
MÉTODOS
Recolección y adecuación del material vegetal
Las hojas con pecíolo fueron colectadas en el municipio del Meta (Colombia), en octubre de 2009. Los ejemplares se clasificaron taxonómicamente en el Herbario Nacional Colombiano de la Universidad Nacional de Colombia, con los códigos de identificación siguientes: Cecropia metensis Cuatrec. (COL 213003) y Cecropia membranacea Trécul. (COL 546004). El material vegetal fue seleccionado, retirándole el material extraño y aquel en mal estado. Posteriormente se secó durante 48 h a 40 °C, en una estufa con aire circulante.
Preparación del extracto total
1 250 g de hojas con pecíolo secas y molidas se pusieron en contacto con 3 L de etanol 96 % durante 24 h. Posteriormente, el material "humedecido" se sometió a extracción por percolación con etanol 96 % hasta agotamiento, confirmado mediante cromatografía de capa delgada (CCD), empleando vainillina/H3PO4 como revelador. Los extractos fueron concentrados en un rotaevaporador Büchi R-114 a temperatura menor que 40 °C y después llevados a sequedad en baño María a 40 °C; finalmente se secaron hasta peso constante, en estufa al vacío, a 40 °C.
Estudio fitoquímico
El análisis fitoquímico de los extractos etanólicos se realizó mediante CCD, empleando diversas fases móviles y reveladores, además de pruebas de coloración y precipitación (tabla 1).16,17
Tabla 1. Estudio fitoquímico preliminar de los extractos etanólicos: ensayos realizados
| Clases de metabolitos secundarios | Fase móvil/prueba de tubo | Revelador para CCD/prueba de tubo | Compuesto de referencia |
| Alcaloides | cloroformo:metanol (18:2), gotas de amoniaco | Dragendorff | Atropina |
| Prueba de tubo | Dragendorff | Fracción alcaloidal de yagé | |
| Esteroides/ | éter de petróleo: acetato de etilo (8:2) | Liebermann-Burchard | Lupeol |
| Naftoquinonas/ | tolueno:acetato de etilo: ácido acético (75:24:1) | KOH 10 % en etanol | Alizarina |
| Glicósidos cardiotónicos | cloroformo:acetona (9:1) | Vainillina 1 %-ácido o-fosfórico 10 %/reactivo de Kedde | Digitoxina |
| Lactonas | cloroformo:acetona (9:1) | Vainillina 1%-ácido o-fosfórico 10%/FeCl3-HCl 2N | Umbeliferona |
| Cumarinas | Cloroformo | Vainillina 1 %-ácido o-fosfórico 10 %/FeCl3-HCl 2N | Umbeliferona |
| Flavonoides | acetato de etilo:ácido acético:ácido fórmico:agua (100:11:11:27) | NP-PEG | Rutina |
| Taninos | tolueno-BuOH-AcOH-H2O (50:25:25:5) | Ferricianuro de potasio al 1 %-cloruro férrico | Ácido tánico |
| Flavonoides | Pruebas de tubo | Shinoda, HCl y calentamiento, FeCl3 | Rutina |
| Proantocianidinas | Butanol/HCl (95:5), baño María | ||
| Taninos | Gelatina-sal/urea/FeCl3 | ||
| Saponinas | Prueba de la espuma Agitación | ||
| Hemolisis | Digitonina |
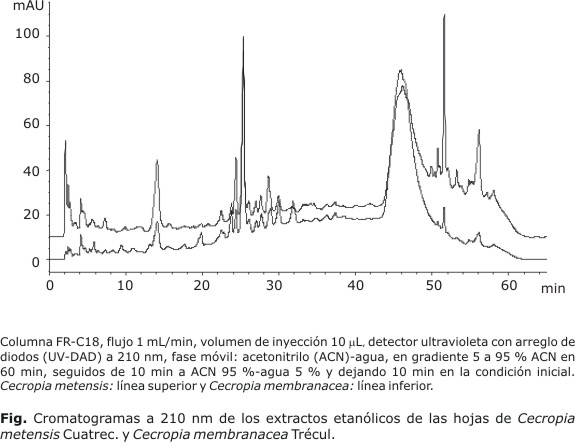
Para la elaboración de los perfiles por cromatografía líquida de alta eficiencia (CLAE) se utilizó un equipo Agilent 1200 con inyector automático, bomba cuaternaria y el detector UV-DAD, procesando a 210, 220, 254, 280 y 350 nm. Se empleó una columna Lichrospher® RP-18 (250 mm × 4 mm × 10 µm) y como fase móvil una mezcla acetonitrilo (ACN)-agua, en gradiente de 5 % a 95 % ACN en 60 min, manteniendo 95 % ACN por 10 min más y dejando 10 min en la condición inicial, previo a la siguiente inyección. Se establecieron las condiciones siguientes: flujo 1 mL/min; volumen de inyección, 10 µL y temperatura, 25 °C. Las muestras de cada extracto se prepararon de concentración 20 mg/mL en ACN. Para favorecer su disolución se colocaron en baño ultrasonido a 30 ºC por 20 min, posteriormente se centrifugaron a 4 400 rpm por 20 min; el sobrenadante obtenido fue filtrado a través de membrana con poro de 0,45 µm, justo antes de la inyección.
RESULTADOS
Análisis fitoquímico
En la tabla 2 se pueden apreciar las clases de metabolitos secundarios detectados mediante las pruebas de coloración y precipitación. Los resultados del perfil cromatográfico por CCD se muestran en la tabla 3. Las pruebas se hicieron en paralelo para los extractos etanólicos de las dos especies.
Los perfiles cromatográficos por CLAE de los extractos de C. metensis y C. membranacea mostraron una alta similitud entre sí y en ambos casos registraron tres grupos de compuestos de alta, media y baja polaridad, respectivamente, con importante absortividad a 210 nm (Fig.).
DISCUSIÓN
Los resultados de las pruebas de tubo (precipitación-coloración) y CCD evidenciaron la presencia y ausencia de las mismas clases de metabolitos en las dos especies evaluadas. Hay poca variedad de metabolitos secundarios: flavonoides, taninos, esteroides y terpenos, en cantidades cualitativamente equivalentes para ambas especies. Se evidenció la ausencia de alcaloides, saponinas, derivados antracénicos, cumarinas y lactonas terpénicas.
En el caso de flavonoides dieron positivas las tres pruebas empleadas, evidenciando no solo la presencia de polifenoles (FeCl3), sino de leucoantocianidinas (HCl y calentamiento) y de flavonoides con el núcleo![]() -benzopirona (Shinoda). La presencia de flavonoides se confirmó por CCD, empleando NP-PEG como reactivo específico para la detección de flavonoides.6
-benzopirona (Shinoda). La presencia de flavonoides se confirmó por CCD, empleando NP-PEG como reactivo específico para la detección de flavonoides.6
Se considera que los extractos etanólicos de C. metensis y C. membranacea contienen taninos, una vez que además de obtenerse precipitado con una proteína (reactivo de gelatina-sal), este se disolvió en urea 10 M, generando una solución que dio prueba positiva (coloración verde con FeCl3) para compuestos fenólicos.16 Adicionalmente, se observó un resultado positivo para taninos condensados (proantocianidinas), una vez que se obtuvo una coloración rojo-vino luego de la hidrolisis en butanol/HCl, característica de las antocianidinas formadas.17-19 Por otro lado la CCD correspondiente evidenció manchas azules luego de revelar con ferricianuro de potasio - cloruro férrico, revelador empleado para detectar polifenoles y taninos.14,17,19
La presencia de compuestos con núcleo terpénico o esteroidal se detectó mediante CCD revelando con el reactivo de Libermann-Burchard, se observaron múltiples manchas de Rf entre 0,43 y 0,60, de coloraciones rosadas y pardas. La presencia de esta clase de metabolitos secundarios se confirmó con la observación de manchas rosadas y violetas, en la CCD revelada con vainillina-H3PO4, parte del ensayo para detectar la presencia de lactonas terpénicas, no identificadas en los extractos evaluados (tabla 1).
Para otras especies del género Cecropia, ej. C. obtusifolia,3,5,15 C. pachystachya,7 C. glaziovii,17,19C. catharinensis20 y C. hololeuca,21 se ha reportado la presencia de flavonoides, taninos, terpenos y esteroides. Pardo y otros14 reportaron la presenta de saponinas en C. peltata, resultado que no coincide con lo obtenido en esta investigación, quizá porque Pardo y otros utilizaron únicamente la prueba de la espuma, la cual puede generar falsos positivos, entre otros por la presencia de proteínas.16 Como parte de la batería de ensayos se incluyó la prueba de hemolisis para confirmar o descartar la presencia de saponinas.
En esta investigación no se detectó la presencia de alcaloides, que coincide con los resultados de otros trabajos, en los cuales se confirmó la ausencia de esta clase de metabolitos secundarios en otras especies del género Cecropia, como C. peltata y C. glaziovii.14,17
Los cromatogramas por CLAE obtenidos mostraron una alta complejidad, como es de esperar en el análisis de extractos etanólicos de un producto natural vegetal. Los perfiles cromatográficos de los extractos de C. metensis y C. membranacea evidenciaron sobre todo compuestos distribuidos en grupos de alta, media y baja polaridad, con apreciable absortividad a 210 y 220 nm, y baja absortividad a las demás longitudes de onda, con excepción de los compuestos de media polaridad, que presentan importante absortividad a 254, 280 y 350 nm. Picos de importancia aparecieron entre 2 y 16 min, que corresponden quizá a ácidos carboxílicos fenólicos y entre 24 y 32 min, región de flavonoides como catequina, epicatequina, quercetina, vitexina e isoorientina.15,17-19,22 Los picos que aparecieron entre 44 y 58 min pueden atribuirse preliminarmente a compuestos esteroidales y terpenos.7 Los perfiles por CLAE son concordantes con los resultados obtenidos por CCD.
El estudio fitoquímico preliminar mostró que los extractos etanólicos de Cecropia metensis y Cecropia membranacea presentaron en abundancia esteroides y terpenos, flavonoides y taninos. Adicionalmente, mediante las pruebas empleadas se evidenció alta similitud en la composición fitoquímica de las dos especies.
La poca diversidad en las clases de metabolitos secundarios detectados y su relativa abundancia, unido a los reportes de usos etnofarmacológicos y de actividades biológicas para otras especies del género Cecropia, sugieren que C. metensis y C. membranacea, pueden tener un potencial interés farmacológico. Esto orienta hacia el desarrollo de nuevas investigaciones encaminadas a la búsqueda de moléculas y fracciones farmacológicamente activas.
REFERENCIAS BIBLIOGRÁFICAS
1. Souccar C, Cysneiros RM, Tanae MM, Torres LM, Lima-Landman MT, Lapa Aj. Inhibition of gastric acid secretion by a standardized aqueous extract of Cecropia glaziovii Sneth. and underlying mechanism. Phytomedicine. 2008;15(6-7):462-9.
2. Revilla-Monsalve MaC, Andrade Cetto A, Palomino-Garibay MA, Wiedenfeld H, Islas-Andrade S. Hypoglycemic effect of Cecropia obtusifolia Bertol. aqueous extracts on type 2 diabetic patients. J Ethnopharmacol. 2007;111(3):636-40.
3. Perez-Guerrero C, Herrera MD, Ortiz R, Álvarez de Sotomayor M, Fernández MA. A pharmacological study of Cecropia obtusifolia Bertol. aqueous extract. J Ethnopharmacol. 2001;76(3):279-84.
4. Andrade Cetto A. Ethnobotanical study of the medicinal plants from Tlanchinol, Hidalgo, México. J Ethnopharmacol. 2009;122(1):163-71.
5. Andrade Cetto A, Heinrich M. Mexican plants with hypoglycemic effect used in the treatment of diabetes. J Ethnopharmacol. 2005;99(3):325-48.
6. Consolini A, Ragone M, Migliori G, Conforti P, Volonté M. Cardiotonic and sedative effects of Cecropia pachystachya Mart. (ambay) on isolated rat hearts and conscious mice. J Ethnopharmacol. 2006;106(1):90-6.
7. Teixeira, V, De Paula C, Krettli L, Goulart A, Krettli U. Antimalarial activity of compounds and mixed fractions of Cecropia pachystachya. Drug Dev Res. 2010;71:82-91.
8. Brandão M, Zanneti N, Oliveira P, Grael C, Santos A, Monte-Món R. Brazilian medicinal plants described by 19th century European naturalists and in the Official Pharmacopoeia. J Ethnopharmacol. 2008;120(2):141-8.
9. Nayad S. Cecropia peltata L. (Cecropiaceae) has wound-healing potential: A preclinical study in a Sprague Dawley rat model. Int J Low Extrem Wounds. 2006;5(1):20-6.
10. Cano JH, Volpato G. Herbal mixtures in the traditional medicine of Eastern Cuba. J Ethnopharmacol. 2004;90(2-3):293-316.
11. Nicasio P, Aguilar Santamaria L, Aranda E, Ortiz S, Gonzales M. Hypoglycemic effect and chlorogenic acid content in two Cecropia species. Phytother Res. 2005;19(8):661-4.
12. Cáceres A, Menéndez H, Mendez E, Cohobo E, Samayoa BE, Jáuregui E, et al. Antigonorrhoeal activity of plants used in Guatemala for the treatment of sexually transmitted diseases. J Ethnopharmacol. 1995;48(2):85-8.
13. Jaramillo D, Rincón J, Guerrero M. Actividad tipo anti-ausencia del extracto metanólico de Cecropia membranacea Trécul. en ratones. VITAE. 2008;15(2):267-73.
14. Pardo A, Triay M, Cuéllar A, Agüero J. Cecropia peltata L. estudios farmacognósticos y de la composición de ácidos grasos libres. Rev Cubana Farm. 2000;34(2):129-33.
15. Andrade-Cetto A, Cárdenas Vásquez R. Gluconeogenesis inhibition and phytochemical composition of two Cecropia species. J Ethnopharmacol. 2010;130(1):93-7.
16. Sanabria A. Análisis Fitoquímico preliminar. Metodología y su aplicación en la evaluación de 40 plantas de la familia Compositae. Bogotá: Universidad Nacional de Colombia, Departamento de Farmácia; 1983.
17. Luengas-Caicedo P. Contribuição para a padronização de extratos de folhas de Cecropia glaziovii Snethl.: estudos de variação sazonal e intra-específica de flavonóides e proantocianidinas, de metodologias de extração e de atividade vasorelaxante [Tesis Doutorado em Ciências Farmacêuticas]. Faculdade de Farmácia, Universidade Federal de Minas Gerais; 2005.
18. Tanae MM, Lima-Landman MT, De Lima TC. Souccar C, Lapa AJ. Chemical standardization of the aqueous extract of Cecropia glaziovii Sneth. endowed with antihypertensive, bronchodilator, antiacid secretion and antidepressant-like activities. Phytomedicine. 2007;14(5): 309-13.
19. Luengas-Caicedo PE, Braga FC, Brandão GC, Oliveira, AB. Seasonal and intraspecific variation of flavonoids and proanthocyanidins in Cecropia glaziovi Sneth. leaves from native and cultivated specimens. Z Naturforsch. 2007;62:701-9.
20. Machado EC, Yunesa RA, Malheiros A, Gomez EC, Delle Monache F. Two new 11a,12a-epoxy-ursan-28,13b-olides and other triterpenes from Cecropia catharinensis. Nat Prod Res. 2008;22(15):1310-6.
21. Lacaille-Dubois, Franck U, Wagner H. Search for potential Angiotensin Converting Enzyme (ACE)-inhibitors from plants. Phytomedicine. 2001;8(1):47-52.
22. Aragão D, Guarize L, Lanini J, Da Costa J, Garcia R, Scio E. Hypoglycemic effects of Cecropia pachystachya in normal and alloxan-induced diabetic rats. J Ethnopharmacol. 2010;128(3):629-33.
Recibido: 14 de febrero de 2013.
Aprobado: 29 de junio de 2013.
Pilar Ester Luengas Caicedo. Universidad Nacional de Colombia. Grupo de Investigación "Principios Bioactivos de Plantas Medicinales". Ciudad Universitaria - Bogotá D.C. Colombia. Carrera 30 # 45 - 03, Departamento de Farmacia, Edificio 450. Conmutador (57-1) 3165000 Ext. 14607-14640. Correo electrónico: peluengasc@unal.edu.co