Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Plantas Medicinales
versión On-line ISSN 1028-4796
Rev Cubana Plant Med vol.19 no.3 Ciudad de la Habana jul.-set. 2014
ARTÍCULO ORIGINAL
Actividad antiinflamatoria y analgésica de un extracto orgánico del alga roja Galaxaura rugosa (J. Ellis & Solander) J.V. Lamouroux
Anti-inflammatory and analgesic activity of an organic extract from the red alga Galaxaura rugosa (J. Ellis & Solander) J.V. Lamouroux
Lic. Abel Duménigo González,I MSc. Ana Iris Frías Vázquez,II MSc. Neivys García Delgado,III Lic. Rosa Mary Ramentol,II MSc. Hirán Ramón Cabrera Suárez,I DraC. Ana María Suárez AlfonsoII, MSc. Ioanna Martínez Hormaza,I DrC. Francisco José Morón RodríguezI†
I Laboratorio Central de Farmacología "DrC. Francisco Morón in memorian". Facultad de Ciencias Médicas "Salvador Allende". Universidad de Ciencias Médicas de La Habana. La Habana, Cuba.
II Facultad de Biología, Centro de Investigaciones Marinas. Universidad de La Habana. La Habana. Cuba.
III Departamento de Neurodesarrollo y Fisiología. Instituto de Fisiología Celular. Universidad Nacional Autónoma de México. Ciudad de México. México.
RESUMEN
Introducción: el alga roja Galaxaura rugosa (J. Ellis & Solander) J.V. Lamouroux (Galaxauraceae) es una de las especies más abundantes en la plataforma rocosa del arrecife coralino del archipiélago cubano, sin embargo, poco se conoce de sus propiedades farmacológicas.
Objetivos: evaluar la actividad antiinflamatoria y analgésica del extracto en diclorometano del alga roja G. rugosa, así como la composición fitoquímica de esta especie.
Métodos: las algas se colectaron en el litoral norte de La Habana. La caracterización fitoquímica del alga se realizó según el Método de Chabra. Para la preparación del extracto se sometió la muestra a extracción Soxhlet con diclorometano a 40 ºC. La actividad antiinflamatoria tópica se estudió en el modelo de edema de la oreja inducido por aceite de Croton en ratones machos OF-1, a las dosis de 10*10-3; 0,125; 0,25; 0,5; 1 y 2 mg/oreja. Se evaluó también la actividad analgésica del extracto en el modelo de contorsiones inducidas por ácido acético al 0,8 %, por vía intraperitoneal (i.p.), a las dosis de 3; 6; 12,5; 25 y 100 mg/kg.
Resultados: G. rugosa presentó en su composición fitoquímica compuestos grasos, lactónicos, triterpénicos y/o esteroidales y carbohidratos. El extracto en diclorometano de G. rugosa a partir de la dosis de 0,125 mg/oreja presenta una potente actividad antiinflamatoria (superior al 40 %). El extracto logró reducir las contorsiones en más de un 75 % a partir de la dosis de 6 mg/kg.
Conclusiones: los resultados presentados demuestran que el extracto en diclorometano del alga roja G. rugosa está constituido por una mezcla de compuestos capaces de inhibir con una elevada eficacia farmacológica la respuesta inflamatoria aguda y el dolor inducido por agentes químicos.
Palabras clave: Galaxaura rugosa , antiinflamatoria, analgésica, extracto en diclorometano, composición fitoquímica.
ABSTRACT
Introduction: the red alga Galaxaura rugosa (J. Ellis & Solander) J.V. Lamouroux (Galaxauraceae) is one of the most abundant species on the rocky platform of the Cuban coral reef. However, little is known about its pharmacological properties.
Objectives: evaluate the anti-inflammatory and analgesic activity of a dichloromethane extract from the red alga G. rugosa and determine the phytochemical composition of the species.
Methods: the algae were collected from the northern coast of Havana. Phytochemical characterization of the alga was performed using Chabra's method. The extract was obtained with a Soxhlet device with dichloromethane at 40 ºC. Topical anti-inflammatory activity was studied with the croton oil ear edema test model in male OF-1 mice at doses of 10*10-3, 0.125, 0.25, 0.5, 1 and 2 mg/ear. The analgesic activity of the extract was evaluated on a model of writhing induced by 0.8 % acetic acid administered intraperitoneally (i.p.) at doses of 3, 6, 12.5, 25 and 100 mg/kg.
Results: phytochemical analysis of G. rugosa revealed the presence of fatty, lactonic, triterpenic and/or steroidal compounds, as well as carbohydrates. The dichloromethane extract of G. rugosa at the dose of 0.125 mg/ear displayed a potent anti-inflammatory activity (above 40 %). The extract reduced writhing by more than 75 % with a dose of 6 mg/kg.
Conclusions: results show that dichloromethane extract of the red alga G. rugosa is composed of a mixture of compounds capable of inhibiting the acute inflammatory response and the pain induced by chemical agents with a high pharmacological efficacy.
Key words: Galaxaura rugosa, anti-inflammatory, analgesic, dichloromethane extract, phytochemical composition.
INTRODUCCIÓN
El 90 % de la biomasa en la Tierra se encuentra en los océanos, donde las especies marinas comprenden aproximadamente la mitad de la biodiversidad global. Esta amplia diversidad constituye un reservorio de potentes moléculas bioactivas, que son producidas por estos organismos para sobrevivir en ambientes hostiles.1,2 Muchos de estos compuestos poseen propiedades farmacológicas que resultan de gran utilidad en el tratamiento de varias patologías como el cáncer, el Síndrome de Inmunodeficiencia Adquirida (SIDA) y la artritis reumatoide.3
Entre los organismos marinos, las algas se han identificado como una fuente sub-explotada en este sentido. La exploración de estos organismos con propósitos farmacéuticos ha revelado importantes prototipos químicos para el descubrimiento de nuevos agentes, lo que ha permitido también estimular la síntesis de compuestos con aplicaciones biomédicas.4
Las algas rojas son consideradas la fuente más importante de metabolitos biológicamente activos en comparación con otras clases de algas.5 En este sentido se han realizado estudios que han demostrado las potencialidades de este grupo de organismos como agentes anticoagulantes,6 antioxidantes,7 antibacterianos,8 antivirales,6 antitumorales,9,10 antiinflamatorios11 y analgésicos.12
Numerosas investigaciones han estado dirigidas a estudiar el efecto antiinflamatorio de diversos compuestos aislados de diferentes especies de algas. Ejemplos de estos estudios son: el aislamiento de compuestos como el fucoidan, polisacárido sulfatado que presenta una marcada actividad antiinflamatoria, ya que inhibe la producción excesiva de óxido nítrico, prostagalandina E2 y citoquinas proinflamatorias en microglía estimulada con LPS.13 También se logró aislar un fluorotanino, el 6,6´-bieckol, del alga Ecklonia cava, que logró inhibir la expresión de óxido nítrico sintasa inducible (iNOS), ciclooxigenasa 2 (COX-2) y citoquinas proinflamatorias, a través de la regulación negativa del factor de transcripción NF-κB, en macrófagos RAW 264.7.14
Nuestro país, por su condición de isla, es privilegiado en cuanto a la abundancia y diversidad de especies marinas, entre las que se encuentran las algas. Estos organismos han despertado el interés de la comunidad científica cubana en los últimos años por sus propiedades farmacológicas como antiinflamatorios, analgésicos y antioxidantes.15
Desde hace algunos años nuestro grupo de trabajo realiza estudios encaminados a la determinación de las propiedades analgésicas y antiinflamatorias de ciertas especies de algas rojas, entre las que se encuentra Galaxaura rugosa (J. Ellis & Solander) J.V. Lamouroux, familia Galaxauraceae.
G. rugosa es un alga tropical y subtropical, y es una de las más abundantes dentro del Phylum Rhodophyta. Se encuentra formando áreas de considerable extensión en las costas cubanas y generalmente forma poblaciones persistentes durante todas las estaciones, con mayor predominio en el verano.16
El conocimiento acerca de la composición química y las propiedades farmacológicas de esta especie como antiinflamatoria y analgésica, se limita solamente al extracto acuoso, el cual mostró una baja eficacia. En la literatura revisada no se encontraron reportes previos de esta especie. Además, se conoce que los solventes empleados en la obtención de un extracto influyen en los metabolitos extraídos, según sea su polaridad, lo que determina también sus propiedades biológicas.
Por todo lo planteado previamente, nos propusimos evaluar las propiedades antiinflamatoria y analgésica del extracto en diclorometano del alga roja G. rugosa, así como la composición fitoquímica de esta especie que pudieran ser los responsables de sus propiedades farmacológicas.
MÉTODOS
Material vegetal
El alga roja Galaxaura rugosa (J. Ellis & Solander) J.V. Lamouroux, familia Galaxauraceae se colectó en la Playa Jaimanitas, al oeste de La Habana, en abril de 2011. La identificación taxonómica de los especímenes fue confirmada por la DraC. Ana María Suárez Alfonso, del Centro de Investigaciones Marinas de la Universidad de La Habana, y se depositó una muestra en el herbario del Acuario Nacional de Cuba (No. de voucher HANC 241). Posterior a la colecta, el material se lavó con agua destilada, se secó a la sombra a temperatura ambiente y se almacenó a 4 °C hasta su utilización.
Análisis fitoquímico de G. rugosa
El análisis cualitativo de la composición química de G. rugosa se realizó de acuerdo al Método de Chabra,17 basado en la extracción con solventes de polaridad creciente y ensayos de color o precipitación para los diferentes tipos de metabolitos.
Preparación del extracto
Se añadieron 500 mL de diclorometano a 100 g de material vegetal seco (talos de G. rugosa) y la muestra se sometió a extracción Soxhlet durante 24 horas a 40 ºC. El material resultante se secó por rotoevaporación.
Animales de experimentación
En todos los experimentos se emplearon ratones machos OF-1 (20-25 g), procedentes del Centro Nacional para la Producción de Animales de Laboratorio (CENPALAB-CUBA). Los animales fueron sometidos, 7 días previos a los experimentos, a un período de adaptación a las condiciones del vivario de la Facultad de Ciencias Médicas "Salvador Allende", en condiciones de temperatura y humedad relativa ambientales, ciclo luz-oscuridad de 12 horas, con alimento y agua ad-libitum. Se distribuyeron al azar en grupos por tratamiento. Los experimentos se desarrollaron siguiendo las normativas de trabajo con animales de experimentación contenidas en la Guía para el cuidado, uso y reproducción de los animales para experimentación, del CENPALAB (2000).18 En el caso de las sustancias que se administraron por vía i.p. la relación volumen-peso fue de 0,01 mL/kg.
Fármacos y reactivos
Los fármacos empleados (indometacina, dexametasona y ácido acetilsalicílico), el agente irritante (aceite de Croton) y el ácido acético procedían de Sigma Chemicals.
Estudios farmacológicos
Modelo de edema de la oreja inducido por aceite de Croton
Para el estudio de la actividad antiinflamatoria se empleó el modelo in vivo de inflamación aguda de edema de la oreja inducido por aceite de Croton.19 Para ello se constituyeron grupos de 6 animales cada uno, y el extracto y los fármacos de referencia se administraron por vía tópica, según el siguiente esquema:
A todos los animales se les aplicaron 20 μL de aceite de Croton al 0,4 % (disuelto en acetona) en la oreja derecha y a continuación las dosis del extracto en diclorometano (10*10-3; 0,125; 0,25; 0,5; 1 y 2 mg/oreja) disueltas en acetona; en tanto la oreja izquierda recibió 20 μL de acetona. Al grupo control se le administraron 20 μL de aceite de Croton y 20 μL de acetona en las orejas derecha e izquierda respectivamente. Los dos grupos controles positivos se trataron con 0,5 mg/oreja de indometacina (disuelta en NaHCO3 al 5 %) y 0,1 mg/oreja de dexametasona (disuelta en solución salina fisiológica).
Todos los animales se sacrificaron por tracción cervical a las 5 horas posteriores a la aplicación del aceite de Croton. La magnitud del edema se determinó por la diferencia de peso entre un disco de 7 mm de diámetro procedente de la oreja inflamada y otro de igual diámetro procedente de la oreja no inflamada. La actividad antiinflamatoria se midió como porcentaje de reducción del edema en los ratones tratados respecto a los controles. El porcentaje de inhibición se calculó según la siguiente expresión:
% de Inhibición = [(ΔPc - ΔPt)/ ΔPc] x 100
Donde: ΔPc : Media aritmética de la variación de peso en el grupo control
ΔPt : Media aritmética de la variación de peso en el grupo tratado
Analgesia periférica en respuesta nocioceptiva inducida por ácido acético intraperitoneal
En la evaluación de la actividad analgésica del extracto se empleó el modelo de contorsiones inducidas por ácido acético al 0,8 %.20 Para este ensayo se diseñaron grupos experimentales de 10 animales cada uno y se les administraron, por vía i.p., diferentes dosis del extracto en diclorometano: 3; 6; 12,5; 25; y 100 mg/kg. Al grupo control se le suministró solución salina fisiológica y se mantuvo en las mismas condiciones que los animales tratados con el extracto. Al grupo control positivo se le administró ácido acetilsalicílico (AAS) a 68 mg/kg por vía oral. Transcurridos 1 hora en el caso de los animales a los cuales se les administró el AAS y 30 minutos para los animales tratados por vía i.p. con diferentes dosis del extracto, se procedió a administrar ácido acético al 0,8 % por vía i.p. y se cuantificó, para cada animal, el número de contorsiones durante
20 minutos.
La actividad analgésica se evaluó como porcentaje de reducción de las contorsiones en los animales tratados respecto a los controles según la siguiente relación:
% de Reducción = [(ΔCc - ΔCt)/ΔCc] x 100
Donde: ΔCc: Media aritmética del número de contorsiones en el grupo control
ΔCt: Media aritmética del número de contorsiones en el grupo tratado
Análisis Estadístico
Previo al procesamiento estadístico de los resultados, se comprobó en todos los experimentos, la normalidad de los datos mediante la Prueba de Kolmogorov-Smirnov y la homogeneidad de varianza por la Prueba de Bartlett. Las medias se compararon mediante la Prueba de Bonferroni. Se señalan las diferencias significativas entre grupos (p<0,0001). El análisis estadístico se realizó en el programa Past, versión 1.99.
RESULTADOS
Composición fitoquímica de G. rugosa
Los resultados de los ensayos cualitativos (Tabla 1) mostraron la presencia de compuestos grasos, alcaloides y triterpenos y/o esteroides en el extracto en diclorometano. Además, las pruebas revelaron la existencia de aminoácidos o aminas libres y en menor proporción carbohidratos reducidos y triterpenos y/o esteroides en el extracto alcohólico. Finalmente, el extracto acuoso presentó compuestos lactónicos, azúcares reducidos, aminoácidos y carbohidratos, con reacciones positivas fuertes en todos los casos.
Efecto del extracto en diclorometano de G. rugosa sobre la respuesta inflamatoria aguda
Los resultados del experimento diseñado para estudiar la acción del extracto en diclorometano de G. rugosa, sobre la formación del edema auricular, se muestran en la Tabla 2.
Como se puede notar, en todos los grupos tratados se logró reducir la formación del edema de la oreja, con respecto al grupo control. Solo la dosis de 10*10-3 mg/oreja estuvo por debajo del 40 % de inhibición del edema, con solamente un 7,6 % de reducción. El resto de los grupos experimentales exhibió una inhibición muy significativa (p<0,0001) al ser comparados con el control. También se debe destacar que todas las dosis evaluadas presentaron diferencias significativas (p<0,0001) con los fármacos de referencia empleados como controles positivos. En el caso de la dosis del extracto de 0,5 mg/oreja el porcentaje de inhibición del edema (76,9 %) fue muy superior al de la indometacina (45,4 %), que se evaluó e esta misma dosis. El efecto máximo se alcanzó a la dosis de 2 mg/oreja, con un 79,2 % de inhibición, similar al de la dexametasona que fue de un 83,9 %.
Efecto analgésico periférico del extracto en diclorometano de G. rugosa
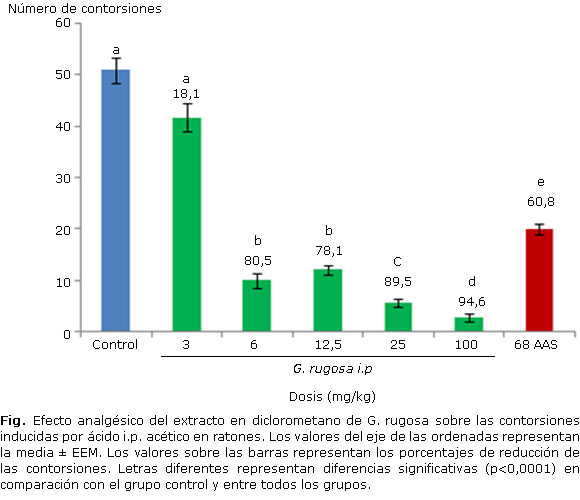
El extracto en diclorometano de G. rugosa disminuyó significativamente (p<0,0001) y de manera dosis dependiente, el número de contorsiones durante 20 minutos, inducidas por ácido acético i.p. en ratones (Figura).
Se puede apreciar que transcurridos treinta minutos después de la administración del extracto, todos los grupos, excepto el tratado con la dosis de 3 mg/kg, lograron disminuir significativamente (p<0,0001) el número de contorsiones, al ser comparados con el grupo control. También se debe destacar, que excepto la dosis de 3 mg/kg, todas las restantes presentaron porcentajes de inhibición superiores al del grupo control positivo. El efecto máximo se alcanzó a la dosis de 100 mg/kg con un 94,68 % de reducción de las contorsiones.
DISCUSIÓN
El ambiente marino contiene más del 80 % de las especies de plantas y animales del planeta, las cuales han desarrollado disímiles habilidades y capacidades adaptativas. Este hecho ha convertido a los organismos marinos en una fuente prolífica para el desarrollo de agentes farmacéuticos alternativos.3,5 En esta perenne búsqueda las algas marinas han constituido una fuente potencial de principios bioactivos utilizados en la elaboración de remedios medicinales para enfermedades como: la gota, dolores menstruales, sífilis, escorbuto, esguinces, reumatismos, enfisema, trastornos circulatorios, y otras dolencias menores como heridas, quemaduras y salpullido.21,22 Debido a estas excelentes propiedades los expertos consideran que sus posibilidades son enormes, teniendo en cuenta que apenas se tienen conocimientos científicos sobre algunas especies.
El análisis cualitativo de la composición química de G. rugosa reveló la presencia de compuestos grasos, de agrupamiento lactónico, triterpenos y/o esteroides, compuestos aminados, azúcares reductores y otros carbohidratos.
Diversas propiedades farmacológicas han sido atribuidas a compuestos de igual naturaleza a los que presenta G. rugosa. En este sentido los compuestos terpénicos y esteroidales aislados de macroalgas han sido muy estudiados por sus propiedades antitumorales y antiinflamatorias.23,24
Los polisacáridos son otro grupo de compuestos con promisorias propiedades farmacológicas descritas. Su actividad antioxidante ha sido demostrada al estudiar polisacáridos procedentes de Ulva rigida y de varias especies de Sargassum respectivamente.25,26 También se han reportado los efectos antioxidantes in vitro y antiinflamatorios in vivo de los polisacáridos obtenidos del alga parda Turbinaria ornata.27
Estas evidencias sugieren las potencialidades que exhibe G. rugosa como fuente de principios bioactivos, al presentar en su composición química compuestos de naturaleza análoga a los descritos anteriormente.
El efecto antiinflamatorio del extracto en diclorometano de G. rugosa se estudió en uno de los modelos de inflamación aguda que ha demostrado ser sensible a los inhibidores de la COX: el edema de la oreja inducido por aceite de Croton. Este es un modelo útil para la evaluación de la actividad antiinflamatoria de diversos compuestos,28 puesto que ha sido establecido que los mediadores más importantes involucrados en la formación del edema inducido por este agente son: la histamina, la serotonina y las prostaglandinas, producto de una exacerbación del metabolismo del ácido araquidónico (AA). De ahí la sensibilidad ante este modelo que presentan los inhibidores de la COX y de otros pasos del metabolismo del AA.
La administración por vía tópica del extracto en diclorometano mostró un potente efecto inhibitorio del proceso inflamatorio inducido por el aceite de Croton. De las 6 dosis evaluadas, 5 lograron porcentajes de inhibición de la reacción inflamatoria superiores al 40 %. La eficacia de la dosis de 0,5 mg/oreja fue superior a la del fármaco de referencia indometacina, inhibidor inespecífico de la COX (45,4 %), evaluado a igual dosis. De este modo, en nuestras condiciones experimentales, el extracto presentó una inhibición dependiente de la dosis sobre la formación del edema, así como una alta eficacia, ya que muestra un efecto máximo inhibitorio muy cercano al 80 %. Si tenemos en consideración que la eficacia es un parámetro relacionado con la potencia inhibitoria de la inflamación en la fase aguda, y que se corresponde con la actividad farmacológica de un extracto crudo y no de una fracción semipurificada o un compuesto puro, los resultados obtenidos en este estudio son un indicativo del potente efecto antiinflamatorio del extracto en diclorometano de G. rugosa.
Nuestros resultados concuerdan con los obtenidos por Payá y colaboradores en 1993, para un extracto en diclorometano de Galaxaura oblongata29 capaz de inhibir el edema auricular en un 76 %; similar al obtenido en nuestro estudio luego de administrar igual dosis del extracto de G. rugosa, para el cual se obtuvo un 71,5 % de inhibición. Por otro lado los resultados obtenidos por Kang y colaboradores en 2008 con el extracto en diclorometano (0,4 mg/oreja) del alga parda Sargassum fulvellum, en el modelo de edema de la oreja inducido por éster de forbol, redujo la reacción inflamatoria en un 79,1 %.30 En tanto, nuestro extracto al ser administrado a la dosis de 0,5 mg/oreja exhibió un porcentaje de reducción del edema de 76,9 %.
Se conoce que la última fase de la respuesta inflamatoria aguda se caracteriza porque en ella alcanzan su máxima expresión los eventos celulares, entre ellos la migración. El hecho de que los mediadores químicos responsables de esta etapa sean los eicosanoides, productos de las reacciones catalizadas por las COX, sugiere que esta fase es sensible a los inhibidores de esta enzima.31 Por esta razón nuestros resultados apuntan a que la acción inhibitoria del extracto sobre las fases que caracterizan la respuesta aguda inmediata puede estar mediado, por dicha inhibición, lo cual interfiere en la síntesis de prostaglandinas y leucotrienos. Esta afirmación está respaldada también por la elevada eficacia mostrada por el extracto, que fue superior a la de la indometacina.
Debido al potente efecto antiinflamatorio del extracto en diclorometano de G. rugosa por vía tópica, así como las implicaciones de una posible interacción de los componentes del extracto con el metabolismo del AA, se decidieron investigar sus efectos antiálgicos por una vía de administración sistémica (i.p.), en el modelo de contorsiones inducidas por ácido acético. Este modelo experimental ha sido ampliamente utilizado como una herramienta para la evaluación de las propiedades analgésicas periféricas de nuevas sustancias y constituye un modelo típico de dolor inflamatorio visceral.32 Implica la presencia de irritación local provocada por el ácido acético en la cavidad peritoneal, lo que desencadena la síntesis y liberación de una variedad de mediadores tales como: la bradicinina, la sustancia P y la PGI2, así como algunas citocinas como: IL-1ß, IL-8 y TNF-α.33 Estos mediadores pueden activar los nocioceptores quimiosensibles que contribuyen al desarrollo del dolor inflamatorio.
Nuestro estudio reveló una potente disminución de la sensación dolorosa cuando el extracto se administró bajo el esquema de dosificación empleado. Este hecho sugiere que algunos de los componentes del extracto interactúan con el metabolismo del AA, debido a que en ambos modelos utilizados hay una marcada implicación de los intermediarios de esta vía.
El extracto en diclorometano mostró una gran potencia desde el punto de vista de sus propiedades antinocioceptivas, ya que dosis inferiores a la utilizada con el fármaco de referencia (AAS) mostraron porcentajes de inhibición superiores.
Los resultados relacionados con las propiedades analgésicas del extracto no resultan sorprendentes, si se tiene en cuenta que estos efectos han sido descritos para extractos de diferentes especies de algas. Llanio y colaboradores en 1998 obtuvieron resultados similares al evaluar el extracto acuoso de Dictyoteris justii administrado por vía i.p. en el mismo modelo. Estos investigadores obtuvieron una inhibición de las contorsiones equivalente al 88 % tras la administración de la dosis de 25 mg/kg. Estos mismos autores también evaluaron el efecto antinocioceptivo del extracto acuoso de Dyctiota dentata administrado por igual vía y obtuvieron una inhibición de casi un 55 % a la dosis única equivalente de 20 mg/kg.34 Así mismo, nuestros resultados coinciden con los obtenidos por Guzmán y colaboradores en 2001 al estudiar la actividad antiálgica por vía i.p. de extractos acuosos y metanólicos obtenidos de las microalgas marinas Chlorella stigmatophora y Phaeodactylum tricornutum, en el mismo modelo experimental.35 Recientemente también se evaluaron las propiedades antinocioceptivas del extracto acuoso del alga roja Dichotomaria obtusata, en el mismo modelo experimental.36 Estos autores obtuvieron porcentajes de inhibición de la reacción dolorosa coincidentes con los nuestros.
Los resultados presentados en este estudio demuestran por primera vez, que el extracto en diclorometano del alga roja G. rugosa, está constituido por una mezcla de compuestos capaces de inhibir con una elevada eficacia farmacológica la respuesta inflamatoria aguda y el dolor inducido por agentes químicos. Estos efectos fueron similares y en algunos casos superiores a los observados en fármacos comúnmente utilizados en la práctica clínica. Las potencialidades que presenta este extracto en la terapia de las patologías que involucran procesos inflamatorios y dolorosos sugiere la necesidad de realizar estudios toxicológicos que permitan validar su seguridad; así como profundizar en el aislamiento, identificación y caracterización de los compuestos con actividad farmacológica presentes en el alga roja G. rugosa.
REFERENCIAS BIBLIOGRÁFICAS
1. Mayer A, Rodríguez AD, Berlinck RG, Fusetani N. Marine pharmacology in 2007–08: marine compounds with antibacterial, anticoagulant, antifungal, anti-inflammatory, antimalarial, antiprotozoal, antituberculosis and antiviral activities, affecting the immune and nervous systems, and other miscellaneous mechanisms of action. Comp Biochem Physiol C Toxicol Pharmacol. 2011;153:191-222.
2. Blunt J, Copp BR, Keyzers RA, Munro MH, Prinsep MR. Marine natural products. Nat Prod Rep. 2012;29:144-222.
3. Kumar R, Zi-rong X. Biomedical Compounds from Marine Organisms. Marine Drugs. 2004;2:123-46.
4. Wijesinghe W, Jeon YJ. Enzyme-assistant extraction (EAE) of bioactive components: a useful approach for recovery of industrially important metabolites from seaweeds: a review. Fitoterapia. 2012;83:6-12.
5. El Gamal AA. Biological importance of marine algae. Saudi Pharmaceutical Journal. 2010;18(1):1-25.
6. Mayer A, Rodríguez AD, Berlinck RGS, Hamann MT. Marine pharmacology in 2005-06: Marine compounds with antihelmintic, antibacterial, anticoagulant, antifungal, anti-inflammatory, antimalarial, antiprotozoal, antituberculosis and antiviral activities; affecting the cardiovascular, immune and nervous systems, and other miscellaneous mechanisms of action. Biochimica et biophysica acta. 2009;1790(5):283-308.
7. Zhang C, Wu WH, Wang J, Lan MB. Antioxidant properties of polysaccharide from the brown seaweed Sargassum graminifolium (Turn.) and its effects on calcium oxalate crystallization. Mar Drugs. 2012;10:119–30.
8. Oh K, Lee JH, Chung SC, Shin J, Shin HJ, Kim HK, Lee HS. Antimicrobial activities of the bromophenols from the red alga Odonthalia corymbifera and some synthetic derivatives. Biorganic and Medicinal Chemistry Letters. 2009;18(11):104-8.
9. Kwong M, Nam TJ. A polysaccharide of the marine alga Capsosiphon fulvescens induces apoptosis in AGS gastric cancer cells via an IGF-IR-mediated P13K/Akt pathway. Cell Biology International. 2007;31:765-75.
10. Wu W, Asumi K, Peng H, Hu X, Wang X, Bao B. Fibrinolytic Compounds Isolated from a Brown Alga, Sargassum fulvellum. Marine Drugs. 2009.
11. Grünewald N, Groth I, Alban S. Evaluation of seasonal variations of the structure and anti-inflammatory activity of sulphated polysaccharides extracted from the red alga Delesseria sanguinea (Hudson) Lamoraoux, (Cleramiales, Delesseriaceae). Biomacromolecules. 2009;10:1155–62.
12. Viana G, Freitas ALP, Lima MML, Vieira LAP, Andrade MCH, Benevides NMB. Antinociceptive activity of sulfated carbohydrates from the red algae Bryothamnion seaforthii (Turner) Kutz. and B. triquetrum (SG Gmel) M. Howe. Brazilian Journal of Medical and Biological Research. 2002;35:713-22.
13. Park H, Han MH, Park C, Jin CY, Kim GY, Choi IW, Kim ND, Nam TJ, Kwon TK, Choi YH. Anti-inflammatory effects of fucoidan through inhibition of NF-B, MDPK and Akt activation in lipolysaccharide-induced BV2 microglia cells. Food Chem Toxicol. 2011;49:1745–52.
14. Yang Y, Shin HC, Kin SH, Park WY, Lee KT, Choi JH. 6,6-bieckol, isolated from marine alga Ecklonia cava, suppressed LPS-induced nitric oxide and PGE production and inflammatory cytokine expression in macrophages: the inhibition of NF-κB. Int Immunopharmacol. 2012;12:510–7.
15. Fernández M, Llanio M, Arteaga F, Dajas F, Echeverry C, Ferreira M, et al. Propiedades antiinflamatoria-analgésica y antioxidante de una planta marina. Revista Cubana de Farmacia. 2004;Supl Esp.
16. Suárez A. Lista de Macroalgas Marinas. Rev Invest Mar. 2005;26(2):93-148.
17. Chabra S, Viso FC, Mshin EN. Phytochemical screening of Tanzanian medicinal plants. I J Ethnopharmacol. 1984;11(2):157-79.
18. CENPALAB. Centro Nacional para la Producción de animales de Laboratorio. Guía para el cuidado, uso y reproducción de los animales para experimentación. ed 01/00. 2000.
19. Tubaro A, Dri P, Melato M, Mulas G, Biachini P, Del Negro P, Della-Loggia R. In the Croton oil ear edema test the effects of non steroidal anti-inflammatory drugs (NSAIDs) are dependent on the dose irritant. Agents Actions. 1986;19:371-3.
20. Koster R, Anderson M, De Beer EJ. Acetic acid for analgesic screening. Fed Proc. 1959;18:412.
21. Melo F, Pereira MS, Foguel D, Mourao PA. Antithrombin-mediated anticoagulant activity of sulfated polysaccharides: different mechanisms for heparin and sulfated galactans. J Biol Chem. 2004;279:20824-35.
22. Mayer A, Rodríguez AD, Berlinck RGS, Hamann M. Marine pharmacology in 2003–4: Marine compounds with antihelmintic, antibacterial, anticoagulant, antifungal, anti-inflammatory, antimalarial, antiplatelet, antiprotozoal, antituberculosis, and antiviral activities; affecting the cardiovascular, immune and nervous systems, and other miscellaneous mechanisms of action. Comparative Biochemistry and Physiology. 2007;145:553-81.
23. Mohammed K, Hossain CF, Zhang L, Bruick RK, Zhou YD, Tagle DG. Laurenditerpenol, a new diterpene from the tropical marine alga Laurencia intricata that potently inhibits HIF-1 mediated hypoxic signaling in breast tumor cells. J Nat Prod. 2003;67:2002-7.
24. Chatter R, Othman RB, Rabhi S, Kladi M, Tarhouni S, Vagias C, Roussis V, Guizani-Tabbane L, Kharrat R. In Vivo and in Vitro Anti-Inflammatory Activity of Neorogioltriol, a New Diterpene Extracted from the Red Algae Laurencia glandulifera. Marine Drugs. 2011;9:1293-306.
25. Godard M, Décordé K, Ventura E, Soteras G, Baccou JC, Cristol JP, et al. Polysaccharides from the green alga Ulva rigida improve the antioxidant status and prevent fatty streak lesions in the high colesterol fed hamster, an animal model of nutritionally-induced atherosclerosis. Food Chemistry. 2009;115:176-80.
26. Kuda T, Ikemori T. Minerals polysaccharides and antioxidant properties of aqueous solutions obtained from macroalgal beach-casts in the Noto Peninsula, Ishikawa, Japan. Food Chemistry. 2009;112:575-81.
27. Ananthi S, Balaji HR, Gopalan A, Gayathri V, Ramakrishnan G, Vasanthi HR. In vitro antioxidant and in vivo anti-inflammatory potential of crude polysaccharide from Turbinaria ornata (Marine Brown Alga). Food and Chemical Toxicology. 2010;48:187-92.
28. Reanmongkol W, Matsumoto K, Watanabe H, Subhadhirasakul S, Takayama H, Sakai SI. Effects of alkaloids extracted from the stem bark of Hunteria zeylanica on acute inflammation in experimental animals. Biol Pharm Bull. 1995;18(1):33-6.
29. Payá M, Ferrándiz ML, Sanz MJ, Bustos G, Blasco R, Rios JL, et al. Study of the antioedema activity of some seaweed and sponge extracts from the Mediterranean coast in mice. Phytother Res. 1993;7:159-62.
30. Kang J, Khan MN, Park NH, Cho JY, Lee MC, Fujii H, Hong YK. Antipyretic, analgesic, and anti-inflammatory activities of the seaweed Sargassum fulvellum and Sargassum thunbergii in mice. J Ethnopharmacol. 2008;116(1):187-90.
31. Sunshine A, Marrero I, Olson N, McCormick N, Laska EM. Comparative study of flurbiprofen, zomepirac sodium, acetaminophen plus codeine, and acetaminophen for the relief of postsurgical dental pain. American Journal of Medicine. 1986;24(80):50-4.
32. Tjolsen A, Hole K. Animal models of analgesia. The Pharmacology of Pain. 1997;130:1-20.
33. Ikeda Y, Ueno A, Naraba H, Oh-Ishi S. Involvement of vanilloid receptor VR1 and prostanoids in the acid-induced writhing responses of mice. Life Sci. 2001;69:2911-9.
34. Llanio M, Fernández MD, Concepción AR, Mustelier E, Cabrera B. Pesquisaje de propiedades antiinflamatorias y analgésicas en extractos de origen marino de Cuba. Rev Cubana Plant Med. 1998;3(2):69-71.
35. Guzmán S, Gato A, Calleja JM. Antiinflammatory, analgesic and free radical scavenging activities of the marine microalgae Chlorella stigmatophora and Phaeodactylum tricornutum. Phytotherapy Research. 2001;15:224-30.
36. Frías A, Dutok CM, García N, Suárez AM, Santos Y, Cabrera H. Anti-inflammatory and analgesic activities of red seaweed Dichotomaria obtusata. Brazilian Journal of Pharmaceutical Sciences. 2011;47(1):111-8.
Recibido: 4 de agosto de 2014.
Aprobado: 6 de agosto de 2014.
Lic. Abel Duménigo González. Laboratorio Central de Farmacología. Facultad de Ciencias Médicas “Salvador Allende”. Universidad de Ciencias Médicas de La Habana. Cuba. Dirección: Carvajal No. 156 entre Agua Dulce y Calle A. Municipio Cerro. CP 12000. Tel: 53 7870 1663
Correo electrónico: abeldg@infomed.sld.cu