Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Plantas Medicinales
versión On-line ISSN 1028-4796
Rev Cubana Plant Med vol.21 no.2 Ciudad de la Habana abr.-jun. 2016
ARTÍCULO ORIGINAL
Extracción de compuestos fenólicos y actividad antioxidante de hojas de Bixa orellana L. (achiote)
Extraction of phenolic compounds and antioxidant activity from leaves of Bixa orellana L. (achiote)
Cindy Tatiana Sepúlveda Rincón,I Gelmy Luz Ciro Gómez,I José Edgar Zapata MontoyaI,II
I Sede de Investigación Universitaria (SIU). Universidad de Antioquia. Medellín, Colombia.
II Grupo de investigación "Nutrición y Tecnología de Alimentos". Universidad de Antioquia. Medellín, Colombia.
RESUMEN
Introducción: Bixa orellana L. también conocida como achiote, es una planta con un rico depósito de compuestos bioactivos, tales como, saponinas, alcaloides y flavonoides, a los cuales se les atribuyen propiedades fisiológicas entre las que se encuentran: actividad antimicrobiana, antiinflamatoria, antialérgica, antiviral, anticancerígena, antioxidante, entre otras.
Objetivos: evaluar el efecto del tiempo de extracción y la relación solvente/ sobre el contenido de fenoles totales, así como el efecto del contenido de sólidos y el pH de la solución, sobre la actividad antioxidante del extracto de hojas de B. orellana.
Métodos: el contenido total de fenoles fue evaluado por el método de Folin-Ciocalteu. La actividad antioxidante se determinó por los métodos espectrofotométricos de reacción con el radical 2,2´-azino-bis (3-etilbenzotiazolin-6- ácido sulfónico) y la medida de la capacidad reductora sobre el Fe+3, los resultados se expresaron como micromoles de equivalentes Trolox por gramo de extracto (μmol ET.g-1).
Resultados: las condiciones del proceso que más favorecen la extracción de compuestos fenólicos desde las hojas de Bixa orellana L. son: tiempo de extracción de 60 h y relación solvente/ hojas (v/p) de 4/1. El contenido máximo de fenoles totales fue de 144,77 ± 9,66 mgAT.g-1, que al someterlo a una solución de pH de 8 y 11,7 °Brix, presenta una actividad antioxidante de 4406,83 ± 43,30 μmol ET.g-1 por el método de reacción con el radical 2,2´-azino-bis (3-etilbenzotiazolin-6- ácido sulfónico) y 4547,22 ± 53,19 μmolET.g-1 por el método de medida de la capacidad reductora sobre el Fe+3.
Conclusiones: se demostró que la cantidad de fenoles totales extraídos de hojas de B. orellana dependen de la relación solvente/material vegetal y del tiempo de extracción; asimismo, se encontró que el pH tiene efecto sobre la actividad antioxidante determinada por la reacción con el radical 2,2´-azino-bis (3-etilbenzotiazolin-6- ácido sulfónico) y la medida de la capacidad reductora sobre el Fe+3.
Palabras clave: Bixa orellana L.; actividad antioxidante; metodología de superficie de respuesta; fenoles totales.
ABSTRACT
Introduction: Bixa orellana L. also known as annatto, is a plant with a high content of bioactive compounds, such as saponins, alkaloids and flavonoids that have physiological properties as antimicrobial, anti-inflammatory, anti-allergenic, antiviral, anticarcinogenic and antioxidant properties, among others.
Objectives: To evaluate the effect of extraction time and the solvent/ leaf ratio over the total phenolic content and the effect of solids and pH of the solution on the antioxidant activity in extracts from Bixa orellana leaves.
Methods : The ethanol extract of leaves of Bixa orellana was obtained by percolation and filtering. Total phenol content was evaluated by the Folin-Ciocalteu. The antioxidant activity was determined by spectrophotometric methods as reaction with 2,2'-Azinobis-(3-ethylbenzothiazoline-6-sulfonic acid) and ferric reducing antioxidant power, the results were expressed as micromoles of Trolox equivalents per gram of extract (μmolTE.g -1).
Results: Process conditions that improve the extraction of phenolic compounds from Bixa. orellana extract are: extraction time of 60 h and solvent/ leaves ratio (v/w) of 4/1. The maximum total phenol content was 144.77 ± 9.66mgAT.g-1, which when subject to a solution of pH 8 and 11.7 °Brix, has an antioxidant activity of 4406.83 ± 43.30 μmolTE.g-1 by the 2,2'-Azinobis-(3-ethylbenzothiazoline-6-sulfonic acid) reaction and 4547.22 ± 53.19 μmolET.g-1 by ferric reducing antioxidant power.
Conclusion: It showed that the amount of TF extracted from leaves of Bixa orellana depend on the solvent/ leaves ratio and the extraction time. In addition, it found that the pH has an effect on the antioxidant activity determined by the methods 2,2'-Azinobis-(3-ethylbenzothiazoline-6-sulfonic acid) reaction and ferric reducing antioxidant power.
Keywords: Bixa orellana L.; antioxidant activity; response surface methodology; total phenols.
INTRODUCCIÓN
El creciente interés del consumidor por satisfacer sus demandas nutricionales con alimentos de excelente calidad y que no representen riesgos para la salud, ha generado nuevas oportunidades para el uso de conservantes derivados de plantas, animales, microorganismos, etc. que sin afectar los atributos sensoriales de los alimentos como sabor, olor, color o textura, extiendan los periodos de vida útil y salvaguarden la seguridad del consumidor.1-6
La oxidación lipídica es considerada como una de las principales causas de deterioro de los alimentos, dado que provoca cambios químicos que afectan sus características sensoriales, como olores y sabores rancios, alteraciones del color y la textura 7 y degradación de compuestos funcionales y nutricionales, produciendo además polímeros oxidados que pueden suscitar problemas de salud.8,9
Las plantas son ricas en compuestos fenólicos, que poseen propiedades antioxidantes, ya que han sido sugeridas con un papel positivo en el alivio del estrés oxidativo y la prevención de enfermedades mediadas por los radicales libres.10
Bixa orellana L. también conocida como achiote, es una especie de planta arborescente de las regiones intertropicales de América, pertenece a la familiaBixaceae,11,12 es un arbusto perenne, de 2 a 6 m de altura, copa baja y extendida, a menudo hemisférica.13 Entre los componentes principales de la planta se encuentran los carotenoides, los cuales comprenden alrededor de un 4 a 5 %, en especial apocarotenos: bixina y pequeñas cantidades de isobixina y norbixina. En la planta se encuentran también otros carotenoides como beta-caroteno, criptoxantina, luteína, zeaxantina, orellina.6
El extracto etanólico de B. orellana ha presentado actividad antimicrobiana frente a algunos microorganismos de interés en la industria alimentaria, así como actividad antioxidante.12,14,15 Sin embargo, son escasos los estudios orientados a la optimización de compuestos fenólicos presentes en esta planta, además, no hay información sobre la influencia del contenido de sólidos y el pH sobre el contenido de compuestos fenólicos y la actividad antioxidante.
La metodología de superficie de respuesta ha sido utilizada para la optimización de compuestos fenólicos ya que como protocolo experimental estadístico, optimiza los parámetros de procesamiento de una manera eficiente, y permite interpretar de forma fácil el efecto de las variables y su interacción.
Por lo anterior, los objetivos del presente trabajo es evaluar el efecto del tiempo de extracción y la relación solvente/material vegetal sobre el contenido de fenoles totales extraídos de las hojas de B. orellana. Además, evaluar el efecto del contenido de sólidos y el pH, sobre la actividad antioxidante del extracto.16
METÓDOS
Material Vegetal
Las hojas de B. orellana se recolectaron en un predio particular del municipio de San Luis del departamento de Antioquia, Colombia; ubicado a 150 metros sobre el nivel del mar (msnm) e identificada como Bixa orellana variedad roja y un ejemplar del espécimen reposa en el Herbario de la Universidad de Antioquia identificado con el número HUA 108450.
Optimización del proceso de extracción de compuestos fenólicos de hojas de B. orellana
Las hojas fueron secadas en estufa convencional a temperatura de 37 ± 0,2 °C. El material vegetal seco fue sometido a un proceso de extracción con etanol al 95%a una temperatura de almacenamiento de 4 ± 0,2 °C. Para este proceso se desarrolló un Diseño Central Compuesto (DCC), en el cual se consideraron como factores la relación solvente/hojas (RSH),con valores entre 2/1 y 4/1 (v/p) y el tiempo de extracción (t) con niveles entre 36 y 60 h, con el fin de optimizar la variable respuesta cantidad de fenoles totales (FT) extraídos del material vegetal. Mediante la metodología de superficie de respuesta (MSR) se determinaron las condiciones en las cuales se obtiene mayor cantidad de compuestos fenólicos.
Evaluación del efecto del contenido de sólidos y el pH sobre la actividad antioxidante del extracto de hojas de B. orellana optimizado
Se desarrolló un DCC para evaluar el efecto de los factores pH (3-8) y el contenido de solidos (SS) (8-20°Brix) sobre la variable respuesta actividad antioxidante del extracto optimizado.
Determinación del contenido de fenoles totales
A 10μldel extracto se le adicionó agua destilada hasta completar 500μl. A la solución anteriorfue agregado 250μl del reactivo Folin-Ciocalteu, así como a las soluciones estándar, a continuación fueron sometidas a un proceso de sonicación por 5 min. Pasado el tiempo, fueron adicionados 1250 μl de Na2CO3 al 20 %. La mezcla se dejó en reposo durante dos h en la oscuridad. Por último, a las muestras se les midió la absorbancia en un espectrofotómetro a 725 nm (UV-1700, Shimadzu Europe) y los resultados fueron leídos en una curva patrón de ácido tánico y expresados como equivalentes de ácido tánico por gramos de (mg AT.g -1).17
Determinación de la actividad antioxidante del extracto optimizado a diferentes condiciones del pH y contenido de sólidos
Reacción con el radical 2,2´-azino-bis(3-etilbenzotiazolin-6-ácido sulfónico)
(ABTS*)
Se determinó de acuerdo a la metodología descrita por Re y colaboradores18 con algunas modificaciones. Se preparó una solución de ABTS de 7mM y una solución de persulfato potásico de 2,45 mM, luego se mezclaron partes iguales de ABTS 7mM y persulfato potásico 2,45 mM, esta mezcla se mantuvo en oscuridad, después de 16 h se mezcló la solución ABTS con 50 mL de etanol, para finalizar 1mL de la solución de ABTS se mezcló con 100 μL de extracto y se llevó a incubación a 30 °C durante 30 min en la oscuridad. Por último fue medida la absorbancia de la solución a una longitud de onda de 730 nm. Los resultados se expresaron como micromoles de equivalentes Trolox por gramo de extracto (μmolET.g-1).
Medida de la capacidad reductora sobre el Fe+3
Se llevó a cabo mediante la metodología propuesta por Pulido y colaboradores,19 en la cual 900 μL del reactivo de FRAP (2,4,6-Tripiridil-s-Triazina, cloruro de hierro y buffer de acetato de sodio) recién preparado y calentado a una temperatura de 37 °C, se mezclaron con 90 μL de agua destilada y 30 μL de extracto o estándar de Trolox y se incubó a 37 °C por 30 min. Se leyó absorbancia a 595 nm. Los resultados fueron expresados como micromoles de equivalentes Trolox por gramo de extracto (μmolET.g-1).
Análisis Estadístico
Los datos resultantes del DCC se ajustaron a un polinomio de la forma de la ecuación 1, utilizándose el software Design-Expert, versión 7.1.6 (Stat-Ease, EE.UU.).
Donde βo es el coeficiente constante, βį, βįį, βij son los coeficientes para el término lineal, cuadrático y la interacción en su respectivo orden, xį y xj son los factores independientes y ε es el error.
El modelo matemático obtenido fue optimizado por medio de la metodología de superficie de respuesta (MSR) para determinar los niveles de los factores que entregan los máximos valores de la variable respuesta. Bajo estas condiciones óptimas, se realizaron las pruebas subsiguientes en el estudio. Se validaron los supuestos de homogeneidad de varianzas mediante la prueba de Breusch-Pagan, la independencia de los errores con la prueba Durbin-Watson y la normalidad mediante la prueba de Shapiro-Wilk.
El ajuste del modelo desarrollado, la significancia estadística de los coeficientes de regresión, la interacción entre las diferentes variables independientes y su correspondiente efecto sobre la respuesta, fueron probados mediante el análisis de varianza (ANOVA).
RESULTADOS
Efectos de t y RSH sobre la cantidad de compuestos fenólicos (FT) extraídos
En la tabla 1, se muestran las corridas experimentales del DCC en forma aleatoria con los resultados de la variable respuesta cantidad de FT.
El ANOVA indicó que RSH y t tienen un efecto estadístico significativo (p<0,0001 y p = 0,0057 en su orden respectivo) sobre la cantidad de FT en su término lineal, por su parteel estadístico R-cuadrado reveló que el modelo ajustado (Ecuación 2) explica un 90 % la variabilidad de FT.
Optimización del proceso de extracción y validación experimental del modelo
El modelo obtenido a partir de los resultados del DCC para la extracción de los compuestos fenólicos (Ecuación 2) se sometió a un procedimiento de optimización con el objetivo de determinar los niveles de los factores que permitieran maximizar la extracción de los compuestos fenólicos presentes en las hojas de la planta.A partir de la optimización se encontró que una extracción durante 60 h, con una RSH de 4/1 se logra extraer la mayor cantidad de compuestos fenólicos de la planta con un valor predicho de FT de 150,20mg AT.g -1. A continuación se realizó la validación experimental del modelo y se encontró que de las muestras de hojas sometidas a las condiciones óptimas del proceso de extracción se logra obtener una concentración en FT de 144,77 ± 9,66mg AT.g -1, que comparado con el predicho por la MSR representa un valor muy cercano.
Evaluación del efecto del contenido de sólidos y el pH sobre la actividad antioxidante del extracto etanólico de hojas de B. orellana
En la tabla 2 se muestran las corridas del DCC de hojas en forma aleatoria y los resultados de FT y actividad antioxidante para cada corrida.
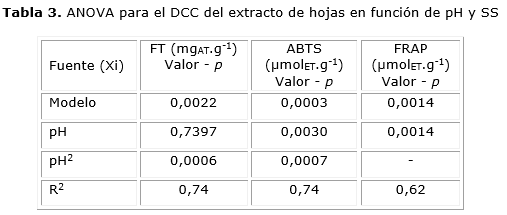
Los resultados del ANOVA del DCC se presentan en la tabla 3, en la cual se indica que el factor pH en su término lineal y cuadrático ejerce un efecto significativo (p < 0,05) sobre las variables respuestas FT y ABTS, mientras que para la variable respuesta FRAP, solo presenta efecto significativo el término lineal del factor pH. Mientras que el factor SS no tiene efectos significativos sobre ninguna de las respuestas.
En las ecuaciones 3-5 se presentan los modelos matemáticos para FT, ABTS y FRAP, en función de pH.
![]()
![]()
En la figura se muestran los gráficos de superficie de respuesta para cada variable respuesta.
Optimización y Validación del modelo
Los valores obtenidos experimentalmente para FT, ABTS y FRAP fueron superiores a los predichos por los modelos (tabla 4), lo que demuestra la potencia de MSR como método de optimización, ya que en este caso se buscaba encontrar las condiciones que maximizaran los valores de las respuestas.
DISCUSIÓN
Efectos de t y RSH sobre la cantidad de compuestos fenólicos (FT) extraídos
La relación positiva entre el factor t y la variable respuesta (ecuación 2) señala un incremento en la cantidad de FT extraídos a mayores tiempos de extracción, lo cual se explica teniéndose en cuenta que la difusión es un fenómeno que depende del tiempo, por lo que entre mayor tiempo transcurra, mayor penetración del solvente en el tejido del material vegetal se obtendrá.16,20, 21
Por otro lado entre mayor volumen de solvente disponible para una cierta cantidad de soluto, menor posibilidad de saturación de la solución.21 El signo positivo del factor RSH en la ecuación 2, implica que al aumentar la cantidad de solvente con respecto a la cantidad del material vegetal, aumentará la cantidad de FT extraídos, que es un comportamiento usual en este tipo de experimentos.20,22
La maximización de la cantidad de FT extraídos redunda en el mayor aprovechamiento del material vegetal disponible, así como en el uso apropiado del tiempo del proceso y de la cantidad de solvente utilizado. Lo cual resulta de importancia si se pone en consideración las actividades antimicrobiana y antioxidante que han sido reportadas para estos compuestos.12,14,15,23,24
Bajo las condiciones del presente estudio es posible obtener extractos de hojas de B. orellana con el mayor contenido de FT (144,77 ± 9,66mg AT.g-1), cuando se trabaja durante un tiempo de extracción de 60h y relación solvente/hojas de 4 mL/gr.
Efecto de SS y pH sobre la actividad antioxidante del extracto
El pH mostró un efecto estadístico significativo (p < 0,05) en sus términos lineal y cuadrático sobre las variables respuesta FT y ABTS (tabla 3), mientras que para la variable respuesta FRAP, solo presentó un efecto significativo (p < 0,05) el término lineal del factor pH presentándose un valor óptimo de 8,00. Los R2 de los modelos sugieren que los polinomios presentan de forma adecuada la relación existente entre las respuestas y el factor pH (tabla 3).Este efecto del pH sobre la actividad antioxidante de los extractos, pone de manifiesto la relevancia del ambiente fisicoquímico en el que se utilicen, cuando se tenga interés en aplicarlos buscándose dicha actividad en productos alimenticios. Es así como se ha reportado que aumentos de pH en ciertas variedades de ñame(Dioscorea alata L.) mostraron una disminución gradual del contenido de FT,25 mientras que un estudio realizado sobre zanahorias y hojas de menta mostraron un aumento significativo en la actividad antioxidante al aumentar el pH de 4 a 9.26 El análisis de varianza indicó también, que en el rango del estudio (8 -20 °Brix), el factor SS no presenta efecto significativo (p > 0,05) sobre FT y la actividad antioxidante.
Se demostró que la cantidad de FT extraídos de hojas de B. orellana dependen de la relación solvente/material vegetal y del tiempo de extracción. Además, se encontró que el pH tiene efecto significativo (p > 0,05) sobre la actividad antioxidante determinada por el método ABTS y FRAP.
REFERENCIAS BIBLIOGRÁFICAS
1. Tiwari BK, Valdramidis O, Donnell CP, Muthukumarappan K, Bourke P, Cullen PJ, et al. Application of Natural Antimicrobials for Food Preservation. J AgrFood Chem. 2009;57(14):5987-6000.
2. Mathenjwa SA, Hugo CJ, Bothma C, Hugo A. Effect of alternative preservatives on the microbial quality, lipid stability and sensory evaluation of boerewors. Meat Sci. 2012;91(2):165-72.
3. Xu W, Qu W, Huang K, Guo F, Yang J, Zhao H, et al. Antibacterial effect of Grapefruit Seed Extract on food-borne pathogens and its application in the preservation of minimally processed vegetables. Postharvest Biol Tec. 2007;45(1):126-33.
4. Gutiérrez-Larraínzar M, Rúa J, Caro I, de Castro C, de Arriaga D, García-Armesto MR, et al. Evaluation of antimicrobial and antioxidant activities of natural phenolic compounds against foodborne pathogens and spoilage bacteria. Food Control. 2012;26(2):555-63.
5. Berk Z. Chapter 16 - Spoilage and preservation of foods. Food Process Engineering and Technology. San Diego: Academic Press; 2009. p. 351-4.
6. Ciro Gómez GL, Quintana Castillo JC, Alarcón Pérez JC, Zapata Montoya JE. Extracto etanólico de hojas de Bixa orellana L.: un potencial conservante de alimentos. Interciencia. 2012;37(7):547-51.
7. Alamed J, Chaiyasit W, McClements DJ, Decker EA. Relationships between Free Radical Scavenging and Antioxidant Activity in Foods. J Agr Food Chem. 2009;57(7):2969-76.
8. Zieliński H, del Castillo MD, Przygodzka M, Ciesarova Z, Kukurova K, Zielińska D, et al. Changes in chemical composition and antioxidative properties of rye ginger cakes during their shelf-life. Food Chem. 2012;135(4):2965-73.
9. Wardhani DH, Fuciños P, Vázquez JA, Pandiella SS. Inhibition kinetics of lipid oxidation of model foods by using antioxidant extract of fermented soybeans. Food Chem. 2013;139(1-4):837-44.
10. Kunyanga CN, Imungi JK, Okoth MW, Biesalski HK, Vadivel V. Total phenolic content, antioxidant and antidiabetic properties of methanolic extract of raw and traditionally processed Kenyan indigenous food ingredients. LWT - Food Sci Technol. 2012;45(2):269-76.
11. Lourido Pérez HdlC, Martínez Sánchez G. La Bixa orellana L. en el tratamiento de afecciones estomatológicas, un tema aún por estudiar. Rev Cubana Farm. 2010;44:231-44.
12. Viuda M, Ciro GL, Ruiz Y, Zapata JE, Sendra E, Pérez JA, et al. In vitro Antioxidant and Antibacterial Activities of Extracts from Annatto ( Bixa orellanaL.) Leaves and Seeds. J Food Safety. 2012;32(4):399-406.
13. Leon J. Botanica de los cultivos tropicales: Editorial Agroamérica, Instituto Interamericano de Cooperación para la Agricultura; 2000.
14. Silva RB, Almeida CR, Chavasco JM, Chavasco JK. Antimycobacterial activity evaluation and MIC determination of liophilizated hydroalcoholic extracts of Bixa orellana L., Bixaceae. Rev Bras Farmacogn. 2010;20:171-4.
15. Venugopalan A, Giridhar P. Bacterial growth inhibition potential of annatto plant parts. Asian Pac J Trop Biomed. 2012;2(3, Supplement):S1879-S82.
16. Yolmeh M, Habibi Najafi MB, Farhoosh R. Optimisation of ultrasound-assisted extraction of natural pigment from annatto seeds by response surface methodology (RSM). Food Chem. 2014;155(0):319-24.
17. Singleton VL, Rossi J. Colorimetry of Total Phenolics with Phosphomolybdic-Phosphotungstic Acid Reagents. Am J Enol Vitic. 1965;16(3):144-58.
18. Re R, Pellegrini N, Proteggente A, Pannala A, Yang M, Rice-Evans C, et al. Antioxidant activity applying an improved ABTS radical cation decolorization assay. Free Radical Bio Med. 1999;26(9-10):1231-7.
19. Pulido R, Bravo L, Saura F. Antioxidant Activity of Dietary Polyphenols As Determined by a Modified Ferric Reducing/Antioxidant Power Assay. J Agr Food Chem. 2000;48(8):3396-402.
20. Wong J, Muñiz DB, Martínez GCG, Belmares RE, Aguilar CN. Ultrasound-assisted extraction of polyphenols from native plants in the Mexican desert. Ultrason Sonochem; 2015.
21. Sinha K, Chowdhury S, Saha PD, Datta S. Modeling of microwave-assisted extraction of natural dye from seeds of Bixa orellana (Annatto) using response surface methodology (RSM) and artificial neural network (ANN). Ind Crop Prod. 2013;41(0):165-71.
22. Chan C-H, Yusoff R, Ngoh G-C. Modeling and kinetics study of conventional and assisted batch solvent extraction. Chem Eng Res Des. 2014;92(6):1169-86.
23. Ciro G. Conservación de uchuva (Physalis peruviana L.), basada en la impregnación a vacío de extractos de plantas con actividad antimicrobiana y antioxidante. Medellín, Colombia: Universidad de Antioquia; 2012.
24. Fleischer TC, Ameade EPK, Mensah MLK, Sawer IK. Antimicrobial activity of the leaves and seeds of Bixa orellana. Fitoterapia. 2003;74(1-2):136-8.
25. Chen Y, Kao W, Lin K. Effects of pH on the total phenolic compound, antioxidative ability and the stability of dioscorin of various yam cultivars. Food Chem. 2008;107(1):250-7.
26. Arabshahi S, Vishalakshi D, Urooj A. Evaluation of antioxidant activity of some plant extracts and their heat, pH and storage stability. Food Chem. 2007;100(3):1100-5.
Recibido: 30 de enero de 2015.
Aprobado: 11 de noviembre de 2015.
Cindy Tatiana Sepúlveda Rincón. Sede de Investigación Universitaria (SIU). Universidad de Antioquia. Carrera 53 # 61-30, Lab. 631 Torre 2. Medellín, Colombia.
Correo electrónico: tatiana1827@gmail.com