Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Plantas Medicinales
versión On-line ISSN 1028-4796
Rev Cubana Plant Med vol.21 no.2 Ciudad de la Habana abr.-jun. 2016
ARTÍCULO ORIGINAL
Actividad ictiotóxica de extractos de dos especies colombianas del género Meriania Swartz (melastomataceae)
Ichtyotoxic activity of two colombian species extracts fromthe genus Meriania Swartz (melastomataceae)
Marcela Aguirre Naranjo,I Miladiz Aguirre Sánchez,I José Hipólito Isaza Martínez,II Ana Julia Colmenares Dulcey,II Diana Marcela Ocampo Serna,I Marco Tulio Jaramillo Salazar,I Jhon Henry Galvis García I
I Facultad de Ciencias Exactas y Naturales. Universidad de Caldas. Manizales, Colombia.
II Departamento de Química. Facultad de Ciencias Naturales y Exactas. Universidad del Valle. Cali, Colombia.
RESUMEN
Introducción: la familia melastomataceae es la séptima más grande del reino vegetal y ha sido utilizada en la medicina tradicional para el tratamiento de algunas enfermedades. En Colombia se encuentra representada por alrededor de 62 géneros, de los cuales Meriania ha sido poco estudiado, sin presentar reportes en la literatura de sus propiedades químicas y biológicas; por lo que el estudio de sus propiedades ictiotóxicas, constituye un acercamiento en la búsqueda de sustancias activas que permitan avanzar en el conocimiento del género y en la búsqueda de compuestos promisorios con aplicaciones biológicas.
Objetivo: evaluar la actividad ictiotóxica de extractos de diferente polaridad de Meriania speciosa (Bonpl.) Naudiny Merianiaquintuplinervis Naudin.
Métodos: los extractos de diferente polaridad (n-hexano, acetona 70%, metanol, acetato de etilo, n-butanol y agua) de ambas especies fueron evaluados frente a peces guppy (Poecilia reticulata Peters),sometidos durante 24 h a la acción de los extractos para la cuantificación del porcentaje de actividad ictiotóxica en una escala semicuantitativa, el test de observación de FinnSandberg-Irwin y como prueba anexa se obtuvieron cortes histopatológicos, con el fin de identificar posibles lesiones generadas por los extractos vegetales.
Resultados: de acuerdo con los porcentajes de actividad ictiotóxica obtenidos en este estudio, las sustancias evaluadas se clasifican como no activas, sin embargo, los resultados aportados por el test de observación indican que las sustancias afectan el sistema nervioso y generan daño hepático en el pez.
Conclusiones: los extractos vegetales de las especies de Meriania estudiadas presentan comportamientos diferentes, ya que M. speciosa ejerce un efecto psicoactivo en los peces, alterándose su sistema nervioso central, mientras que M. quintuplinervis está más relacionada con un nivel de toxicidad moderado, además de provocar un efecto vasodilatador comprobado en el hígado de P. reticulata.
Palabras clave: ictiotoxicidad; poeciliareticulata; meriania; melastomataceae; metabolitos secundarios.
ABSTRACT
Introduction: Melastomataceae is the seventh largest family in the plant kingdom and has been widely used in traditional medicine for the treatment of some diseases. In Colombia it is represented by around 62 genera, of which Meriania has been understudied, without presenting reports in the literature of its chemical and biological properties; so the study of their ichtyotoxic properties constitutes an approach in the search for active substances that advance knowledge of genus and in finding promising compounds with biological applications.
Objetive: To evaluate the ichtyotoxic activity of extracts of different polarity of Meriania speciosa (Bonpl.) and MerianiaquintuplinervisNaudin.
Methods: The extracts of different polarity (n-hexane, acetone 70 %, methanol, ethyl acetate, n-butanol and water) of both species were evaluated against guppy (Poeciliareticulata Peters), subjected for 24 h to action extracts for quantification of the percentage of ichtyotoxic activity in a semiquantitative scale and the observation Finn Sandberg-Irwintest and histopathological sections were obtained, in order to identify potential injuries from plant extracts.
Results: According to ichtyotoxic activity rates obtained in this study, the evaluated substances are classified as inactive; however, the test results indicate that the substances affect the nervous system and produce liver damage in fishes.
Conclusions: The plant extracts of the Merianiaspecies studied have different behaviors, as M. speciosahas a psychoactive effect on fishes, mainly altering the central nervous system, while M. quintuplinervisis more related to a moderate level of toxicity as well as causing a vasodilator effect found in the liver of P. reticulata.
KEY WORDS: Ichtyotoxicity; poeciliareticulate; meriania; melastomataceae; secondary metabolites.
INTRODUCCIÓN
La familia melastomataceae es la séptima más diversa del reino vegetal,1 ha sido aplicada en la medicina tradicional para el tratamiento de afecciones respiratorias, dolencias del tracto genitourinario, infecciones y heridas en la piel,2 utilizándose las partes aéreas y raíces; estructuras donde se han encontrado flavonoides, triterpenos, taninos, antocianinas, flavan-3-oles, saponinas, glicósidos y compuestos fenólicos, asociados a actividades biológicas como antihemorrágica, antioxidante, analgésica, alelopática, colorante, leishmanicida, ictiotóxica, antiinflamatoria y antibacterial.3,4 De esta familia hoy se conocen en Colombia unos 62 géneros nativos y 900 especies, con abundante representación en los bosques húmedos de los Andes, el Chocó biogeográfico y la Amazonía. Uno de estos géneros es Meriania, el cual comprende alrededor de 85 especies neotropicales, de las cuales 36 están presentes en el territorio colombiano desde el nivel del mar hasta los 3,600 m de altitud, con una mayor abundancia en los Andes.1 Su distribución restringida y su bajo número de colectas lo categorizan como susceptible a la extinción, considerándose la disminución de bosques nativos en pro del incremento de zonas de cultivo, además, la falta de conocimiento y reportes en la literatura de sus propiedades etnobotánicas y fitoquímicas contribuye a que sea considerado solo como ornamental.5
Con el fin de contribuir al conocimiento de las propiedades de este género,se seleccionaron dos especies (M. speciosa y M. quintuplinervis) y así aumentar el conocimiento de sus propiedades, iniciándose con la determinación de la actividad ictiotóxica, como evaluación preliminar paradetectarla presencia de sustancias bioactivas de las plantas, mediante el efecto causado por los extractos en el comportamiento o la supervivencia de los peces.2 Las sustancias que presentan dicha actividad con frecuencia son promisorias para el tratamiento de diferentes enfermedades como úlceras e infecciones bacterianas, además de promover o impedir la formación de tumores.6,7 Los ensayos de actividad ictiotóxica constituyen una aproximación importante en la búsqueda de compuestos vegetales con potencial terapéutico o agrícola, lo cual promueve estudios farmacológicos que pueden llevar a comprender ciertos mecanismos que aún no están elucidados.2,7 En este tipo de prueba suelen utilizarse organismos resistentes, como los peces guppy (P. reticulata), especie vivípara reconocida por sus aspectos genéticos y su adaptabilidad para sobrevivir en condiciones extremas de contaminación.8
En este estudio se evaluó la actividad ictiotóxica de los extractos de diferente polaridad de hojas de las especies M. speciosay M. quintuplinervis frente a peces guppy (P. reticulata) y se determinó, mediante pruebas las pruebas presuntivas, el grupo de metabolitos secundarios a los que se les pueden atribuir este comportamiento.
MÉTODOS
Material vegetal
M. speciosa (flor de Mayo) fue colectada en Pance, municipio del Valle del Cauca (Colombia) a una altura de 1700msnm y M. quintuplinervis(cebolleta) en la reserva civil, El Refugio Valle del Cauca (Colombia) a1800 msnm. Los ejemplares fueron identificados en el herbario de la Universidad de Caldas con los registrosFAUC 6820 y FAUC 6829, respectivamente.
Obtención de extractos
Las hojas se secaron a temperatura ambiente (25°C), durante 15 días, con un porcentaje de humedad del 60 %. Luego, las hojas se molieron en molino de cuchillas hasta un tamaño de partícula menor a 5 mm. Se tomaron 200 g ± 0,005 de las hojas secas y molidas de cada especie y se extrajeron con 500 mL de n-hexano en ultrasonido por 15 min (materia prima: solvente 2:5), repitiéndose este proceso 4 veces. Se realizó el mismo procedimiento con acetona: agua (70:30). Los filtrados fueron concentrados y secados mediante rotación continua. Para el extracto de acetona: agua (70:30), una vez se eliminó la acetona por rotación continua, se liofilizó para eliminar el agua y obtener el extracto seco. Los extractos fueron pesados y almacenados en refrigeración.
Al extracto de n-hexano se le realizó una extracción líquido-líquido con una mezcla de hexano-metanol (50:50), empleándose una proporción 1 a 3 entre el solvente y la muestra; se obtuvieron los extractos de hexano 1 (1,1) y metanol 1 (1,2).Al extracto de acetona al 70% (2,0)se le realizó una extracción líquido-líquido con acetato de etilo en proporción 1 a 3, obteniéndose dos extractos, el de acetato de etilo (2,1) y la fase acuosa, al cual se le realizó una extracción líquido-líquido con butanol saturado en proporción 1 a 3, obteniéndose dos extractos, butanólico (2,2) y acuoso (2,3).Finalmente se realizó una extracción líquido-líquido al extracto de acetato de etilo con una mezcla de hexano: metanol (50:50) en proporción 1 a 3, obteniendo así el extracto hexano 2 (2,1,1) y metanol 2 (2,1,2).
Pruebas fitoquímicas preliminares
Los diferentes extractos se sometieron a pruebas cualitativas; prueba de Salkowski y Lieberman-Burchard para terpenoides y esteroides; prueba de Folin-Ciocalteau y de cloruro férrico para detectar fenoles; prueba de Shinoda para flavonoides y la prueba de HCl/BuOH para taninos condensados y nitrito de sodio en etanol parataninos hidrolizables.9-11
Actividad ictiotóxica
El manejo y disposición final de los peces utilizados para determinar la actividad ictiotóxica, se realizó de acuerdo a las recomendaciones del Comité de Ética de la Universidad de Caldas (Resolución 1166 del 2014. Expediente IDB0353).
La ictiotoxicidadde los extractos de ambas especies vegetales fue evaluada sobre peces guppy (P. reticulata) obtenidos en el comercio. Estos fueron aclimatados en el laboratorio de Instrumentación Biofísica de la Universidad de Caldas en acuarios de 40x20x30cmcon agua reconstituida,12 monitoreándose valores de pH (pH-metro WTW), oxígeno disuelto (Oxímetro WTW), porcentaje de saturación (Oxímetro WTW), temperatura (Termómetro Digital CEM) y conductividad eléctrica (ConductivímetroHanna) durante 15 días antes de cada bioensayo realizándose cambios de agua cada 4 días y alimentándose los organismos dos veces al día con Tetracolor (TETRA TE16162).
La alimentación fue suspendida 24 h antes de la realización de los bioensayos. Para esta prueba se siguió la notación de Isaza,6 se disolvieron40mg del extracto en 0,5 mL de dimetilsulfóxido (DMSO), enseguida, se adicionaron 100 mL de agua reposada en erlenmeyer de 250 mL con 5 peces guppy (P. reticulata). Como blanco se emplearon 0,5 mL de DMSO en 100 mL de agua y como control negativo agua reposada. Los extractos se evaluaron por triplicado durante 24 h. Posterior al tiempo de monitoreo, se determinó el porcentaje de actividad ictiotóxica de los extractos mediante el uso de una escala semicuantitativa desarrollada por Isaza6 (tabla 1) y el test de comportamiento de FinnSandberg-Irwin, el cual se basa en tres parámetros de respuesta:
- Observación de movimientos del pez (disminución de movimiento del pez, clasificación de coordinación motora, parálisis de las aletas dorsales, laterales y cola).
- Síntomas de Estimulación (reacción de sobresalto, analgesia (insensibilidad), movimientos letárgicos).
- Parámetros subjetivos (catalepsia, posición del cuerpo en el momento de morir, muerte).13
La escala semicuantitativa para determinar el porcentaje de actividad ictiotóxica (% A.I) fue calculada de acuerdo a la siguiente ecuación:
De allí que, por ejemplo al morir un pez a las 7 h, el porcentaje de actividad ictiotóxica de acuerdo con la escala semicuantitativa correspondería a 2,90 %.
Determinación de la actividad ictiotóxica de una sustancia
Siguiéndose los parámetros propuestos por Ramírez,7 se consideró que la actividad de una sustancia está determinada por la totalidad de los peces muertos en un tiempo inferior a siete h (5 peces), las muestras activas producen la muerte de los 5 peces en un tiempo igual o mayor a 7 h y las muestras no activas no producen muerte de los peces durante las 24 h de bioensayo.
Histopatología
Como prueba anexa a la determinación de la actividad ictiotóxica, se realizaron análisis histopatológicos en el laboratorio de Patología Animal de la Universidad de Caldas, siguiéndose el protocolo descrito por Dogan.14 Posterior a los ensayos de actividad ictiotóxica, los peces muertos se fijaron en formol al 10 % durante 48 h a temperatura ambiente. Las muestras fueron deshidratadas en un procesador automático de tejidos (KEVEE KD-TSG) con intercambio de alcohol, desde 60 % a 100 % de pureza, durante siete h y luego incluidas en parafina (56 ºC), utilizándose moldes plásticos de inclusión para obtener cortes sagitales y ventrales de 2µm de grosor en micrótomo (Leica RM 2135). Se realizó tinción con Hematoxilina-Eosina (H&E). El análisis histológico se efectuó por microscopía (Leica ICC50 HD), con el fin de identificar, describir y caracterizar las posibles alteraciones en el tejido estudiado.
RESULTADOS
Pruebas fitoquímicas preliminares
El análisis cualitativo preliminar mostró que las dos especies presentan similitudes en los metabolitos secundarios de tipo terpenoide y esteroide con la prueba de Salkowski y Lieberman-Bouchard, en los extractos hexano 1(1,1) y metanol (2,1,2);hay presencia de fenoles con cloruro férrico y la prueba de Folin-Ciocalteu en los extractos metanol (2,1,2), butanólico (2,2) y acuoso (2,3) para ambas especies; presencia de flavonoides con Shinoda en los extractos metanólico (2,1,2) y butanólico de M. quintuplinervis; taninos condensados en los extractos butanólico (2,2) y acuoso(2,3) en el caso de M. speciosa; mientras que para M. quintuplinervis solo en el extracto acuoso (2,3); taninos hidrolizables en los extractos butanólico (2,2)y acuoso (2,3) en ambas especies.
Actividad ictiotóxica
Los resultados obtenidos al aplicar la escala semicuantitativa en las pruebas de actividad ictiotóxica sobre P. reticulata, indican que los extractos con mayor actividad de M. speciosa fueron aquellos obtenidos con metanol (2,1,2) y agua (2,3). En M. quintuplinervis, los extractos con actividad fueron los de acetona 70 % (2,0), acetato de etilo (2,1), metanólico (2,1,2) y acuoso (2,3). El número máximo de muertes fue de un pez por réplica como se muestra en las tablas 2 y 3.
Los resultados aportados por el test de observación de Finn Sandberg-Irwin, indican que las sustancias afectan el sistema nervioso del pez. Analizándose los parámetros de movimiento del pez, a partir de las 10 h el organismo reduce la locomoción y pierde su movimiento espontáneo a partir de las 18h de exposición a los tratamientos. Se presentó nado errático (movimientos acelerados alrededor del recipiente), parálisis de las aletas, movimientos letárgicos e insensibilidad al estímulo, además, muerte en posición horizontal ratificándose daños en el sistema nervioso autónomo (tabla 4).
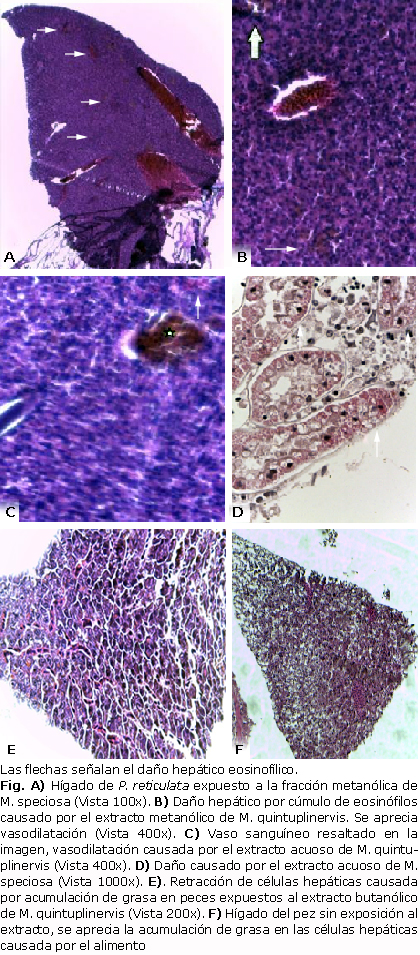
Los peces sometidos al analisis histológico fueron aquellos que durante la prueba de actividad ictiotóxica mostraron cambios en su comportamiento, como nado errático, parálisis de las aletas, movimientos letargicos y pérdida de la reacción de sobresalto. Estos organismos fueron sometidos a la acción de los extractos durante 24 h.Posterior a su muerte, se realizó análisis histopatológico, obteniéndose como resultado que tras el tiempo de exposición se generan lesiones en el hígado, evidenciadas en la acumulación de eosinófilos en los hepatocitos, también puede apreciarse vasodilatación, acumulación de grasa en las células hepáticas, superior a la apreciada en peces que no fueron sometidos a los tratamientos (Fig.).
DISCUSIÓN
Actividad ictiotóxica
En promedio, los cambios en el comportamiento se evidencian entre las 10 y 13 h de tratamiento, el número de alteraciones en los peces es mayor en M. speciosa al aumentar la polaridad del extracto, en contraste con M. quintuplinervis, donde las alteraciones son generadas por los extractos menos polares,sin embargo, M. quintuplinervis presentó deceso de un pez en cuatro de sus extractos, en menor tiempo que las muertes producidas por M. speciosa. Todas las alteraciones en el comportamiento de los peces se atribuyen a un efecto sobre el sistema nervioso central y la médula del pez, impidiéndose la transmisión de impulsos eléctricos y obstaculizándose la percepción de las señales del medio.2
Los tratamientos de M. speciosa que presentaron mayor número de efectos en el comportamiento de los peces fueron los extractos butanólico (2,2) y acuoso (2,3), lo que indica que los terpenos, fenoles y taninos de esta especie son los posibles responsables de los efectos sobre el sistema nervioso del pez.15 En M. quintuplinervis, los cambios en el comportamiento son producidos por los extractos en acetona al 70 % (2,0), acetato de etilo (2,1) y metanólico (2,1,2), por lo que su acción sobre el sistema nervioso puede estar dada por terpenos, esteroides, esteroles y fenoles (flavonoides y taninos) presentes en estos extractos, de acuerdo con los resultados obtenidos con las pruebas cualitativas preliminares.6,15
Las lesiones encontradas en el hígado de P. reticulata, corresponden a cúmulos de eosinófilos, los cuales están asociados con la formación de tumores hepáticos, posiblemente causados por la exposición a las sustancias presentes en los extractos vegetales, especialmente el metanólico (2,1,2) y el acuoso (2,3) de ambas especies de Meriania, lo cual sugiere que aunque las sustancias no presentan altos valores de actividad ictiotóxica, sus compuestos ingresan al organismo, actúan sobre el sistema nervioso y causan reacciones tóxicas que desencadenan la acción de las células de defensa.
De acuerdo con el análisis histopatológico, se observa que en los organismos expuestos a los extractos de M. quintuplinervis generaron un aumento de sustancias lipídicas en este tejido, lo que puede ocasionar deficiencias en el funcionamiento del órgano, comparado con los organismos que no fueron sometidos a los tratamientos. Sumado a lo anterior, los extractos vegetales de M. quintuplinervis ocasionaron vasodilatación que no es común en este tejido, por lo cual, estos extractos pueden ejercer una acción vasodilatadora, postulándolos como elementos importantes en la investigación médica para la formulación de medicamentos útiles en el tratamiento de pacientes con hipertensión arterial.
Con los resultados encontrados en los extractos vegetales de las dos especies de Meriania estudiadas, se puede decir que presentan comportamientos diferentes, ya que los extractos de M. speciosa ejercen un efecto psicoactivo en los peces, alterándose su sistema nervioso central; mientras que los extractos de diferente polaridad de M. quintuplinervis presentaron un nivel de toxicidad moderado, además de provocar un efecto vasodilatador comprobado en el estudio histopatológico realizado en el hígado de P. reticulata, al observar la presencia de eosinófilos.16
Agradecimientos
A la Universidad del Valle (CI-7848) y a la Universidad de Caldas por el apoyo en la comisión de estudios de Diana Marecla Ocampo para la ejecución de este proyecto.
Apoyo financiero
A Departamento Administrativo de Ciencia, Tecnología e Innovación de Colombia (COLCIENCIAS) con códigoCT-410-2011.
Declaración de Conflicto de Intereses
Los autores manifiestan expresamente no tener conflicto alguno de intereses, ni internos ni externos.
REFERENCIAS BIBLIOGRÁFICAS
1. Goldenberg R, Baumgratz JFA, Souza MLDR. Taxonomy of Melastomataceae in Brazil: Retrospective and perspective views, and an identification key for the genera. Rodriguesia. 2012;63(1):145-61.
2. Lopera IA, Velásquez CD. Actividad ictiotóxica de extractos polares y apolares de algunas especies de los génerosMiconia, Clidemia (Melastomataceae) y Palicourea, Hamelia (Rubiaceae). Facultad de Tecnología. Pereira Universidad Tecnológica de Pereira; 2009. p. 87.
3. Zakaria ZA, Raden RNS, Hanan NG, Abdul ZDF, Sulaiman MR, Rathna G, et al. Antinociceptive, anti-inflammatory and antipyretic properties of Melastoma malabathricum leaves aqueous extract in experimental animals. pharmacolgy and toxicology. 2006;84(12):1291-300.
4. Joffry SM, Yob NJ, Rofiee MS, Meor Mohd MMR, Affandi Z, Suhaili F, et al. Melastoma malabathricum (L.) Smith Ethnomedicinal Uses, Chemical Constituents, and Pharmacological Properties: A Review. Hindawi Publishing Corporation; 2012. p. 1-48.
5. Isaza JH. Productos naturales y actividad biológica in vitro del género Meriania. 2015 [Consultado 15 Ene 2015] Disponible en: http://scienti.colciencias.gov.co:8081/cvlac/visualizador/generarCurriculoCv.do?cod_rh=00002734652011 .
6. Isaza JH, Veloza LA, Ramírez LS. Actividad ictiotóxica de Miconia coronata (Bonpl.) D.C. (Melastomataceae). Scientia et Technica. 2005;11(28):197-202.
7. Ramírez LS, Marín D, Jiménez FJ. Actividad ictiotóxica y citotóxica de extractos de plantas Chrysobalanaceae, Melastomataceae, Rubiaceae y Rutaceae de la flora Colombiana. Scientia et Technica. 2013;18(3):548-53.
8. Dasilva E, Moreno S, Zanette J, Bianchin A. Salinity-dependent copper accumulation in the guppy Poecillia vivipara is associated with CTR1 and ATP7B transcriptional regulation. Aquatic Toxicology. 2014;152(9):300-7.
9. Dominguez Sepúlveda JA. Métodos de investigación fitoquímica. Limusa Wiley; 1973.
10. de Ugaz OL. Invetigacion Fitoquimica, Metodos en el estudio de productos naturales. Segunda Edicion. Fondo Editorial de la Pontifiicia Universidad Católica del Perú; 1994.
11. Mandal S, Mandal V, Kumar A. Essentials of Botanical extraction. Principles and applications; 2015. p. 206.
12. Association APH. Standard methods for the examination of water and wastewater 21th ed Washington:APHA; 2005.
13. Ito H, Murakana Y, Mori K, Tokuda H, Nishino H, Yoshida T. Ichthyotoxic phloroglucinol derivatives from Dryopteris fragrans and their anti-tumor promoting activity. Chem Pharm Bull. 2000;48(8):1190-5.
14. Dogan N, Yazıcı Z, Man TS, Askın H. Acute toxic effects of fenpyroximate acaricide on Guppy (Poecilia reticulata Peters, 1859). Toxicology and Industrial Health. 2012;29(8):716-21.
15. Aristizabal LSR, Marín D, González FJJ. Actividad ictiotóxica y citotóxica de extractos de plantas Chrysobalanaceae, Melastomataceae, Rubiaceae y Rutaceae, de la flora Colombiana. Scientia et Technica. 2013;18(3):548-52.
16. Dogan N, Yazici Z, Sisman T, Askin H. Acute toxic effects of fenpyroximate acaricide on Guppy (Poecilia reticulata Peters, 1859). Toxicology and industrial health. 2013;29(8):716-21.
Recibido: 29 de julio de 2015.
Aprobado: 17 de febrero de 2016.
José Hipólito Isaza Martínez . Departamento de Química. Facultad de Ciencias Naturales y exactas. Universidad del Valle. Cali, Colombia.
Correo electrónico: jose.isaza@correounivalle.edu.co