Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Cubana de Plantas Medicinales
versão On-line ISSN 1028-4796
Rev Cubana Plant Med vol.21 no.2 Ciudad de la Habana abr.-jun. 2016
ARTÍCULO ORIGINAL
Identificación de ácidos polifenólicos en el extracto metanólico de las hojas de Terminalia catappa Linn
Identification of polyphenolic acids in the methanolic extract from Terminalia catappa Linn leaves
David Marrero Delange, Carmen Luisa Morales Rico
Centro de Productos Naturales. Cubanacán, Playa. Cuba.
RESUMEN
Introducción: diferentes extractos de Terminalia Catappa Linn. (Combretaceae) han demostrado de forma internacional, propiedades farmacológicas beneficiosas para la salud humana. Estas propiedades han sido atribuidas en lo fundamental a los polifenoles y glicósidos, encontrados en hojas, corteza y frutos. En Cuba esta especie es catalogada como una planta invasora y existen pocas investigaciones sobre su composición química y estudios farmacológicos.
Objetivos: identificar y cuantificar los ácidos polifenólicos presentes en el extracto metanólico de las hojas de T. catappa utilizándose la cromatografía de gases acoplada a espectrometría de masas.
Métodos: las hojas amarillo-rojizas fueron secadas, molidas, desgrasadas con hexano y y con posterioridad extraídas con metanol en un baño ultrasónico. El extracto se filtró y el disolvente se eliminó al vacío. El extracto seco se hidrolizó con ácido clorhídrico y se extrajo con acetato de etilo. Se determinó el rendimiento de extracción, las características organolépticas y los polifenoles totales mediante el método de Follin-Ciocalteu. La composición química del extracto hidrolizado se llevó a cabo por cromatografía de gases acoplada a espectrometría de masas, previa formación de los derivados trimetilsilil.
Resultados: se obtuvo un líquido de color pardo rojizo oscuro de olor característico. El contenido total de polifenoles fue 184,6 (mg Pirogalol/100 g Extracto). Se detectaron 37 compuestos por cromatografía de gases acoplada a espectrometría de masas en el extracto metanólico hidrolizado. Este extracto está compuesto de manera general por ácidos polifenólicos como el ácido gálico; ácido vanílico; ácido 3,4-dihidroxibenzoico; ácido 2,5-dihidroxi-benzoico y ácido 4- hidroxibenzoico. También se detectaron otros compuestos con elevados contenidos como ácido elágico y ácido levulínico.
Conclusiones: el extracto metanólico de hojas de T. catappa que crece en Cuba mostró un elevado contenido de ácidos polifenólicos, donde los ácidos gálico y elágico fueron los mayoritarios. La presencia de estos compuestos pudiera justificar las propiedades medicinales atribuidas a esta especie, a la vez que servirían de base para continuar con futuras pruebas farmacológicas que avalen sus usos con fines farmacéuticos.
Palabras clave: Terminalia Catappa; Combretaceae; ácido gálico; polifenoles; CG-EM, TMS.
ABSTRACT
Introduction: Different extracts of Terminalia Catappa Linn. (Combretaceae) internationally have shown pharmacological properties beneficial to human health. These properties have been largely attributed to polyphenols and their glycosides found in the leaves, bark and fruits. In Cuba this species is listed as an invasive plant and there is limited research on its chemical composition and pharmacological studies.
Objectives: To identify and quantify the polyphenolic acids that could be present in the methanol extract of Terminalia catappa leaves using gas chromatography-mass spectrometry.
Methods: The yellow-red leaves were dried, ground, defatted with hexane and then extracted with methanol in an ultrasonic bath. The extract was filtered and the solvent removed under vacuum. The dry extract was hydrolyzed with hydrochloric acid and extracted with ethyl acetate. The extraction yield, the organoleptic characteristics and the total polyphenols by Follin-Ciocalteu method were determined. The chemical composition of the hydrolyzed extract was performed by gas chromatography-mass spectrometry after formation of trimethylsilyl derivatives.
Results: A dark reddish brown liquid with a characteristic odor was obtained. The total polyphenol content was 184.6 (mg Pyrogallol/100g extract). By mean of gas chromatography-mass spectrometry a total of 37 compounds were detected in the hydrolyzed methanol extract. This extract consists mainly of polyphenolic acids such as gallic acid; vanillic acid; 3,4-dihydroxybenzoic acid; 2,5-dihydroxybenzoic acid and 4- hydroxybenzoic acid. Other compounds with high content as ellagic acid and levulinic acid were also detected.
Conclusions: The methanolic extract obtained from the leaves of Terminalia catappa growing in Cuba showed a high content of polyphenolic acids where gallic acid and ellagic predominated. The presence of these compounds could justify the medicinal properties attributed to this species, while providing the basis for further future pharmacological evidence to support its use for pharmaceutical purposes.
Key words: Terminalia Catappa; Combretaceae; gallic acid; polyphenols; GC-MS; TMS.
INTRODUCCIÓN
El empleo de las plantas medicinales cada día cobra mayor interés. Sin embargo, existe gran preocupación en cuanto a la eficacia, seguridad y calidad de los extractos utilizados en la medicina popular. La eficacia y seguridad de cualquier producto farmacéutico está relación de manera directa con los compuestos bioactivos que estos presentan. Por lo que determinar la composición de tales extractos resulta indispensable para la comunidad científica y la población.
Varias de las especies del género Terminalia, familia Combretaceae, han demostrado propiedades farmacológicas como cardioprotectoras, hipolipemiantes, hipoglicemiantes, vasodilatadoras, diuréticas, antioxidantes, gastroprotectoras, hepatoprotectoras, antiinflamatorias, y analgésicas, entre otras.1-4 Estas propiedades han sido atribuidas en lo fundamental a los polifenoles encontrados en las hojas, la corteza y los frutos de esta planta.
La especie Terminalia catappa Linn se encuentra distribuida en las zonas tropicales y subtropicales.4-6 En Cuba esta especie es conocida como "Almendrón de la India" o "Almendrón". Sus hojas se han empleado para tratar enfermedades de la piel y la hemoptisis. También se ha utilizado con fines ornamentales y para dar sombra.5,6 Por su abundancia en nuestro país se ha catalogado como una planta invasora.7
Se ha descrito que las hojas de T. catappa son ricas en compuestos polifenólicos, taninos como: punicalagina, punicalina, ácido chebulágico y geranina corialgina,8,9 ácidos gálico y elágico, isovitexina, vitexina, rutina,10-13 entre otros. Diferentes extractos de estas hojas como algunos de sus componentes puros han mostrado las siguientes propiedades farmacológicas: antiulcerosas,4 anti-Helicobacter pylori,4 antioxidantes,11,13-16 hepatoprotectoras,11,14 antiinflamatorias,12 antidiabéticas,17 analgésicas,18-20 antimutagénicas,21-22 antiresortivas,23-24 antisiclémicas,25 antimicrobianas26,27 y antimaláricas.28
La combinación de métodos extractivos que emplean además, hidrólisis y la cromatografía de gases acoplada a espectrometría de masas (CG-EM) ha sido una poderosa herramienta analítica para el estudio de aglicones, en particular de ácidos polifenólicos y flavonoides, provenientes de glicósidos y taninos, entre otras estructuras relacionadas con polifenoles.13,29-31
Teniéndose en cuenta que en Cuba la especie T. Catappa es catalogada como una planta invasora y que existen pocos trabajos relacionados con su composición química, se llevó a cabo un estudio para determinar ácidos polifenólicos en el extracto metanólico de sus hojas mediante la CG-EM previa formación de derivados trimetilsilil (TMS).
MÉTODOS
Las hojas de color amarillo-rojizo de T. catappa se recolectaron en el Jardín Botánico Nacional en junio del 2012. Un ejemplar se autentificó por el Dr. Jorge Gutiérrez y se preservó en el herbario (HFC-87643). Dichas hojas se secaron a 40 ºC en una estufa con circulación de aire durante 72 h. Luego, se molieron en un molino de bolas, se desgrasaron con n-hexano (20 g en 250 mL, se repitió 2 veces), y se extrajeron con metanol (1:30, en dos ocasiones) mediante ultrasonido a 35 KHz durante 40 min. El extracto obtenido se filtró, se secó al vacío a 60 ºC hasta eliminar el metanol y se determinó el rendimiento de extracción.
El extracto metanólico seco se caracterizó de manera organoléptica (estado físico, apariencia, color y olor). Con el fin de identificar los componentes que integraban dicho extracto, este se sometió a una hidrólisis ácida con 20 mL de HCl (2N) a reflujo durante 2 h. Luego se extrajo tres veces con 20 mL de acetato de etilo, se unificaron los extractos y se secaron a vacío en un evaporador rotatorio.
Para los análisis de las muestras por CG-EM se pesaron de manera aproximada 10 mg, se disolvieron en 0,5 mL de cloroformo y se derivatizaron con 100 µL de N-metil-N-trimetilsililtrifuoroacetamida (MSTFA) a 70 ºC durante 30 min en un termostato seco. Se utilizó un cromatógrafo de gases 6890 N acoplado a un detector selectivo de masas 5975 B inert (Agilent, EEUU) con un sistema de cómputo y una columna capilar HP-5 Ms (30 m x 0,25 mm de diámetro interno y 0,25 μm de espesor de película, Agilent, EEUU). El horno se programó desde 60 ºC (2 min isotérmico) hasta 200 ºC a razón de 20 °C/min y desde 200 ºC hasta 320 °C (30 min isotérmico) a 8 °C/min. El inyector, en modo splitless, se mantuvo a 320 °C. El flujo del gas portador (He) fue 1,0 mL/min. Las temperaturas de la interfase, la fuente de ionización y el cuadrupolo fueron 300, 280 y 150 °C, de manera respectiva. La energía de ionización fue de 70 eV. La adquisición se realizó desde 20 hasta 800 m/z. Se inyectó 1 μL de muestra.
La identificación se llevó a cabo por comparación de los espectros de masas obtenidos con los de las bibliotecas de espectros Wiley 275 mass espectrometry (MS), 6ª ed. y la del National Institute of Standards and Technology (NIST) 11, así como con los de sustancias de referencia comerciales disponibles y los aportados por la literatura. Para la cuantificación de cada componente identificado se empleó el método de normalización interna (%).
Al extracto metanólico hidrolizado se le determinó el contenido de polifenoles totales.10,13 Para ello, se pesaron 20 mg del extracto polar seco en un volumétrico de 25 mL. Se enrasó con agua destilada. Se tomó 1 mL de la disolución y se llevó a un volumétrico de 50 mL. Se añadieron 200 µL de reactivo de Folin-Ciocalteau y se incubó durante 5 min. Se añadiieron 200 µL de disolución de carbonato de sodio al 20 %. Se enrasó con agua destilada, se protegió de la luz con papel de aluminio y se incubó durante 30 min. Posterior a esto se determinaron las absorbancias de cada extracto en el espectrofotómetro ultravioleta (UV)-Visible a 765 nm. Las absorbancias obtenidas fueron interpoladas en una curva de calibración (y = 0,008 x + 0,00003; R2 = 0,999) para determinar las concentraciones.
RESULTADOS
Se obtuvo un líquido de color pardo rojizo oscuro de olor característico y con un rendimiento de extracción de 10,8 %. El contenido total de polifenoles fue 184,6 (mg Pirogalol/100g Extracto).
Al hidrolizar el extracto metanólico, extraerlo con acetato de etilo, derivatizarlo y analizarlo por CG-EM se detectaron 37 compuestos (tabla). Entre los ácidos polifenólicos mayoritarios se encontraron el ácido gálico (3,4,5-trihidroxibenzoico); ácido vanílico (3-metoxi-4-hidroxibenzoico); ácido protocatechuico (ácido 3,4-dihidroxibenzoico); ácido 2,5-dihidroxi-benzoico y ácido 4-hidroxibenzoico. También se detectaron otras estructuras relacionadas con polifenoles como el ácido elágico, quercetina y otros compuestos. Estos resultados coinciden con lo informado en la literatura para la especie.4,10,16
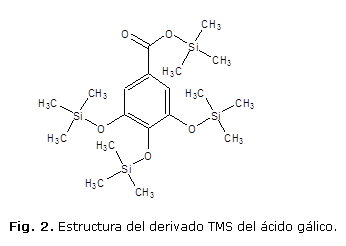
En la figura 1, presentada como ejemplo de identificación de dichos compuestos, se puede apreciar la similitud entre el espectro del derivado TMS del ácido gálico (Fig. 2) encontrado en el extracto hidrolizado de las hojas de T. catappa y el espectro de dicho compuesto presente en la biblioteca del equipo. Las identificaciones realizadas se corroboraron además, por comparación de los espectros para las sustancias descritos en la literatura.
DISCUSIÓN
El metanol se escogió como disolvente debido a que fue el más efectivo para la extracción de polifenoles de las hojas de esta especie al compararlo con otros disolventes, además dicho extracto metanólico fue el que mostró mayor capacidad antioxidante.15,16 También se seleccionó el método de extracción por ultrasonido, ya que ha sido de igual manera efectivo en la extracción de este tipo de compuestos, permite obtener buenos rendimientos, y está catalogado como una tecnología limpia.13,30-32
Las características organolépticas del extracto metanólico de las hojas de T. catappa que crece en Cuba concordaron con lo informado en la literatura.13,15,16 Sin embargo, a pesar de existir numerosos trabajos publicados en otras regiones, el rendimiento de extracción no se pudo comparar ya que en su mayoría no lo informan y se limitan solamente a la obtención de dichos extractos y al aislamiento y la purificación de sus compuestos para realizar con estos estudios farmacológicos.4,15,16 No obstante, rendimientos similares fueron obtenidos por otros autores a partir de extractos hidroalcohólicos, acuosos y acetónicos.4,8,13,16
Los resultados también coincidieron con los obtenidos por Annegowda13,32 tanto en el empleo del ultrasonido para realizar la extracción de los ácidos polifenólicos como en el uso de la hidrólisis ácida y con la determinación por UV de los polifenoles totales. Dicho autor demostró que para la extracción de los polifenoles de las hojas de esta especie, el empleo de 40 y 60 min de ultrasonido fueron los mejores respecto a 20 min y la maceracion durante 24 h. De la misma manera, este autor comprobó que con la hidrólisis ácida se obtenían mayores contenidos de compuestos polifenólicos al compararla con la hidrólisis básica, lo cual ha sido descrito en la literatura.29,31
En aras de identificar cuáles eran los polifenoles detectados por UV, el extracto hidrolizado se derivatizó y se analizó por CG-EM. Como resultado de dicho análisis (tabla), se obtuvo que el compuesto mayoritario dentro los ácidos polifenólicos, que tienen como base al ácido benzóico, fue el ácido gálico (37,4 %). Estos resultados coinciden con la presencia de este compuesto tanto en las hojas como en el fruto de esta especie en otros países, pero en ellos se encuentra en una menor proporción (1-5 %).4,9,10,16 También, se ha informado la existencia de una elevada concentración (28 %) de dicho compuesto en el extracto metanólico de las hojas de T. chebula, 32 lo que pudiera avalar a estas plantas como fuentes para la obtención de dicho ácido. En este sentido, se ha descrito que el ácido gálico es un compuesto bioactivo con demostradas propiedades farmacológicas como antioxidantes, antiinflamatorias, cardioprotectoras, gastroprotectoras, hepatoprotectoras, y antimutagénicas y anticarcinogénicas.3,4,32 Otros ácidos polifenólicos de estructura similar encontrados en este estudio (tabla) fueron: 4-hidroxi-3-metoxi-benzoico; 2,5-dihidroxi-benzoico; 3,4-dihidroxibenzoico; y 4-hidroxibenzoico, donde los dos últimos también fueron detectados con anterioridad en esta especie.16
Por su parte el ácido elágico, polifenol perteneciente a los elagitaninos, fue el segundo compuesto de mayor proporción (19,8 %) encontrado en el extracto en estudio, y cuya presencia en las hojas de esta especie había sido informada con anterioridad,9,10 aunque en tales estudios sus concentraciones fueron algo superiores a las del ácido gálico. De la misma manera se identificaron otras estructuras relacionadas con polifenoles como la 7,8-dihidroxiflavona, la quercetina y un derivado del ácido elágico. Tanto el ácido elágico como la quercetina han mostrado efectos beneficiosos a la salud.4,6,26-34
Vale la pena resaltar que entre los compuestos presentes en el extracto estudiado que presentaron una elevada concentración se detectó al ácido levulínico (17,4 %), el cual no ha sido reportado para la especie y se ha utilizado en la industria química y farmacéutica. En esta última debido a sus propiedades antiinflamatorias y anticonvulsivantes.35
Otros compuestos minoritarios que fueron de igual manera detectados y que presentan actividades farmacológicas demostradas fueron los ácidos grasos (C16:0, C18:0, C18:1, C18:2), el a-tocoferol y el b-sitosterol, cuya presencia también fue descrita en extractos alcohólicos de las hojas rojas y amarillas de T. cattapa.16
Por otro lado, las variaciones observadas en la composición química del extracto estudiado respecto a otros de diferentes regiones del mundo pueden deberse a diversos factores tales como las características genéticas de la especie, el estado fenológico de la planta, las condiciones climáticas, la época y lugar de recolección, así como a las variaciones intrínsecas de los métodos de preparación y análisis empleados, entre otros.16,29-31
Por su parte, el empleo de los derivados TMS ha jugado un papel fundamental en la identificación por CG-EM de compuestos polifénolicos presentes en las plantas.29-31 Para ilustrarlo, se escogió la fragmentación obtenida para el derivado TMS del ácido gálico (Fig. 1 y 2), por ser este ácido polifenólico mayoritario en el extracto analizado. Como puede observarse en la figura 1, existe una gran similitud (coincidencia superior al 99 %) entre los espectros del derivado TMS del ácido gálico presente en el extracto metanólico hidrolizado de T. catappa (tr 14,16 min) con el espectro de la biblioteca NIST 2011 del equipo de CG-EM.
El espectro de masas mostró un ion molecular [M]+ a m/z 458, el cual corresponde al derivado TMS del ácido gálico y cuya fórmula global es C19H38O5Si4. Otros fragmentos característicos que demuestran el patrón de fragmentación bien establecido para los ésteres TMS de ácidos aromáticos fueron el ion fragmento a m/z 443 ([M-15]+) que representó la pérdida del radical metilo [(-CH3)·] por ruptura alfa en el grupo TMS y el ion fragmento a m/z 399 ([M-59]+) que representó la pérdida de CO 2 luego de un re arreglo, así como la pérdida de TMSO ([M-89]+) que generó un ion a m/z 369 por formación del catión acilio. De la fragmentación también se detectó un ion de gran intensidad a m/z 281 correspondiente a la pérdida [M-177] +, del cual no se ha descrito su origen para los ácidos fenólicos31 y se especula que puede estar relacionado con la presencia de grupos TMS adyacentes. Por su parte, el pico base del espectro fue el fragmento con m/z 73, que representa la pérdida del grupo TMS [Si(CH3)3+], formado por la ruptura del enlace O-Si. Además, la presencia del fragmento a m/z 147, que se atribuyó a la estructura [(CH3)2Si=O-Si(CH3)3]+, significa la presencia de dos o más grupos TMS en la molécula. Este espectro también coincidió con los descritos en la literatura para dicho compuesto.29,36,37
Se puede plantear que se identificaron y se cuantificaron mediante CG-EM ácidos polifenólicos presentes en el extracto metanólico de las hojas de T. catappa, entre los cuales el mayoritario resultó el ácido gálico. Otros compuestos que se encontraron en elevadas concentraciones fueron los ácidos elágico y levulínico. También fueron detectados en menores proporciones flavonoides como la quercetina, ácidos grasos, a-tocoferol y b-sitosterol, entre otros, algunos informados por primera vez para la especie que crece en Cuba y que en su mayoría presentan propiedades farmacológicas demostradas todo lo cual pudiera avalar los posibles usos medicinales que se le atribuyen a las hojas de esta especie.
REFERENCIAS BIBLIOGRÁFICAS
1. Rajni HS, Manish RA. Review on pharmacological Ayurvedic compound of Terminalia arjuna. International journal of phytotherapy research. 2014;4(4):31-8.
2. Mallik J, Das P, Karon B, Das S. A review on phytochemistry and pharmacological activity of Terminalia belerica. International journal of drug formulation and research. 2012;3(6):1-7.
3. Rathinamoorthy R, Thilagavathi G. Terminalia Chebula - Review on Pharmacological and Biochemical Studies. International Journal of PharmTech Research. 2014;6(1):97-116.
4. Pinheiro L, Damacena C, Bonamin F, Kushima H, Mininel FJ, Campaner L, et al. Terminalia catappa L.: A medicinal plant from the Caribbean pharmacopeia with anti-Helicobacter pylori and antiulcer action in experimental rodent models . Journal of Ethnopharmacology. 2015;159(15):285-95.
5. Roig JT. Plantas medicinales, aromáticas o venenosas de Cuba. Segunda Edición. La Habana: Editorial Científico-Técnica. 2012:135-6.
6. Hernández M, García L, Rojo DM, Olivares D. Almendro de la India: potencial biológico valioso. Rev Cubana Invest. Bioméd. 2003;22(1):41-7.
7. Oviedo R, Herrera P, Caluff MG, Regalado L, Ventosa I, Plasencia JM, et al. Lista nacional de especies de plantas invasoras y potencialmente invasoras en la República de Cuba - 2011. Bissea. 2012;6(1):22-96.
8. Mininel FJ, Junior CSL, Espanha LG, Resende FA, Varanda EA, Fujimura CQ, et al. Characterization and Quantification of Compounds in the Hydroalcoholic Extract of the Leaves from Terminalia catappa Linn. (Combretaceae) and Their Mutagenic Activity. Evidence-Based Complementary and Alternative Medicine. 2014:1-12.
9. Tanaka T, Nonaka G, Itsuo N. Isolation and characterization for new hidrolyzable tannins, terflavins A and B, tergallagin and tercatain from the leaves of Terminalia catappa L. Chem Pharm Bull. 1986;34(3):1039-49.
10. Lin YC, Kou YH, Shiao MS, Chen CC, Ou JC. Flavonoid glycosides from Terminalia catappa. J Chim. Chem Soc. 2000;47(1):253-6.
11. Lin CC, Chen YL, Lin JM, Ujiie T. Evaluation of the antioxidant and hepatoprotective activity of Terminalia catappa L. J Chin Med. 1997;25(2):153-61.
12. Fan YM, Xu LZ, Gao J, Wang Y, Tang XH, Zhao XN, et al. Phytochemical and antiinflammatory studies on Terminalia catappa. Fitoterapia. 2004;75(3-4):253-60.
13. Annegowda HV, Ween CN, Mordi MN, Ramanathan S, Mansor SM. Evaluation of Phenolic Content and Antioxidant Property of Hydrolysed Extracts of Terminalia catappa L. Leaf. Asian Journal of Plant Sciences. 2010a;9(8):479-85.
14. Kinoshita S, Inoue Y, Nakama S, Ichiba T, Aniya Y. Antioxidant and hepatoprotective actions of medicinal herb, Terminalia catappa L from Okinawa Island and its tannin corilagin. Phytomedicin. 2007;14:755-62.
15. Chyau CC, Tsai SY, Ko PT, Mau JL. Antioxidant properties of solvent extracts from Terminalia catappa leaves. Food Chem. 2002;78:483-8.
16. Chyau CC, Ko PT, Mau JL. Antioxidant properties of aqueous extracts from Terminalia catappa leaves. LWT. 2006;39:1099-108.
17. Ahmed SA, Swamy BMV, Gopkumar P, Dhanapal R, Chandrashekara VM. Anti-diabetic activity of Terminalia catappa Linn. Leaf extracts in alloxan-induced diabetic rats. Iranian Journal of Pharmacology & Therapeutics. 2005;4:36-39.
18. Ratnasooriya wd, Dharmasiri mg, rajapakse ras, de silva ms, jayawardena spm, fernando pud, et al. Tender leaf extract of Terminalia catappa antinociceptive activity in rats. Pharmaceutical biology. Analgesic. 2002;40(1):60-6.
19. Annegowda HV, Mordi MN, Ramanathan S, Mansor SM. Analgesic and Antioxidant Properties of Ethanolic Extract of Terminalia catappa L. Leaves. International journal of pharmacology. 2010;6(6):910-5.
20. Arjariya S, Nema N, Tiwari S, Dubey R. Antinociceptive Potential of Terminalia Catappa (Indian Almond) Leaves in Swiss Albino Rat. American Journal of Phytomedicine and Clinical Therapeutics. 2013;1(1):071-7.
21. Chu SC, Yang SF, Liu SJ, Kuo WH, Chang YZ, Hsieh YS, et al. In vitro and in vivo antimetastatic effects of Terminalia catappa L. leaves on lung cancer cells. Food and chemical toxicology. 2007;45(7):1194-201.
22. Shun-Fa Y, Mu-Kuan C, Yih-Shou H. Antimetastatic effects of Terminalia catappa L. on oral cancer via a down-regulation of metastasis-associated proteases. Food and chemical toxicology. 2010;48(4):1052-8.
23. Koyama T, Nakajima C, Nishimoto S. Suppressive Effects of the Leaf of Terminalia catappa L. on Osteoclast Differentiation In Vitro and Bone Weight Loss In Vivo. Journal of nutritional science and vitaminology. 2012;58(2):129-35.
24. Ahmad MS, Ahmad S, Arshad M, Rai KB, Afzal M. Terminalia catappa, an anticlastogenic agent against MMS induced genotoxicity in the human lymphocyte culture and in bone marrow cells of Albino mice. Egyptian Journal of Medical Human Genetics. 2014;15(3):227-33.
25. Mgbemene CN, Ohiri FC. Anti-sickling potential of Terminalia catappa leaf extract. Pharmaceutical Biology. 1999;37(2):152-4.
26. Taganna JC, Quanico J, Perono RMG, Amor EC, Rivera WL. Tannin-rich fraction from Terminalia catappa inhibits quorum sensing (QS) in Chromobacterium violaceum and the QS-controlled biofilm maturation and LasA staphylolytic activity in Pseudomonas aeruginosa. Journal of Ethnopharmacology. 2011;134(3):865-71.
27. Nwankwo IU, Ukaegbu-Obi KM. Preliminary phytochemical screening and antibacterial activity of two Nigerian medicinal plants (Ficus asperifolia and Terminalis catappa). J of Medicinal plant and herbal therapy res. 2014;2:1-5.
28. Mudi SY, Muhammad A. Antimalaria activity of ethanolic extracts of leaves of Terminalia catappa L. Combretaceae [indian almond]," Bayero Journal of Pure and Applied Sciences. 2010;2:14-8.
29. Proestos C, Komaitis M. Analysis of Naturally Occurring Phenolic Compounds in Aromatic Plants by RP-HPLC Coupled to Diode Array Detector (DAD) and GC-MS after Silylation. Foods. 2013;2:90-9.
30. Khoddami A, Wilkes MA, Roberts TH. Techniques for Analysis of Plant Phenolic Compounds. Molecules. 2013;18:2328-75.
31. Robbins JR. Phenolic acids in foods: An overview of analytical methodology. J. Agric. Food Chem. 2003;51:2866-87.
32. Annegowda HV, Anwar LN, Mordi MN. Influence of sonication on the phenolic content and antioxidant activity of Terminalia catappa L. leaves. Pharmacognosy research. 2010;2(6):368-73.
33. Sree G, Racheal D, Shenbagaradhai B. Isolation, identification and characterization of Gallic acid from leaves of Terminalia chebula (Retz). International Journal of Green and Herbal Chemistry. 2015;4(1):78-91.
34. Nagappa AN, Thakurdesai PA, Venkat Rao N, Singh J. Antidiabetic activity of Terminalia catappa Linn fruits. Journal of Ethanopharmacology. 2003;88:45-50.
35. Aggarwal N, Mishra P. Synthesis and evaluation of 4-substituted semicarbazones of levulinic acid for anticonvulsant activity. J Zhejiang Univ SCI. 2005;6B(7):617-21.
36. Arpino P, Moreau JP, Ourezabal C, Flieder F. Gas chromatographic-mass spectromectric analysis of tannin hydrolysates from the ink of ancient manuscripts XIth to XVIth Century. J of Chromatogr. 1977;134:433-9.
37. Jaroszynska J, Ligor T. The identification of phenolic compounds by a gas chromatographic method on three capillary columns with the same non-polar stationary phase. Anal. Chim. Acta. 2005;539:11-5.
Recibido: 10 de noviembre de 2015.
Aprobado: 19 de febrero de 2016.
Centro de Productos Naturales. Cubanacán, Playa. Cuba.
Correo electrónico: david.marrero@cnic.edu.cu