Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Plantas Medicinales
versión On-line ISSN 1028-4796
Rev Cubana Plant Med vol.21 no.3 Ciudad de la Habana jul.-set. 2016
ARTÍCULO ORIGINAL
Composición química del aceite esencial de Ocotea cymbarum Kunth (cascarillo y/o sasafrás) de la región Orinoquia
Chemical composition of essential oil of Ocotea cymbarum Kunth (cascarilla and/or sassafras) from the Orinoquía region
Wilman Antonio Delgado Avila; Luis Enrique Cuca Suárez; José Fernando Caroprese
Universidad Nacional de Colombia-Sede Bogotá. Colombia.
RESUMEN
Introducción: en algunas poblaciones de la Orinoquia colombiana y/o venezolana venden, en plazas de mercado, los aceites de cascarillo y sasafrás; estos aceites son empleados para aliviar dolencias como artritis reumática, afecciones respiratorias y tratar picaduras de insectos y animales ponsoñosos. Los productos se obtienen de la especie Ocotea cymbarum Kunth, la cual tiene una abundante sinonimia botánica como Alseodaphne cymbarum,Licaria cymbarum, Misanteca cymbarum, Nectandra barcellensis, Nectandra cymbarum, Nectandra elaiophora, Nectandra oleífera y Ocotea barcellensis.
Objetivo: realizar un análisis comparativo de las características fisicoquímicas del aceite esencial de cascarillo y/o sasafrás (posible Ocotea cymbarum Kunth).
Métodos: la composición química relativa de los aceites obtenidos de madera y corteza fue determinada mediante cromatografía de gases acoplada a espectrometría de masas (CG-EM), el cálculo y comparación de índices de retención en columnas de polaridad ortogonal y la comparación de los espectros de masas por impacto electrónico con los de las bases de datos NIST08.L, Wiley9.L.
Resultados: fueron determinados 45 compuestos en las muestras analizadas y más del 90 % de la composición relativa establecida para cada aceite corresponde a compuestos monoterpénicos principalmente alcanfor y alfa-terpineol.
Al realizar un análisis de las rutas biosintéticas que conducen a la generación de los principales compuestos detectados en los aceites analizados, se evidenció que las especies de donde se obtuvieron estos aceites, presentan diferentes grados de evolución micromolecular.
Conclusión: los aceites de cascarillo y sasafrás provienen de especies vegetales con diferentes grados de evolución química. Este resultado refuerza la evidencia de la alta diversidad biológica de la familia Lauraceae.
El trabajo fue realizado con el apoyo financiero del Laboratorio de Productos Naturales Vegetales del departamento de Química de la Universidad Nacional de Colombia sede Bogotá.
Palabras clave: lauraceae; Ocotea cymbarum; Ocotea barcellensis; Nectandra cymbarum; aceite de cascarilo; aceite de sasafrás; evolución micromolecular.
ABSTRACT
Introduction: cascarilla and sassafras oils are sold in market places of some settlements in the Colombian and/or Venezuelan Orinoquía. These oils are used to alleviate conditions such as rheumatoid arthritis and respiratory disorders, and to treat the bites of insects and poisonous animals. The oils are obtained from the species Ocotea cymbarum Kunth, which displays abundant botanical synonymy as Alseodaphne cymbarum, Licaria cymbarum,Misanteca cymbarum, Nectandra barcellensis, Nectandra cymbarum, Nectandra elaiophora, Nectandra oleífera and Ocotea barcellensis.
Objective: carry out a comparative analysis of the physicochemical characteristics of essential oil of cascarilla and/or sassafras (Ocotea cymbarum Kunth).
Methods: the relative chemical composition of oils obtained from wood and bark was determined by gas chromatography coupled with mass spectrometry (GC-MS). Estimation and comparison of retention indices was conducted with orthogonal polarity columns. Comparison of electron impact mass spectra was performed with the databases NIST08.L and Wiley9.L.
Results: forty-five compounds were determined from the samples analyzed. More than 90% of the relative composition established for each oil corresponds to monoterpenic compounds, mainly camphor and alpha-terpineol. Analysis of the biosynthetic pathways leading to the generation of the main compounds detected in the oils studied, showed that the species from which the oils were obtained exhibit varying degrees of micromolecular evolution.
Conclusion: cascarilla and sassafras oils are obtained from plant species at varying stages of chemical evolution. This result constitutes additional evidence of the great biological diversity of the Lauraceae family.
The study was conducted with financial support from the Natural Plant Products Laboratory of the Chemistry Department at the National University of Colombia at Bogotá.
Keywords: lauraceae; Ocotea cymbarum; Ocotea barcellensis; Nectandra cymbarum; cascarilla oil; sassafras oil; micromolecular evolution.
INTRODUCCIÓN
Según los datos de SiB Colombia1 y del profesor Santiago Madriñan, (Laboratorio de Botánica y Sistemática de la Universidad de los Andes)2 hasta el año 2014 en Colombia se han reportado 315 especies vegetales pertenecientes a la familia Lauraceae, distribuidas en 20 géneros, siendo los géneros Ocotea, Endlicheria, Nectandra, Aniba y Persea los más representativos en cuanto a número de especies con 85, 49, 45, 25 y 25 respectivamente.
Las especies de la familia Lauraceae son muy apreciadas por la calidad de sus maderas que presentan colores amarillos, dorados o rosados, con buena resistencia mecánica, resistencia al ataque de insectos y de aroma agradable que se emplean en ebanistería, construcción de viviendas, puentes y embarcaciones.3 En Colombia y Venezuela, popularmente, muchas especies se conocen con los nombres de amarillo, aguacatillo, jigua, comino, y laurel.4 Algunas especies son también reconocidas por los usos dados en el campo de la medicina tradicional y en especial los aceites esenciales u oleorresinas extraídos de distintos organelos de estas plantas; así por ejemplo del tallo de la especie Ocotea caparrapi se extrae una oleoresina conocida como "Aceite de caparrapí" el cual es empleado como alexifármico, vulnerario, curativo de toda clase de tumores, repelente de insectos y "contra" en mordeduras de serpientes venenosas5,6 el Aceite de caparrapí ha sido objeto de estudios fitoquímicos y de actividad biológica que han confirmado los usos etnobotánicos reportados.7
En Colombia la especie Ocotea aciphylla, la mayor especie de Ocotea neotropical, es empleada por grupos indígenas de la región del Magdalena en forma de infusión por vía oral para tratar la mordeduras de serpientes.6 En algunas poblaciones de la Orinoquia se consigue en plazas de mercado los llamados aceites de cascarillo y sasafrás, según los habitantes de esta región, estos aceites, son empleados, para aliviar dolencias como artritis reumática, afecciones respiratorias y tratar picaduras de insectos y animales ponsoñosos, y provienen de la especie Ocotea cymbarum, 8 la cual presenta una abundante sinonimia botánica que incluye los nombresAlseodaphne cymbarum, Licaria cymbarum, Misanteca cymbarum, Nectandra barcellensis, Nectandra cymbarum, Nectandra elaiophora, Nectandra oleífera y Ocotea barcellensis.9 A pesar de ser un producto empleado en esta región, no se encontró en las bases de datos registros de estudios químicos realizados recientemente sobre esta especie o estos productos.
Sin embargo, por tratarse de productos empleados en la medicina tradicional, se realizó un estudio comparativo de las características fisicoquímicas de dos muestras de estos productos conseguidos en la región y se discute entorno al origen biosintético de los compuestos determinados.
MÉTODOS
El aceite de cascarillo se adquirió en la plaza de mercado de la ciudad de Arauca, (Colombia) fue obtenido mediante perforación del tallo del árbol hasta la médula a una altura aproximada de 1,5m y el aceite de sasafrás fue obtenido por estudiantes del programa de Tecnología en Aprovechamiento de los Recursos Vegetales no Maderables del Bosque y Biodiversidad Vegetal del SENA Regional Guainía, mediante destilación por arrastre con vapor de madera y corteza. Luego de su adquisición, los aceites se sometieron a proceso de decantación y secado sobre sulfato de sodio anhidro y pruebas de caracterización fisicoquímica como índice de refracción, densidad, rotación específica y determinación de la composición química mediante cromatografía de gases de alta resolución con detector selectivo de masas (CG/EM).
La densidad fue determinada en un picnómetro de 1 ml y una balanza ViBRA HT con una sensibilidad de 0,0001g. El índice de refracción se determinó en un refractómetro tipo ABBE & 32200. La rotación específica se determinó en polarímetro ATAGO POLAX 2L en una celda de 10 ml de capacidad y 1 dm de paso óptico. La determinación de la composición relativa se realizó en un equipo Agilent Technologies 7890 Acoplado a un detector de masas 7593, equipado con un inyector split/splitless con una columna capilar Carbowax 30m x 0,25 mm x 0,25 m. y una HP-5 60m x 0,25 mm. X 0,25 m. y con la siguiente programación de temperatura: Temperatura inicial 40 °C (0 min), a 4 °C/min hasta 160 °C (0 min), a 2,5 °C/min Hasta 220 °C (0 min), a 8°C/min hasta 280 °C (4 min). La temperatura de la línea de transferencia se mantuvo en 300 °C, se usó helio 5,0 como gas de arrastre a 1mL/min, Split: 30:1, vol. de inyección de 1 L de una solución de cada aceite de 25 L/mL en CH2Cl2.
RESULTADOS
En la tabla 1, se muestran los resultados de las mediciones de las constantes fisicoquímicas de los aceites estudiados; en ella se observa que estos productos poseen diferencias muy marcadas especialmente en los valores de de peso específico y rotación específica. Al analizar los datos de composición química, se encuentra que tanto el aceite de cascarillo como el de sasafrás son de tipo monoterpénico (93,5 % para el aceite de cascarillo y 96,7 % para el aceite de sasafrás). En el aceite de cascarillo, la fracción monoterpénica se encuentra distribuida en 71,1 % de monoterpenos y 22,4 % de monoterpenoides y en el aceite de sasafrás se encuentra un 35,1 % de monoterpenos y 61,6 % de monoterpenoides. Además en el aceite de cascarillo se encontró un 4,5 % de sesquiterpenos, mientras que en el aceite de sasafrás solo se encontró un sesquiterpenoide en una proporción relativa menor del 1 %. En el aceite de sasafrás se detectaron compuestos de tipo arilpropano en una proporción del 1,2 % y menos del 1 % en el aceite de sasafrás. En tabla 2, se muestra la composición química relativa detallada de los dos aceites estudiados, determinada mediante cromatografía de gases de alta resolución acoplada a espectrometría de masas, y establecida mediante el análisis y comparación de los espectros de masas obtenidos, con los de las bases de datos NIST08.L, Wiley.9 L y mediante la comparación índices de retención en columnas de polaridad ortogonal DB-Wax y HP-5 (Polietilenglicol 100% y 5% Fenil 95% dimetilpolisiloxano respectivamente).
Tabla 2. Composición química relativa de los aceites de cascarillo y sasafrás, determinados mediante cromatografía
de gases de alta resolución acoplada a espectrometría de masas y comparación de índices de retención
|
Compuesto | IR calculado HP-5, (IR literatura) | IR calculado DB-Wax, (IR literatura) | Cascarillo (% relativo) | Sasafrás (% relativo) |
| alfa-Pineno | 938, (939) 10 | -- | 47,2 | 18,5 |
| alfa-Fencheno | 952, (952) 10 | -- | -- | 0,4 |
| Camfeno | 954, (953) 10 | -- | 1,2 | 1,6 |
| beta-Pineno | 985, (890) 10 | 1128, (1124) 11 | 4,2 | 2,4 |
| delta-3-Careno | -- | 1165 | 0,4 | -- |
| beta-Mirceno | 989, (991) 10 | 1183, (1176) 14 | 7,2 | 0,6 |
| alfa-Felandreno | 1011, (1005) 10 | 1179, (1177) 11 | 1,1 | -- |
| Isocineoleno | 1022 | -- | -- | 0,2 |
| alfa-Terpineno | 1025, (1018) 10 | -- | -- | 0,3 |
| para-Cimeno | 1033, (1026) 10 | 1277, (1272) 11 | 0,5 | 1,5 |
| Limoneno | 1036, (1031) 10 | 1209, (1206) 11 | 1,2 | 5,1 |
| beta-Felandreno | 1038, (1031) 10 | 1217, (1216) 11 | 8,1 | -- |
| 1,8-Cineol | 1042, (1033) 10 | 1219, (1228) 11 | -- | 1,5 |
| gama-Terpineno | 1070, (1062) 10 | 1255, (1251) 11 | -- | 0,3 |
| alfa-Terpinoleno | 1101, (1088) 10 | 1290, (1287) 11 | -- | 4,2 |
| Fenchona | 1103, (1094) 10 | -- | -- | 0,2 |
| M.O.N.I. | 1116 | 1554 | 1,0 | -- |
| Longicicleno | -- | 1490 | 0,6 | -- |
| Sativeno | -- | 1519 | 0,4 | -- |
| Acetato de bornilo | -- | 1581, (1580) 15 | -- | 2,1 |
| Fenchol | 1129, (1117) 10 | 1586, (1574) 11 | -- | 6,3 |
| beta-Terpineol | 1163, (1159) 14 | 1601, (1616) 11 | -- | 1,3 |
| Alcanfor | 1154, (1143) 10 | 1508, (1498) 16 | 21,4 | 0,5 |
| Exo-metil camfenilol | 1171 | - | -- | 0,2 |
| Isoborneol | 1167, (1156) 10 | -- | -- | 0,7 |
| Borneol | 1175, (1165) 10 | 1666, (1664) 11 | -- | 6,2 |
| 4-Terpineol | 1184, (1177) 10 | 1633, (1628) 11 | -- | 1,1 |
| Estragol | 1202, (1203) 19 | 1663, (1652) 11 | 0,8 | -- |
| Acetato de Terpinilo | -- | 1691, (1687) 11 | -- | 2,6 |
| alfa-Terpineol | 1202, (1189) 10 | 1700, (1711) 17 | -- | 34,9 |
| Acetato de fenchilo | 1229, (1226) 20 | 1469, (1473) 11 | -- | 0,7 |
| Acetato de isobornilo | 1307, (1304) 21 | -- | -- | 1,3 |
| gama-Terpineol | 1315 | -- | -- | 0,1 |
| M.O.N.I. | 1330 | -- | -- | 0,2 |
| M.O.N.I. | 1358 | -- | -- | 1,6 |
| alfa-Longipineno | 1358, (1351) 9 | 1463 | 0,4 | -- |
| Longifoleno | 1426, (1418) 21 | 1559, (1574) 18 | 3,1 | -- |
| Isobutirato de bornilo | 1471 | -- | -- | 0,1 |
| E-Nerolidol | 1561, (1564) 9 | 2039, (2054) 17 | -- | 0,3 |
| 1,2,3,4-Tetrametoxi-5 (2-propenil) benceno | 1585, (1591) 22 | 2100 | -- | 0,4 |
| Timol | -- | 2110, (2100) 11 | -- | 0,6 |
| Apiol | 1772, (1680) 9 | 2390 | -- | 0,2 |
| Total monoterpenos |
|
| 71,1 | 35,1 |
| Total monoterpenoides |
|
| 22,4 | 61,6 |
| Total sesquiterpenos y sesquiterpenoides |
|
| 4,5 | 0,3 |
| Total arilpropanoides |
|
| 0,8 | 1,2 |
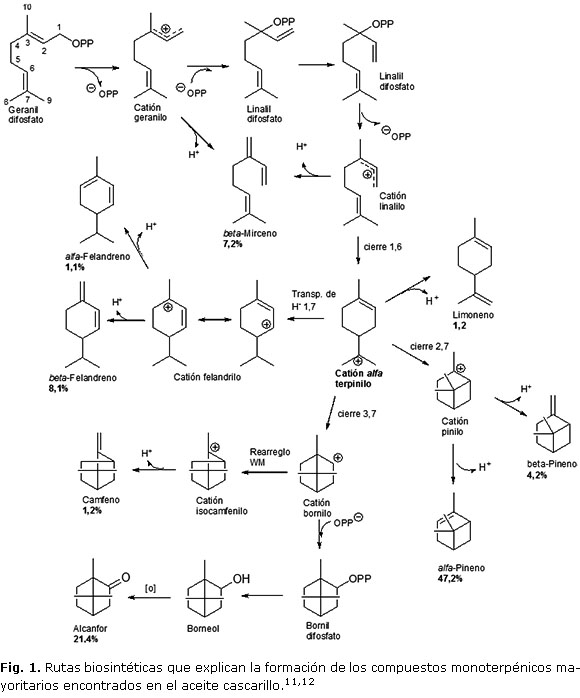
En las Figs 1 y 2, se ilustran las rutas biosintéticas propuestas en otras angiospermas, que conducen a la formación de los productos mayoritarios de tipo monoterpénico detectados en cada aceite.12,13
En la Fig 3, se ilustran las rutas biosintéticas que conducen a la formación de los productos de tipo sesquiterpénico detectados en los aceites analizados. En esta figura, se observa que los tres compuestos detectados (longifoleno, alfa-longipineno y longicicleno) tienen como precursor la misma especie química, el catión himachelenilo.12
DISCUSIÓN
Según Bandoni,8 tanto el aceite de cascarillo como el aceite de sasafrás, (que se conoce en algunos lugares de Suramérica) son obtenidos de la especie O. barcellensis, sinonimia de O. cymbarum, y no de las especies Sassafras albidum u O. pretiosa como podría pensarse. Sin embargo, este autor resalta que los resultados de algunas investigaciones sobre la composición química de las esencias obtenidas de esta especie difieren significativamente. Así, en uno de los estudios encontraron como componentes principales de esta esencia para-cimeno (92,31 %) y limoneno (4,47 %); y reportan una rotación específica de +29,6, un índice de refracción de 1,4768 y una densidad de 0,8532 g/mL. Otro estudio reveló que el aceite obtenido de la madera del fuste de la misma especie, tiene como compuestos mayoritarios alfa-felandreno, para-cimeno y alfa-pineno y en una tercera investigación se encontró beta-pineno en una proporción del 97 %. A su vez, estos tres estudios difieren de los resultados para los dos aceites analizados en el presente trabajo.
Al analizar las rutas biosintéticas que conducen a la formación de los compuestos mayoritarios detectados en los dos aceites, se encuentran diferencias significativas: Solo en el aceite de cascarillo se detectaron hidrocarburos sesquiterpénicos mayores del 1 %, esto implica la presencia de enzimas de tipo preniltransferasa en el citosol, que a partir de nerolidil difosfato (NPP), (el cual es originado por la ruta alterna a la del ácido acético o ruta del gliceraldehído 3-fosfato a partir del cual se originan los compuestos de tipo sesquiterpénico) 12 catalizan la formación del catión nerolidilo, seguida de una ciclación mediante cierre entre los carbono 1 y 11 para generar el catión Z,E -humulilo. En la Figura 3 se observa con más detalle la ruta biosintética que conduce a la formación de los sesquiterpenos detectados. Los tres compuestos sesquiterpénicos detectados poseen estructuras triciclicas y se originan a partir del catión himachelenilo el cual a su vez es originado por una ciclación de los carbonos 6 y 1 y transposición de hidruro de tipo 1,3 del catión Z,E-humulilo. Es notoria la baja diversificación química encontrada en esta ruta. En el aceite de sasafrás solo se detectó el sesquiterpenoide nerolidol en una proporción relativa baja (0,3%).
En el caso de los compuestos monoterpénicos, también existen diferencias, aunque las dos especies presentan preniltransferasas que conducen a la formación del intermediario geranil pirofosfato, (GPP) y este a su vez da origen al intermediario catión alfa-terpinilo, y posteriormente mediante reacciones de ciclación a compuestos monociclicos y biciclicos. En el caso de los componentes del aceite de cascarillo, los compuestos mayoritarios se originan inicialmente por reacciones de desprotonación de los cationes geranilo o linalilo, transposición de hidruro (1,7) cierres entre los carbonos 2 y 7 y 3 y 7 del catión alfa-terpinilo, y en una segunda y tercera etapa se evidencian reacciones de fosforilación desprotonación, rearreglo WM y oxidación (Figura 1). Por otro lado los compuestos encontrados en el aceite de sasafrás, tienen también como principal intermediario el catión alfa-terpinilo y directamente a partir de éste, se originan productos finales mediante reacciones de desprotonación, (limoneno y terpinoleno) hidratación (terpineol) y a partir de estos la formación de productos secundarios como para-cimeno, (a partir de limoneno) acetato de terpinilo y 1,8 cineol (a partir del terpineol). Es común en los dos aceites la presencia de compuestos originados mediante cierre de los carbonos 2 y 7 del catión alfa-terpinilo que da origen a los alfa y beta-pineno. El fenchol y su derivado acetato de fenchilo también son originados a partir del catión pinilo seguido de un rearreglo de tipo WM y una hidratación, solo se detectaron en el aceite de sasafrás. Otra reacción en común, es la ciclación por un cierre entre los carbono 3 y 7 que originan el catión bornilo y de este mediante un rearreglo WM seguido de deshidratación se genera el camfeno presente en los dos aceites. Mediante reacciones de fosforilación, hidrólisis y acetilación borneol y acetato de bornilo en el aceite de sasafrás, y mediante reacciones de fosforilación, hidrólisis y oxidación o borneol y alcanfor en el aceite de cascarillo.
Al hacer un análisis de la proporciones relativas y los compuestos de tipo monoterpénico encontrados en los dos aceites y teniendo en cuenta los dos primeros postulados de evolución micromolecular, (a mayor grado de diversificación y mayor grado de oxidación mayor es el grado de evolución química)23 se encuentra que el aceite de sasafrás presenta una mayor diversificación a partir del catión alfa-terpenilo dando origen a compuestos de tipo hidrocarburo (monociclico y biciclico) y alcohol éster y éter cíclico. Y en el caso del aceite de cascarillo, la diversidad química es menor y está representada por hidrocarburos, (aciclicos, monociclicos y biciclicos) y cetona; aunque según la ruta biosintética la cetona tiene como precursor el alcohol, este no fue detectado. Se evidencia que no hay diferencias significativas en las ramificaciones de las rutas biosentéticas observadas pero sí en la diversidad química observada y el grado oxidación. Esto de acuerdo a los postulados de evolución micromolecular indicaría un mayor grado de evolución química de la especie de la cual se obtuvo el aceite de sasafrás.
Las diferencias observadas en la composición química de los aceites son resultado de diferentes tipos de reacciones catalíticas. Comparando las dos rutas metabólicas que conducen a la formación de los compuestos monoterpénicos, para el cascarillo, no se evidencian reacciones de acetilación, ciclación para formación de éter, e hidratación catiónica, que son las reacciones que dan origen a los principales compuestos oxigenados observados en el aceite de sasafrás. Por otro lado, para el sasafrás no se evidencian reacciones de oxidación que conduzcan a la formación de cetonas ni reacciones de transposición de hidruro.
La no coincidencia entre los diferentes estudios de composición referenciados y los realizados en este trabajo, las diferencias encontradas en las rutas biosintéticas que conducen a la formación de los componentes mayoritarios observados en los aceites, las diferencias en los tipos de reacciones involucradas en la formación de los componentes y el aparente mayor grado de evolución química observada en la composición de la fracción monoterpénica del aceite de sasafrás en comparación con el del aceite de cascarillo, son indicativos de que se trata de taxones con diferencias en cuanto a su química, a pesar de que aparentemente se trata de la misma especie. Esto a su vez evidencia la alta complejidad en la sistemática de estas especies y en general de la familia Lauraceae,2 justificando el empleo de otras herramientas que puedan dar una mayor certeza en la identificación de estas especies vegetales. Es posible que la diversidad química encontrada al analizar la composición de los aceites esenciales se deba a que no se trata de especies distintas, lo que indica un aumento de la diversidad biológica. Hecho que no es nuevo en la familia, pues como lo menciona el profesor Madriñan, parte de las nuevas especies de Lauraceae que se han descrito últimamente provienen de Colombia, y se ha observado que al realizar las revisiones botánicas de diferentes géneros de la familia el número de especies ha aumentado hasta en un 50 %.2
Dada la relativamente alta proporción de compuestos con comprobada actividad medicinal (alcanfor) y aplicaciones en la industria de la perfumería (alfa-terpineol y sus derivados) encontrados en los aceites analizados, es importante profundizar en los estudios de las especies vegetales de las cuales se extraen estos aceites, teniendo como primera medida la identificación correcta, su localización, estado de vulnerabilidad, y métodos de propagación y conservación.
AGRADECIMIENTOS
Al doctor Luis Fernando Anzola Pinto Exgobernador del Guainía por la gestión en la consecución de la muestra de aceite de sasafrás, al Departamento de Química de la Universidad Nacional de Colombia por permitir la realización de este trabajo.
REFERENCIAS BIBLIOGRÁFICAS
1. Instituto de Investigación de Recursos Biológicos Alexander von Humboldt. Sistema de información sobre Biodiversidad de Colombia (SIB). [citado 20 mar 2015]. Disponible en: http://data.sibcolombia.net/inicio.htm.
2. Universidad de los Andes.edu.co. Laboratorio de Botánica y sistemática. [citado 10 feb 2015]. Disponible en: http://botanica.uniandes.edu.co/investigacion/lauraceae.htm
3. Acero Duarte LE. Plantas útiles de la cuenca del Orinoco. 2nd ed. Colombia: Zona Ediciones; 2007.
4. Puentes de Díaz A., Bisnorneolignano de la madera de Ocotea simulans. Rev. Col. Quim. 1996;25(1-2):1-6.
5. García Barriga H. Flora Medicinal de Colombia. 2nd ed. Vol. 1. Bogotá, Colombia: Editorial Tercer Mundo; 1992.
6. Gupta MP. (Editor). Plantas Medicinales Iberoamericanas. Colombia: Quebecor World Bogotá; 2008.
7. Palomino E, Maldonado C, Kempff MB, Ksebati MB. Caparratriene, an active sesquiterpene hydrocarbon from Ocotea caparrapi, J. Nat. Prod. 1996;59(1):77-9.
8. Bandoni A. (Editor). Los Recursos Vegetales Aromáticos en Latinoamérica, su aprovechamiento industrial para la producción de aromas y sabores. Buenos Aires: Editorial de la Universidad Nacional de la Plata; 2000.
9. Royal Botanic Gardens. Kew and Missouri Botanical Garden. [citado 12 Feb 2016]. Disponible en: http://www.theplantlist.org/tpl1.1/record/kew-2386431
10. Adams RP. Identification of essential oil components by gas chromatography/mass spectrometry. Illinois: Allured Publishing Corporation, Carol Stream; 1995.
11. Jennings W, Shibamoto T. Qualitative Analysis of Flavor and Fragance Volatiles by Glass Capillary Gas Chromatography. New York: Academic Press; 1980.
12. Davis ED, Croteau R. Cyclation Enzymes in the Boisynthesis of Monoterpenes, sesquiterpenes, and Diterpenes: in Leedper FJ, and Vederas JC. 209 Topics in Current Chemistry Biosynthesis Aromatic Poliketides, Isoprenoids, Alkaloids. Germany: Springer; 2000.
13. Degenhardt J, Köllner TG, Gershhenzon J. Monoterpene and sesquiterpene synthases and the origin of terpene skeletal diversity in plants. Phytochemystry. 2009;70(15-16):1621-37.
14. Hognadottir A, and Rouseff RL. Identification of aroma active compounds in orange essence oil using gas chromatography-olfactometry and gas chromatography - mass spectrometry, J. Chromatogr. A. 2003;998(1-2):201-11.
15. Priestap HA, Van Baren CM, Di Leo Lira P, Coussio JD, and Bandoni AL. Volatile constituents of Aristolochia argentina. Phytochemistry. 2003;63(2):221-5.
16. Varming C, Petersen MA, and Poll L. Comparison of isolation methods for the determination of important aroma compounds in blackcurrant (Ribes nigrum L.) juice, using nasal impact frequency profiling. J. Agric. Food Chem. 2004;52(6):1647-52.
17. Choi HS. Character impact odorants of Citrus hallabong [(C. unshiu Marcov x C. sinensis Osbeck) x C. reticulata Blanco] cold-pressed peel oil. J. Agric. Food Chem. 2003;51(9):2687-92.
18. Davies NW. Gas chromatographic retention indices of monoterpenes and sesquiterpenes on methyl silicone and Carbowax 20M phases. J. Chromatogr. A. 1990;503:1-24.
19. Weissbecker B, Holighaus G, Schütz S. Gas chromatography with mass spectrometric and electroantennographic detection: analysis of wood odorants by direct coupling of insect olfaction and mass spectrometry . J. Chromatogr. A 2004;1056(1-2):209-16.
20. Hamm S, Bleton J, and Tchapla A. Headspace solid phase microextraction for screening for the presence of resins in Egyptian archaeological samples. J. Sep. Sci. 2004;27(3):235-43.
21. Sotomayor JA, Martínez RM, García AJ, and Jordan MJ. Thymus zygis subsp. gracilis: watering level effect on phytomass production and essential oil quality. J. Agric. Food Chem. 2004;52(17):5418-24.
22. Wang Q, Yang Y, Zhao X, Zhu B, Nan P, Zhao J, et al. Chemical variation in the essential oil of Ephedra sinica from Northeastern China Food Chem. 2006;98(1):52-8.
23. Gottlieb OR. Micromolecular Evolution, Systematics and Ecology. Germany: Springer-Verlag; 1982.
Recibido: 21 de marzo de 2015.
Aprobado: 19 de abril de 2016.