Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Plantas Medicinales
versión On-line ISSN 1028-4796
Rev Cubana Plant Med vol.21 no.3 Ciudad de la Habana jul.-set. 2016
ARTÍCULO ORIGINAL
Estudio fitoquímico y actividad antiinflamatoria de hojas, flores y frutos de Bejaria resinosa Mutis ex L. (Pegamosco)
Phytochemical study and anti-inflammatory activity of leaves, flowers and fruits of Bejaria resinosa Mutis ex L. (pegamosco)
Javier Andrés Matulevich PeláezI, Elizabeth Gil ArchilaII, Luis Fernando Ospina GiraldoIII
IUniversidad Distrital Francisco José de Caldas. Bogotá, Colombia.
IIPontificia Universidad Javeriana. Bogotá, Colombia.
IIIUniversidad Nacional de Colombia. Colombia.
RESUMEN
Introducción: Bejaria resinosa Mutis ex L. es una especie vegetal conocida en Colombia como pegamosco; es empleada por diferentes comunidades para atrapar insectos y para el tratamiento de dolencias respiratorias; además, es una especie que cuenta con escasos estudios desde el punto de vista químico y biológico.
Objetivos: contribuir al estudio fitoquímico de las hojas, flores y frutos de B. resinosa (Ericaceae) y evaluar su actividad antiinflamatoria.
Métodos: hojas, flores y frutos por separado fueron extraídos por maceración en frío con éter de petróleo y etanol 96 %; estos extractos se fraccionaron por partición líquido/líquido y métodos cromatográficos; su actividad antiinflamatoria se evaluó utilizando el modelo murino de edema auricular inducido por 13-acetato de 12-tetradecanoilforbol (TPA). La elucidación estructural de los compuestos aislados se llevó a cabo mediante las técnicas de CG-EM y RMN (experimentos 1H, 13C, COSY, J-MOD, HSQC y HMBC).
Resultados: la separación de los extractos y fracciones por cromatografías en columna, en capa delgada y preparativa, permitieron obtener una mezcla de compuestos tipo triterpeno compuesta por germanicol, -amirina y -amirina y el aislamiento de lupeol, salicilato de metilo, 3,5,7,3´,4´ pentahidroxiflavona (quercetina), 3,5-dihidroxi-6,7,8-trimetoxiflavona y 3,5,7,3´,4´ pentahidroxiflavanol. Se encontró que la fracción que contiene la mezcla de triterpenos y la quercetina fueron las que presentaron un efecto antiinflamatorio mayor al 65 %.
Conclusiones: el estudio fitoquímico de la especie vegetal B. resinosa permitió establecer similitud en cuanto a la composición química de los diferentes órganos ya que se encontraron metabolitos secundarios comunes para hojas flores y frutos como la mezcla de triterpenos, lupeol y quercetina; además se logró establecer que la mezcla de triterpenos y la quercetina son fuertes agentes antiinflamatorios, pues redujeron significativamente el edema causado por el TPA en la oreja del ratón con porcentajes de inhibición cercanos a los presentados por el fármaco de referencia, indometacina.
Palabras clave: Bejaria resinosa; actividad antiinflamatoria; terpenos; flavonoides.
ABSTRACT
Introduction: Bejaria resinosa Mutis ex L. is a plant species known as pegamosco in Colombia. It is used by several communities to catch insects and to treat respiratory disorders. Few chemical and biological studies have been conducted about this species.
Objectives: Contribute to the phytochemical study of leaves, flowers and fruits of B. resinosa (Ericaceae) and evaluate its anti-inflammatory activity.
Methods: Leaves, flowers and fruits were extracted separately by cold maceration with petroleum ether and 96% ethanol. The extracts obtained were fractioned using liquid / liquid partition and chromatographic methods. Their anti-inflammatory activity was evaluated with the mouse model of ear edema induced by 12-tetradecanoyl phorbol 13-acetate (TPA). Structural characterization of the compounds isolated was based on GC-MS and NMR techniques (experiments 1H, 13C, COSY, J-MOD, HSQC and HMBC).
Results: Separation of extracts and fractions by thin-layer and preparative column chromatography made it possible to obtain a mixture of triterpene compounds made up of germanicol, α-amyrin and β-amyrin, and isolate lupeol, methyl salicylate, 3,5,7,3´,4´-pentahydroxyflavone (quercetin), 3,5-dihydroxy-6,7,8-trimetoxyflavona and 3,5,7,3´,4´-pentahydroxyflavanol. It was found that the fraction containing the mixture of triterpenes and quercetin had an anti-inflammatory effect above 65%.
Conclusions: The phytochemical study of the plant species B. resinosa revealed similarities between the chemical composition of the different organs, since common secondary metabolites were found in leaves, flowers and fruits, such as the mixture of triterpenes, lupeol and quercetin. It was also established that the mixture of triterpenes and quercetin is a strong anti-inflammatory agent, for it significantly reduced the mouse ear edema caused by TPA with inhibition percentages close to those of the drug of reference indometacin.
Key words: Bejaria resinosa; anti-inflammatory activity; terpenes; flavonoids.
INTRODUCCIÓN
El género Bejaria perteneciente a la familia Ericaceae se caracteriza por ser un género neo tropical taxonómicamente complejo de 15 especies frugíferas y arbóreas distribuidas en el sureste de Estados Unidos, oeste de Cuba, centro y sur de México, dispersamente localizadas en Centroamérica y en Suramérica se encuentran desde Colombia hasta Bolivia. Sus flores presentan como característica principal siete pétalos libres, las anteras son no apendiculares y los frutos son capsulares.1 Este género se caracteriza por biosintetizar compuestos como triterpenos y flavonoides tales como la quercetina y la miricetina2 a los cuales se les han determinado importantes actividades biológicas tales como analgésicas, antiinflamatorias, antimicrobianas, entre otras.3
Bejaria resinosa Mutis ex L.es un arbusto de flores vistosas de color rojo, cubiertas de una resina la cual le sirve como goma para atrapar insectos; es un arbusto de páramo o subpáramo localizada desde el Páramo de Tamá (Venezuela) al sur de Colombia, y del Páramo del Castillo (Ecuador) al Cerro de Calla (Perú), a (1750- 2500 - 3700 m.s.n.m.). En Colombia se distribuye en los departamentos de Antioquia, Arauca, Boyacá, Cauca, Cundinamarca, Santander y Valle. Comúnmente es conocida con el nombre de pegamosco, pegajosa, angucho, carbonero, azalea del monte, pegapega, payama y purunrosa. Esta especie es usada en Colombia (Cundinamarca) como goma para atrapar insectos, de allí los nombres de matamosca y pegamosca; en Ecuador se emplea para tratar heridas y esguinces; también es empleada como purgante y como agente preventor de ataques al corazón; en Perú es considerada una fuerte medicina para dolencias respiratorias.4
Esta planta a pesar de ser ampliamente distribuida, ha sido muy poco estudiada desde el punto de vista fitoquímico y biológico, debido a lo cual la presente investigación tuvo por objetivo contribuir al estudio fitoquímico de sus hojas, flores y frutos y evaluar su actividad antiinflamatoria.
MÉTODOS
El material vegetal fue recolectado en el municipio de Guasca, Cundinamarca (Coordenadas geográficas: 4° 52′ 0″ N, 73° 53′ 0″ W) en el mes de mayo de 2013. Una muestra testigo fue enviada al Herbario Nacional de Colombia para su determinación taxonómica la cual fue clasificada como Bejaria resinosa Mutis ex L. f. (Ericaceae) bajo el número de colección COL 565500. Hojas, flores y frutos por separado fueron secados a temperatura ambiente y posteriormente molidos para su extracción con éter de petróleo y etanol.
Obtención de extractos y fracciones
Hojas (980 g), flores (370 g) y frutos (180 g) por separado, una vez secos y triturados en molino fueron sometidos por separado a una extracción con éter de petróleo (40 - 60°C) por el método de maceración en frio; los extractos obtenidos de hojas (E.Edp.BrH 2,93 % p/p), flores (E.Edp.BrFL 4,38 % p/p) y frutos (E.Edp.BrFR 1,53 % p/p) fueron floculados con acetona, filtrados y concentrados a presión reducida a 40°C.
Se tomaron 0,7 g del extracto E.Edp.BrH y se fraccionaron por Cromatografia en columna (CC) utilizando como fase móvil Edp:AcOEt 7:3, obteniendo 7 fracciones. En la fracción número 3 (E.Edp.BrH.F3) se obtuvieron 23,3 mg de un sólido de color blanco denominado mezcla Br1. Esta mezcla fue identificada también en los extractos de flores y frutos.
El residuo de cada uno de los órganos después de la extracción con éter de petróleo fue extraído con etanol por el método de maceración en frío, obteniendo los extractos totales etanólicos de hojas (E.EtOH.BrH 10,6 % p/p), flores (E.EtOH.BrFL 22 % p/p) y frutos (E.EtOH.BrFR 10,9 % p/p) los cuales fueron floculados con agua, posteriormente filtrados y concentrados a presión reducida a 40°C. A los extractos etanólicos se les realizaron pruebas químicas de precipitación y/o coloración, con el fin de conocer los posibles grupos de metabolitos secundarios presentes en ellos.5,6
Para el fraccionamiento de cada uno de los extractos etanólicos se empleó el método de extracción líquido - líquido continuo con solventes de polaridad creciente obteniéndose las fracciones de éter de petróleo (F.Edp), diclorometano (F.CH2Cl2 ), y acetato de etilo (F.AcOEt) de cada uno de los órganos.
De la fracción de diclorometano de hojas (F.CH2Cl2.BrH) fueron fraccionados 2 g por Cromatografia flash (CF) utilizando como fase móvil Hexano:acetona 6:4, obteniendo 6 fracciones. En la fracción número 4 (F.CH2Cl2.BrH.F4) precipitó un sólido color blanco (25 mg) el cual se volvió a fraccionar por CC empleando como fase móvil Hexano:Acetona 1:1, obteniendo 5 subfracciones. En la fracción número 1 (F.CH2Cl2.BrH.F4.1) se obtuvo (10,1 mg) de un sólido color blanco denominado compuesto Br2. Este mismo compuesto fue identificado en las fracciones de diclorometano de flores y frutos.
De la fracción de acetato de etilo de hojas (F.AcOEt.BrH) fue fraccionado 1 g por CF empleando como fase móvil AcOEt:Acetona 8:2 obteniendo 10 fracciones de las cuales las fracciones 5 y 6 fueron estudiadas (F.AcOEt.BrH.F5 y F.AcOEt.BrH.F6). 90 mg de F.AcOEt.BrH.F5 fueron fraccionados por CC empleando como fase móvil AcOEt:Acetona 7:3 obteniendo 7 fracciones, de la subfracción 2 (F.AcOEt.BrH.F5.2) se obtuvo 31,2 mg de un sólido de color amarillo denominado compuesto Br3. De otra parte, 74 mg de F.AcOEt.BrH.F6 fueron subfraccionados de la misma manera que la fracción anterior (F.AcOEt.BrH.F5) obteniendo 7 subfracciones. En la subfracción número 4 (F.AcOEt.BrH.F6.4) se obtuvieron 4,4 mg de un aceite color amarillo denominado compuesto Br4.
Se tomaron 3 g de la fracción de acetato de etilo de flores (F.AcOEt.BrFL) y se subfraccionaron por CF empleando como fase móvil AcOEt:Acetona 8:2 obteniendo 5 fracciones. En la subfracción número 1 (F.AcOEt.BrFL.F1) precipitó un sólido color amarillo (350 mg) el cual se purificó por CC empleando una mezcla de AcOEt:Acetona 9:1 obteniendo 7 mg de un sólido color amarillo denominado compuesto Br5.
Por último se tomaron 2 g de la fracción de acetato de etilo de frutos y se sometieron a extracción solido - líquido con éter etílico, la fracción soluble en éter etílico (F.Eet.BrFR) se concentró a presión reducida a 40°C, la cual se fraccionó por CC empleando como fase móvil éter etílico obteniendo 6 fracciones. 26 mg de la fracción número 1(F.Eet.BrFR.F1) fue purificada por Cromatografia en capa delgada preparativa (CCD) utilizando una mezcla de éter etílico:MeOH 7:3 y como revelador vainillina en ácido sulfúrico obteniendo un sólido de color café rojizo (4,6 mg) denominado compuesto Br6.
Evaluación de la actividad antiinflamatoria
La actividad antiinflamatoria se realizó siguiendo el modelo murino de edema auricular inducido por 13-acetato de 12-tetradecanoilforbol (TPA) descrito por De Young 7 y modificado por Payá.8 Se seleccionaron nueve fracciones y un metabolito mayoritario teniendo en cuenta como criterio de selección la cantidad de muestra requerida para el análisis y su solubilidad en acetona. Para el ensayo se emplearon ratones albinos hembras de 32 a 39 g, entre siete a diez semanas de crecimiento (n = 10), suministrados por el Departamento de Farmacia, Universidad Nacional de Colombia (DFUNC). Los animales empleados fueron manejados acorde al cumplimiento de los principios éticos relacionados con el empleo de animales de experimentación y los requerimientos de salud y bienestar animal, tal como lo indica la legislación colombiana, los mismos se mantuvieron en condiciones estándar. Se administró 2,5 μg/oreja del irritante TPA (Sigma Chemical Co. St. Louis, MO, USA) junto con 1000 μg/oreja de indometacina como patrón (Sigma Chemical Co. St. Louis, MO, USA) o con la sustancia evaluada (fracción o metabolito secundario 1000 g/oreja) disueltas en acetona (Mallinckrodt Chemicals) vía tópica en la oreja derecha (volumen total: 20 l/oreja, 10 [a2] l/cara). La oreja izquierda se empleó como control. Transcurridas 4 h se sacrificaron los animales por dislocación cervical y se obtuvo una muestra de cada pabellón auricular por sacabocado (7 mm de diámetro). Se calculó la diferencia de peso entre oreja tratada y no tratada, los resultados se expresaron como porcentaje de inhibición del edema. Se considera como actividad antiinflamatoria moderada la inhibición del edema del 35 al 65 % y como buen efecto antiinflamatorio un valor mayor de 65 %.9
Finalmente, se realizó un análisis estadístico de los resultados mediante el software SPSS Statistic 20,0 asumiendo un análisis de varianza univariado seguido de prueba Tukey para comparaciones múltiples. Los valores P<0,05 se consideraron como significativos.
Técnicas para la elucidación estructural y caracterización de los compuestos aislados
Para la determinación de las mezclas se empleó un cromatógrafo con detector selectivo de masas SHIMADZU QP2010 plus. La separación se realizó en una columna capilar SHRXi - 5MS de 30 metros de longitud x 0,25 mm x 0,25 μm con una inyección en modo Split (10:1), el gas de arrastre utilizado fue helio (grado 5.0) con flujo constante de 1,2ml[ADG3] /min. La programación de la temperatura del horno fue: de 50 °C (2 min) incremento de 15°C/min hasta 200°C (2 min) y de 10°C/min hasta 300°C (10min) para un tiempo total de análisis de 34 min, la temperatura de la línea de transferencia fue de 275°C y de la cámara de ionización de 230°C.
Los espectros de masas de las sustancias aisladas fueron tomados en un equipo SHIMADZU MS QP2010 dotado con sonda de inserción directa y analizador de masas cuadrupolar. El modo utilizado fue por ionización electrónica (IE) a 70Ev y la temperatura de la cámara de ionización fue de 230°C.
Los espectros de RMN de hidrogeno (1H), carbono (13C) y sus correlaciones bidimensionales Correlated Spectroscopy (COSY), J-modulated spin-echo (J-MOD), Heteronuclear Single Quantum Correlation (HSQC) y Heteronuclear Multiple Bond Correlation (HMBC) fueron tomados en un espectrómetro Bruker Avance. Los análisis se realizaron a 300 MHz para 1H y 75 MHz para 13C, empleando solventes deuterados (CDCl3, Acetona-d6 y CD3OD), con tetrametilsilano (TMS) como referencia interna.
RESULTADOS
Análisis fitoquímico preliminar
Los resultados de los ensayos químicos preliminares realizados a los extractos etanólicos de hojas (E.EtOH.BrH), flores (E.EtOH.BrFL) y frutos (E.EtOH.BrFR) de la especie B. resinosa se encuentran en la tabla 1.
Metabolitos secundarios aislados
Mezcla Br1
La mezcla Br1 (141,3 mg) fue obtenida como un sólido cristalino de color blanco en forma de agujas, con un punto de fusión de 168 - 172 ºC el cual presentó una mancha de color violeta en cromatografía en capa delgada (CCD) al ser revelada con el reactivo de vainillina/ H2 SO4. En el análisis por cromatografía de gases acoplada a espectrometría de masas (CG-EM) de la mezcla Br1 se obtuvieron tres señales en la corriente iónica total (TIC). La comparación de los espectros de masas con los de la librería NIST 08 confirma la presencia de -amirina, -amirina y germanicol.
Compuesto Br2
El compuesto Br2 se obtuvo como un sólido color blanco con un punto de fusión de 216-217°C el cual presentó una mancha de color violeta en CCD al ser revelada con el reactivo de vainillina/ H2SO4. En el espectro de masas se observa el ion molecular a m/z 426, el pico base a m/z 43 y los característicos en m/z 218y m/z 189 para compuestos triterpenicos tipo lupano10. El espectro de RMN 1H del compuesto Br2, muestra siete singletes en d 0,74, 0,77, 0,81, 0,92, 0,95, 1,01 y 1,66 ppm correspondientes a grupos metilos. La señal de d 2,30 a 2,42 ppm (m) corresponde a un protón unido al carbono que soporta el grupo isopropilidénico. Los singletes anchos en d 4,55 y 4,66 ppm indican la presencia de un grupo exometilénico, correspondientes a dos protones olefínicos. Por otra parte, el doble doblete a d 3,16 ppm (dd, J= 5,17 y 10,85 Hz, 1H) es causado por un protón unido al carbono 3 el cual soporta el grupo hidroxilo.11
En el experimento J-MOD tomado a 75 MHz en CDCl3 se pueden observar 30 señales de carbonos, de las cuales 17 corresponden a carbonos cuaternarios y metilénicos y las 13 restantes a carbonos metílicos y metínicos. De estas señales se pueden resaltar por su desplazamiento químico las de d 151,6 y δ 109,9 ppm que corresponden a dos carbonos olefínicos del grupo exometilénico y d 79,6 ppm de un grupo metino enlazado al grupo hidroxilo.10
La conectividad de cada hidrogeno con el carbono al cual está unido, se realizó mediante el análisis del espectro HSQC; en este espectro se muestran conectividades como la de los protones en d 4,55 (s, 1H) y 4,66 (s, 1H) con un solo carbono de tipo sp2 d 109,9 corroborando la presencia del grupo exometilénico; el protón del grupo metino δ 3,15 con el carbono d 79,6 que soporta al grupo hidroxilo y el protón de d 2,35 con el carbono d 48,8 que se encuentra unido al grupo isopropilidénico.
Luego del análisis de los datos de RMN, CG-EM y de la comparación con datos de la literatura, se asignaron los desplazamientos químicos para cada uno de los carbonos e hidrógenos de la molécula la cual se identificó como lupeol.
Compuesto Br3
El compuesto Br3 (31,2 mg) se obtuvo como un sólido color amarillo con punto de fusión de 315°C, soluble en acetona, en CCD fue revelado con vapores de amoniaco mostrando una mancha de color verde y posteriormente con vainillina/H2SO4 mostrando una sola mancha de color rojizo. EM-IE: m/z 302 equivalente a la formula molecular C15H10O7. En el espectro de RMN 1H se observan 5 señales correspondientes a protones aromáticos en la región de 6 a 8 ppm. A campo bajo del espectro se observa una señal a d 12,20 ppm característica de un grupo OH fenólico que forma puente de hidrógeno con un grupo carbonilo lo cual permite considerar la presencia de un grupo hidroxilo en la posición C-3 o C-5 de un núcleo flavonoide. Las señales de 6,27 (d, J= 2,06 Hz, 1H) y δ 6,54 (d, J= 2,06 Hz, 1H) se pueden asignar a los hidrógenos en las posiciones C-6 y C-8 respectivamente del anillo A de un flavonoide. La señal de d 7,70 (dd, J= 8,51 Hz, 2,18 Hz, 1H) puede ser asignada a un protón en la posición H-6'. La señal de d 7,02 (d, J= 8,51 Hz, 1H) corresponde al protón en posición H-5' y la señal de d 7,84 (d, J= 2,17 Hz, 1H) al protón en posición H-2'. Luego del análisis de los datos de RMN, CG-EM y de la comparación con datos de la literatura, se logró identificar el compuesto Br3 como quercetina.
Compuesto Br4
El compuesto Br4 (4,4 mg) se obtuvo como un aceite de color amarillo. En el espectro de masas de esta señal se observa el ión molecular a m/z 152, el pico base a m/z 120 el cual es atribuible a la pérdida de metanol (M- CH3OH) otra señal en m/z 92 que corresponde a la eliminación de un grupo acilo y la señal en m/z 121 atribuible a la eliminación de un grupo metoxilo (M-O-CH3) seguida de la eliminación de un grupo acilo a m/z 93. El espectro de RMN 1H del compuesto Br4, muestra la existencia de un singlete en d 10,76 correspondiente a al protón de un grupo OH fenólico, en la región aromática del espectro se evidencian cuatro señales d 7,79 (ddd, 1H), d 7,46 (m, 1H), d 6,97 (m, 1H) y d 6,89 (m, 1H) correspondientes a cuatro protones aromáticos lo cual indica que el anillo de benceno se encuentra disustituido. La señal de d 3,95 ( s, 3H) es indicativa de un grupo metoxilo. Los datos obtenidos con el espectro de RMN 1H y el análisis del espectro de masas confirman que el compuesto Br4 corresponde al salicilato de metilo.
Compuesto Br5
El compuesto Br5 (7 mg) se obtuvo como un sólido de color amarillo soluble en acetona con un punto de fusión de 148-149ºC. En el espectro de masas de esta señal se observa el ión molecular a m/z 344 y el pico base a m/z 329; además, exhibe los picos a m/z 301, 286 y 105.
En el espectro de RMN 1H se observa un total de cinco señales para protones aromáticos en la región de 6 a 8 ppm. A campo bajo del espectro se observa un singlete a d 11,9 característico de un grupo OH fenólico que forma puente de hidrógeno con un grupo carbonilo. Las señales de d 8,31 - 8,33 ppm (dd, J= 1,54 Hz, 2H) y d 7,51 - 7,62 (m, 3H), se pueden asignar a los hidrógenos en las posiciones C-2´, C-3´, C4´, C5´ y C-6´ del anillo B de un flavonoide. En la zona alifática del espectro se presentaron 3 señales, las cuales corresponden a los protones de tres grupos metoxilo d 3,88 (s, 3H), 3,98 (s, 3H) y 4,09 (s, 3H) confirmando lo observado en el análisis por CG-EM. Luego del análisis de los datos de RMN, EM y de la comparación con datos de la literatura, se asignaron los desplazamientos químicos para cada uno de los carbonos e hidrógenos de la molécula la cual se identificó como, 5-dihidroxi,-6,7,8-trimetoxiflavona.
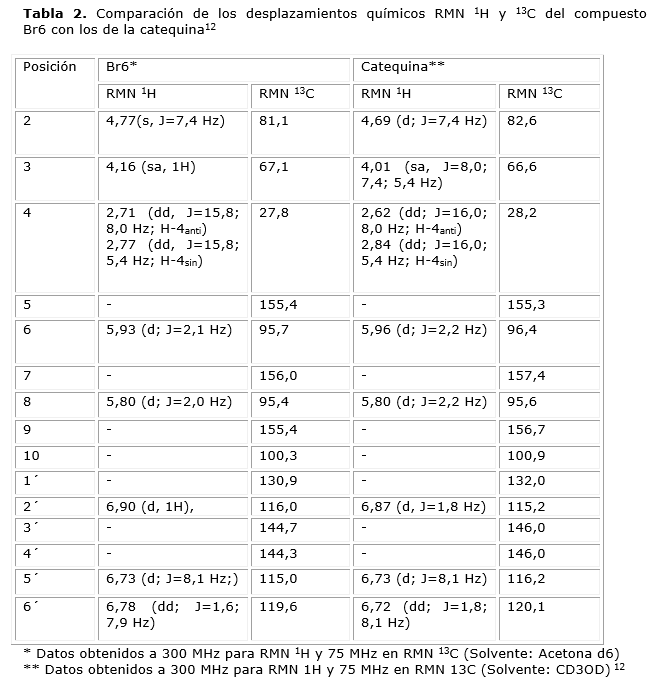
Compuesto Br6
El compuesto Br6 (4,6 mg) se obtuvo como un sólido color café-rojizo con punto de fusión: 176-178°C, soluble en acetona, en CCD fue revelado con vapores de amoniaco mostrando una mancha de color verde y posteriormente con vainillina/H2SO4 mostrando una sola mancha de color rojizo. Luego del análisis de los datos de RMN (tabla 2), se asignaron los desplazamientos químicos para cada uno de los carbonos e hidrógenos de la molécula la cual se identificó como, 3,5,7,3´,4´-pentahidroxiflavanol (catequina).
Actividad Antiinflamatoria
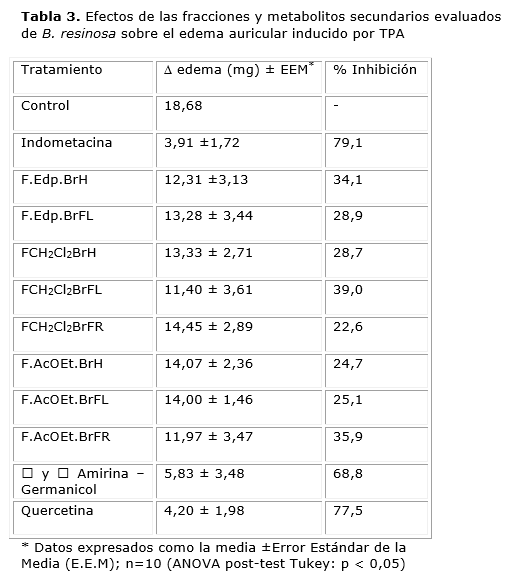
Las fracciones y metabolitos evaluados fueron: las fracciones éter de petróleo de hojas y flores (F.Edp.BrH, F.Edp.BrFL), fracciones diclorometano de hojas, flores y frutos (FCH2Cl2BrH, FCH2Cl2BrFL, FCH2Cl2BrFR), fracciones acetato de etilo de hojas flores y frutos (F.AcOEt.BrH, F.AcOEt.BrFL, F.AcOEt.BrFR), la mezcla y Amirina - Germanicol y la Quercetina. Las demás fracciones y metabolitos aislados no fueron evaluados en este modelo por ser insolubles en acetona y por la cantidad de sustancia requerida para el análisis. La tabla 3 muestra los resultados del efecto de las fracciones y metabolitos evaluados sobre el edema producido por la aplicación del TPA.
DISCUSIÓN
El análisis fitoquímico preliminar indica la presencia de metabolitos secundarios como terpenos y/o esteroides y flavonoides en la planta lo cual confirma lo encontrado por Harborne y Williams (1973)13 y Ueda (1961)14 para especies vegetales pertenecientes a la familia Ericaceae. Cabe resaltar que la familia Ericaceae no se caracteriza por la presencia de alcaloides,15 sin embargo las tres pruebas realizadas en este estudio dieron resultados positivos aunque con formación de precipitados en muy baja cantidad.
Este es el primer estudio fitoquímico realizado a la especie vegetal B. resinosa. Como resultado del mismo, se aislaron e identificaron una mezcla conformada por triterpenos pentaciclicos y cinco sustancias de las cuales tres corresponden a flavonoides, un triterpeno, y un compuesto fenólico. De acuerdo con los antecedentes descritos en la bibliografía, los constituyentes químicos mayoritarios presentes en la familia Ericaceae y particularmente en el género Bejaria son los flavonoides y triterpenos, y los resultados del presente estudio demuestran que B. resinosa no es la excepción, ya que la gran mayoría de los compuestos aislados pertenecen a esta categoría de metabolitos secundarios.
Los triterpenos identificados en la mezcla Br1 han sido ampliamente aislados de otras familias de especies vegetales como son: Apocinaceae16 Euphorbiaceae17 y en la familia Ericaceae de especies como: Arctostaphylus uva ursi y Craibiodendron yunnanense; en el género Bejaria también han sido encontrados en las especies Bejaria congesta, Bejaria aestuans y Bejaria glutinosa.18
El compuesto Br2 identificado como lupeol es un triterpeno pentacíclico ampliamente extraído de especies de diferentes familias como: las especies Hieracium plumulsum10 y solidago canadensis19 de la familia Asteraceae; en la especie Salvia cyanescens 20 de la familia Lamiaceae, en la especie Plumbago zeylanica21 de la familia Plumbaginaceae, entre otras. En la familia Ericaceae ha sido aislado de Arbutus menziessi22 y Bejaria glutinosa.18
El compuesto Br3 identificado como quercetina es un metabolito secundario ampliamente distribuido en diferentes familias de especies vegetales así como en la familia Ericaceae donde es considerada un marcador quimiotaxonómico ya que siempre se ha encontrado en diferentes estudios realizados a especies de esta familia.13
El compuesto Br 4 identificado como salicilato de metilo no ha sido reportado para la especie B. resinosa; pero se ha encontrado en algunas especies de la familia Ericaceae como en Gaultheria yunnanensis.23
El compuesto Br5 (5-dihidroxi,-6,7,8-trimetoxiflavona) ha sido reportado en otras familias de especies vegetales como: Asteraceae en la especie Bacharis nítida, Achyrocline bogotensis y en la familia Ericaceae se han encontrado flavonoides trimetoxilados pero en diferentes posiciones como el 3,5,7,4' Tetrahidroxi-8,3',5' trimetoxiflavona 3-O-α-L-ramnopiranósido.24
El compuesto Br6 identificado como 3,5,7,3´,4´-pentahidroxiflavanol (catequina) ha sido identificado en diferentes familias y especies como Cucumis melo (Cucurbitaceae), Fragacia vesca y Malus pumila (Rosaceae), y Vitis vinifera (Vitaceae). En la familia Ericaceae, la catequina ha sido aislada en especies como Vaccinium floribundum,Vaccinium myrtilus y Vaccinium mortinia, entre otras.25,26
La Tabla 3 muestra los resultados del efecto de las fracciones y metabolitos evaluados sobre el edema producido por la aplicación del TPA, encontrándose que la mezcla de y Amirina - Germanicol y la Quercetina exhibieron la mayor inhibición de la inflamación respecto al control (p<0.05) con un porcentaje de inhibición del edema de 68,8±3,3 y 77,5±2,8 respectivamente, mientras que la indometacina mostró una inhibición del edema de 79,1±2,19 a la misma dosis con lo que se confirma la validez del ensayo y los resultados mostrados por las fracciones y metabolitos evaluados. Las fracciones F.Edp.BrFL, FCH2Cl2BrFR y F.AcOEt.BrFR no presentan efecto antiinflamatorio y existe actividad antiinflamatoria moderada en las fracciones F.Edp.BrH, FCH2Cl2BrH, FCH2Cl2 BrFL, F.AcOEt.BrH y F.AcOEt.BrFL.
El método empleado (edema auricular inducido por TPA) es ampliamente utilizado para evaluar sustancias antiinflamatorias; en el cual el proceso inflamatorio desencadenado por la aplicación tópica del TPA se debe a la activación de la proteína cinasa C (PKC) dérmica y la fosfolipasa A2 así como la producción de prostaglandinas y leucotrienos mediadores que podrían intervenir en el efecto antiinflamatorio.9 Una gran cantidad de agentes antiinflamatorios muestran actividad en este modelo, pero principalmente los encargados de inhibir las enzimas cicloxigenasa(COX) y lipoxigenasa (LOX)27 aunque los inhibidores de la cicloxigenasa parecen ser más efectivos que los inhibidores de la lipoxigenasa (LOX) para reducir la respuesta edematosa.9 La actividad antiinflamatoria mostrada por la mezcla de y [a4] Amirina - Germanicol y la quercetina puede deberse probablemente a que muchos triterpenos y flavonoides pueden modular la síntesis de prostaglandinas, funcionando como inhibidores enzimáticos. Unos pueden inhibir la enzima cicloxigenasa (COX) como es el caso de los triterpenos pentaciclicos, mientras que otros pueden inhibir la enzima lipoxigenasa, como es el caso de la quercetina.28 Cabe resaltar que los flavonoides también pueden manifestar propiedades antiinflamatorias a través de su acción antioxidante (capacidad de captar radicales libres) lo cual les permite actuar contra el daño tisular debido a la formación de radicales libres generados como subproductos de las rutas cicloxigenasa y lipoxigenasa, pudiendo citar entre ellos a la rutina.29,30
El presente estudio es un aporte a las investigaciones fitoquímicas de la familia Ericaceae en Colombia y en particular del género Bejaria, ya que éste es el primer reporte reciente en cuanto a la constitución de metabolitos fijos de un género que cuenta con escasos estudios químicos y biológicos.
REFERENCIAS BIBLIOGRÁFICAS
1. Luteyn J, Pedraza P. The New York Boanical Garden. [Internet]; 2007. Disponible en: www.nybg.org/bsci/res/lut2.
2. Clemants S. Two New Species of Bejaria (Ericaceae) from South America. Brittonia. 1991;43(3):171-77.
3. Bussmann RW, Malca-Garcia G, Glenn A, Sharon D, Chait G, Diaz D, et al. Minimum inhibitory concentrations of medicinal plants used in Northern Peru as antibacterial remedies. Journal of Ethnopharmacology. 2010;132:101-08.
4. Luteyn JL. Ericaceae New York: Organization for Flora Neotropica: New York Botanical Garden; 1995.
5. Bilbao M. Análisis Fitoquimico Preliminar Armenia: Oficina de publicaciones Universidad del Quindio; 1997.
6. Sanabria A. Análisis fitoquímico preliminar Bogotá: Universidad Nacional de Colombia; 1983.
7. De Young L, Kheifets J, Ballaron S, Young J. Edema and cell infiltration in the forbol esther treated mouse ear are temporally separated and can be differentially modulated by pharmacologic agents. Agents and actions. 1989;26:335-41.
8. Payá M, Ferrándiz ML, Sanz MJ, Bustos G, Blasco R, Rios JL, et al. Study of the antioedema activity of some seaweed and sponge extracts from the mediterranean coast in mice. Phytotherapy Research. 1993:7:159-62.
9. Garcia MD, Fernandez M, Alvarez A, Saenz M. Anticonceptive and antiinflamatory effect of the aqueous extract from leaves of pimenta racemosa var ozua (Mirtaceae). Journal of Ethnopharmacology. 2004; 91:69-73.
10. Argay G, Kalman A, Kapor A, Ribar B, Petrovic S, Gorunovid M. Crystal structure of a mixture of lupeol acetate tautomers isolated from Hieracium plumulosum A. Kerner, Asteraceae. Journal of Molecular Structure. 1997;435:169-79.
11. Bracho J, Rodriguez C, Llanez F. Triterpenos pentacíclicos en propóleo. Revista de la Sociedad Química del Perú. 2009;75:439-52.
12. Costa M, Chaves M. Constituientes Quimicos e atividade antioxidante de extratos das folhas de Terminalia fagifolia Mart. et Zucc. Quimica Nova. 2009;32:1509-12.
13. Harborne J, Williams C. A chemotaxonomic survey of flavonoids and simple phenols in leaves of the Ericaceae. Botanical J. Linn. 1973;66:37-54.
14. Ueda K, Herz W, Pachter I. The Triterpenes of Befaria racemosa. Deparment of chemistry,The Florida State University. 1961;271-72.
15. Font Quer P. Plantas Medicinales, El Dioscórides Renovado Barcelona: Ediciones Península; 2001.
16. Talapatra B, Patra A, Sunil T. Terpenoids and alkaloids of the leaves of Tabernaemontana coronaria. Phytochemistry. 1975;14(7):1652-53.
17. Bhattacharyya J, Barros C. Triterpenoids of Cnidosculus urens. Phytochemistry. 1985;25(1):274-76.
18. Urrego O. Contribución al estudio fitoquimico de las especies Bejaria congesta, Bejaria aestuans y Bejaria resinosa. Bogota: 1988.
19. Prakash C, Bing-Nan Z, Shigie G, Shannon J, Sidney M. New lupane triterpenoids from Solidago canadensis that inhibit the lyase activity of DNA polymerase β. Bioorganic & Medicinal Chemistry. 2004;12(23):6271-75.
20. Godkil G, Topcu G, Sonmez U, Ulubelen A. Terpenoids and flavonoids from Salvia cyanescens. Phytochemistry. 1997;46(4):799-800.
21. Nguyen A, Malonne H, Duez P, Vanhaelen-Fastrea R, Vanhaelen M, Fontaine J. Cytotoxic constituents from Plumbago zeylanica. Fitoterapia. 2004;75(5):500-04.
22. Robinson F, Martel H. Betulinic acid from Arbutus menziesii. Phytochemistry. 1970;9(4):907-09.
23. Zhang B, LI HE X, Ding Y, Du G. Gaultherin, a natural salicylate derivative from Gaultheria yunnanensis: Towards a better non-steroidal anti-inflammatory drug. European Journal of Pharmacology. 2006;530:166-171.
24. Gournelis DC. Flavonoids of Erica verticillata. Journal of Natural Products. 1995;58:1065-69.
25. Tsanova F, Ribarova F, y Gerova M. (+)-Catechin and (-)-epicatechin in Bulgarian fruits. Journal of Food Composition and Analysis. 2005;18:691-698.
26. Vasco C, Riihinen K, Ruales J, Kamal A. Chemical composition and phenolic compound profile of Mortiño (Vaccinium floribundum Kuth). Journal of Agricultural and Food Chemistry. 2009;57:8274-8281.
27. Jimenez M, Chilpa R, Apan T, Lledias F, Hansberg W, Arrieta D. Antiinflammatory activity of cacalol and cacalona sesquiterpenes isolated from Psacalium decompositum. Journal of Ethnopharmacology. 2006;105:34-38.
28. Gonzalez E, Villca T, Loza R. Evaluacion de la actividad antiinflamatoria de ocho especies del genero Baccharis: B. articulata, B. dracunculifolia, B. salicifolia, B. ulcina, B. latifolia, B. pentlandii, B. obtusifolia, B. subalata. Revista Boliviana de Química. 2007;24:41-44.
29. Selloum L, Bouriche H, Tigrine C, Boudoukha C. Antiinflammatory effect of rutin on rat paw oedema, and on neutrophils chemotaxis and degranulation. URBAN & FISCHER. Exp Toxic Pathol. 2003;54:313-18.
30. Coskun O, Kanter M, Armutcu F, Cetin K, Kaybolmaz B, Yazgan O. Protective effects of quercetin, a flavonoid antioxidant, in absolute etanol induced. Eur. J. Med. 2004;1:37-42.
Recibido: 7 de julio de 2015.
Aprobado: 22 de abril de 2016.
Javier Andrés Matulevich Peláez: Universidad Distrital Francisco José de Caldas. Bogotá. Colombia. Correo electrónico: abeldg@infomed.sld.cu
 Todo el contenido de esta revista, excepto dónde está identificado, está bajo una Licencia Creative Commons
Todo el contenido de esta revista, excepto dónde está identificado, está bajo una Licencia Creative Commons