Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Plantas Medicinales
versión On-line ISSN 1028-4796
Rev Cubana Plant Med vol.22 no.1 Ciudad de la Habana ene.-mar. 2017
ARTÍCULO ORIGINAL
Actividad biológica de tres Curcuminoides de Curcuma longa L. (Cúrcuma) cultivada en el Quindío-Colombia
Biological activity of three curcuminoids from Curcuma longa L. (turmeric) grown in Quindío, Colombia
Leidy Lorena García Ariza, Jorge Humberto Olaya Montes Quim, Jorge Iván Sierra Acevedo, Leonardo Padilla Sanabria
Universidad del Quindío, Armenia, Quindío, Colombia.
RESUMEN
Introducción: Curcuma longa L. es una planta de la familia Zingiberaceae distribuida en las regiones tropicales y subtropicales, utilizada en la industria alimentaria, en medicina y en cosmética. Su colorante principal es la curcumina, un polifenol con múltiples efectos medicinales.
Objetivos: obtener, caracterizar químicamente y evaluar la actividad biológica de tres curcuminoides de C. longa, cultivada en el Quindío-Colombia.
Métodos: se purificaron tres curcuminoides (curcumina (C), demetoxicurcumina (DMC) y bisdemetoxicurcumina (BDMC) desde el rizoma de la planta, en estado seco, por cromatografía en columna y se caracterizaron por punto de fusión, espectroscopía infrarroja (IR), espectroscopía UV-vis y espectrometría de masas. Se evaluó la actividad antimicrobiana en bacterias y hongos por el método modificado de pozos de agar, la citotoxicidad sobre células BHK-21 por el método de bromuro de 3-(4,5- dimetiltiazol-2-ilo)-2,5-difeniltetrazol (MTT) y la toxicidad sobre Artemia salina. Finalmente se determinó el efecto de los curcuminoides en células BHK-21 infectadas con dengue virus 2.
Resultados: la curcumina presentó mayor punto de fusión (177,3 ºC-183,2 ºC). El espectro IR reveló los grupos funcionales característicos y el UV-vis indicó máximos de absorción para curcumina, demetoxicurcumina y bisdemetoxicurcumina de 419, 418 y 414 nm en cloroformo, respectivamente. El espectro de masas mostró m/z para C: 368, DMC: 338 y BDMC: 308. Se encontró actividad antimicrobiana frente a Staphylococcus aureus y Staphylococcus epidermidis, se determinó que BDMC presentó menor toxicidad y se evidenció mayor efecto inhibitorio sobre viriones infectivos de dengue con curcumina a 20 y 30 M.
Conclusiones: la caracterización de los compuestos confirma su composición como polifenoles, lo cual se relaciona a la actividad biológica de éstos, encontrándose principalmente que la curcumina altera la infección por virus dengue en cultivo celular. Esta investigación confirma la importancia de los principios activos de plantas con amplio espectro farmacológico como C. longa.
Palabras clave: Curcuma longa L.; curcuminoides; actividad antimicrobiana; citotoxicidad; Artemia salina; viriones infectivos de dengue.
ABSTRACT
Introduction: Curcuma longa L. is a plant from the family Zingiberaceae distributed in tropical and subtropical regions and used in the food industry, in medicine and in cosmetics. Its main coloring substance is curcumin, a polyphenol with many medicinal properties.
Objectives: Obtain, characterize chemically and evaluate the biological activity of three curcuminoids from C. longa grown in Quindío, Colombia.
Methods: Three curcuminoids (curcumin (C), demethoxycurcumin (DMC) and bisdemethoxycurcumin BDMC) from the rhizome of the plant were purified in a dry state by column chromatography and characterized by fusion point, infrared (IR) spectroscopy, UV-vis spectroscopy and mass spectrometry. Antimicrobial activity against bacteria and fungi was evaluated by the modified agar well method, cytotoxicity to BHK-21 cells by the 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide (MTT) method, and toxicity against Artemia salina. Finally, determination was made of the effect of the curcuminoids in BHK-21 cells infected with dengue virus 2.
Results: Curcumin had the highest fusion point (177.3 ºC-183.2 ºC). IR spectroscopy revealed the characteristic functional groups and UV-vis spectroscopy showed maximum absorption values for curcumin, demethoxycurcumin and bisdemethoxycurcumin of 419, 418 and 414 nm in chloroform, respectively. Mass spectrometry found that m/z values were C: 368, DMC: 338 and BDMC: 308. Antimicrobial activity was observed against Staphylococcus aureus and Staphylococcus epidermidis. BDMC was found to have lower toxicity. A greater inhibitory effect against infective dengue virions was observed with curcumin at 20 y 30 μM.
Conclusions: Characterization of the compounds confirms their polyphenolic composition, which manifests in their biological activity, mainly the capacity of curcumin to alter infection by dengue virus in cell cultures. The study corroborated the importance of the active principles of plants with a wide pharmacological spectrum, such as C. longa.
Keywords: Curcuma longa L.; curcuminoids; antimicrobial activity; cytotoxicity; Artemia salina; infective dengue virions.
INTRODUCCIÓN
Curcuma Longa L. es una planta herbácea de la familia Zingiberaceae originaria del sudeste asiático1,2 conocida comúnmente por sus propiedades medicinales en la medicina tradicional india.2 Son muchas las propiedades atribuidas a los extractos de C. longa y a su principal componente la curcumina. Esta planta es utilizada como aromatizante de alimentos, posee propiedades cosméticas, también ha sido utilizada en la protección y tratamiento de afecciones cutáneas, hepáticas, digestivas y contra parásitos intestinales, como remedio de venenos y de picaduras de serpientes.3
El rizoma de C. longa ha sido objeto de muchas investigaciones, se ha intentado encontrar sus principios activos con el fin de optimizar su actividad y de explicar su mecanismo de acción; se han preparado numerosos extractos, etanólicos, metanólicos y con distintos solventes para analizar sus actividades biológicas. La curcumina (diferuloilmetano) es la sustancia causante del color amarillo característico de los rizomas de esta planta, y es uno de los ingredientes activos responsable de su actividad biológica. La síntesis de este compuesto es conocida y su estructura fue determinada en 1910.3
Los reportes afirman que desde 1974 se conoce la actividad antibacteriana in vitro del extracto alcohólico de C. longa, de la curcumina y de sus aceites esenciales contra las bacterias Gram positivas. Asimismo, en 1987, se comprobó que la curcumina era bastante tóxica para Salmonella typhimurium, aunque no para Escherichia coli, y que tenía capacidad para alterar el ADN en presencia de luz visible. En 1978 se demostró la actividad antifúngica de la curcumina, así como del uso tópico del aceite de C. longa, en un experimento realizado en cobayas y en condiciones in vitro sobre varios aislados patológicos.3
Hasta la fecha se han reportado diversos estudios in vivo e in vitro que demuestran la actividad biológica de los curcuminoides.4-6 Se conocen reportes en los cuales extractos de la familia de las Zingiberaceas han presentado efecto sobre la actividad proteasa del virus dengue 2 (DENV-2),7 así como la inhibición del proteosoma de células de cáncer de colon por acción de la curcumina.8 Además ha sido reportado que la curcumina afecta la replicación de diferentes virus como Coxsackie, VIH, Herpes y Epstein-Barr.9-14 En estudios recientes se ha encontrado que la curcumina provoca varios efectos inhibitorios en células infectadas in vitro con DENV-2.15
De igual manera, investigaciones han señalado que al evaluar los curcuminoides como inductores de la apoptosis en células de carcinoma renal, se ha determinado mayor actividad por parte de los compuestos metoxilados (curcumina (C) y dimetoxicurcumina (DMC)), respecto a la bisdemetoxicurcumina (BDMC).16
C. longa cultivada en el departamento del Quindío también ha sido empleada en investigaciones previas, lo cual ha permitido que esta planta sea caracterizada en esta región. Entre estos estudios se encuentra la "Caracterización espectroscópica y cromatográfica de curcumina extraída de los rizomas de Cúrcuma (Curcuma longa L.) Cultivada en el departamento del Quindío".17 Otra investigación hecha corresponde al "Estudio del perfil de compuestos volátiles de los rizomas de la Curcuma longa L. Cultivada en el departamento del Quindío- Colombia", en la cual se determinó que el aceite esencial obtenido de la C. longa en la región del Quindío, en contraste con otros reportes, mostró un mayor contenido de ar-turmerona (36,94 %), curlona (18,96 %), alfa turmerona (13,66 %) y alto contenido de isómeros sesquiterpenoides con anillos ciclopentanil (6,11 %), confirmando que el aceite esencial de C. longa de esta región es diferente en su composición, dándole valor como objeto de estudio en futuras investigaciones con respecto a sus propiedades para ser utilizado en la industria alimentaria.18
Por lo anterior, en ésta investigación se tuvo como objetivo obtener, caracterizar químicamente y evaluar la actividad biológica de tres curcuminoides de C. longa cultivada en el departamento del Quindío-Colombia.
MÉTODOS
Obtención del material vegetal
El material vegetal (rizomas de Curcuma longa L.), fue donado al Laboratorio de Investigación de Diseño de Nuevos Productos de la Universidad del Quindío por la Asociación Bioagroindustrial (ASOBAI). Esta planta fue cultivada a 1294 m.s.n.m. en el corregimiento de Pueblo Tapao, municipio de Montenegro, departamento del Quindío, Colombia.17 Un ejemplar del espécimen vegetal utilizado reposa en el herbario de la Universidad del Quindío (HUQ) con el número 037533. Este estudio fue realizado conforme a las reglamentaciones y los principios éticos existentes para la investigación en animales, los estudios clínicos y los derechos de biodiversidad.
Preparación del material vegetal
El material vegetal luego de ser seleccionado fue lavado y secado en estufa de recirculación de aire a 38 °C durante 48 h, posteriormente se molió y se desengrasó mediante sistema soxhlet utilizando éter de petróleo durante 6 h.
Extracción, separación y purificación de los curcuminoides
El polvo del rizoma desengrasado se sometió a un sistema soxhlet con etanol al 96 % durante 6 h. El extracto se concentró a un volumen final de 25 mL, a éste se le realizó cromatografía en capa fina (CCF) utilizando sílica Gel F254 con una mezcla de cloroformo -acetato de etilo (7:1) como fase móvil para verificar la presencia de los curcuminoides, y posteriormente se realizó cromatografía en columna de vidrio para efectuar la separación de los mismos empleando sílica gel como fase estacionaria y cloroformo como fase móvil. Las fracciones con el mismo valor de RF fueron reunidas y pasadas a través de una columna de 0,5 cm de diámetro y 10 cm de longitud. A la fracción de cada compuesto separado se le realizó cromatografía preparativa con el fin de eliminar impurezas presentes y la presencia de otros colorantes.
Identificación de los curcuminoides
Cada uno de los curcuminoides separados fueron identificados mediante punto de fusión (en medidor de punto de fusión digital-IA9000 series-Electrothermal), espectroscopía IR (en espectrofotómetro FT-IR Thermo Nicolet Avatar 320 con pastillas de KBr), UV-vis (en espectrofotómetro UV-VIS HP-8453- D.A.D, con celda de cuarzo de 1 cm, empleando como solvente etanol y cloroformo) y espectrometría de masas (utilizando un cromatógrafo de gases acoplado a un espectrómetro de masas marca Shimadzu GCMS-QP2010).
Actividad antimicrobiana
Se empleó el método modificado de pozos de agar y se evaluaron los curcuminoides a 10.000 ppm, frente a Staphylococcus aureus, Staphylococcus epidermidis, Escherichia coli, Pseudomona aeruginosa, Candida albicans y Aspergillus niger. Se realizó frotis del inóculo de cada microorganismo sobre el agar y se perforó la superficie con un sacabocados con un diámetro de 2 mm. Seguidamente se depositó en éstos 10 μL de cada muestra a evaluar y luego de 15 min se incubaron las placas a 37 °C durante 24 h. Finalmente se midió el diámetro de los halos de inhibición. Como control positivo se utilizó ampicilina (Gram positivas), ciprofloxacina (Gram negativas) y fluconazol (hongos) y como control negativo dimetilsulfóxido (DMSO). Todos los análisis se realizaron por duplicado.
Citotoxicidad
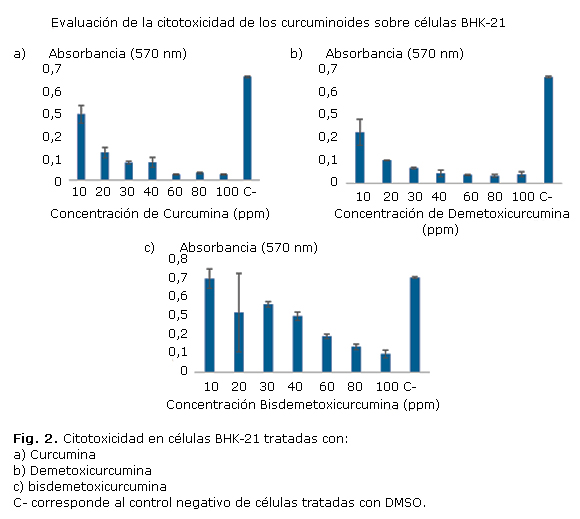
La determinación de la citotoxicidad de los compuestos se realizó por el método basado en la reducción metabólica del bromuro de 3-(4,5-dimetiltiazol-2-ilo)-2,5-difeniltetrazol (MTT) empleando 100 000 células BHK-21 por pozo, seguidamente se adicionaron las diferentes muestras de los curcuminoides a concentraciones de 10, 20, 30, 40, 60, 80, 100 ppm, disueltos en DMSO, se incubó a 37 °C y CO2 al 0,5 % durante 24 h, se adicionó MTT al 10 % en medio de cultivo, se incubó por 2 h bajo las mismas condiciones, seguidamente se disolvieron los cristales de formazán y se midió la absorbancia a 570 nm.
Dosis letal media (DL50)
Se emplearon 10 nauplios de Artemia salina, los cuales fueron expuestos a las muestras de los curcuminoides a las concentraciones de 1000, 750, 500, 250, 100, 50, 25,5 ppm. Sobre cada pozo de una placa de 24 pozos se adicionó 1 mL de solución salina con los nauplios, 1 mL de las diferentes concentraciones y se completó hasta 3 mL con solución salina adicionando una gota de suspensión de levadura disuelta en agua de mar (0,6 mg/mL). Finalmente se realizó el conteo de nauplios hasta la 72 h. Se realizó control para cada solución y cada muestra se evaluó por triplicado. Los resultados fueron procesados en el programa STATGRAPHICS versión 5.1, determinando el valor de DL50.
Evaluación del efecto de los curcuminoides frente a viriones infectivos de Dengue
Se utilizaron 100 000 células BHK-21 previamente infectadas con el virus dengue serotipo 2, a una multiplicidad de infección de 5. Seguidamente se adicionó cada uno de los curcuminoides en concentraciones de 10, 20 y 30 µM y se incubó a 37 °C y CO 2 al 5 % durante 24 h. Transcurrido este tiempo, los sobrenadantes fueron colectados y se realizó la técnica de recuento en placa para determinar el número de unidades formadoras de placa (UFP). Todos los ensayos se llevaron a cabo por triplicado. Como control positivo se utilizaron células infectadas no tratadas y como control negativo fue adicionado dimetilsulfóxido (DMSO), diluyente de los curcuminoides, a las células infectadas.
RESULTADOS
Separación y purificación de los curcuminoides
La cromatografía en capa fina demostró la separación adecuada de los curcuminoides con valores de factor de retención (RF) de 0,3, 0,15 y 0,05 para curcumina, demetoxicurcumina y bisdemetoxicurcumina, respectivamente, empleando cloroformo como fase móvil.
Identificación de los curcuminoides
Cada curcuminoide fue identificado por su punto de fusión, determinándose los siguientes rangos: 217 ºC-221,8 ºC para bisdemetoxicurcumina, 177,3 ºC-183,2 ºC para curcumina y 164,5 ºC-170,7 ºC para demetoxicurcumina.
Los espectros IR reportaron los grupos funcionales más relevantes de estos compuestos: OH (cerca de 3 500 cm-1), C= O (cerca de 1 627 cm -1, debilitada por la presencia de dobles enlaces), C= C (cercana a 1 508 cm-1), O-C de éter aromático (cerca de 1 280 cm-1), C-H con hibridación sp2 (entre 3 000 y 3 100 cm-1), C-H del grupo metilo y metileno (cerca de 2 850 y 2 929 cm -1) y CH3 (cerca de 1 375 cm-1). Las bandas anteriormente citadas se encontraron en los espectros IR de los tres curcuminoides, excepto la de C-O del éter aromático y la característica del grupo CH3 que no fueron registradas en el espectro de la bisdemetoxicurcumina, ya que esta molécula carece de dichos grupos. En cuanto a los espectros UV-vis, estos muestran máximos de absorción para la curcumina, demetoxicurcumina y bisdemetoxicurcumina de 425, 422 y 418 nm en etanol y 419, 418 y 414 nm en cloroformo, respectivamente. Por su parte, según el espectro de masas de la curcumina, se presenta un pico intenso que corresponde al ión molecular M+ (m/z: 368), al igual que se hace evidente el ión pico base m/z: 350; para la demetoxicurcumina, se observa el ión molecular M+ (m/z: 338) y el ión pico base m/z: 147 y para bisdemetoxicurcumina el ión molecular M+ (m/z: 308) y el ión pico base m/z: 147. Los resultados anteriores, según el espectro de masas, confirman el peso molecular de los tres curcuminoides evaluados (fig. 1).
Actividad antimicrobiana
Los tres curcuminoides presentaron actividad frente a S. aureus y S. epidermidis a 10 000 ppm, mientras que frente a las bacterias Gram negativas y los hongos no se observó efecto inhibitorio alguno. Por su parte, los controles utilizados funcionaron como era esperado, encontrando ausencia de inhibición por parte del DMSO e inhibición por parte del antibiótico. Los resultados se presentan en la tabla.
Citotoxicidad
El ensayo de citotoxicidad determinó menor efecto tóxico para las células por parte de la bisdemetoxicurcumina, seguido de la curcumina y de la demetoxicurcumina, respectivamente. Según los resultados encontrados, se presentó efecto dosis dependiente de la concentración con cada uno de los curcuminoides evaluados (fig. 2).
Dosis letal media (DL50)
Los valores de la DL50 fueron determinados a las 72 h, con base en la mortalidad de los nauplios de Artemia salina. Los resultados indicaron valores de DL50 para curcumina de 834 ppm, demetoxicurcumina DL50 640 ppm y bisdemetoxicurcumina de DL 50 982 ppm.
Evaluación del efecto de los curcuminoides frente al viriones infectivos de Dengue
Los resultados de este ensayo de tamizaje demuestran que la curcumina presenta un efecto sobre el virus dengue a las concentraciones de 20 y 30 µM, pues se evidencia ausencia de UFP en las diferentes diluciones. Adicionalmente, se encontró que la demetoxicurcumina solo tiene efecto a la concentración de 30 µM, hallándose 1 UFP/mL, respecto al control positivo (2 300 UFP/mL). Por su parte, la bisdemetoxicurcumina no causó efecto en ninguna de las concentraciones evaluadas, ya que se observaron UFP en las diferentes diluciones, siendo similares a las encontradas el control positivo del ensayo (400 UFP/mL) (fig. 3).
DISCUSIÓN
Identificación de los curcuminoides
En la identificación de los curcuminoides mediante CCF se evidenció valores de RF diferentes a los reportados por otros autores; 2,19,20 lo cual se relaciona con la fase móvil utilizada para la separación de los compuestos, ya que en esta investigación se utilizó mezcla de cloroformo-acetato de etilo (7:1) y generalmente ha sido empleada una mezcla de cloroformo: metanol (95:5)2,19 para tal fin.
Los valores de las absorciones para los curcuminoides, según los espectros UV-visible, son característicos de la presencia de múltiples enlaces p de estos compuestos; los datos encontrados de las absorciones máximas también son concordantes con lo que ha sido indicado en otras investigaciones.17,19,20
Los espectros de masas de los curcuminoides permitieron confirmar el peso molecular de los mismos, con base en el ión molecular (M+) según los cromatogramas obtenidos (m/z: 368, m/z: 338, m/z: 308 para curcumina, demetoxicurcumina y bisdemetoxicurcumina, respectivamente),17 lo cual demuestra la efectiva separación y purificación de los compuestos.
Actividad biológica de los curcuminoides
De acuerdo a los resultados de la actividad antimicrobiana, se encontró que los curcuminoides fueron activos contra las dos cepas de bacterias Gram positivas (S. aureus y S. epidermidis) y no frente a las bacterias Gram negativas, lo cual puede relacionarse con la diferencia que existe en la composición de la pared. Otros autores han reportado que la curcumina posee actividad frente a algunas bacterias Gram negativas, Gram positivas y hongos.21 Estudios recientes han demostrado que la curcumina presenta un efecto sinérgico con antibióticos importantes como la cefixima, vancomicina y tetraciclina frente a S. aureus y que la acción de este compuesto polifenólico está relacionada con el daño en la membrana de las bacterias.22 Es posible que el efecto observado esté relacionado con la presencia de grupos fenólicos en la estructura de los curcuminoides. Según lo que ha sido indicado, los fenoles son bactericidas a bajas concentraciones y causan daño a las membranas con pérdida de los constituyentes citoplasmáticos, inactivando irreversiblemente las oxidasas y deshidrogenasas de la membrana y produciendo desnaturalización de las proteínas.5 El pequeño diámetro de los halos de inhibición encontrados, respecto al control positivo, puede atribuirse a la baja difusión de los curcuminoides debido a su carácter hidrofóbico, lo cual también explica la evaluación de altas concentraciones de los compuestos para evidenciar el efecto sobre los microorganismos, como ha sido indicado por Tyagi y colaboradores.22
En la determinación de la citotoxicidad de los curcuminoides, se evidenció menor efecto sobre las células por parte de la bisdemetoxicurcumina, seguido de la curcumina y de la demetoxicurcumina, respectivamente; demostrándose un comportamiento dosis dependiente de los compuestos sobre la viabilidad celular (fig. 2). El mismo efecto fue determinado en los análisis de toxicidad, confirmando la baja acción de la bisdemetoxicurcumina entre los tres curcuminoides evaluados.
Así mismo, los ensayos frente a viriones infectivos de dengue indicaron que la curcumina presentó actividad a 20 y 30 µM y DMC a 30 µM, mientras que BDMC fue el único compuesto que no presentó efecto antiviral, ya que existen UFP en todas las concentraciones evaluadas (10, 20 y 30 µM), similares a las apreciadas en el control positivo (400 UFP/mL) (fig. 3). Moghadamtousi y colaboradores han señalado que la curcumina presenta un amplio rango de actividad antiviral, actuando sobre la replicación de virus como Coxsackie, VIH, Herpes y Epstein-Barr;9-14 por su parte, Tan Siew y colaboradores reportaron que el extracto metanólico de C. longa presenta efecto inhibitorio frente a NS2B/NS3 del virus dengue8 y Padilla y colaboradores han indicado que la curcumina provoca varios efectos inhibitorios en células infectadas in vitro con DENV2.15
La diferencia en la actividad de los curcuminoides puede verse relacionada con la estructura química de los mismos. En estudios previos se ha evaluado la interacción entre moléculas como la curcumina y componentes celulares, y ha sido reportado que los carbonos de los dos grupos carbonilo de esta molécula son altamente susceptibles a un ataque nucleofílico, además de que los grupos hidroxilo expuestos de la curcumina podría potencialmente formar enlaces de hidrógeno con los aminoácidos circundantes.8 Así mismo, ensayos con análogos sintéticos de la curcumina como la dimetoxicurcumina (DiMC), que posee cuatro grupos metoxilos, han demostrado un comportamiento similar al del curcuminoide original, aunque el análogo presenta mayor estabilidad metabólica; además de que los grupos carbonilos α, β-insaturados pueden ser importantes para la actividad.23
Lee y colaboradores han señalado que la actividad para inducir apoptosis en células Caki (células de carcinoma renal humano) es alta para DiMC, intermedia para C y más baja para BDMC, con lo cual se sugiere que los grupos metoxilo contribuyen a la mejora de la apoptosis. Por su parte, es posible que la diferencia en la eficacia de los análogos de la curcumina pueda estar asociada con sus diferentes estabilidades metabólicas, así como a la variación en la permeabilidad de los compuestos a través de la membrana celular, probablemente debido al número de grupos metoxilo hidrofóbicos.16Además, Revathy y colaboradores han señalado que el mejor inhibidor de células MCF-7 fue DMC, comparado con C y BDMC, lo cual también ha sido evidenciado en otros estudios sobre sistemas biológicos.2,24
De igual manera, Feng y colaboradores reportaron la evaluación de la actividad biológica de algunos derivados de los curcuminoides, indicando que aquellos con usencia de grupo metoxilo presentaban menor actividad. Adicionalmente, fue señalado que el compuesto metoxilado 7 g exhibía mayor actividad antioxidante que los curcuminoides y se reportó que la actividad antibacteriana de este compuesto fue cinco veces mejor que de la ampicilina a concentraciones similares.25
Los resultados destacan la importancia de caracterizar compuestos extraídos directamente de la especie, lo cual ha permitido relacionarlos con su actividad biológica y resaltar las diversas propiedades que poseen.
Finalmente se puede afirmar que la caracterización de los compuestos confirma su composición como polifenoles, lo cual se relaciona a la actividad biológica de éstos, encontrándose principalmente que la curcumina altera la infección por virus dengue en cultivo celular. Esta investigación confirma la importancia de los principios activos de plantas con amplio espectro farmacológico como C . longa.
AGRADECIMIENTOS
Los autores agradecen al grupo de Agroindustria de Frutas Tropicales, al grupo de Inmunología Molecular (GYMOL) y al Centro de investigaciones Biomédicas de la Universidad del Quindío.
REFERENCIAS BIBLIOGRÁFICAS
1. Cos PS De, Carril EP. Cúrcuma I (Curcuma longa L.). Reduca (Biología). Serie Botánica. 2014;7(2):84-99.
2. Revathy S, Elumalai S, Benny M, Antony B. Isolation, Purification and Identification of Curcuminoids from Turmeric (Curcuma longa L.) by Column Chromatography. Journal of Experimental Sciences. 2011;2(7):21-5.
3. Mesa M, Ramírez M, Aguilera C A. Ramírez A y Gil A. Efectos farmacológicos y nutricionales de los extractos de Cúrcuma longa L. y de los curcuminoides. Ars Pharmaceutica. 2000;41(3):307-21.
4. Guo LY, Cai XF, Lee JJ, et al. Comparison of Suppressive Effects of Demethoxycurcumin and Bisdemethoxycurcumin on Expressions of Inflammatory Mediators In Vitro and In Vivo. Arch Pharm Res. 2008;31(4):490-6.
5. Huang M, Ma W, Lu Y, et al. Effects of curcumin, demethoxycurcumin, bisdemethoxycurcumin and tetrahydrocurcumin on 12-0-tetradecanoylphorbol-13-acetate-induced tumor promotion. Carcinogenesis. 1995;16(10):2493-7.
6. Jayaprakasha GK, Rao LJ, Sakariah KK. Food Chemistry Antioxidant activities of curcumin, demethoxycurcumin and bisdemethoxycurcumin. Food Chemistry. 2006;98:720-4.
7. Siew Tan, Pippen R, Yusof R, et al. Screening of selected zingiberaceae extracts for dengue-2 virus protease inhibitory activities. Sunway Academic Journal. 2006;7:1-7.
8. Milacic V, Banerjee S, Landis-piwowar KR. Curcumin Inhibits the Proteasome Activity in Human Colon Cancer Cells In vitro and In vivo Curcumin Inhibits the Proteasome Activity in Human Colon Cancer Cells In vitro and In vivo. Cancer Res. 2008;7283-92.
9. Si X, Wang Y, Wong J, Zhang J, Mcmanus BM, Luo H. Dysregulation of the Ubiquitin-Proteasome System by Curcumin Suppresses Coxsackievirus B3 Replication. J Virol. 2007;81(7):3142-50.
10. Pommier Y, Johnson AA, Marchand C. Integrase inhibitors to treat HIV/AIDS. Nat Rev Drug Discov. 2005;4:236-48.
11. Mazumder A, Raghavan K, Weinstein J, Kohn KW, Pommier Y. Inhibition of human immunodeficiency integrase by curcumin virus type-l. Biochem Pharmacol. 1995;49(8):1165-70.
12. Kutluay SB, Doroghazi J, Roemer ME, Triezenberg SJ. Curcumin inhibits herpes simplex virus immediate-early gene expression by a mechanism independent of p300/CBP histone acetyltransferase activity. Virology. 2008;373:239-47.
13. Hergenhahn M, Soto U, Weninger A, Polack A, Hsu C. The Chemopreventive Compound Curcumin Is an Ef ® cient Inhibitor of Epstein-Barr Virus BZLF1 Transcription in Raji DR-LUC Cells. Mol Carcinog. 2002;145:137-45.
14. Moghadamtousi SZ, Kadir HA, Hassandarvish P, Tajik H, Abubakar S, Zandi K. A Review on Antibacterial, Antiviral, and Antifungal Activity of Curcumin. Biomed Res Int. 2014;2014.
15. Padilla L, Rodriguez A, González MM, Gallego JC, Castaño JC. Inhibitory effects of curcumin on dengue virus type 2-infected cells in vitro. Arch Virol. 2014:573-9.
16. Lee JW, Hong HM, Kwon DD, Pae H, Jeong HJ. Dimethoxycurcumin, a Structural Analogue of Curcumin, Induces Apoptosis in Human Renal Carcinoma Caki Cells Through the Production of Reactive Oxygen Species, the Release of Cytochrome c, and the Activation of Caspase-3. Korean J Urol 2010;(Cyt c):870-8.
17. Rios E, Duque AL, Leon DF. Caracterización espectroscópica y cromatográfica de curcumina extraída de los rizomas de Cúrcuma (Curcuma Longa L.) Cultivada en el departamento del Quindío Spectroscopy and chromatography characterization of curcumin extracted from the rhizome of turmeric crops in the department of Quindío (Colombia). Revista de investigaciones Universidad del Quindío. 2009;(19):18-22.
18. Ríos E, Giraldo GA, Leon DF, Moreno A. Estudio del perfil de compuestos volátiles de los rizomas de Curcuma longa l. Cultivada en el departamento del Quindío-Colombia. Revista de Investigaciones, Universidad del Quindío. 2008;32-7.
19. Megalathan A, Kumarage S, Dilhari A, Weerasekera MM, Samarasinghe S. Natural curcuminoids encapsulated in layered double hydroxides : a novel antimicrobial nanohybrid. Chem Cent J. 2016:1-10.
20. Jha NN, Ghosh D, Das S, et al. Effect of curcumin analogs on α -synuclein aggregation and cytotoxicity. Nat Publ Gr. 2016;1-15.
21. Song J, Choi B, Jin E, Yoon Y, Choi K. Curcumin suppresses Streptococcus mutans adherence to human tooth surfaces and extracellular matrix proteins. Eur J Clin Microbiol Infect Dis. 2012:1347-52.
22. Tyagi P, Singh M, Kumari H, Kumari A, Mukhopadhyay K. Bactericidal Activity of Curcumin I Is Associated with Damaging of Bacterial Membrane. PLoS One. 2015;1-15.
23. Nutr JCB, Jeong S, Oh G, et al. Synthetic Curcumin Analogue, Induces Heme Oxygenase-1 Expression through Nrf2 Activation in RAW264. 7 Macrophages. J Clin Biochem Nutr. 2009;1:79-84.
24. Simon A, Allais DP, Duroux JL, Basly JP, Durand-fontanier S, Delage C. Inhibitory effect of curcuminoids on MCF-7 cell proliferation and structure - activity relationships. Cancer Lett. 1998;129:111-6.
25. Feng L, Li Y, Song Z, Li H, Huai Q. Synthesis and Biological Evaluation of Curcuminoid Derivatives. Chem. Pharm Bull (Tokyo). 2015;63(11):873-81.
Recibido: 24 de noviembre de 2016.
Aprobado: 19 de enero de 2017.
Leidy Lorena García Ariza. Universidad del Quindío, Armenia, Quindío, Colombia. Correo electrónico: llgarcia@uniquindio.edu.co