Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Plantas Medicinales
versión On-line ISSN 1028-4796
Rev Cubana Plant Med vol.22 no.1 Ciudad de la Habana ene.-mar. 2017
ARTÍCULO ORIGINAL
Estudio fitoquímico preliminar y evaluación de la actividad antibacteriana del Solanum Dolichosepalum Bitter (Frutillo)
Preliminary phytochemical study and evaluation of the antibacterial activity of Solanum Dolichosepalum Bitter (frutillo)
Alexander Ramírez Cárdenas, Gustavo Isaza Mejía, Jorge E. Pérez Cárdenas, Maby M. Martínez Garzón
Universidad de Caldas. Manizales. Colombia.
RESUMEN
Introducción: Solanum dolichosepalum Bitter, llamada comúnmente frutillo, es tradicionalmente usada en Colombia como antibacteriano, antiinflamatorio, cicatrizante y en enfermedades renales. La escasa información en bases de datos sobre la planta en estudio no permitió referenciar un mayor número de artículos actuales.
Objetivo: evaluar la actividad antibacteriana de extractos obtenidos del fruto de S. dolichosepalum y realizar un estudio fitoquímico preliminar.
Método: la actividad antimicrobiana fue evaluada a partir de cuatro fracciones (F) obtenidas del extracto etanólico de los frutos secos deS. dolichosepalum frente a cepas deEscherichia coli, Staphylococcus aureus y Pseudomona aeruginosa por el método de Kirby-Bauer. La primera fracción se sometió a cromatografía en columna y a sus fracciones se les evaluó la concentración inhibitoria mínima (MIC) por el método de microdilución. Los metabolitos responsables de la actividad antimicrobiana se identificaron por cromatografía de capa delgada en placas de sílica gel (MERCK) y lámpara ultravioleta (365nm). Se realizó finalmente un estudio fitoquímico del extracto etanólico de los frutos para evaluar la presencia de metabolitos bioactivos.
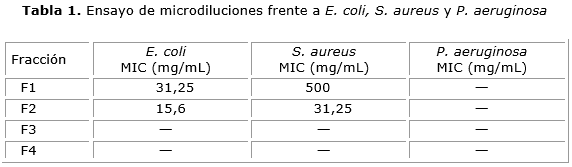
Resultados: las pruebas fitoquímicas del extracto etanólico revelaron la presencia de alcaloides, esteroides y/o triterpenoides libres, taninos, saponinas, flavonoides y glucósidos cardiotónicos. De las cuatro fracciones obtenidas a partir de este extracto, las fracciones F1 y F2 tuvieron MIC de 31,25 y 15,62 mg/mL, respectivamente frente a E. coli y de 500 y 31,25 mg/mL frente a S. aureus. F3 y F4 no presentaron inhibición y ninguna fracción tuvo actividad frente a P. aeruginosa. Las fracciones obtenidas por cromatografía en columna a partir de F1 se denominaron F1A, F1B, F1C y F1D; la fracción F 1B mostró la mayor actividad antimicrobiana, con MICs de 35 y 17,5 mg/mL frente a S. aureus y E. coli respectivamente.
Conclusiones: los resultados obtenidos confirman el uso tradicional delS. dolichosepalum como antibacteriana, con actividad frente a E. coli y S. aureus.
Palabras clave: Solanum dolichosepalum Bitter; actividad antibacteriana; fitoquímica preliminar.
ABSTRACT
Introduction: Solanum dolichosepalum Bitter, commonly known as frutillo, has been traditionally used in Colombia as antibacterial, antiinflammatory and cicatrizant, and to treat renal disease. Due to the scant information about the study plant contained in databases, it was not possible to reference a larger number of current papers.
Objective: Evaluate the antibacterial activity of extracts obtained from the fruit of S. dolichosepalum and conduct a preliminary phytochemical study.
Method: The Kirby-Bauer method was applied to four fractions (F) obtained from the ethanolic extract of dry fruits of S. dolichosepalum to evaluate antimicrobial activity against strains ofEscherichia coli, Staphylococcus aureus and Pseudomona aeruginosa. The first fraction underwent column chromatography and its fractions were tested for minimum inhibitory concentration (MIC) using the microdilution method. Metabolites responsible for antimicrobial activity were identified by thin layer chromatography on silica gel plates (MERCK) with an ultraviolet lamp (365 nm). Finally, a phytochemical study was conducted of the ethanolic extract of the fruits to determine the presence of bioactive metabolites.
Results: Phytochemical testing of the ethanolic extract revealed the presence of alkaloids, steroids and/or free triterpenoids, tannins, saponins, flavonoids and cardiotonic glucosides. Of the four fractions obtained from the extract, fractions F1 and F2 had an MIC of 31.25 and 15.62 mg/mL, respectively, against E. coli, and 500 and 31.25 mg/mL against S. aureus. F3 and F4 did not show any inhibition, and no fraction displayed any activity against P. aeruginosa. The fractions obtained by column chromatography from F1 were named F1A, F1B, F1C and F1D. Fraction F1B showed the highest antimicrobial activity, with MICs of 35 and 17.5 mg/mL against S. aureus and E. coli, respectively.
Conclusions: The results obtained confirm the validity of the traditional use ofS. dolichosepalum as antibacterial, with activity against E. coli and S. aureus.
Keywords: Solanum dolichosepalum Bitter; antibacterial activity; preliminary phytochemical study.
INTRODUCCIÓN
Desde el auge de los antibióticos a finales de la década del 40 en el siglo pasado, el uso de derivados vegetales como agentes antimicrobianos ha sido escaso, a causa principalmente de la fuerte presión de la industria farmacéutica a favor de los productos sintéticos, semisintéticos o los obtenidos por fermentación de hongos, fácilmente patentables.1 El uso tradicional de plantas medicinales para el tratamiento de infecciones bacterianas las han convertido en una fuente importante de compuestos antimicrobianos.2,3 En el Vademécum colombiano de plantas medicinales, es muy bajo el número de plantas con indicaciones antimicrobianas (Hyptis capitata Jacq, Solanum nigrum Linn, Jacaranda caucana Pittier y Solanum lycopersicum Linn); lo que motiva a explorar con más detalle la flora colombiana y realizar estudios etnofarmacológicos adicionales para ampliar el arsenal antimicrobiano.
Especies del género Solanum tradicionalmente se han empleado en otros países para tratar algunas enfermedades. Solanum incanum Linn, S. nigrum, y Solanum violaceum Linn, son usadas en Asia como antibacterianas, en procesos inflamatorios, diabetes y desórdenes bucales.4,5 En Brasil Solanum stramonifolium Jacq como antidiarreico y Solanum licocarpum St. Hill como hipoglucemiante.6 En Centro y Suramérica Solanum nigrescens Mart. & Gal. (Hierba Mora) se utiliza para tratar infecciones cutáneas como acné, abscesos, úlceras.7 Otra solanácea-no tan común- es Solanum dolichosepalum Bitter, llamada popularmente frutillo, es una planta espontánea de bosque húmedo de la Cordillera Central de Colombia. Empíricamente se emplean sus hojas y frutos como cicatrizante, para tratar la pediculosis, en enfermedades renales, como antiinflamatorio y antibiótico.8 En la literatura revisada no se encontraron reportes de estudios sobre la actividad antibacteriana de los frutos de S. dolichosepalum.
El objetivo de esta investigación es realizar un estudio fitoquímico y determinar las propiedades antibacterianas de los frutos de S. dolichosepalum sobre S. aureus, E. coli y P. aeruginosa.
MÉTODOS
Material vegetal
Se utilizaron los frutos de la planta S. dolichosepalum recolectada en el departamento del Valle del Cauca, zona rural del municipio de Cartago, finca El Guayabo, vereda Coloradas a una altura de 1.200 m.s.n.m. y una temperatura promedio de 22 °C. La especie fue clasificada en el Herbario del Departamento de Botánica de la Facultad de Ciencias Agropecuarias de la Universidad de Caldas, con el número de barras 8755.
Los frutos maduros fueron lavados con agua bidestilada, secados a 40 °C y pulverizados; se pesaron 400 g y se maceraron por 72 h en etanol al 95 %; el filtrado se roto-evaporó y los residuos de solvente se evaporaron a 40 °C; el rendimiento fue de 2,4 %. El extracto seco se sometió a extracción con solventes de diferente polaridad usando éter de petróleo, mezcla de acetato de etilo-agua (1:1), alcohol n-butílico y agua de las que se obtuvo las fracciones F1, F2, F3 y F4 con rendimientos del 0,55; 0,78; 0,45 y 0,28 % respectivamente.
Evaluación de la actividad antibacteriana de las cuatro fracciones
Se utilizaron cepas certificadas de S. aureus ATCC 25923, E. coli ATCC 25922 y P. aeruginosa ATCC 27853. Las fracciones obtenidas se reconstituyeron con dimetil sulfóxido (DMSO) a una concentración de 500 mg/mL. El ensayo microbiológico de los extractos se realizó primero por el método de Kirby Bauer. Se incubó a 37 °C por 18 h y los halos de inhibición se compararon con los obtenidos con gentamicina (control de inhibición 0,1 mg/mL, SIGMA®); el control de reactivo se hizo con DMSO.9 Para la determinación de la Concentración Inhibitoria Mínima (MIC) se utilizó el método de microdilución preparando extractos en DMSO a una concentración de 1 g/mL, sobre una placa de microtitulación estéril de 96 pozos, se agregó 0,1 mL de caldo Müeller Hinton a todos los pozos de la placa con excepción de los pozos A; en estos pozos se colocaron 0,1 mL de las fracciones diluidas con DMSO; en los pozos B se colocaron también 0,1 mL de dichas fracciones y a partir de estos pozos se hicieron diluciones seriadas hasta obtener una concentración de 3,9 mg/mL; a cada pozo se le agregó 0,1 mL de la cepa bacteriana a probar en una concentración de 1,5 × 108 UFC/mL, obteniendo diluciones a la mitad de su concentración. Cada fracción se probó por triplicado para cada especie bacteriana utilizada.
La placa de microdilución se incubó a 37 °C por 24 h. El color oscuro de las fracciones no permitió realizar lecturas espectrofotométricas ni visuales para establecer el crecimiento bacteriano; por tal razón, 0,01 mL de cada pozo se inoculó en cajas de Petri con agar Müeller Hinton. Se consideró que la MIC correspondía a aquella dilución hasta la cual hubo una inhibición igual a la del control de inhibición. Se realizaron cuatro controles: control de crecimiento bacteriano o C+ (medio e inóculo); control de reactivos (DMSO), control de esterilidad (Müeller-Hinton) y el control de inhibición (gentamicina a 0,1 mg/mL).
Separación cromatográfica de F1
Se empleó una columna de 2,7 cm de diámetro por 33,5 cm de largo, empacada con sílica gel (0,2-0,5 mm, MERCK). La muestra F1 (una de las fracciones más activas) se sembró y se eluyó inicialmente con 200 mL de una mezcla de éter de petróleo-acetato de etilo (2:1), seguida por 150 mL de cloroformo y finalmente con 150 mL de metanol.
Durante el desarrollo de la cromatografía de columna (CC), se obtuvieron 290 fracciones en volúmenes entre 2-3 mL; para confirmar la presencia de los metabolitos, se utilizó cromatografía en capa delgada (CCD) utilizando una mezcla de solventes en proporciones 1:1:1:2 de éter de petróleo-acetato de etilo-metanol-cloroformo respectivamente.
De las fracciones obtenidas se realizaron diluciones seriadas y sus MICs se determinaron por el método de microdilución descrito anteriormente. En este procedimiento se emplearon los controles anteriormente mencionados y los respectivos blancos con los solventes usados en cromatografía.
Estudio fitoquímico preliminar
Para identificar los grupos de metabolitos secundarios presentes en S. dolichosepalum se utilizó el protocolo descrito por Sanabria.10
RESULTADOS
En la tabla 1 se presentan los ensayos por microdilución de la actividad antibacteriana de las fracciones F1, F2, F3 y F4 frente a E. coli, S. aureus y P. aeruginosa.
Fracciones por cromatografía de columna a partir de la fracción F1
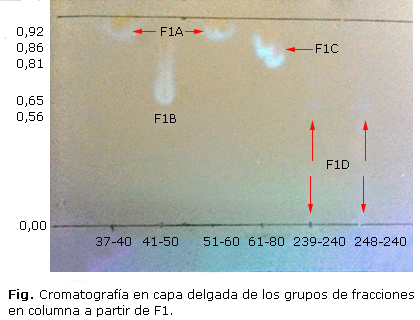
Se obtuvieron 4 fracciones (F1A, F1B, F1C y F1D) a las que se les determinó su MIC, -diluidas previamente en (DMSO)- obteniendo las siguientes concentraciones; F1A= 600 mg/mL; F1B= 70 mg/mL; F1C= 747 mg/mL y F1D= 45 mg/mL (Fig.). Se realizaron diluciones a concentraciones de hasta 4,7 mg/mL para F1A, 0,55 mg/mL para F1B, 5,8 mg/mL para F 1C y 0,78 mg/mL para F1D.
La tabla 2 describe las fracciones recolectadas por CC y los factores de retención (Rf) obtenidos a partir de F1 en CCD.
En la tabla 3 se observan los resultados obtenidos y la MIC de las fracciones cromatográficas obtenidas a partir de F1. La fracción F1B presentó mayor actividad inhibitoria de S. aureus y E. coli, seguida de la fracción F1A que tuvo mayor capacidad de inhibir el crecimiento de E. coli y de la fracción F1C que tuvo mayor actividad frente a S. aureus. La concentración probada de la fracción F1D no inhibió ninguna de las cepas bacterianas evaluadas.
Tamizaje fitoquímico preliminar de los frutos de S. dolichosepalum
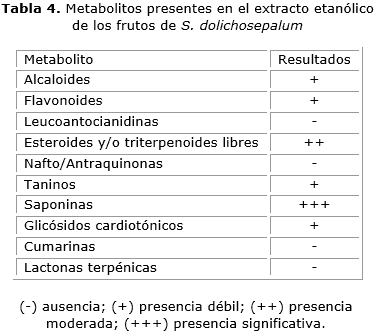
Los resultados obtenidos en el tamizaje fitoquímico de los frutos del S. dolichosepalum, muestran la presencia cualitativa de algunos grupos de metabolitos secundarios como saponinas, alcaloides, esteroides y/o triterpenoides, taninos y glicósidos cardiotónicos (tabla 4).
DISCUSIÓN
El estudio fitoquímico preliminar permitió identificar que el fruto de S. dolichosepalum contiene alcaloides, flavonoides, esteroides y/o triterpeniodes libres, taninos, saponinas y glicósidos cardiotónicos. Por las características químicas de estos compuestos y por la afinidad química a los diferentes solventes usados, se podría inferir en qué fracciones predominan algunos de estos metabolitos. La fracción F1 obtenida con éter de petróleo podría contener terpenoides y esteroides. F2 que se obtuvo con Acetato de etilo podría contener alcaloides y saponinas; F3 obtenida con n-butanol posiblemente contiene flavonoides y taninos y F4 una mezcla de glicósidos cardiotónicos, flavonoides y taninos ya que esta fracción se obtuvo con una solución acuosa.
Zubair, al estudiar la actividad antibacteriana de S. nigrum frente a S. aureus y E. coli, encontró que los extractos obtenidos con n-hexano (equivalente a éter de petróleo en nuestro estudio) y acetato de etilo, presentaron mayor actividad frente a estas bacterias. La fracción de hexano inhibió ambas bacterias en concentraciones de 80 y 258 mg/mL respectivamente; mientras que la fracción de acetato de etilo produjo inhibición a concentraciones de 34,8 y 98,2 mg/mL respectivamente.5 En la presente investigación la fracción de acetato de etilo o F2, mostró una inhibición similar a la obtenida con S. nigrum frente a S. aureus (31,25 mg/mL), mientras que la fracción de éter de petróleo o F1, presentó MICs de 500 mg/mL; en cuanto a E. coli, las MIC de los extractos de S. dolichosepalum (F1= 31,25 y F2= 15,6 mg/mL) fueron menores a las obtenidas con S. nigrum. Estudios hechos por Sheeba usando un extracto etanólico de Solanum surattense Burm, demuestran al igual que en nuestro estudio una mayor sensibilidad de E. coli, comparada con S. aureus, además de no mostrar inhibición contra P. aeruginosa.11
De las fracciones obtenidas a partir de F1, la F1B presentó mayor actividad antibacteriana frente a E. coli. La CCD de esta muestra (usando la mezcla éter de petróleo: acetato de etilo: metanol: cloroformo en una proporción 1:1:1:2), permite proponer que la fracción contiene mayoritariamente terpenoides y esteroides (por su baja migración con respecto a las demás fracciones F1).
Cowan1 & Mazandarani,12 señalan que los terpenoides tienen un alto grado de efectividad frente a bacterias, hongos, virus y protozoos y según el hallazgo del metabolito en nuestra especie estudiada, es posible pensar que éste podría haber contribuido a desencadenar el efecto antibacteriano. Según un estudio realizado por Maguna, E. coli es más sensible a los terpenoides que S. aureus,13 lo que según Cox et al., puede ser explicado por los posibles mecanismos de incremento en la permeabilidad y desestabilización de la membrana de bacterias Gram negativas.14 Esto es coherente con los resultados obtenidos en los nuestros ensayos de microdilución, donde se obtuvo una mayor actividad antibacteriana frente E. coli en comparación con S. aureus.
Las fracciones F1A y F1C también presentaron actividad antibacteriana y la migración de sus manchas permite suponer que contienen mayoritariamente metabolitos más polares (saponinas y alcaloides) que F1B a causa de las características químicas de los solventes utilizados. Kannabiran K. et al, reportan que la fracción de saponina de Solanum xanthocarpum Linn, inhibió el crecimiento de S. aureus y E. coli con diámetros de inhibición de 21 y 17 mm respectivamente, presentando una mayor actividad frente a la especie Gram positiva;15 Martínez et al, al hacer ensayos similares con la saponina de esta planta, solo encontraron actividad frente S. aureus con halos de inhibición de hasta 12 mm correspondientes a una concentración de 200 mg/mL a partir de un extracto etanólico.16 Los resultados anteriores comparados con los obtenidos en las pruebas preliminares de la presente investigación, muestran diferencias en la capacidad de inhibición de los diferentes extractos obtenidos. Frente a E. coli mostró halos de inhibición de (18 mm para F1 y 12 mm para F2 a concentraciones de 250 y 125 mg/mL respectivamente) y S. aureus (13 mm y 12 mm, a concentraciones de 500 y 250 mg/mL respectivamente), lo que se debe probablemente a la mezcla de metabolitos y concentraciones variables de saponinas presentes en las fracciones F1 y F2. Es importante destacar que probablemente F1A y F1C también pueden contener alcaloides, que según destacan Alarcón L et al. y Cowan, poseen propiedades antibacterianas;17,1 por otro lado Sanabria et al. proponen que la actividad de estos compuestos se relaciona directamente con la concentración de los mismos.10
La fracción F1D fue obtenida con metanol; por tal razón es posible que allí se encuentren metabolitos como taninos, glucósidos y flavonoides; en nuestro estudio esta fracción no presentó actividad antibacteriana, posiblemente asociado a las bajas concentraciones de estos metabolitos en el análisis fitoquímico. No obstante, Tiwari et al, reportan una buena presencia de flavonoides en la especie Solanum melongena Linn, obteniendo actividad antibacteriana frente S. aureus y E. coli, aunque ellos evaluaron el extracto metanólico y no fracciones.18
En la literatura revisada no se encontró reportes de la actividad antibacteriana de los esteroides de origen vegetal frente a las especies bacterianas evaluadas en esta investigación.
Al realizar la separación cromatográfica de la fracción F1, aumenta la capacidad inhibitoria de tres de las cuatro fracciones obtenidas con respecto a las fracciones no cromatográficas; este cambio en la MIC, puede estar indicando que es posible una inhibición de la actividad antimicrobiana por la presencia de moléculas que pueden estar inactivando la acción de los metabolitos que son eluidos en esta fracción. También es posible que el proceso cromatográfico haya concentrado el metabolito, potenciando la actividad antimicrobiana sobre ambas bacterias.
Los resultados obtenidos en esta investigación confirman la acción antibacteriana que empíricamente se ha atribuido a S. dolichosepalum.
Arango et al., en estudios realizados utilizando hojas de esta misma planta han demostrado también la presencia de metabolitos activos frente a S. aureus a concentraciones de 250 mg/mL y ausencia da acción antimicrobiana frente a E. coli a concentraciones de 500 mg/mL;19 si se comparan los resultados con los extractos no cromatográficos de esta investigación, se observa que los resultados para S. aureus son muy similares; sin embargo, frente a E. coli hay diferencias importantes que podrían estar asociadas con el tipo de componente activo o la concentración del mismo ya que aunque en ambos estudios se partió de un extracto etanólico, en el presente se realizaron extracciones líquido-líquido, con solventes de diferente polaridad (éter de petróleo, acetato de etilo, n- butanol y agua).
El estudio realizado sobre S. dolichosepalum evidencia la actividad antibacteriana de la especie, la que tiene relación con S. nigrum y S. lycopersicum; dos de las cuatro especies del mismo género con tal actividad, que registra el Vademécum colombiano de plantas medicinales. Esto permite concluir que el género es rico en metabolitos secundarios con actividad antibacteriana y debería analizarse su inclusión en este Vademécum.
Finalmente, es necesario profundizar en el reconocimiento de las estructuras químicas de los metabolitos secundarios para establecer con certeza su naturaleza química y en el uso de otras técnicas que permitan relacionar la estructura, con la actividad antibacteriana encontrada.
Los resultados obtenidos confirman el uso tradicional delS. dolichosepalum como antibacteriana, con actividad frente a E. coli y S. aureus.
El apoyo financiero que sustentó este trabajo fue otorgado por la Universidad de Caldas, Manizales. Caldas (Colombia).
Módulos y anexos:
- Ministerio de la Protección Social. Dirección general de salud pública Vademécum de Plantas Medicinales Colombiano. República de Colombia (Ed). Arte y Sistemas Integrados. Bogotá D.C. 2008:1-23.
- Programa Iberoamericano de Ciencia y Tecnología para el Desarrollo, CYTED (Ed). Manual de Técnicas de Investigación. Técnicas Cuantitativas. Cálculo de la MIC (Concentración Mínima Inhibitoria), Santa Fé de Bogotá, 1995;69,70,73,74.
- República de Colombia, Ministerio de Salud, Dirección de Desarrollo Científico y Tecnológico. Título IV; De la bioseguridad de las investigaciones. En: Dirección de desarrollo científico y tecnológico (ed). Normas científicas, técnicas y administrativas para la investigación en salud, resolución N. 008430 de 1993. Santafé de Bogotá, D.C: 26-29.
REFERENCIAS BIBLIOGRAFICAS
1. Cowan MM. Plants products as antimicrobial agents. Clin Microbiol Rev. 1999;14:564-84.
2. Maroyi A. Traditional use of medicinal plants in south-central Zimbabwe: review and perspectives. J Ethnobiol Ethnomedicine. 2013;9:31.
3. Franco Ospina LA, et al. Actividad antiinflamatoria, antioxidante y antibacteriana de dos especies del género Tabebuia. Rev Cubana Plant Med. 2013;18(1):34-6.
4. Zubair M, Rizwan K, Rasool N, Afshan N, Shahid M, Ahmed VU. Antimicrobial potential of various extract and fractions of leaves of Solanum Nigrum. International Journal of Phytomedicine. 2011;3:63-7.
5. Britto S, Senthilkumar S. Antibacterial activity of Solanum incanum L. leaf extracts. Asian J of Microb Biotechnol Environmental Science. 2001;3:65-6.
6. Oliveira ACP, Endringer DC, Araújo RJP, Brandão MGL, Coelho MM. The starch from Solanum lycocarpum St. Hill. fruit is not a hypoglycemic agent. Braz J Med Biol Res. 2003;36(4):525-30.
7. Cáceres A. Plantas de uso medicinal en Guatemala. Ed. Universitaria. 1999:402.
8. Restrepo MF, Álvarez LMM, Gallego JHM. Solanaceae. Uso popular de las plantas medicinales en tres zonas de Caldas: Manizales, Riosucio y Viterbo. Editor: Manizales: Universidad de Caldas, 1987.
9. Rakesh Kumar A. Antimicrobial sensitivity pattern of Klebsiella pneumonia isolated from pus from tertiary care hospital and issues related to the rational selection of antimicrobials. J. Chem. Pharm. Res. 2013;5(11):326-31.
10. Sanabria A. Análisis fitoquímico preliminar. Metodología y su aplicación en la evaluación de 40 plantas de la familia Compositae. Bogotá, Colombia: Universidad Nacional de Colombia, Facultad de Ciencias, Departamento de Farmacia. 1983;58-88.
11. Sheeba E. Antibacterial activity of Solanum surattense Burm. F. Kathmandu University Journal of Science, Engineering and Technology. 2010;6(1):1-4.
12. Mazandarani M. Autecology, ethnopharmacology, phytochemical, antioxidant and antimicrobial activity of Thymus carmanicus Jalas. from Golestan province in north of Iran. J of Medicinal Plants and By-Products . 2015;4(1):67-5.
13. Maguna FP, Romero AM, Garro OA, Okulik NB. Actividad antimicrobiana de un grupo de Terpenoides. Facultad de Agroindustrias, UNNE, Argentina. 2006 [citado 12 ago 2014]. Disponible en: http://www.unne.edu.ar/Web/cyt/cyt2006/08-Exactas /2006-E-057.pdf
14. Cox SD, Gustafson JE, Mann CM, Markham JL, Liew YC, et al. Tea tree oil causes K+ leakage and inhibits respiration in Escherichia coli. Letters in Applied Microbiology. 1998;26:355-8.
15. Kannabiran K, Mohankumar T, Gunaseker V. Evaluation of Antimicrobial Activity of Saponin Isolated From Solanum Xanthocarpum and Centella asiática. IJNES. 2009;3(1):25-8.
16. Martínez AY, Soto RF, Almeida SM, Hermosilla ER, Martínez YO. Metabolitos secundarios y actividad antibacteriana in vitro de extractos de hojas de Anacardium occidentale L. (marañón). Rev Cubana Plant Med. 2012;17(4).
17. Alarcón L, Velasco J, Usubillaga A. Determinación de la actividad antibacteriana de los alcaloides presentes en los frutos verdes del Solanum hypomalocophyllum Bitter. Rev. Latinoamer. Quím. 2006;34(1-3):13-21.
18. Tiwari Anushree, Jadon Rajesh S, Tiwari Piyush, Nayak S. Phytochemical Investigations of Crown of Solanum melongena fruit. International Journal of Phytomedicine. 2009;1:(1)9-11.
19. Arango MC, Bueno JG, Isaza G, Pérez JE, Álvarez LF, et al. Efectos antibacterianos y antimicóticos de Alternanthera williamsii, Solanum dolichosepalum, Baccharis trinervis, Tabebuia chrysantha y Phenax rugosus. Biosalud. 2004;3:49-55.
Recibido: 22 de febrero de 2016.
Aprobado: 20 de enero de 2017.
Alexander Ramírez Cárdenas. Universidad de Caldas. Manizales Colombia. Correo electrónico: alexander.ramirez@ucaldas.edu.co