Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
MEDISAN
versión On-line ISSN 1029-3019
MEDISAN vol.16 no.8 Santiago de Cuba ago. 2012
ARTÍCULO ORIGINAL
Efecto del adyuvante vacunal AFCo1 intranasal sobre la concentración plasmática de teofilina en ratas
Effect of intranasal vaccine adjuvant AFCo1 on plasma concentration of theophylline in rats
Dr. Alexander Batista Duharte, I Lic. Onel Fong Lores, I Lic. José Carlos Rodríguez Tito, I Dr. Edgar Puente Zapata I y Dr. C. Oliver Pérez Martin II
I Centro de Toxicología y Biomedicina, Santiago de Cuba, Cuba.
II Departamento de Inmunología. Instituto Finlay, Ciudad de La Habana, Cuba.
RESUMEN
En este estudio se evaluó el efecto del adyuvante Finlay cocleato 1 (AFCo1), aplicado 4 veces por vía intranasal en 2 niveles de dosis (50 µg y 100 µg) sobre la concentración plasmática de teofilina, administrada a las 24 horas de la última aplicación (5 mg/kg, por vía intraperitoneal) en ratas Sprague-Dawley. Se empleó como control positivo de inflamación la aplicación de 2 dosis por vía subcutánea de adyuvante completo de Freund (ACF). Las ratas que recibieron AFCo1 no mostraron cambios significativos en la concentración sérica de teofilina; mientras que las tratadas con ACF desarrollaron inflamación local asociadas a signos de toxicidad a la teofilina y elevación de las cifras de inmunoglobulina G específica, de las concentraciones plasmáticas y el tiempo de vida media de teofilina en suero, en comparación con los grupos restantes. Estos resultados indican que la inmunoestimulación inducida por AFCo1 intranasal no incrementa los parámetros farmacocinéticos ni la toxicidad de la teofilina en el modelo empleado.
Palabras clave: AFCo1, adyuvante, rata Sprague-Dawley, citocromo P450, teofilina, toxicidad.
ABSTRACT
The effect of the adjuvant Finlay cochleate1 (AFCo1), applied intranasally 4 times in 2 dose levels (50 µg and 100 µg) on plasma concentration of theophylline administered 24 hours after the last application (5 mg/kg intraperitoneally) in Sprague-Dawley rats was evaluated in this study. Application subcutaneously of 2 doses of Freund's complete adjuvant (FCA) was used as positive control of inflammation. Rats receiving AFCo1 had no significant changes in serum theophylline concentration, while those treated with FCA developed local inflammation associated with signs of theophylline toxicity and increased specific G immunoglobulin, plasma concentrations and serum theophylline half-life as compared with the remaining groups. These results show that intranasal AFCo1-induced immunostimulation does not increase pharmacokinetic parameters and theophylline toxicity in the model used
Key words: AFCo1, adjuvant, Sprague-Dawley rat, P450 cytochrome, theophylline, toxicity.
INTRODUCCIÓN
La biotransformación de drogas por las enzimas del sistema citocromo P 450 (CYP) se inhibe por la acción de una respuesta inflamatoria y por la administración de Bacillus Calmette Guerin (BCG) y otras vacunas. Renton et al 1 notificaron problemas con la biotransformación hepática, con incremento de la toxicidad de la teofilina después de la aplicación de una vacuna contra la influenza como una evidencia de este efecto. En otros estudios se demostró que citoquinas como IL-1, IL-2, IL-6, TNF, TGF-b e IFNs, están involucradas en importantes modulaciones de la expresión de muchas isoformas de CYP. 2, 3
También ha sido informado un rápido decrecimiento en el contenido total de CYP en hígado de ratas tratadas con ACF y otros productos inmunoestimulantes con la disminución selectiva de isoformas específicas de estas enzimas, demostrado por disminución de los niveles de ácido ribonucleico mensajero (mRNA, por sus siglas en inglés) contenido proteico o actividad catalítica. 2, 3 Estas modificaciones pueden tener consecuencias farmacocinéticas y farmacodinámicas cuando las drogas que son aclaradas en el hígado se administran conjuntamente con inmunoestimuladores potentes y vacunas. 4, 5
La teofilina es una droga con efecto broncodilatador, ampliamente utilizada en pacientes con crisis de asma bronquial y otras afecciones respiratorias. 6 Se metaboliza por la vía de la CYP, por lo que una inhibición de estas enzimas producto a la inmunoestimulación puede acarrear un incremento de sus concentraciones plasmáticas y de la toxicidad. 5
Por otra parte, los adyuvantes son componentes esenciales en vacunas que permiten una respuesta inmune más eficiente y prolongada; 7 sin embargo, uno de los problemas que presentan es que pueden incrementar la toxicidad de las vacunas, entre ellas la modificación del metabolismo de drogas, en caso de productos altamente inmunoestimulantes. 8 El adyuvante Finlay cocleato 1 (AFCo1) es un congénere de la vacuna VA-MENGOC-BC tipo cocleato, desarrollado en el Instituto Finlay de Ciudad de La Habana como adyuvante para vacunas intranasales.9 Este trabajo, como parte de los estudios toxicológicos preclínicos que se realizan a este producto, tiene como objetivo determinar si la administración de AFCo1 por vía intranasal es capaz de modificar las concentraciones en sangre de teofilina en ratas Sprague Dawley.
MÉTODOS
Animales: Ratas macho Sprague Dawley de 6-8 semanas y entre 265-325 g de peso, suministradas por el Centro Nacional para la Producción de Animales de Laboratorio (CENPALAB). El ensayo se realizó en ratas machos por tener mayor corpulencia y volemia.
Adyuvantes: Adyuvante completo de Freund (AFC) y adyuvante incompleto de Freund (AIF) (Difco, USA). En ambos casos se utilizó una emulsión preparada con solución salina fisiológica al 0,9 % en proporción v/v y mezclada durante 15 minutos en agitador vórtex.
El adyuvante Finlay cocleato 1 (AFCo1) es un cocleato derivado del proteoliposoma de Neisseia meningitidis B, en el Instituto Finlay, obtenido bajo condiciones estandarizadas. 9
Droga: Teofilina (Quimefa, Cuba).
Administración de adyuvantes: Se utilizaron4 grupos de 10 ratas cada uno: un grupo control negativo al cual se le aplicó 20 µL x fosa nasal (fn) del vehículo de AFCo1, que contenía solución tampón Tris-Ca, por vía nasal los días 0, 5, 10 y 19; un grupo control positivo al que se le aplicó ACF emulsionado los días 1 y 14, así como 2 grupos experimentales, en estos últimos se empleó AFCo1 en 2 niveles de dosis: 50 µg/dosis en 20 µL x fn y 100 µg/dosis en 20 µL x fn, respectivamente los días 0, 5, 10 y 19.
Administración de teofilina: A estas 4 variantes se le aplicó teofilina a razón de 5 mg/kg de peso corporal, por vía intraperitoneal, 24 horas después de la última dosis de adyuvantes.
Observación y registro de signos clínicos: Durante todo el estudio se registró la existencia de signos clínicos de toxicidad, tales como: comportamiento anormal, piloerección, diarrea, taquipnea, secesión nasal, hipersecreción salival u otro signo de toxicidad a la teofilina. También se registró el peso corporal de cada rata al inicio y al final del experimento.
Toma de muestras: Se tomó muestra de sangre por vía retroorbital a 2 ratas por cada tiempo y por grupo para la cuantificación de teofilina. Al final del estudio se extrajo el resto de la sangre para estudiar niveles de alanina aminotransferasa (ALAT), aspartato aminotransferasa (ASAT), glucemia, colesterol, triglicéridos, urea y creatinina, a fin de evaluar el estado general de la función metabólica y en especial de las funciones hepática y renal. De igual forma se determinó la inducción de respuesta inmune IgG anti VME por ELISA.
Las muestras de sangre una vez coaguladas fueron centrifugadas (16 000 g, 5 min) y las alícuotas de 100 ìL de cada muestra de suero se conservaron a -70°C hasta su evaluación para la cuantificación de teofilina y determinaciones bioquímicas e inmunológicas.
Una vez realizada la eutanasia por dislocación cervical, se examinaron todos los órganos en especial el sitio de inoculación de la región subcutánea en el grupo tratado con ACF y se tomaron muestras para procesamiento histológico de la cavidad nasal en los grupos tratados con AFCo1 y en el grupo control.
Determinación de la concentración plasmática de teofilina: La concentración de teofilina en muestras de suero de rata se determinó por cromatografía líquida de alta precisión (HPLC) por el método de Kamakatsu modificado, 6 al tiempo 0 (antes de la administración), al finalizar la administración, a los 30, 60, 120 y 240 minutos. Se emplearon 2 ratas por grupo y para cada tiempo.
Con los puntos obtenidos se confeccionó una curva de concentración/tiempo y se determinó el área bajo la curva (ABC) por medio del programa Origin 70, así como el pico de concentración máxima (C máx) y el tiempo de vida media.
ELISA anti IgG específica: La técnica de ELISA se realizó en placas de 96 pozos de alta capacidad de unión (Maxisorp, Nunc, EUA) que se cubrieron con una solución de 20 µg/mL de proteoliposoma de N. meningitidis B diluido en solución tampón de recubrimiento (Na2CO3 11 mM, NaHCO3 35 mM (pH 9,6). Las placas se incubaron durante toda la noche a 4oC en cámara húmeda y se lavaron 3 veces con solución salina tamponada con fosfato 0,15 M (pH 7,2) (SSTF). Luego de bloquear con solución de bloqueo (seroalbúmina bovina (SAB) al 1% (p/v en SSTF) durante 1 hora, a temperatura ambiente en cámara húmeda. Las placas se lavaron 3 veces con solución de lavado (SSTF, Tween 20 al 0,1% (v/v), pH 7,4).
El suero de referencia y los sueros a evaluar se diluyeron 1:200 en solución de bloqueo más Tween 20 al 0,1% (v/v). Se aplicaron 100 µL/pozo por duplicado de las diluciones de los sueros individuales y del suero de referencia. Las placas se incubaron a 37 °C por 2 h, luego se lavaron 4 veces con SSTF. Se adicionaron 100 µL/pozo de anti-IgG de rata, conjugado a peroxidasa de rábano picante (SIGMA, St. Louis, Misuri en EE.UU.) diluido 1:2000 en solución de bloqueo más Tween 20 al 0,1% (v/v), durante una hora a 37 °C en cámara húmeda.
Posteriormente, se lavaron las placas 5 veces con solución de lavado, se adicionaron 100 µL/pozo de una solución de peróxido de hidrógeno al 0,01 % (v/v) y del cromógeno ortofenilendiamina (OPD) 0,6 mg/mL en solución tampón sustrato (Na2HPO4 52 mM y ácido cítrico 25 mM (pH 5,6) y se incubaron en la oscuridad urante 30 minutos. La reacción se detuvo mediante la adición de 50 µL de una solución de H2SO4 2 M. La densidad óptica (DO) se leyó a 492 nm en un lector de microplacas (Titertek, Multiskan Plus).
La cuantificación de ALT, AST, glucemia, colesterol, triglicéridos, urea y creatinina se realizó a través de un analizador automático Hitachi, con kits específicos procedentes de la firma Roche.
Análisis estadístico: Todos los datos son expresados como la media ± SD. La comparación entre grupos se llevó a cabo por un análisis de la varianza de una vía, seguido por una prueba post-hoc de Tukey. Las diferencias entre grupos fueron significativas si p = 0,05. El análisis estadístico se realizó con el paquete Statgraphics Plus 5.1
Los estudios realizados cumplieron con las regulaciones éticas, así como las buenas prácticas de laboratorio establecidas en TOXIMED.
RESULTADOS
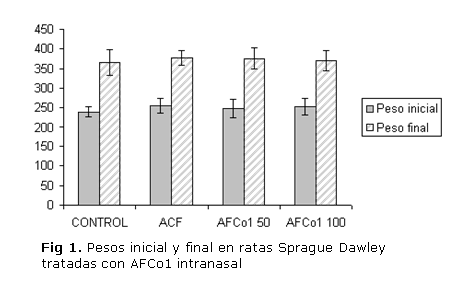
Los animales tratados con AFCo1 por vía intranasal, en 2 niveles de dosis no mostraron cambios significativos en el peso corporal inicial y final en comparación con los grupos controles negativo y positivo (figura 1).
No hubo diferencias significativas entre los grupos para los pesos iniciales y finales, pero sí dentro de cada grupo (p<0,05).
Todos los animales tratados con ACF, una vez administrada la teofilina, presentaron incremento de la frecuencia respiratoria, 5 de ellos diarrea pastosa y 2 piloerección, lo cual se detectó a partir de la primera hora de aplicado el broncodilatador.
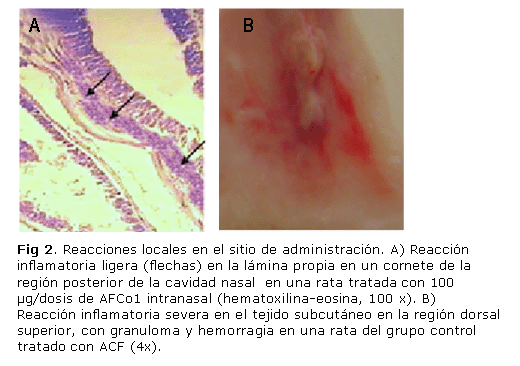
En el sitio de inoculación de los adyuvantes se detectó, en el caso del AFCo1, una ligera infiltración de células inflamatorias en la submucosa de la cavidad nasal, propio del efecto adyuvante del AFCo1; mientras que el grupo con ACF evidenció una severa reacción local con granulomas y hemorragias (figura 2).
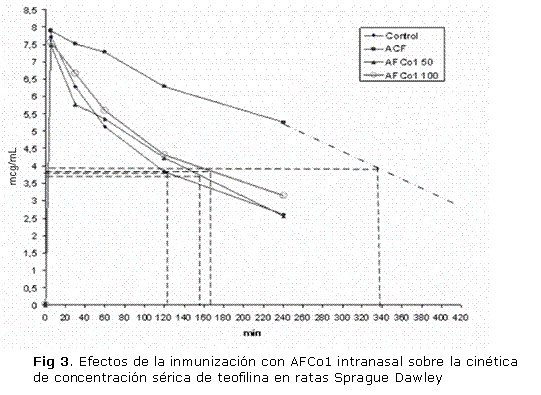
Como se muestra en la figura 3 y en la tabla 1, en la curva de concentración de teofilina, en un período de 240 minutos (4 horas), se detectó que el pico de concentración máxima fue similar en los 4 grupos a los 5 minutos; sin embargo, a partir de los 30 minutos y hasta el último tiempo evaluado el grupo control positivo evidenció una mayor elevación sostenida de la concentración de teofilina en sangre, elevando el tiempo de vida media a 338 minutos, en comparación con el grupo control y los grupos de AFCo1 50 y AFCo1 100, que fueron de 123, 156 y 176 respectivamente. Aunque el tiempo de vida media (TVM) de la teofilina de los grupos tratados con AFCo1 fue ligeramente superior al grupo control negativo, esta diferencia no fue significativa. De igual modo, el ABC fue significativamente superior en el grupo tratado con ACF en relación con el grupo control y tratados con AFCo1 intranasal.
Hubo diferencias significativas en el área bajo la curva (ABC) que representa la concentración plasmática de teofilina y en el tiempo de vida media entre el grupo tratado con ACF y el resto de los grupos (p<0,05). Cada punto representa la media de la concentración plasmática de 2 ratas en cada grupo. La línea discontinua de la curva en el control positivo representa un valor estimado para determinar el TVM en ese grupo; también hubo diferencias significativas entre el grupo tratado con ACF y el resto de los grupos a partir de los 60 minutos de evaluación.
La respuesta de IgG antiproteoliposoma en suero se muestra en la figura 4, donde se evidencia una elevación en los 2 grupos a los cuales se les aplicó AFCo1 intranasal y en menor proporción en el grupo tratado con ACF.
Hubo diferencias significativas entre el grupo control y el resto de los grupos, así como entre el grupo tratado con ACF y el resto de los grupos; pero no entre ambos grupos tratados con AFCo1 por vía nasal (p<0,05).
En la tabla 2 se puede apreciar que al comparar los grupos entre sí, no hubo cambios significativos en las variables bioquímicas estudiadas, lo cual indica que no ocurrieron modificaciones metabólicas significativos, ni afectaciones en las esferas renal y hepática que pudieran justificar un aumento de la concentración plasmática de teofilina por trastornos en la excreción; este ultimo aspecto lo indican los valores normales de urea y creatinina, biomarcadores de funcionamiento renal.
Los parámetros bioquímicos evaluados no mostraron cambios significativos en ninguno de los grupos evaluados (p<0,05).
DISCUSIÓN
La posible interacción entre la inmunoestimulación inducida por vacunas y ciertas drogas que pueden ser administradas de forma concomitante, es un tema relativamente poco estudiado. Varios autores 1, 10, 11 han alertado que la inflamación asociada con la estimulación de la respuesta inmune suele afectar la biotransformación de sustancias químicas y medicamentos, lo cual puede modificar su toxicidad. En este sentido se ha demostrado que la expresión y la actividad de las CYP constitutivas e inducibles, están reguladas por la acción de gran número de citoquinas y mediadores inflamatorios liberados durante la respuesta inmune del organismo ante diferentes situaciones. 1 Los principales mecanismos de regulación son los transcripcionales y los postranscripcionales, además de aquellos encargados de regular la expresión de las CYP inducibles, a través de receptores nucleares. 2
La teofilina es un broncodilatador utilizado para el tratamiento de pacientes con asma y enfermedad pulmonar obstructiva crónica, con un margen terapéutico estrecho, lo que propicia la aparición de reacciones adversas, bien cuando los niveles plasmáticos se elevan o cuando existen dificultades con su metabolismo y eliminación en quienes presentan enfermedades hepáticas, cardíacas y renales. 6 Esta droga se metaboliza por la vía de la CYP en el hígado, específicamente 1A1/2, 2B1/2 y 3A1/2 en ratas Sprague-Dawley y se ha empleado como un modelo para evaluar el efecto de compuestos inmunomoduladores sobre el metabolismo de drogas por esta vía. 5
En este artículo se evaluaron los efectos de la inmunización intranasal con AFCo1, nuevo adyuvante vacunal para uso intranasal, sobre los niveles de teofilina en suero, inmediatamente y durante las primeras horas posvacunación, para lo cual se utilizó como grupo control positivo la administración de ACF, adyuvante de referencia que produce una respuesta inflamatoria intensa en el sitio de inoculación, asociada a una potente disminución de las enzimas CYP hepáticas, sobre todo a las 24 horas de la administración de este. 4
Los resultados de este estudio evidenciaron que en el grupo control positivo la concentración sérica de teofilina tuvo mayor persistencia, dada por el TVM y el ABC, en comparación con los grupos a los cuales se les administró AFCo1 intranasal, que no mostraron cambios significativos en la concentración sérica de este medicamento al compararse con el grupo control negativo. De igual modo, clínicamente se evidenció aumento de la frecuencia respiratoria, presencia de diarrea y piloerección en varios animales del grupo tratado con ACF, como evidencia de toxicidad a la teofilina. 6 Todos estos cambios estuvieron asociados a una intensa respuesta inflamatoria local en el sitio de inoculación en ese grupo, a diferencia del resto de los grupos, como expresión de que la inflamación asociada al ACF pudo estar involucrada en la toxicidad a la teofilina.
Por otra parte, no se evaluó la actividad de la CYP, pero este efecto de las citoquinas proinflamatorias y la inflamación sobre la inhibición de la actividad de esta enzima ya fue demostrada por Provean et al. 4 En los grupos tratados con AFCo1, a 2 niveles de dosis, no se observó una elevación significativa de las concentraciones de teofilina plasmática en comparación con el grupo control, aunque en estos grupos los tiempos de vida media de esta droga fueron ligeramente superiores en relación con el grupo no tratado, en especial el de mayor dosis, lo cual puede obedecer a que en la región nasal se observó ligera respuesta inflamatoria, aunque mucho menor que la del grupo control positivo.
Esta ligera respuesta inflamatoria a nivel nasal, inducida por AFCo1, fue también descrita por Infante et al 12 y no obedece a un efecto irritante directo del producto, 13 sino que es interpretado como propio de la actividad adyuvante del cocleato.
También se observó que los grupos tratados con AFCo1 desarrollaron una significativa respuesta específica contra el proteoliposoma de N. meningitidis B y, sorpresivamente, una elevación de dicha respuesta en los grupos tratados con ACF, aunque mucho menor, lo cual pudiera ser debido a algún antígeno presente en las micobacterias que comparte similitud con un componente del meningococo, de modo que genera una reactividad cruzada.
De igual manera, las variables bioquímicas estudiadas no revelaron cambios significativos en los grupos estudiados. De especial interés resultó la normalidad de las enzimas transaminasas, cuya elevación puede revelar la presencia de daño hepático, así como la urea y la creatinina, que al incrementarse, expresan trastornos renales; 14 dicha normalidad expresa que el comportamiento de la concentración de teofilina en sangre no estuvo influido por trastornos en estos órganos.
Teniendo en cuenta todos los resultados obtenidos, se concluye que potencialmente la aplicación de AFCo1 por vía intranasal no afecta la concentración plasmática de teofilina al ser administrada 24 horas después de la última dosis del adyuvante, lo cual resulta de interés desde el punto de vista regulatorio para quienes utilizan este fármaco, como los asmáticos, y que pudieran ser inmunizados en un futuro con vacunas que contienen este adyuvante.
AGRADECIMIENTOS
A las licenciadas Eliveth Legrá y Mereidis Colón, por el procesamiento de las muestras para los estudios bioquímicos; al Dr. Danny Larramendi, por el procesamiento anatomopatológico; a la Lic. Mirley Romero, por la revisión y supervisión de los aspectos de garantía de la calidad y a la Dra. Lidia Páez, por su contribución en la realización de este estudio. De igual modo, se agradece a los miembros del Departamento de Inmunología Básica y Clínica, dirigido por el doctor Oliver Pérez del Instituto Finlay, por el suministro de AFCo1 y el apoyo en determinadas evaluaciones.
REFERENCIAS BIBLIOGRÁFICAS
1. Renton KW, Gray JD, Hall RI. Decreased elimination of theophyiline after influenza vaccination. Can Med Assoc J.1980; 123: 288-90.
2. Bleau AM, Maurel P, Pichette V, Leblond F, du Souich P. Interleukin-1h, interleukin-6, tumour necrosis factor- á and interferon- g released by a viral infection and an aseptic inflammation reduce CYP1A1,1A2 and 3A6 expression in rabbit hepatocytes. Eur J Pharmacol. 2003; 473:197-206.
3. Projean D, Dautrey S, Vu HK, Groblewski T, Brazier JL, Ducharme J. Selective downregulation of hepatic cytochrome P450 expression and activity in a rat model of inflammatory pain. Pharm Res. 2005; 22: 62-70.
4. Projean D, Lessard E, Ducharme P, Ducharme J. Use of Freund's Complete Adjuvant (FCA) in inflammatory pain models: consequences on the metabolism and pharmacokinetics of the non-peptidic delta receptor agonist SNC80 in the rat. Xenobiotica. 2007; 37(8): 870-88.
5. Yang KH, Jung YS, Lee DY, Lee JH, Kim,YC, Lee MG. Time-dependent effects of Klebsiella pneumoniae Endotoxin (KPLPS) on the pharmacokinetics of theophylline in rats: return of the parameters in 96-hour KPLPS rats to the control levels. Drug Metabol Disp. 2008; 36(5):811-15.
6. Sweetman SC. Martindale: the complete drug reference. 36th. New York: Pharmaceutical Press; 2009.
7. Reed SG, Bertholet S, Coler RN, Friede M. New horizons in adjuvants for vaccine development. Trends Immunol. 2009; (30)1: 23-32.
8. Batista Duharte A, Lindblad E, Oviedo E. Progress in understanding adjuvant immunotoxicity mechanisms. Toxicol Lett. 2011; 203: 97-105.
9. Método de obtención de estructuras cocleares. Composiciones vacunales y adyuvantes basados en estructuras cocleares y sus intermediarios [citado 15 May 2012]. Disponible en: http://www.patentesonline.com.co/metodo-de-obtencion-de-estructuras-cocleares -composiciones-vacunales-y-adyuantes-49101.html
10. Descotes J. Immunomodulating agents and hepatic drugs metabolism enzymes. Drug Metab Rev. 1985; 16(1-2):175-84.
11. Luster M, Simeonova P, Gallucci R, Bruccoleri A, Blazka M, Yucesoy B. Role of inflammation in chemical-induced hepatotoxicity. Toxicol Lett. 2001; 120(1-3): 317_32.
12. Infante JF, Sifontes S, Pérez V, Bracho G, Hernández T, Zayas C,et al. Ensayo de inmunogenicidad y de toxicidad local del cocleato de Neisseria meningitidis en ratas Spregue Dawley. VacciMonitor. 2009; 18(1):1-7.
13. Batista Duharte A, Murillo GJ, Pérez U, Tur NE, Portuondo FD, Pérez O. Evaluación de la irritabilidad en mucosa del adyuvante AFCO1 por el método de HET-CAM. VacciMonitor 2011; 20(1):22-27.
14. Duffus JH, Templeton DM, Nordberg M. Concepts in Toxicology. Cambridge: Royal Society of Chemistry; 2009.
Recibido: 2 de julio de 2012.
Aprobado:7 de julio de 2012
Alexander Batista Duharte. Centro de Toxicología y Biomedicina (TOXIMED). Autopista Nacional, km 1 ½, Santiago de Cuba, Cuba. Correo electrónico:alexander.batista@medired.scu.sld.cu