Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
MEDISAN
versión On-line ISSN 1029-3019
MEDISAN vol.20 no.5 Santiago de Cuba mayo.-mayo 2016
COMUNICACIÓN BREVE
Desarrollo y principales resultados en la ejecución de los ensayos clínicos en el Hospital General Docente "Dr. Juan Bruno Zayas Alfonso"
Development and main results in the implementation of clinical trials in "Dr. Juan Bruno Zayas Alfonso" Teaching General Hospital
Dra. Tatiana Marañón Cardonne,I Lic. Sanlia Landazuri Llago,II Lic. Oneyda Clapé Laffita, II Lic. Llilian Vaillant LoraI y Dra. Kenia Mastrapa Cantillo I
I Hospital General Docente "Dr. Juan Bruno Zayas Alfonso", Universidad de Ciencias Médicas, Santiago de Cuba, Cuba.
II Universidad de Ciencias Médicas, Santiago de Cuba, Cuba.
RESUMEN
A partir del desarrollo de la biotecnología y la industria farmacéutica surge el Centro Nacional Coordinador de Ensayos Clínicos, por lo cual fue necesario crear una red que contara con múltiples instituciones en el país para la ejecución de los ensayos clínicos multicéntricos, para aumentar así la eficiencia y alcanzar los resultados con los estándares de calidad establecidos; contexto en el cual se insertó el Hospital General Docente "Dr. Juan Bruno Zayas Alfonso" de Santiago de Cuba. A tales efectos, en el presente artículo se comunica brevemente lo relacionado con el desarrollo de dichos ensayos en el mencionado centro hospitalario.
Palabras clave: biotecnología, industria farmacéutica, ensayo clínico multicéntrico, investigación clínica, sistema nacional de salud.
ABSTRACT
Since the development of the biotechnology and the pharmaceutical industry the Coordinator National Center of Clinical Trials emerges, reason why it was necessary to create a network that took into account multiple institutions in the country for the implementation of the multicenter clinical trials, to increase the efficiency and reach the results with the established quality standards; context in which "Dr. Juan Bruno Zayas Alfonso" Teaching General Hospital in Santiago de Cuba was inserted. To such effects, everything related to the development of these trials in the abovementioned hospital center is briefly stated in this work.
Key words: biotechnology, pharmaceutical industry, multicenter clinical trial, clinical investigation, national health system.
INTRODUCCIÓN
Un ensayo clínico es un experimento controlado en personas voluntarias, que se utiliza para evaluar la seguridad y eficacia de tratamientos o intervenciones contra enfermedades y problemas de salud de cualquier tipo, así como también para determinar efectos farmacológicos, farmacocinéticos o farmacodinámicos de nuevos productos terapéuticos, incluyendo el estudio de sus reacciones adversas.1
A tales efectos, el ensayo clínico controlado (ECC) continúa siendo el más utilizado, de manera que para que haya llegado a convertirse en el estándar de oro de la investigación clínica ha sido necesario el análisis minucioso de los defectos y los sesgos existentes en los primeros diseños y la puesta en marcha de medidas encaminadas a evitarlos. De esa forma se han ido desarrollando métodos de evaluación más objetivos y generalizado el empleo de la aleatorización, del enmascaramiento y del correcto análisis estadístico. Esos son los pilares sobre los cuales descansa la calidad de un ensayo clínico y los que garantizan la fiabilidad de los resultados obtenidos.2
Desde que en 1950 fuera publicado el primer ensayo clínico randomizado, donde se analizó y demostró la eficacia de la estreptomicina contra la tuberculosis,3 estos han ocasionado cambios fundamentales en los patrones que establecen las bases para el diagnóstico, pronóstico y tratamiento en la práctica médica, de manera que han proporcionado un nuevo modelo denominado medicina basada en evidencias.4
Por otra parte, constituye también un paradigma para el registro sanitario de tecnologías sanitarias en general. En la actualidad, uno de los mayores retos que enfrenta la industria médico farmacéutica y biotecnológica, una vez transcurrida la etapa de investigación preclínica, es la investigación clínica.5
Estas investigaciones son esenciales para determinar la eficacia y seguridad, así como la calidad y efectividad de una nueva terapéutica, donde según expertos los resultados obtenidos de estas pueden generalizarse de manera segura a otras poblaciones.
Los ECC permiten obtener un alto nivel de evidencia para demostrar que el procedimiento médico que se realiza es el más adecuado con los conocimientos científicos que existen en ese momento, debido al diseño del estudio, donde las variables estadísticas están controladas para evitar posibles sesgos.6
La evaluación clínica, etapa previa al registro, se compone de varias fases: 7
- Fase I. Seguridad y tolerancia. Farmacocinética y farmacodinámica
- Fase II. Efectos, seguridad, tolerancia y otros aspectos farmacológicos
- Fase III. Eficacia, seguridad y tolerancia
Una vez que se registra el producto en investigación, generalmente se desarrolla una cuarta fase, la de estudios posrregistro y farmacovigilancia.
En Cuba, durante las últimas décadas del siglo pasado, hubo un incremento importante de las investigaciones clínicas, lo que trajo aparejado el consecuente desarrollo científico en el diseño, coordinación, conducción, monitorización, inspección y auditoría de los estudios en seres humanos, además de la consiguiente protección de los derechos de los sujetos incluidos en este tipo de investigación.5
En la década de los 90 este desarrollo acelerado impuso la necesidad de crear estructuras que garantizaran la evaluación clínica de estos productos para su introducción a la práctica médica y posterior comercialización. Así surgió el Centro Nacional Coordinador de Ensayos Clínicos (CENCEC) y, a partir de ese momento, un propósito importante fue la creación de una red que contara con múltiples instituciones en el país para la ejecución de los ensayos clínicos, con vistas a aumentar la eficiencia, alcanzar los resultados con mayor velocidad y con los estándares de calidad requeridos, lo cual fue posible por disponer de un sistema de salud único y contar con la infraestructura y preparación científica adecuada del personal de la salud en todas las provincias.5
En este contexto se insertó el Hospital General Docente "Dr. Juan Bruno Zayas Alfonso" de Santiago de Cuba en 1998; centro con una participación activa en la ejecución de los ensayos clínicos multicéntricos a partir de una estrategia de apertura de dichos ensayos desde el 2006. Por tanto, ha contribuido a proporcionar evidencias científicas que sustenten las intervenciones y determinadas acciones de salud, al igual que el registro sanitario de nuevos productos y su posterior comercialización dentro y fuera del país.
El objetivo del presente trabajo es mostrar la evolución en la ejecución de los ensayos clínicos, así como los principales resultados obtenidos por la institución a partir de un análisis de documentos institucionales e informes no publicados.
Inicios de la participación en los ensayos clínicos multicéntricos
Los primeros ensayos clínicos se ejecutaron en los servicios de Dermatología, Psiquiatría y Hematología, en diversas afecciones como psoriasis, vitíligo, esquizofrenia paranoide, leucemia mieloide crónica, mieloma múltiple y otras enfermedades oncohematológicas.
Un propósito importante desde la creación del CENCEC fue conformar una red de ensayos clínicos multicéntricos, que contara con una serie de instituciones en las diferentes especialidades donde se ejecutaran estos estudios. 5
El mencionado centro hospitalario se insertó en esta red y a partir del 2006 se trazó una estrategia de apertura para la ejecución de ensayos clínicos, de manera que surge así el coordinador de la investigación clínica (CIC), que junto con el investigador se encarga de gestionar todo lo relacionado con los aspectos técnicos, logísticos y organizativos en el sitio clínico donde se desarrolla dicho ensayo.8
Por sus funciones, el CIC ha devenido en un eslabón principal entre el equipo de investigación y todos los servicios médicos involucrados en el estudio para el diagnóstico, la pesquisa, el tratamiento y la evaluación de los pacientes incluidos en un ensayo clínico; asimismo, constituye el pilar fundamental sobre el cual se apoya el investigador responsable para el cumplimiento de las normas de buenas prácticas clínicas (BPC) y la realización eficiente del estudio. 9, 10
Período 2006- 2014
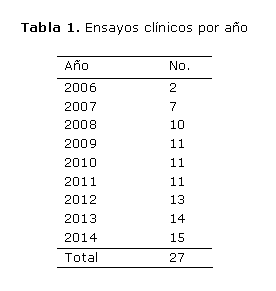
En este período se ejecutaron en la institución 27 ensayos clínicos, distribuidos como sigue: 1 de fases I y II; 7 de fase II; 3 de fases II y III; 10 de fase III y 6 de fase IV, de los cuales 22fueron coordinados a través del CENCEC, uno directamente coordinado con el Centro de Inmunología Molecular (CIM) y 4 con el Centro de Ingeniería Genética y Biotecnología (CIGB). En la tabla 1 se muestra el número de ensayos clínicos efectuados durante la etapa señalada.
Por otra parte, también se aprecia un ascenso creciente en la ejecución de los ensayos clínicos, pues de 27 han sido terminados 13.
Se han ensayado productos en disímiles afecciones, entre las cuales figuran: el cáncer en diferentes localizaciones (mamas, pulmón, esófago, próstata, riñón, cabeza y cuello, piel), las enfermedades oncohematológicas, las dermatlógicas, la hepatitis B, en pacientes VIH/SIDA y en asmáticos. Los servicios que han participado en estas investigaciones han sido: Dermatología, Neumología, Urología, Hematología, Medicina Interna y Coloproctología, entre otros, así como los departamentos de Laboratorio Clínico, Imagenología, Farmacia, Anatomía Patológica y Archivo.
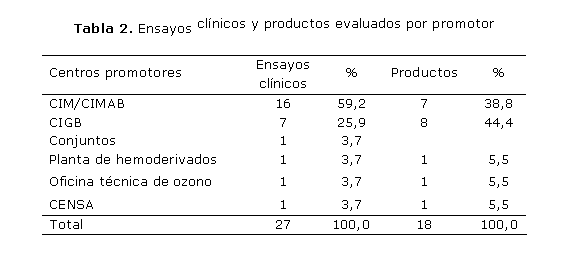
Al analizar los productos por promotor (tabla 2), se observó que el Centro de Inmunología Molecular (CIM) y el Centro de Ingeniería Genética Y Biotecnología (CIGB) fueron los de mayor número de ensayos clínicos ejecutados (85,1 %), con superioridad para el primero de estos (59,2 %).
La institución cuenta con más de 90 investigadores: médicos, enfermeras, licenciados, tecnólogos y técnicos, de ellos 81,3 % son investigadores y 79,1 % másteres en ciencias.
Los ensayos clínicos ejecutados por la institución, teniendo en cuenta los centros promotores, los productos evaluados, los investigadores, los pacientes incluidos y los convenios con los centros promotores y otros del sistema nacional de salud se muestran en la tabla 3.
En el período analizado se concluyeron 12 ensayos clínicos, con un total de 18 productos evaluados, que corresponden a 5 centros promotores. Han participado más de 90 investigadores y se han incluido más de 400 pacientes.
Los productos evaluados han sido fundamentalmente vacunas moleculares y productos biotecnológicos producidos por la industria farmacéutica cubana, sobre todo, de los centros antes mencionados.
Durante el 2011, este centro se introdujo en el proceso de certificación en buenas prácticas cínicas. En ese año logró certificar 3 sitios clínicos y 8 servicios, de manera que fue el único hospital del país certificado fuera de la capital.
El principal impacto que ha tenido la ejecución de los ensayos clínicos a lo largo de todos estos años, ha sido el registro sanitario de varios productos y su incorporación al cuadro básico de medicamentos, entre los cuales se encuentran: los interferones y sus disímiles usos en la medicina, la estreptoquinasa recombinante y su uso en cardiología y, de manera local, en la crisis hemorroidal, lo que ha evitado considerablemente las intervenciones quirúrgicas, sus complicaciones y recuperación prolongada además del costo que ello lleva consigo. Por otra parte, resulta válido destacar el registro de anticuerpos monoclonales como el nimotuzumab contra el cáncer en las localizaciones de cabeza y cuello, esófago y su incorporación al cuadro básico de medicamentos para estas afecciones, con la seguridad y eficacia demostrada; igualmente, el registro de la vacuna Cimavax EGF contra el cáncer de pulmón y racotumobab para igual localización, esta última con alta incidencia en la población.
Se han ensayado productos que han disminuido las intervenciones quirúrgicas por enfermedades como la trombosis hemorroidal y el carcinoma basocelular de piel, con lo cual se ha evitado la recuperación prolongada o la afectación estética de los pacientes, con la consecuente mejora de la calidad de vida.
La ejecución de los ensayos clínicos, con la implantación de una serie de medidas sistematizadas, con una norma internacional de calidad científica y ética que es la buena práctica clínica, favorece la ejecución de los diferentes procesos en el ámbito hospitalario, eleva la calidad de estos y, de hecho, deviene en una mejor atención a la población.
Este centro hospitalario ha tenido una influencia positiva en el sistema nacional de salud, no solo al elevar la calidad de diferentes procesos relacionados con la atención a los pacientes, ya que para la aceptación del protocolo del ensayo clínico se exigen los mejores estándares de diagnóstico, evaluación y tratamiento; también ha contribuido a la superación de los recursos humanos que participan en el estudio, con un mayor rigor científico, tanto en su especialidad como en otras materias relacionadas con la investigación clínica, las buenas prácticas clínicas, ética en la investigación y la medicina basada en la evidencia, lo cual deviene en una mejor atención a los afectados.
CONSIDERACIONES FINALES
En el Hospital General Docente "Dr. Juan Bruno Zayas Alfonso" de Cuba se inició la ejecución de los ensayos clínicos en 1998 y a partir del 2006 se comenzaron a desarrollar los ensayos clínicos, con tendencias crecientes en cuanto a la calidad en la ejecución de estos.
Un aspecto vital fue la incorporación del coordinador de la investigación clínica como el profesional encargado de gestionar todos los aspectos técnicos, logísticos y organizativos en el sitio clínico donde se desarrolla el ensayo clínico.
Al estar la institución certificada en BPC supone un reto mantener la calidad alcanzada en la ejecución de dichos ensayos, a fin de garantizar este proceso acorde con estándares internacionales.
Ha sido un logro haber contribuido al registro de varios productos biotecnológicos, elevar la calidad de vida de los pacientes incluidos y la calidad de los procesos vinculados a la atención de estos pacientes, lo cual implica una mejor atención y la superación de los recursos humanos que llevan a cabo estas investigaciones.
REFERENCIAS BIBLIOGRÁFICAS
1. Lascano E, Salazar E, Gutiérrez P, Angeles A, Hernández A, Viramontes JL. Ensayos clínicos aleatorizados: variantes, métodos de aleatorización, análisis, consideraciones éticas y regulación. Salud Pública de México. 2004 [citado 14 Jun 2014]; 46(6). Disponible en: http://www.redalyc.org/articulo.oa?id=10646610
2. Sacristán JA, Soto J, Galende I. Evaluación crítica de ensayos clínicos. Med Clin Barc. 1993 [citado 14 Jun 2014];100. Disponible en: http://www.cfe-fcm.unc.edu.ar/archivos/03/ececc_ checklist.pdf
3. Araujo RJ, Arencibia JR, Gutiérrez CC. Ensayos clínicos cubanos publicados en revistas de impacto internacional: estudio bibliométrico del período 1991-2001. Rev Esp Doc Cient. 2002;25(3):254-66.
4. Díaz Novás J, Gallego Machado BR, León González A. Medicina basada en evidencias. Rev Cubana Med Gen Integr. 2000 [citado 14 Jun 2014]; (16)4. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0864-21252000000400010
5. Pascual López MA, Jiménez Rivero G, Torres Pombert A, Fors López MM, López Zayas I. Surgimiento, evolución y principales resultados del Centro Nacional Coordinador de Ensayos Clínicos. Rev Cubana Farm. 2011 [citado 14 Jun 2014]; 45(1). Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0034-75152011000100002
6. Fors López MM. Los ensayos clínicos y su contribución a la salud pública cubana. Rev Cubana Salud Pública. 2012 [citado 14 Jun 2014]; 38(supl 5). Disponible en: http://scielo.sld.cu/scielo. php?script=sci_arttext&pid=S0864-34662012000500010
7. ICH Harmonised Tripartite Guideline. ICH E8 General considerations for clinical trials. Geneva: ICH Steering Committee; 1998. [citado 14 Jun 2014] Disponible en: http://www.ema.europa.eu/ docs/en_GB/document_library/Scientific_guideline/2009/09/WC500002877.pdf
8. Sánchez Barbero M. Enfermera coordinadora de estudios clínicos: data manager. Metas Enferm. 2006 [citado 15 Abr 2010]; 9(8). Disponible en: https://dialnet.unirioja.es/servlet/articulo? codigo=2100813
9. Cuba. Ministerio de Salud Pública. Directrices sobre buenas prácticas clínicas en Cuba. Centro para el Control Estatal de la Calidad de los Medicamentos. La Habana: MINSAP; 2000.
10. Méndez Triana R, Rivas Lorenzo AM, Pérez Machín M. El coordinador de la investigación clínica: un profesional necesario en instituciones de salud que ejecutan ensayos clínicos. Acta Médica. 2009 [citado 14 Jun 2014]; 3(2). Disponible en: http://www.actamedica.sld.cu/r2_09/coordinador.htm
Recibido: 20 de junio de 2015.
Aprobado: 10 de enero de 2016.
Tatiana Marañón Cardonne. Hospital Clinicoquirúrgico Docente "Dr. Joaquín Castillo Duany", Punta Blanca s/n, Santiago de Cuba, Cuba. Correo electrónico:tatiana@hospclin.scu.sld.cu