Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
MEDISAN
versión On-line ISSN 1029-3019
MEDISAN vol.22 no.2 Santiago de Cuba feb. 2018
ARTÍCULO ORIGINAL
Clasificación morfológica de células endoteliales de venas del cordón umbilical humano en imágenes digitales de cultivos in vitro
Morphological classification of endothelial cells of veins from the human umbilical cord in digital images of in vitro cultures
MsC. Miriela Milagros Escobedo Nicot,I Dra. C. Silena Herold García,I Dra. C. Ligia Ferreira Gomes,II Ing. Wilkie Ernesto Delgado Font,I MsC. Camila MachadoII y Dra. C. Elisângela Monteiro PereiraIII
I Universidad de Oriente, Santiago de Cuba, Cuba.
II Universidade de São Paulo, Brasil.
III Universidade Federal de Alfenas, Minas Gerais, Brasil.
RESUMEN
Se realizó un estudio descriptivo y transversal desde julio hasta octubre de 2017, por especialistas de la Universidad de Oriente y de la Universidad de Sao Paulo, Brasil, para analizar desde el punto de vista morfológico células endoteliales de venas del cordón umbilical humano, presentes en imágenes digitales de cultivos in vitro 2D, tratadas con la β2GPI. Se propuso la clasificación supervisada celular considerando 3 clases: circulares, deformadas alargadas y deformadas poco alargadas, según los coeficientes de formas elíptico y circular, todo lo cual permitió identificar formas celulares relevantes. Para comparar los resultados de las muestras de control y las tratadas, se calcularon los intervalos de confianza para cada una de las clases, con un nivel de confianza de 95 %. Se concluye que el análisis de las alteraciones morfológicas in vitro puede ser utilizada en cultivos 2D precoces (de 24 y 48 horas) para la cuantificación de la angiogénesis.
Palabras clave: análisis morfológico, células endoteliales, cultivo in vitro, angiogénesis.
ABSTRACT
A descriptive and cross-sectional study was carried out from July to October, 2017, by specialists of the Oriente University and the University of Sao Paulo, Brazil, to analyze from the morphological point of view endothelial cells of the human umbilical cord veins, which were present in digital images of 2D in vitro cultures, treated with the β2GPI. The cellular supervised classification was proposed considering 3 classes: circular, distorted elongated and distorted not very elongated, according to the coefficients of elliptic and circular shapes, all that allowed to identify outstanding cellular forms. To compare the results of the control and treated samples, the intervals of confidence were calculated for each of the classes, with a 95 % level of confidence. It was concluded that the analysis of the morphological disorders in vitro can be used in early 2D cultures (24 and 48 hours) for the quantification of the angiogenesis.
Key words: morphological analysis, endothelial cells, in vitro culture, angiogenesis.
INTRODUCCIÓN
El análisis de imágenes digitales incluye varios pasos entre los que se encuentra la extracción de características. Este es un proceso que permite llegar a conclusiones (de carácter cualitativo o cuantitativo) sobre los objetos de interés en estas. En dicho análisis, el estudio morfológico de objetos reviste gran importancia, pues existen en la práctica infinidad de casos donde se tratan situaciones de clasificación de objetos detectados en imágenes digitales a partir de su forma específica.
En medicina, algunas afecciones o determinados procesos asociados a enfermedades, causan deformaciones celulares que conllevan a cambios en la función original de las células y que pueden ser identificadas y procesadas para emitir diagnósticos y sugerir tratamientos adecuados. En el presente artículo se hará referencia a la angiogénesis, proceso que permite la formación de nuevos capilares a partir de vasos preexistentes en el cuerpo y comprende una secuencia compleja de eventos mediados por moléculas de señalización para el crecimiento, la migración y la diferenciación celular.1
La actividad de las vías bioquímicas relacionadas con la angiogénesis es un objetivo terapéutico en animales y en el ser humano, particularmente en condiciones crónicas relacionadas con inflamaciones y neoplasias. Su estudio puede realizarse a través de modelos experimentales tanto in vitro (2D y 3D) como in vivo. En los primeros, los endotelios empleados tienen diversos orígenes y, específicamente en esta investigación, se usaron las células endoteliales de venas de cordón umbilical humano (HUVEC, por sus siglas en inglés), las cuales han sido cultivadas con éxito desde 1973.1
Aunque en la bibliografía consultada al respecto se describen algunos estudios relacionados con el análisis morfológico de células endoteliales, esta es un área que no ha sido muy explotada. En estas investigaciones, normalmente, se analiza la angiogénesis a partir de las 48 horas de incubación, que es el momento en el que estas células han alcanzado un nivel relativamente avanzado de deformación y la densidad celular es mayor. Esta metodología implica un tiempo de espera de, al menos, dos días para emitir un criterio sobre los resultados observados; cuestión que siempre es de interés reducir.
El análisis de las alteraciones morfológicas in vitro se puede realizar en cultivos 2D precoces (24 horas), donde las células existentes están bien determinadas y ha comenzado su diferenciación, aunque el nivel de densidad celular es menor. Esto permite que se simplifique la cuantificación y se reduzca el costo del análisis de la respuesta de proliferación asociada a efectos de sustancias antiangiogénicas sobre las células endoteliales.
Teniendo en cuenta estos antecedentes y considerando la factibilidad de analizar el desarrollo celular desde etapas tempranas, o sea, a partir de las 24 horas de incubación, en el presente artículo se propone realizar un análisis morfológico cuantitativo de HUVEC en imágenes digitales de cultivos 2D in vitro obtenidas a las 24 horas y que están bajo la influencia de la proteína plasmática β2GPI, compuesto al cual se le han atribuido propiedades de carácter antiangiogénicas en determinados ambientes experimentales.2 El análisis se extiende a las 48 horas con interés de realizar comparaciones.
MÉTODOS
Se realizó un estudio descriptivo y transversal, desde julio hasta octubre de 2017, por especialistas de la Universidad de Oriente y de la Universidad de Sao Paulo, Brasil, para analizar desde el punto de vista morfológico células endoteliales de venas del cordón umbilical humano, presentes en imágenes digitales de cultivos in vitro 2D, tratadas con la β2GPI. Las imágenes se tomaron de muestras preparadas considerando la metodología que se explica a continuación.
Preparación de las muestras y captura de las imágenes
Los estudios fueron conducidos con subfracciones del proceso de purificación que son ricas en monómeros de β2GPI purificada, obtenidas por elución de la columna de heparina sefarosa después de filtración por membranas de acetato de celulosa, con poros de diámetro de 0,22 µm para eliminar la contaminación bacteriana y dilución en medio de cultivo sin suero.
Las células endoteliales en la concentración de 2x104 células/mL se colocaron en medio de cultivo RPMI 1640 (Roswell Park Memorial Institute) suplementado con suero fetal bovino a 10 % en placas de 24 pozos, sobre cubreobjetos de vidrio con 13 mm de diámetro, previamente esterilizados en autoclave. En cada pozo se adicionó una concentración de 30 µm g/mL de la proteína y la incubación se interrumpió a las 24 horas. Las células adheridas a los cubreobjetos fueron teñidas con una mezcla de hematoxilina y azul de metileno, utilizada en laboratorios de hematología (May-Grunwald-Giemsa), para un resultado de patrón suave con buena transparencia citoplasmática.
Las imágenes se obtuvieron de distintos campos a partir de 8 muestras de HUVEC, para lo cual se usó una cámara Point Grey (GS3-U3-1455M) con objetivo de aumento de 3,2X y una resolución de 1384x1036 píxeles. Las imágenes se dividieron en 2 grupos: uno no tratado con la β2GPI, denominado grupo control y otro sí tratado.
Procesamiento de imágenes
Considerando que existe una buena diferenciación entre los objetos de interés (HUVEC) y el fondo, las imágenes fueron segmentadas mediante un método de segmentación por umbralización, el cual hace una clasificación de esta en 2 clases de píxeles.3
Asimismo, se propone estudiar la diferenciación celular en 3 clases: circulares, deformadas alargadas (elongadas) y deformadas poco alargadas (otras deformaciones). Esta clasificación permite determinar formas que expresan elementos morfológicos relevantes para la evaluación del proceso de la angiogénesis, por ejemplo: formación de prolongamientos celulares, pérdida de la simetría radial, aparición de la simetría axial o de formas triangulares, variaciones de tamaño, y al sugerir diferentes niveles de deformación estos pueden ser correlacionados con la aparición de los fenotipos celulares tip y stalk.4 El primero se asocia con la aparición de formas elongadas y con el proceso de migración celular; el segundo, con la aparición de formas circulares y el proceso de proliferación de las células endoteliales.
Se emplearon como características morfológicas el coeficiente elíptico (ESF) y el coeficiente de circularidad (CSF),5 los cuales se basan en características geométricas de los objetos y han demostrado buen desempeño al ser empleados con anterioridad en estudios con eritrocitos6 y con HUVEC presentes en ensayos 3D.3 En ambos casos se adoptan formas semejantes a las definidas en la presente investigación. El valor de ESF expresa la elongación del objeto; mientras que CSF la cercanía del objeto a una forma circular.
Las ecuaciones que definen los descriptores CSF y ESF se describen a continuación, donde A y P son el área y el perímetro del objeto, respectivamente:

• Eme: Representa la abscisa menor del objeto.
• Ema: Representa la abscisa mayor del objeto.
Para determinar los valores de ESF y CSF idóneos según la clasificación de las HUVEC contemplando la tres clases anteriormente mencionadas, se realizaron varios experimentos en los rangos de variación comprendidos entre: 0,4<ESF<0,7 y 0,7<ESF<0,1; fuera de estos rangos los resultados no fueron representativos. Los resultados obtenidos mostraron que con el rango de variación que se describe a continuación se lograron los mejores resultados en la clasificación:
• Si ESF<0,5 la célula es deformada alargada o elongada.
• Si ESF>0,5 y CSF<0,9 la célula es deformada poco alargada o con otra deformación.
• Si ESF>0,5 y CSF>0,9 la célula es circular.
El proceso fue dividido en dos etapas:
1. Verificar la efectividad de la detección de células como resultado del proceso de segmentación y verificar la efectividad de realizar una clasificación supervisada en este tipo de imágenes, tomando una parte del total de las imágenes del conjunto.
2. Realizar la clasificación para todo el conjunto de imágenes restantes y el análisis estadístico de los resultados obtenidos.
Para validar la efectividad en la detección de células en las imágenes, se aplicó el siguiente funcional de calidad:
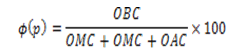
Donde:
• OBC: representa la cantidad de células bien detectadas en el proceso de detección p.
• OMC: cantidad de regiones pertenecientes a células no detectadas.
• OAC: cantidad de células mal detectadas.
Para evaluar el desempeño en la clasificación se utilizaron un conjunto de imágenes clasificadas de antemano, manualmente, por los especialistas. Estas fueron segmentadas y clasificadas según los criterios descritos anteriormente; igualmente, para cada clase obtenida se determinaron los valores de sensibilidad (TPR), precisión (P) y especificidad (TNR) que son medidas de calidad, extraídas a partir de la matriz de confusión.7
Luego de realizarse la clasificación para todo el conjunto de imágenes restantes, los resultados se procesaron mediante el software STATISTICA, versión 10. Para la comparación de los resultados entre las muestras control y las tratadas con la β2GPI se usó la propuesta de una prueba visual para comparar dos muestras no pareadas, que consiste en calcular intervalos de confianza por separado para cada alternativa y cómo estos se relacionan con respecto al valor medio.8 Este método brinda además información acerca de la dispersión de los datos.
Se consideró como valor representativo para el conjunto de imágenes que se corresponden a un pozo, el valor promedio de los parámetros medidos. Los intervalos de confianza para cada una de las clases fueron calculados con un nivel de confiabilidad de 95 %.
RESULTADOS
En la primera etapa se procesaron 40 imágenes (cerca de 18 % del total), con 985 células. Con el proceso de detección se alcanzó 95,07 % de efectividad y valores de OBC de 985, de OAC de 51 y no se tienen valores correspondientes a OMC. Todas las células presentes en las imágenes valoradas fueron detectadas, las regiones no pertenecientes a células detectadas se corresponden con elementos que provienen de la forma de preparación de las muestras que pueden ser: burbujas de aire, restos celulares o fragmentos insolubles. Esto evidencia la poca existencia de ruido en esas imágenes y hace factible aplicar como método de segmentación la umbralización. Con este análisis se demostró que el proceso de detección de las regiones de interés (células) en las imágenes valoradas es eficiente, ya que logra detectar correctamente la mayor cantidad de células posibles.
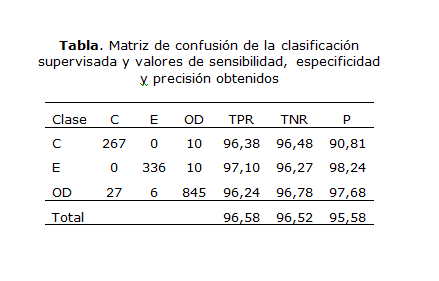
Como segundo paso de esta etapa se procedió a la clasificación de las células y se comparó con el criterio de los especialistas. La matriz de confusión del proceso de clasificación supervisada desarrollado y los resultados de las medidas obtenidas se muestran en la tabla, donde C se corresponde con la clase circular, E con la elongada y OD con la de otras deformaciones.
Los valores mostrados evidencian que los coeficientes elementales ESF y CSF presentaron un desempeño alto; asimismo, la sensibilidad para las 3 clases está por encima de 96 % y ninguna célula elongada fue clasificada como circular y viceversa. En el caso de las células con otras deformaciones, los errores en la clasificación se deben a la existencia de células con otras deformaciones en estas muestras que pueden presentar valores más cercanos a los valores de circularidad o de elongación.
En la segunda etapa se realizó la clasificación para todo el conjunto de imágenes restantes. En la figura se muestra el análisis estadístico para las 24 y 48 horas. En las células circulares y elongadas (A y B), los intervalos confidenciales se solapan y la media de ambos cae en el intervalo de confianza del otro y, por tanto, se concluye que no hay diferencias significativas entre la cantidad de células circulares y elongadas para las muestras control y tratadas, con un nivel de confiabilidad de 95 %.
En las células circulares se puede ver un ligero aumento en la media y en la dispersión en las muestras tratadas. En las elongadas, disminuye el valor de la media y los valores se concentran más en torno a esta en las muestras tratadas; mientras que en las muestras control la dispersión es mayor. Para las células con otras deformaciones, los intervalos de confianza no se solapan (C), lo que permite indicar que hay diferencias significativas entre las muestras control y las tratadas.
Se puede apreciar además que en las muestras tratadas hay una disminución en el valor de la media y un aumento en la dispersión, lo cual puede ser asociado a que en esta clase se contemplan todos los tipos de deformaciones celulares que existen en estas muestras que no llegan a ser propiamente células elongadas o circulares.
A las 48 horas, en las células elongadas y con otras deformaciones (E y F), los intervalos de confianza se solapan y la media de ambos cae en el intervalo confidencial del otro, por lo tanto se puede concluir que no hay diferencias significativas entre las muestras control y tratadas para estas clases, con un nivel de confiabilidad de 95 %.
En ambos casos, las muestras control tienen una mayor dispersión con respecto a la media y en las tratadas los valores se concentran más en torno a esta. En las células elongadas hay un aumento de la media con respecto a su control y en las células circulares los intervalos de confianza no se solapan (D), lo que permite indicar que hay diferencias significativas entre las muestras control y las tratadas. Se puede apreciar, además, que en estas últimas aumenta el valor de la media y la dispersión del intervalo en ambos casos se mantiene de forma similar.
DISCUSIÓN
El estudio de la morfología de las HUVEC es una herramienta importante debido a que la alteración en la estructura y en el crecimiento de estas células puede representar una respuesta positiva o negativa para el tratamiento en una enfermedad determinada.
Un ejemplo concreto donde se realiza el análisis morfológico es el estudio efectuado por Chotard et al,9 quienes proponen una metodología que a partir del uso de técnicas de morfología matemática realiza la cuantificación de estructuras con forma de tubos capilares y, precisamente, uno de los parámetros analizados es la forma de las estructuras. Por su parte, Angulo y Matou10 utilizaron el análisis morfológico, específicamente la relación eje menor/eje mayor, para el estudio de las interacciones células tumorales/células endoteliales; mientras que Liuet al11 proponen realizar una clasificación de células endoteliales en el sentido de elongadas o circulares teniendo en cuenta el coeficiente de circularidad, bajo varias combinaciones de tensión de cizallamiento y presión hidrostática en microfluidos.
En estos casos el análisis de la angiogénesis se realiza a partir de las 48 horas de incubación y la diferenciación que se propone considera solamente las células circulares o elongadas, lo cual no siempre es adecuado para emitir criterios sobre el desarrollo del proceso, pues también resulta interesante observar en cierto momento, diferencias que puedan sugerir otras formas celulares que aparecen en estas muestras.
Sobre la base de lo expuesto, en la presente investigación se propone un método para realizar el análisis morfológico cuantitativo de HUVEC en imágenes digitales de cultivos 2D in vitro obtenidas a las 24 horas, y que están bajo la influencia de la proteína plasmática β2GPI; asimismo, para la clasificación celular se propone considerar 3 clases: células circulares, elongadas y con otras deformaciones mediante los coeficientes elementales del análisis de formas ESF y CSF.
Con el empleo de este método es posible obtener un criterio sobre la diferenciación celular asociada al proceso de la angiogénesis con más de 96 % de sensibilidad y en etapas tempranas del proceso de incubación, o sea, a las 24 horas.
AGRADECIMIENTOS
Este trabajo está soportado por las agencias de investigación brasileñas CAPES, FAPESP y CNPq, la Universidad de São Paulo, la Universidad Fluminense de Brasil y la Universidad de Oriente, Cuba. Agradecemos a los Doctores en Ciencias: Durvanei Augusto Maria, Mikiya Muramatsu, Adriano Alencar y Diogo Soga, de la Universidad de São Paulo, Brasil y a Larisa Zamora de la Universidad de Oriente por su colaboración en el análisis de los resultados.
REFERENCIAS BIBLIOGRÁFICAS
1. Shibuya M. Vascular endothelial growth factor and its receptor system: physiological functions in angiogenesis and pathological roles in various diseases. J Biochem. 2013;153(1):13-9.
2. Chiu WC, Chiou TJ, Chung MJ, Chiang AN. β2-glycoprotein I inhibits vascular endothelial growth factor-induced angiogenesis by suppressing the phosphorylation of extracellular signal-regulated kinase 1/2, Akt, and endothelial nitric oxide synthase. PLoS ONE. 2016 [citado 29 Oct 2017];11(8). Disponible en: https://www.ncbi.nlm.nih.gov/pubmed/27579889
3. Machado C, Escobedo M, Nigro C, Vass S, Cassia P, Augusto D, et al. Digital image processing assessment of the differential in vitro antiangiogenic effects of dimeric and monomeric beta2-glycoprotein I. J Cytol Histol. 2013 [citado 29 Oct 2017]; 4. Disponible en: https://www.omicsonline.org/digital-image-processing-assessment-of-the-differential-in -vitro-antiangiogenic-effects-of-dimeric-and-monomeric-betaglycoprotein-i-2157 -7099.1000187.php?aid=19899
4. De Falco S. Antiangiogenesis therapy: an update after the first decade. Korean J Intern Med. 2014;29(1):1-11.
5. Nok Chiu S, Stoyan D, Kendall W, Mecke J. Stochastic geometry and its applications. New York: John Wiley & Sons; 2013.
6. Fernández K, Herold S, Fernández A, Escobedo M, Coello G, Marrero P. Estudio morfológico en muestras de sangre periférica. La Habana: V Congreso Latinoamericano de Ingeniería Biomédica (CLAIB2011); 2013. p. 543-6.
7. Stehman S. Selecting and interpreting measures of thematic classification accuracy. Remote Sensing of Environment. 1997; 62(1):77-89.
8. Jain R. The art of computer systems performance analysis. New York: Wiley; 1991.
9. Chotard Ghodsnia R, Haddad O, Leyrat A, Drochon A, Verdier C, Duperray A. Morphological analysis of tumor cell/endothelial cell interactions under shear flow. J Biomech. 2007; 40(2):335-44.
10. Angulo J, Matou S. Application of mathematical morphology to the quantification of in vitro endothelial cell organization into tubular-like structures. Cell Mol Biol. 2007; 53(2):22-35.
11. Liu M, Shih H, Wu J, Weng T, Wu C, Lu J, et al. Electrofluidic pressure sensor embedded microfluidic device: a study of endothelial cells under hydrostatic pressure and shear stress combinations. Lab Chip. 2013;13(9):1743-53.
Recibido: 30 de octubre de 2017.
Aprobado: 5 de enero de 2018.
Miriela Milagros Escobedo Nicot. Universidad de Oriente, avenida Patricio Lumumba s/n, reparto Jiménez, Santiago de Cuba, Cuba. Correo electrónico:miri@uo.edu.cu