Introducción
El cáncer cutáneo no melanoma (CCNM) es el tipo de neoplasia maligna más frecuente en el hombre, que incluye a los carcinomas basocelular (CBC) y de células escamosas.1 Cada año se notifican en el mundo entre 2 y 3 millones de nuevos casos y se estima, que mueren 66 000 personas a causa de esta enfermedad. Debido a su frecuencia e incremento cada año, constituye un problema de salud a escala mundial.2,3
Actualmente, Cuba se sitúa entre los países de América Latina y el tercer mundo con mayor incidencia del CCNM, donde ocupa el primer lugar. En el Anuario Estadístico de Salud cubano del 2017 se muestra la incidencia del cáncer de piel en el país durante el 2016, que fue de 12 209 pacientes, de los cuales el mayor número presentó CBC.4
El carcinoma basocelular es una neoplasia maligna derivada de las células no queratinizadas, que se originan de la capa basal de la epidermis. Se presenta localmente, crece con lentitud y rara vez metastiza, pero puede ser desfigurante y provocar graves deformidades o pérdida de la función del órgano afectado.5)
De hecho, existen múltiples factores de riesgo relacionados con este tipo de tumor, entre los cuales sobresalen: exposición a la radiación ultravioleta, fenotipo (fototipos claros de Fitzpatrick), antecedente personal o heredofamiliar de CBC, senilidad e inmunosupresión.6) Tiene varias formas clínicas e histológicas, que le confieren individualidades propias. La dermatoscopia aumenta la exactitud del diagnóstico. Las estructuras dermatoscópicas asociadas a esta neoplasia se clasifican en: pigmentadas, vasculares y no pigmentadas/no vasculares.7)
Estos carcinomas tienen un pronóstico favorable y casi siempre pueden ser tratados con intención curativa. Por estas razones, resulta conveniente disponer de nuevas alternativas de tratamiento, que tengan ventajas específicas sobre otras técnicas y puedan ser más convenientes para algunos casos, incluso los que han recidivado o no han tenido respuesta completa a otros planes terapéuticos.8
Ahora bien, el HeberFERON® es un medicamento cubano cuya composición radica en una combinación de interferón alfa 2b y gamma; ambos muestran propiedades antiproliferativa, inmunomoduladora y antiangiogénica. Estos 2 principios activos actúan de forma sinérgica y promueven una respuesta antitumoral más rápida y prolongada, con un perfil de seguridad excelente. Este tratamiento es 5-10 veces más potente que el uso de los interferones por separado; puede utilizarse antes o después de una cirugía o como primera opción combinado con quimioterapia y radioterapia.9
Teniendo en cuenta los beneficios de este medicamento, los autores de la investigación se trazaron como objetivo determinar la respuesta al HeberFERON® en los pacientes con carcinoma basocelular.
Métodos
Se realizó un estudio observacional, descriptivo y longitudinal de 90 pacientes, quienes acudieron a la Consulta de Dermatología del Hospital General Docente Dr. Juan Bruno Zayas Alfonso de Santiago de Cuba, con diagnóstico de carcinoma basocelular, desde enero de 2017 hasta diciembre de 2019.
Al llegar el paciente se realizó la historia clínica, los exámenes clínico y dermatoscópico de la lesión; se le explicó en qué consistía el tratamiento y que era necesaria la realización de una biopsia para confirmar el diagnóstico en caso de que no la tuviera, así como la obtención de exámenes complementarios, para lo cual se solicitó su aprobación (consentimiento informado). Se le entregó una hoja informativa donde se explicaba detalladamente en qué consistía el tratamiento y se citó a una segunda consulta, en la cual se valoraron los resultados histológicos y paraclínicos obtenidos. Nuevamente se expusieron las alternativas de tratamiento y en caso de estar conforme con la aplicación del HeberFERON®, se le solicitó su consentimiento por escrito y se incluyó en el estudio, si cumplía con los criterios de inclusión. Para recopilar la información se elaboró una planilla de recogida del dato primario de los pacientes incluidos en el estudio.
En cada sesión se aplicó 3 bulbos (10,5MUI) de HeberFERON® (bulbos 3,5MUI) de forma perilesional e intradérmica, con una frecuencia 3 veces semanal, durante 3 semanas, para un total de 9 dosis administradas. Se realizó seguimiento del paciente cada 4 semanas hasta completar las 16 para realizar la evaluación final, donde se precisó el tamaño de la lesión, los cambios clínicos, dermatoscópicos e histológicos y los eventos adversos.
Para determinar la respuesta, se tuvieron en cuenta los criterios internacionales propuestos para la evaluación de respuesta en tumores sólidos (RECIST, por sus siglas en inglés), que los clasifica en: respuesta completa (RC), cuando la lesión desaparece de manera total; respuesta parcial (RP), si hay reducción de, al menos, 30 % de la suma de los diámetros mayores; enfermedad estable (EE), cuando la reducción no es suficiente para clasificar como repuesta parcial y enfermedad progresiva (EP), si hay incremento de, al menos, 20 % en la suma de los diámetros mayores.
Los datos primarios fueron procesados con el programa informático para el análisis estadístico SPSS para Windows, versión 20.0 y EpiDat; versión 3.0. Posteriormente, la información fue llevada a tablas y gráficos estadísticos con valores absolutos y porcentuales.
Esta investigación se realizó de acuerdo con los principios establecidos en la declaración de Helsinki. Se cumplió con los criterios de la bioética, pues se protegió el derecho a la intimidad y la confidencialidad de la información de cada paciente. Se contó además, con la aprobación de los consejos científico y de ética de la institución.
Resultados
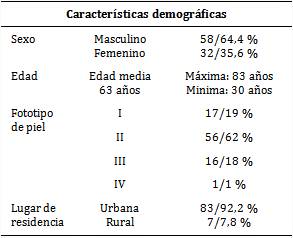
Como se observa en la tabla 1, prevaleció el sexo masculino con 58 pacientes (64,4 %) y la edad media fue de 63 años. El mayor número de afectados presentó fototipo de piel II (56 para 62,0 %) y 93 (92,2 %) procedían del área urbana.
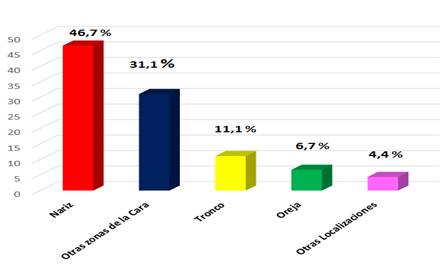
En la figura 1 se muestra un predomio de las lesiones localizadas en la nariz (42 pacientes para 46,7 %), seguidas de las situadas en otros sitios de la cara (28 para 31,1 %).
Resulta importante señalar, que 33,3 % de los pacientes tratados tenían riesgo de mutilación del área afectada.
En la casuística prevaleció el subtipo clínico nodular (41 pacientes para 45,6 %) seguido del superficial (34 para 37,8 %); 40,0 % de las lesiones eran recidivantes. El subtipo histológico sólido primó en 42 afectados (46,7 %).
Respecto a los eventos adversos, preponderó la fiebre en 63,0 % de los integrantes de la serie, seguida de la astenia y las artralgias en 52,7 y 50,9 %, respectivamente. Los eventos presentados por los pacientes fueron leves y moderados, contra estos últimos, se requirió la administración de analgésicos y antipiréticos, los cuales fueron de corta duración (menos de 24 horas). No se informaron eventos graves.
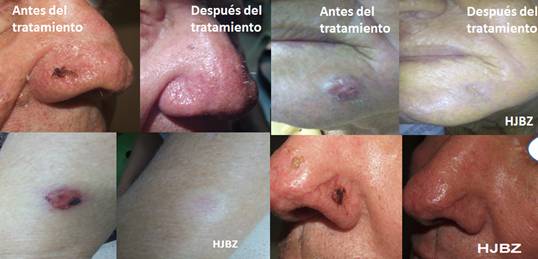
Cabe destacar, que la respuesta al tratamiento fue completa en 60,0 % de los pacientes (fig.2) y en 21,1 % se logró una disminución de la lesión de 30,0 % o más. Se alcanzó 81,1 % de respuesta objetiva y en 100,0 % el control de la enfermedad (tabla 2).
Discusión
En investigaciones realizadas también se han señalado resultados similares a los expuestos anteriormente en cuanto a los grupos de edades.10) En tal sentido, un estudio de 1 669 pacientes con diagnóstico de carcinoma basocelular en Bucaramanga, Colombia, encontró un predominio del grupo de 70-79 años de edad.11 En cuanto al sexo, prevaleció el masculino (72,7 %) respecto al femenino (27,2%), lo cual coincide con los datos epidemiológicos encontrados a esacala mundial, donde se notifica mayor frecuencia de CBC en los varones, con una proporción de 2:1 presumiblemente relacionado con una mayor exposición al sol por motivos ocupacionales.12
Se observa un predominio de pacientes provenientes de zonas urbanas, lo cual podría estar relacionado con el estilo de vida citadino, prácticas cotidianas de deporte, exposiciones frecuentes al sol, entre otras actividades donde no se usan adecuadamente los medios de protección; sin desestimar que el hospital donde se realizó el estudio se localiza en la ciudad y el mayor número de personas que acuden radican en ella.
En relación con el fototipo cutáneo, los resultados obtenidos coinciden con datos encontrados donde se notifica, que 90,0 % de los pacientes con CBC tienen color de la piel blanco, así como cabellos y ojos claros (fototipos I y II). Además, cabe destacar, que la patogenia del cáncer basocelular está principalmente relacionada con la fotoexposición a los rayos ultravioletas y la poca tendencia a broncearse.12
Por otro lado García y Millares13 señalan, que la mayor frecuencia de carcinoma no melanocítico se encontraba en pacientes con fototipos cutáneo I y II, personas que se queman fácilmente y no se broncean. En tal sentido, se plantea que mientras es menor el fototipo de piel mayor será el riesgo de presentar CBC.14
Ahora bien, 80,0 % de los carcinomas basocelulares se localizan en cabeza y cuello, siendo más frecuente la región facial; dentro de ella la más afectada es la zona de la máscara facial, que presenta alto riesgo, conocida también como área H, que abarca pirámide nasal, áreas paranasales, regiones temporales, perioculares, peribucal, preretroauriculares y retroauriculares. En esta zona existen distintos factores, tales como mayor densidad de nervios y de glándulas sebáceas, además de que la dermis se encuentra más cercana al pericondrio, periostio y músculo, lo cual favorece que el tumor desarrolle extensiones laterales y profundas más importantes.15 Las neoplasias originadas en esta región presentan mayor tasa de recaída local, destrucción y mutilación en estas estructuras.16
La recidiva de los carcinomas basocelulares a los 5 años es de 5,0 % aproximadamente para los primarios y de 15,4 % para los que fueron tratados previamente. Entre los factores implicados en las recidivas figuran: tamaño del tumor mayor de 2 cm de diámetro, localización en nariz, pliegue nasolabial o región periocular, probablemente relacionado con la dificultad de conseguir márgenes de extirpación adecuados dada la anatomía de estas zonas, lo cual concuerda con lo referido por algunos autores.17
Cabe agregar, que los datos obtenidos en esta investigación concuerdan con otro estudio14 donde el subtipo clínico e histológico nodular tuvo mayor frecuencia.
Los eventos adversos que se han notificado durante el uso del HeberFERON® en estudios previos16,18 son similares a los informados para los interferones de forma general, siendo los más frecuentes: fiebre, cefalea, malestar general, artralgia, mialgia, anorexia, escalofríos y otros.15,19
Sánchez et al15 refieren, que de los 31 pacientes en los cuales se concluyó la aplicación del HeberFERON®, se alcanzó una respuesta objetiva en 93,7 % y completa en 62,5 %. Por su parte, Anasagasti et al20 apuntan que 95,0 % de los pacientes tratados con dicho medicamento obtuvieron una respuesta objetiva y 42,1 % de ellos logró una respuesta completa, lo cual demuestra la superioridad de este tratamiento ante el grupo tratado con IFNα-2b. Asimismo, Ferrá et al20) alcanzaron respuesta completa en 15 pacientes (68,1 %), parcial en 7 (31,9 %) y objetiva en todos ellos (100,0 %).
Se concluye, que el HeberFERON® resultó de gran utilidad en los pacientes con carcinoma basocelular, puesto que se obtuvo una respuesta completa en más de la mitad de ellos, lo cual estuvo relacionado con las características específicas de la lesión.