Introducción
Los tumores malignos constituyen un gran desafío para las ciencias médicas, de ahí que la lucha contra esta enfermedad es una prioridad para la Organización Mundial de la Salud (OMS) desde 2005.1) Desde hace más de tres décadas deviene la segunda causa de muerte en Cuba, solo antecedida por las enfermedades cardiovasculares;2,3) mientras que la tasa de mortalidad por tumores cerebrales primarios, entre los que sobresalen el glioma y el meningioma, se aproxima a la de incidencia, lo cual pone de relieve la gran letalidad de estos, pues provocan 2 % de las muertes por tumores malignos.1,4,5
Actualmente, en pacientes con tumor cerebral primario maligno, el tratamiento de primera línea es la intervención quirúrgica, seguida por la radioterapia y la quimioterapia. En Cuba, el protocolo terapéutico vigente en el Instituto Nacional de Oncología y Radiobiología (INOR) propone la radioterapia durante 6 semanas como tratamiento adyuvante de dicha intervención en adultos, asociada a la inmunoterapia o seguida de esta.1,6
El nimotuzumab es el anticuerpo monoclonal (AcM) humanizado, producido en el Centro de Inmunología Molecular de Cuba,1,6,7 recomendado como inmunoterapia para los afectados por estos tipos de tumores, según el protocolo anterior. Este bloquea la unión del ligando al receptor del factor de crecimiento epidérmico (EGFR), inhibe la actividad de la tirosina quinasa del receptor e interfiere con la ruta de señalización celular involucrada en la proliferación de células y posee efectos antiangiogénico, antiproliferativo y proapoptótico en aquellos tumores que sobrexpresan el EGFR, de manera que inhibe el crecimiento de células tumorales de origen epitelial in vitro e in vivo.8,9,10,11) Otros hallazgos clínicos demuestran la sinergia de este AcM cuando se combina con radioterapia y quimioterapia.12,13,14,15
A pesar de que el nimotuzumab cuenta con registro nacional para el tratamiento de pacientes con diversos tumores malignos y continúa su evaluación a escala mundial, a través de ensayos clínicos para diferentes localizaciones, aún la experiencia sobre su uso es insuficiente, por lo que los estudios de farmacovigilancia resultan indispensables para complementar y ampliar la información sobre su seguridad y efectividad en la práctica médica habitual,12pues los eventos adversos (EA) que se presentan a largo plazo no pueden ser detectados antes del registro y comercialización del producto.
Por todo lo anterior los autores decidieron realizar la presente investigación con el objetivo de caracterizar los EA relacionados con la administración de este medicamento en pacientes con tumor cerebral primario.
Métodos
Se realizó un estudio descriptivo y transversal de todos los pacientes con tumor cerebral primario confirmado por técnicas histológicas, tratados con el AcM nimotuzumab en el Departamento de Ensayos Clínicos del Hospital Provincial Docente Saturnino Lora Torres” de Santiago de Cuba, entre mayo de 2017 y abril de 2019, de los cuales se seleccionó una muestra de 41 de ellos mediante muestreo por conveniencia.
Como variables de respuesta primaria y secundaria a los EA se consideraron aquellas que permitieron clasificar a estos eventos, tales como el conocimiento previo sobre el EA, la frecuencia de aparición, la intensidad, el resultado, la actitud respecto al medicamento y relación de causalidad; también se tuvieron en cuenta algunas variables de control como tiempo con tratamiento y tipo de tumor.
Para la obtención de los datos primarios se implementó un método activo de farmacovigilancia, fundamentado en la recolección de forma sistemática y detallada de los EA que aparecieron después de la administración del nimotuzumab en cada consulta.
Esta investigación se desarrolló siguiendo los postulados éticos relacionados con la investigación biomédica con seres humanos.
Resultados
En esta casuística, la administración de nimotuzumab fue de 5,2 veces como promedio por cada persona tratada (213 administraciones). Predominó sexo femenino (58,5 %) y el grupo etario de 55 años y más (43,9 %). Cabe destacar que la edad de los incluidos en la serie estuvo comprendida entre 27 y 75 años, con un promedio de 49,6 años y una variabilidad media de 10,9. En general, todos los pacientes estudiados presentaron al menos un evento adverso.
Como se observa en la tabla 1, se identificaron 31 eventos adversos que aparecieron en 388 ocasiones, de los cuales 17 resultaron ser conocidos, aceptados en su prospecto como reacciones adversas medicamentosas (RAM), y 14 no conocidos. Entre los primeros, la cefalea, la debilidad muscular en miembros inferiores (MI), la fosfatasa alcalina elevada (FA) y las náuseas fueron los más comunes; entre los segundos, el mareo, la hiperalbuminemia y la visión borrosa.
Tabla 1 Episodios de eventos adversos según su conocimiento previo
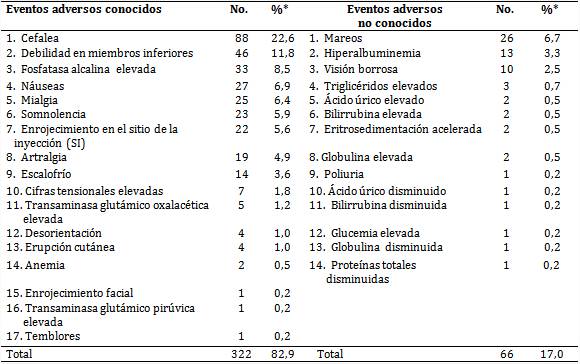
*Porcentajes calculados sobre la base del total de eventos adversos (388).
Como EA más frecuentes (tabla 2) prevalecieron la cefalea (80,5 %), la debilidad en MI (48,8 %) y la FA elevada (41,5 %), en ese orden. En general, entre 12-80 % de los pacientes padeció alguno de ello.
Asimismo, se aprecian 3 grupos de EA preponderantes por aparecer en más de 10,0 % de los pacientes, a saber: los que presentaron más de 30,0 %; un grupo intermedio, entre 20,0-30,0 % y por último, inferior a 20 %.
Con el término de otros se consideraron 18 de dichos eventos, entre conocidos y no conocidos, presentes en 12 pacientes, con una frecuencia de aparición menor de 10 %, es decir, en menos de 4 de los afectados.
Tabla 2 Pacientes según eventos adversos más frecuentes
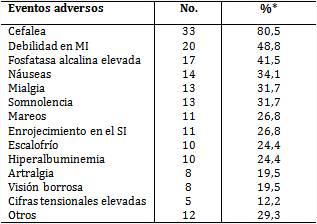
* Porcentajes calculados sobre la base del total de pacientes
Teniendo en cuenta los criterios terminológicos comunes para eventos adversos, el total de estos fueron categorizados como ligeros o de grado 1, según su intensidad; reversibles, según sus resultados y sin cambios, según la actitud respecto al medicamento, ya que no hubo que modificar la dosis o interrumpir el tratamiento por esa causa.
En lo adelante, solo se hará referencia a los EA más frecuentes y que presentaron diferentes categorías de causalidad (tabla 3), con predominio de los clasificados como posibles (42,5 %), seguidos de los probables (32,9 %), con las particularidades de que los EA no conocidos (mareos e hiperalbuminemia) siempre fueron condicionales por no estar descritos como RAM; mientras que la visión borrosa se consideró no relacionada en todos los casos, pues al no estar descrita como RAM, se pudo explicar por el cuadro clínico de la enfermedad de base del paciente.
Hubo EA que no adquirieron la categoría de definitiva (cefalea, debilidad en MI y las náuseas), a pesar de haber reaparecido con la reexposición al medicamento, porque al igual que lo expresado en el párrafo precedente, se pueden explicar por el cuadro clínico que motivó a la prescripción del AcM o por efectos de otros fármacos.
Tabla 3 Episodios según eventos adversos más frecuentes y relación de causalidad
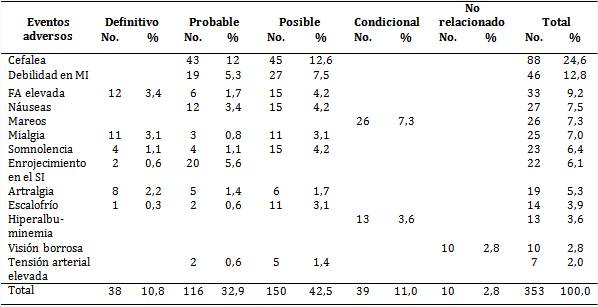
La relación de causalidad se estableció según algoritmo de Karch y Lasagna
En la tabla 4 se aprecia que los eventos adversos preponderaron en el primer año de tratamiento (49,8 %); en el segundo hubo algunos menos comunes y otros, por el contrario, aumentaron su ocurrencia (FA elevada, náuseas, mialgia, artralgia, mareos y cifras tensionales elevadas); pero excepto estas últimas, en el tercero, todos disminuyeron su aparición en cuanto al primero.
Según la prueba de bondad de ajuste aplicada las diferencias fueron estadísticamente significativas y no hubo correspondencia entre ambas distribuciones de frecuencias; es decir, los años con un determinado plan terapéutico no se relacionaron con el número de veces que aparecieron los EA más frecuentes.
Lo anterior es más evidente cuando se analizan los promedios de cada intervalo de tiempo, puesto que los 20 pacientes (9 con dosis de inducción y 11 con dosis de mantenimiento) incluidos en el primer año de tratamiento, presentaron una media de 8,8 eventos, la cual fue de 10,4 en los 14 que estaban en el segundo y de 4,6 en los 7 del tercero.
Tabla 4 Eventos adversos más frecuentes y tiempo de tratamiento

* Eventos adversos que aumentaron su frecuencia del primer al segundo año
Todos los porcentajes se calcularon sobre la base del total de eventos adversos (353)
χ2 = 23,668 P = 1,148 E-6
En la serie (tabla 5) se produjeron más EA en los pacientes con meningioma que en aquellos con glioma, lo cual estuvo relacionado con la proporción de afectados por estos tipos de tumores (26 y 15, respectivamente).
Exceptuando la mialgia, la somnolencia y la visión borrosa, los restantes EA tuvieron una frecuencia relativa menor en los pacientes que presentaban glioma. Solo se encontró asociación entre el tipo de tumor y la FA elevada.
Discusión
El hecho de que en todos los pacientes estudiados se identificara, al menos un EA, evidencia las ventajas del método de farmacovigilancia activa, independientemente de ello, Álvarez et al,13) quienes emplearon un método pasivo para identificar y caracterizar EA del nimotuzumab, encontraron en su investigación que más de la mitad de los pacientes presentaron alguno.
Las EA identificados en la casuística se notificaron en los ensayos clínicos que permitieron el registro del medicamento, en los cuales se determinó la relación de causalidad para considerarlos como reacciones adversas del nimotuzumab, además se han informado en otros estudios después de su registro;8,9,10,11 sin embargo, de los eventos no conocidos no se tiene información en publicaciones anteriores o posteriores a la comercialización del medicamento.7,8,12
En investigaciones nacionales y foráneas12,13,16,17 también se describen como eventos adversos frecuentes la cefalea, el enrojecimiento en el SI, el escalofrío y la cifras tensionales elevadas.
De igual manera, en esta serie, las características de los EA vinculados con la administración del mencionado medicamento, relacionadas con la intensidad, los resultados y la actitud respecto al medicamento, distinguen el excelente perfil de seguridad de este anticuerpo sobre otros que tienen como diana terapéutica el EGFR, lo cual se fundamenta en la afinidad optimizada que presenta, que permite preservar el efecto terapéutico junto con la seguridad. Lo anterior significa que posee una fuerza de unión intermedia y es más sensible a unirse a las células con mayor densidad del EGFR, como las tumorales, que otras con expresión normal del EGFR.12,13
Cabe señalar que de los estudios consultados para analizar la relación de causalidad, el de Saborido et al,18) resultó ser el único donde la cefalea no fue un evento adverso frecuente del nimotuzumab, pues lo utilizaron para el tratamiento de pacientes con tumores de esófago, lo cual pudiera explicarse, independientemente de que esté descrita como una RAM, que su aparición se relacione más con el cuadro clínico de la enfermedad (tumor cerebral primario) que con el medicamento.
Estos mismos autores refieren que la mayoría de los EA fueron posibles y probables igual que en la presente investigación, pero revelaron que un elevado número de pacientes experimentaron eventos no relacionados con el anticuerpo y sí con la radioterapia, a diferencia de lo encontrado en este estudio, donde esta última no fue concurrente con el uso del medicamento.
La tendencia a disminuir la frecuencia de EA con el mayor tiempo de exposición al medicamento, concuerda con lo informado por Martínez et al 12) en su artículo sobre seguridad y efectividad del nimotuzumab en los pacientes con tumores gliales malignos; hallazgos que reafirman que este medicamento puede administrarse durante largo tiempo de forma mantenida, a fin de garantizar el control de la enfermedad, en contraste con la quimioterapia tradicional de estrecho margen de seguridad, que limita su uso prolongado.
Figueredo et al19) también describieron la asociación entre el tipo de tumor y la FA elevada en pacientes con meningioma que habían sido tratados con nimotuzumab; mientras que Simó et al,20 plantearon en un estudio reciente que el meningioma es el tumor primario intracraneal más frecuente y representa aproximadamente 35,5 % de todos los tumores cerebrales primarios, cuya prevalencia se estima en alrededor de 97,5/100 000 habitantes, con una incidencia anual de 7,1 por cada 100 000 habitantes en Estados Unidos de Norteamérica.
Se concluye que la caracterización de los EA relacionados con la administración del nimotuzumab, en pacientes con tumor cerebral primario, son similares a los descritos en estudios que también avalan la seguridad del medicamento.
















