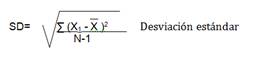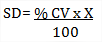Introducción
El laboratorio clínico acompaña al médico de cabecera en el diagnóstico, al establecer pronósticos, en la evaluación del tratamiento y en la rehabilitación. Según algunos criterios, la mayoría de las decisiones clínicas están basadas en esta especialidad, por lo cual la calidad tiene que estar presente en todos los procesos que se llevan a cabo en esos servicios tecnológicos, a fin de lograr resultados confiables y clínicamente útiles. De acuerdo con lo anterior, los profesionales del laboratorio deben contribuir a posicionar al paciente en el centro de la atención sanitaria; cuestión imprescindible, según la Organización Mundial de la Salud, para lograr los objetivos planteados en la Agenda Mundial hasta el 2030.1
El sistema de gestión de la calidad promueve la ejecución de actividades de forma planificada y se sostiene en la dirección de la organización, que despliega los esfuerzos hacia la mejora continua para superar las expectativas de los clientes.2Por su parte, el control interno de calidad en el laboratorio clínico es un componente de la gestión, una actividad especializada que mediante mecanismos, procesos y procedimientos monitoriza el sistema de medición y asegura que los resultados sean confiables y que todos los requerimientos de la calidad sean alcanzados.1
Este control permite aceptar o rechazar las corridas analíticas de las diferentes determinaciones y posibilita, a su vez, adoptar las medidas preventivas dirigidas a evitar o minimizar las fuentes de errores. Las primeras evidencias del control interno de calidad en el laboratorio clínico fueron la aplicación de las cartas de control por Levey y Jennings, en 1950, enriquecidas más tarde por Henry y Segalove, al incluirse las primeras reglas de control. En 1974 se añadieron otras reglas, organizadas por Westgard, hasta la combinación de otras, conocidas hoy día como reglas de Westgard o multirreglas de control de calidad.3
Las agencias internacionales que norman la calidad promueven las buenas prácticas del laboratorio y orientan la implementación de un sistema de gestión de la calidad, donde esté incluido el aseguramiento y el control de esta. En la Norma ISO 15189, Requerimiento para la calidad y competencia de los laboratorios médicos, adoptada como el modelo de acreditación de laboratorios en muchos países, se plantea que el laboratorio debe diseñar un sistema de control de calidad interno adecuado para verificar el logro de la calidad esperada en los resultados.4) Esta y otras normas sirvieron de base para que el Centro para el Control Estatal de Medicamentos, Equipos y dispositivos médicos (CECMED) del Ministerio de Salud Pública de Cuba, aprobara y pusiera en vigor la Regulación D 03-21 Buenas Prácticas de Laboratorio Clínico en su tercera edición, la cual constituye la referencia para la implementación de los requisitos de buenas prácticas de los laboratorios clínicos en Cuba y para que el CECMED verifique su cumplimiento a través de las inspecciones.5
En los procesos del laboratorio clínico se incluyen 3 fases de trabajo, a saber: preanalítica, analítica y posanalítica. Se considera que más 80 % de los problemas se generan antes y después de la etapa analítica; no obstante, aunque los errores analíticos son menos frecuentes se puede inferir que son los más trascendentales.
Westgard JO4) considera que la calidad analítica en los laboratorios es, probablemente, aún más crítica en la actualidad debido a que las pruebas se realizan a los pacientes por procesos de medición diferentes, en laboratorios diferentes y por personal con conocimientos diferentes. Por otra parte, Acosta y Peñate6) refieren que los procedimientos empleados para obtener los resultados, generalmente se encuentran expuestos a factores que introducen errores aleatorios o sistemáticos y que pueden comprometer la confiabilidad de dichos resultados.
En concordancia con lo anterior se considera que la garantía en la confiabilidad de los resultados en un laboratorio tiene como sustento los programas de controles interno y externo de la calidad, basados en las normas y estándares mundiales.7
Según Del Campilloet al8) actualmente se reconoce la falta de armonización en las metas de calidad propuestas por distintas fuentes. Así, en noviembre 2014, la Federación Europea de Química Clínica y Medicina de Laboratorio organizó la primera conferencia estratégica para definir especificaciones globales de calidad analítica.
Al respecto se plantea la necesidad urgente de garantizar que en los diferentes laboratorios se obtengan los mismos resultados analíticos sobre cualquier muestra. Un proceso de control de la calidad basado en la ciencia será un prerrequisito para proporcionar este nivel de desempeño analítico que apoyará el movimiento de los pacientes a través de fronteras y manteniendo resultados estandarizados.4)
Dadas las diferencias inherentes entre los laboratorios, basadas en sus recursos, capacidades y misiones, es de esperar que los sistemas de control interno de la calidad varíen de uno a otro; sin embargo, todos deberían estar diseñados atendiendo a iguales principios para garantizar que se cumplan los objetivos y requerimientos de la calidad. Esta actividad se ha enriquecido en el mundo, pero en la mayoría de los laboratorios de la región no se ha logrado actualizarlas, de ahí que algunos especialistas han sugerido nuevas herramientas que complementan las tradicionales, por lo cual se diseñó un software con una guía práctica actualizada para perfeccionar el control interno de la calidad en los laboratorios clínicos, teniendo en cuenta las diferentes condiciones tecnológicas y las exigencias de los órganos reguladores nacionales e internacionales para tales fines.
Etapas en el proceso de análisis en los laboratorios clínicos
Como se planteó anteriormente, este proceso incluye 3 subprocesos, etapas o fases (preanalítica, analítica y posanalítica), con el fin de obtener resultados confiables y así contribuir a la seguridad del paciente,4,9 lo que se describe como sigue:
Fase preanalítica: Es la etapa previa a la realización del análisis de laboratorio, donde los procesos comienzan cronológicamente, desde la solicitud de los análisis por el médico, y terminan cuando comienza el procedimiento analítico.5
Fase analítica: Es donde se realiza el análisis y se controla la calidad de este.5 Entre las partes que se incluyen en esta se encuentran el fraccionamiento de las muestras, la configuración del equipo, la calibración del ensayo, el procesamiento de la muestra y el control de la calidad.9
Con referencia al control de la calidad en la fase analítica, hoy día constituye una herramienta indispensable en el laboratorio clínico para alcanzar la excelencia en el trabajo. El control interno y externo se realiza después de verificado el método que se desea desarrollar.
Con la finalidad de garantizar la confiabilidad de los resultados generados en el laboratorio clínico, es necesario implementar un programa de control de calidad interno (PCCI) y complementarlo con la participación en programas de evaluación externa de la calidad (PEEC). En esencia, los PCCI comparan el desempeño del laboratorio con sí mismo y en función del tiempo; mientras que los PEEC estiman el error sistemático de los procedimientos de medida empleados y se comparan los resultados con otros laboratorios; también verifica la exactitud de los métodos y asegura que el desempeño estable de estos se encuentre alineado con los valores verdaderos o correctos.6
Todas las determinaciones de laboratorio están expuestas a múltiples fuentes de errores, tanto evitables como inevitables, que en conjunto determinan su calidad. En el trabajo de laboratorio existen 2 posibles fuentes de variación de errores: el aleatorio (por azar) y el sistemático.
La precisión se define como la mejor concordancia entre resultados de mediciones independientes, obtenidos mediante un procedimiento de medición que solo depende de la distribución de los errores aleatorios de dicho procedimiento, y constituye una medida de la reproducibilidad y la repetibilidad. No tiene expresión numérica.
La imprecisión es la dispersión de resultados independientes, alcanzados mediante un procedimiento de medición, bajo condiciones específicas y tiene expresión numérica; es el inverso de la precisión y puede ser medida sobre un sistema de ordenadas como pequeña, media y grande.9
Fase posanalítica: Comienza cuando los resultados se liberan y se informan en las indicaciones médicas y concluye cuando se entregan al usuario, es decir incluye los procesos que siguen al análisis: revisión y conservación de los resultados, retención y almacenamiento de las muestras, desecho de la muestra (y los residuos), preparación del informe de laboratorio y su interpretación, autorización para la entrega y transmisión de los resultados.5
Error analítico aleatorio
Se refiere a la imprecisión y puede ser negativo o positivo. Este tipo de error suele causar variaciones mínimas, pero en ocasiones puede cambiar radicalmente y convertirse en el motivo de grandes variaciones. Este se debe a causas accidentales difíciles de determinar y ocasiona más imprecisión, es decir, a mayor error aleatorio más amplia es la distribución (menos precisa). Se cuantifican a través del cálculo de la media (), la desviación estándar (SD) y el coeficiente de variación (CV).
Entre las causas del error aleatorio figuran: fluctuaciones en condiciones ambientales (temperatura/humedad); oscilaciones en la corriente eléctrica; temperatura de incubación inestable; diferencias en el personal del laboratorio, en pipeteo, tiempos y otros; burbujas en los reactivos o líneas de reactivos; errores en el pipeteo, mezcla o agitación; uso de material de reactivo, control y calibrador equivocado; deterioro inesperado del reactivo, control o calibrador; reutilización del material desechable y problemas de funcionamiento de los equipos.
Por su parte, la exactitud, el sesgo o la veracidad se refieren a la concordancia entre el valor obtenido y el valor real de lo que se mide.4,6,9
Error analítico sistemático
Se refiere a la inexactitud y está siempre en una dirección, por encima o por debajo del valor verdadero. Se debe a una misma causa que se repite, desplaza al valor promedio del verdadero, se cuantifica con el sesgo y es el error más común; asimismo, puede ser constante o proporcional y es relativamente fácil de identificar.
Como principales causas del error sistemático sobresalen las siguientes: deterioro lento del reactivo, control y calibrador; cambio en lotes de reactivo, control y calibrador; deterioro del calibrador y de reactivos; valores erróneos para calibrar; controles o reactivos mal preparados; temperatura inadecuada en la incubadora; deterioro de filtro o lámpara del espectrofotómetro; cambio en los volúmenes de reactivos y/o muestras preparadas con el diluyente equivocado; errores en el pipeteo y pipetas mal calibradas; lectura errónea del resultado; tiempo de lectura incorrecto; longitud de onda incorrecta; almacenamiento inadecuado de los reactivos, calibradores, controladores y cambio de procedimientos entre operadores.4,6,9
Error total
Resulta del efecto combinado del error aleatorio y el sistemático, de manera que al calcularlo se analiza de forma integral la precisión y la exactitud del método en cuestión. 3,4
Error total máximo permitido o aceptable y error total calculado
Los requisitos o especificación de calidad se expresan mediante el error máximo tolerable (EMT), el error total permisible (ETp) o error total aceptable (ETa), que establece un límite para la imprecisión (error aleatorio) y la inexactitud (error sistemático). A cada determinación o ensayo analítico le corresponde un valor de ETa, que cambia según los criterios de los órganos reguladores en los diferentes países. En el laboratorio de análisis clínico se escogen los requisitos de calidad que se van a utilizar como referencia. La Asociación Americana de Química Clínica sugiere los requisitos de la Enmienda para el Mejoramiento de los Laboratorios Clínicos de 1988 (CLIA’88, por sus siglas en inglés).3,4
Con el error total calculado en el laboratorio (ETc) se obtiene información integral de la precisión y exactitud del método durante una etapa de trabajo, pues compara el valor obtenido en el laboratorio con el requisito de calidad que se escogió como referente (Eta). Con este resultado se pueden analizar los errores analíticos que ocurrieron en la etapa y el grado en que afectaron la calidad, así como determinar la linealidad de una curva de calibración, evaluar un nuevo lote de reactivo y medir la competencia analítica de las determinaciones.3,4
La competencia analítica es la pericia, la aptitud, la idoneidad o la capacidad que tiene un método analítico para cumplir con los requisitos de calidad (Eta, ETp), que están definidos como óptimos por el laboratorio clínico, de forma tal, que el ETc para un determinado analito sea menor que el ETa o ETp para declarar el proceso como competente.3
Métrica seis sigma
Seis sigma es un método para mejorar los procesos y disminuir la variabilidad de estos. Muestra la relación entre la meta o requisito de calidad (ETa), la precisión y el sesgo, que son determinados durante los estudios de validación de métodos en una etapa determinada no menor de 20 días, es decir, para estimar la métrica sigma se utiliza la medida de variación del proceso y se evalúa el desempeño analítico mediante categorías. Por tanto, es un indicador de mayor exigencia y mientras más desviaciones estándar del proceso entran dentro del error permitido, más alto será el valor de sigma y el proceso será más seguro.10
El desempeño analítico3) es la capacidad del laboratorio clínico para evaluar el proceso de control de calidad, de modo que considera la imprecisión y la inexactitud máxima permitida, el rango analítico, las interferencias, la recuperación, así como la frecuencia y duración del error analítico. Para su cálculo se pueden utilizar fórmulas matemáticas o gráficas como las cartas OPSpecs y el sigma métrico.
Se ha demostrado que la competencia y desempeño analíticos pueden variar de categoría según el requisito de calidad utilizado como referente.10
Para el control de la calidad y la verificación de métodos se necesitan los materiales o requisitos siguientes: patrones o calibrador, sueros controles de, al menos 2 niveles o concentraciones, gráfica de Levey-Jenning, tablas de las reglas de Westgard, así como establecer los requisitos de calidad, tener el valor del sesgo o inexactitud de cada determinación analítica obtenida por el Programa del Control Externo de la Calidad (sesgo y porcentaje). Si no existe este programa se utilizarán alternativas, además de los registros y documentos,4,7,9) todo lo cual se describe a continuación:
Calibrador o patrón: El material utilizado para la calibración puede ser de 2 tipos, bien soluciones acuosas (patrones acuosos), que contienen la sustancia pesada exactamente en el diluente requerido, o bien un suero comercial con valor único para el componente en cuestión o varios componentes (calibrador).
Controlador o suero control: Es el suero de origen humano, con baja turbidez, caducidad mínima de un año, líquido o liofilizado, con valores asignados e intervalos de valores normales y patológicos.
Entre los errores que podrían cometerse al preparar los controladores figuran: pérdida de sustancia al reconstituir, calidad del agua, errores en el pipeteo, homogenización no adecuada, acción de la luz solar, congelación y descongelación repetidas.
Gráfica de Levey-Jennings: Se utiliza para simplificar la comparación del valor observado en el día para un material de control estable, con lo que se espera, sobre la base de los valores históricos obtenidos con anterioridad. La idea es que para un procedimiento de medida estable, las nuevas mediciones del control deberían mostrar la misma distribución que las pasadas o históricas. Una vez que se obtienen los valores del control en condiciones óptimas, se confecciona la gráfica con un sistema de ordenadas, donde se fija la media en el eje de las Y, hacia arriba los valores de la X más 1,2 y 3 SD y hacia abajo la X menos 1,2, 3 SD. Se comienzan a trazar los nuevos valores del control que son obtenidos día a día como parte del trabajo diario (Fig. 1.).
Al observar los valores de los controles en la gráfica se pueden detectar los errores analíticos aleatorios y sistemáticos, de manera que al aplicar las reglas de control de Westgard y analizar de inmediato las posibles causas de esos errores se tomarán las medidas consecuentes para evitarlos o, al menos, minimizarlos. Al final de cada etapa, que usualmente es cada 20 corridas, se realizan los cálculos necesarios para el análisis estadístico del control interno de calidad para determinar la imprecisión, la inexactitud, el error total y la métrica seis sigma completa.
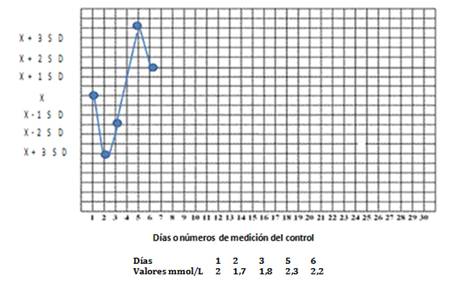
Fig. 1 Ejemplo del uso de la gráfica de Levey Jennings con 5 valores de suero control de colesterol, obtenido en condiciones óptimas X=2 mmol/L SD=0,1 mmol/L
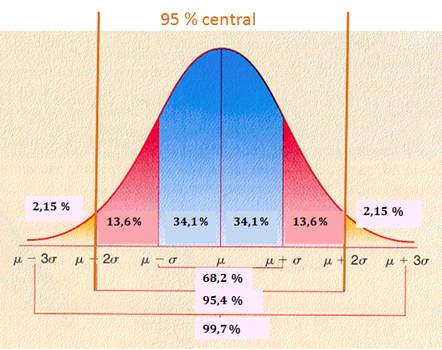
La decisión de utilizar ± 2SD como límites de confianza o de control se basa en la distribución del área bajo la curva de Gauss, que se conoce como distribución normal (Fig. 2.). Para los propósitos de las cartas para el control de la calidad en el laboratorio y como los errores aleatorios se distribuyen normalmente (distribución gaussiana, distribución normal, distribución de Gauss), el área bajo la curva entre ±2SD, comprende 95 % de la población (resultados, en este caso). De esta forma se puede asegurar, con 95 % de probabilidades, que si los valores se mantienen dentro de estos límites, el componente está bajo control y solo queda 5 % de probabilidades de que no lo esté. Por esto, uno de cada 20 valores puede caer en las “zonas de alarma” entre los límites `X ±3 SD hasta `X ±2 SD. Esta situación puede indicar una falsa alarma en vez de un problema real. Si la cantidad de valores en la zona de alarma es mayor a la esperada estadísticamente (1/20) se considera como indicativo de que hay algún problema; si alternan entre los límites superiores e inferiores, el problema es de precisión; si se sitúan de un solo lado del promedio, es un problema de exactitud o veracidad.
Asimismo, cuando hay cambios en la exactitud del método y el error sistemático es grande, se aprecian en el gráfico desplazamientos de los valores por encima o por debajo de la media. Días antes de establecerse dicho desplazamiento, la observación diaria de la carta de control por un personal con experiencia, permitirá detectar la tendencia de los puntos a subir o bajar. Estos son los cambios que producen los errores sistemáticos y que constituyen la inexactitud. Los errores aleatorios, que dan lugar a la imprecisión, causan la dispersión de los puntos alrededor de la media.9
Reglas de control
Las reglas de control son herramientas estadísticas para apoyar al operador en la interpretación de los resultados con material control y evaluar si el procedimiento mantiene una ejecución estable o si se han introducido efectos sistemáticos o aleatorios. Se expresan con un número que indica la cantidad de veces que se produce el error y un subíndice que muestra la salida del control por encima o por debajo del límite de la SD en cuestión, por ejemplo: una regla de control puede ser 13S, que evalúa si un valor cae fuera de los límites de acción. Otra regla es 22S, que evalúa si 2 valores de un mismo material en 2 corridas consecutivas, o 2 muestras de control independientes en la misma corrida, exceden el límite de alarma. Cada regla de control se caracteriza por 2 probabilidades: la de detección de un error y la de una falsa alarma.
‒Reglas de Westgard: El control de la calidad de reglas múltiples utiliza una combinación de criterios para decidir si la corrida analítica se encuentra en control o fuera de este, de ahí que se emplean 5 reglas de control distintas para juzgar la aceptabilidad de una corrida analítica. En comparación, un procedimiento de control de la calidad de regla única emplea un único criterio o conjunto de límites de control, como el gráfico de Levey-Jennings, con límites de control establecidos como la media ± 2 desvíos estándar (2s) o la media ± 3 desvíos estándar (3s).
Estas reglas generalmente se emplean con 2 o 4 mediciones del control por corrida, lo que implica que son apropiadas cuando 2 materiales de control diferentes se miden 1 o 2 veces cada uno, que es el caso de muchas aplicaciones en química.
Se recomienda utilizar como base para el procedimiento de control de calidad 5 reglas de control: 13S, 22S, R4S, 41S y 10X,
¿Cómo utilizar estas reglas? Dada una advertencia (12S) se inspeccionan los datos del control mediante las reglas anteriores, usualmente en ese orden. Primero se observan los errores más grandes y luego los más pequeños (se usan subíndices para indicar los límites de control). La combinación de reglas se indica generalmente mediante una barra (/) entre las reglas de control, por ejemplo: 13S/22S. Si se viola una sola de estas, eso confirma que hay un problema, de manera que la corrida está fuera de control y debería rechazarse, lo cual significa que los resultados no deberían ser informados; pero si ninguna de estas reglas adicionales ha sido violada, se asume que la corrida está en control y los resultados pueden informarse. En figura 1, los días 2 y 5 se violaron dichas reglas.
‒ Establecer los requisitos de calidad: Existen diferentes requisitos de calidad según los criterios de los órganos reguladores en cada país, entre los cuales se encuentran los de CLIA’ 88 (Estados Unidos), Rback (Alemania), ProbioQual (Francia), Seek Dmax (República Checa), Bélgica y España.3,4
El error total aceptable se obtiene de estos requisitos, de manera que el error total calculado en el laboratorio se acepta cuando es numéricamente menor que el Eta.
La Asociación Americana de Química clínica, el Grupo de trabajo latinoamericano y la Fundación Wallace H. Coulter sugieren los requisitos de calidad de la CLIA’88 de Estados Unidos.
Registros y documentos
Se registran todas las acciones que se realizan cada día de forma tal que se pueda utilizar la trazabilidad en caso de algún problema. En la guía propuesta hay modelos para registrar la verificación de cada método, la planificación del control de la calidad, el resultado diario de las muestras de pacientes y de los controladores, el monitorio diario y las incidencias del día, los valores en condiciones óptimas de trabajo, registro de los controladores y calibradores utilizados, seguimiento de los equipos, mantenimiento y rotura, así como registro de la verificación de los reactivos al cambiar de lote.
Registro control de reproducibilidad y repetibilidad: Son documentos únicos donde se transfieren los resultados de los controladores de cada determinación y el tecnólogo los anota diariamente en el registro de muestras, los cuales se colocan en columnas. Cada 20 valores se calcula la X, la SD y el %CV, que se anotan al final de dicha columna.
Resumen control de reproducibilidad y repetibilidad: A estos documentos se transfieren los resultados de los 2 anteriores para completar el análisis estadístico del control de calidad con el cálculo de los 4 indicadores (precisión, exactitud, ET y métrica seis sigma) y quedan aquí plasmados los resultados de la etapa en cuestión analizada.
Informe final: Los resultados anteriores se analizan de forma cualitativa.
Secuencia para establecer el control interno de calidad en el laboratorio
Verificar el desempeño del método y nuevos lotes de reactivos.
Planificar el control de la calidad.
Efectuar control interno de calidad diario.
Realizar el análisis estadístico del control de la calidad (etapas de al menos 20 días).
Estimar el error aleatorio (precisión) y el sistemático (sesgo/exactitud).
Determinar el error total (evaluar la competencia analítica).
Determinar la métrica seis sigma (evaluar el desempeño analítico) y proponer mejoras según reglas de control de Westgard.4
Análisis estadístico del control de la calidad
‒Imprecisión: Se halla la media, la SD y %CV de los valores habituales que ya se obtuvieron junto con la gráfica de Levey-Jennings y se desechan los valores fuera de control. Se puede utilizar el programa de informática MedLabQC, versión 3.21. Se considera aceptable si %CV ≤ %CV de referencia o si SD ≤ SD de referencia. Si no se acepta puede verificar con la SD y el Eta como se explica a continuación:
La SD es ⅓ o menos del error total permitido,4 lo que significa que: SD < 0,33 x Eta (SD intercorrida, o sea, día a día).
Con el valor del %CV se puede determinar la desviación estándar:
Coeficiente de variación:
Leyenda: X (valor de cada control), (media de valores), N (número de controles)
‒El sesgo o inexactitud (diferencia entre medias) se calcula con el control externo de la calidad. Es el resultado que ofrece este control cuando se determina la diferencia entre el valor del laboratorio y el de la media de todos los laboratorios participantes. En caso de no estar funcionando este programa se pueden utilizar otras medias que se comparan con la obtenida en la etapa analizada, la hallada en la verificación del método o en los valores obtenidos en condiciones óptimas o los valores históricos anteriores y, en última instancia, la informada por el fabricante de los controladores.
Para el cálculo se pueden utilizar varios estadísticos, tales como el test de Lord, el índice de variación, la prueba T de Student y la regresión lineal.9
‒ El error total se calcula para evaluar la competencia analítica del método que es aceptada cuando el ETc es menor que el ETa. Se calcula con el sesgo, el CV y el Eta, donde:
Leyenda:
X1(media de referencia)
X (media del laboratorio)
Competente: %ETc< %ETa
No competente: % ETc> %Eta
%ETc= Error total calculado en el laboratorio
%ETa= Error total aceptable o permisible según CLIA’88
‒Métrica seis sigma: El valor numérico de este indicador se lleva a una escala del 1 al 6 o más (cuadro) y refleja la calidad del control interno realizado, califica el desempeño y sugiere las reglas de Westgard a utilizar para mejorar los resultados.
A medida que se alcance un número mayor en la escala, se sugiere un mejor desempeño de ese control de calidad y los valores inferiores a 3 no se aceptan.3,4,10
Se calcula de la manera siguiente:
Sigma= (% ETa - % sesgo)/%CV
Escala: 1 al ≥ 6 Se acepta ≥3
Por ejemplo: glucosa
%TEa: 10 %, % sesgo= 1 % CV%= 1,8 %
Seis sigma= (10% - 1%)/1,8% = 5 (excelente).
Con un esquema de regla única se aseguran resultados útiles.
En resumen, cada 20 días se realiza la evaluación estadística del control interno de la calidad de análisis en química y hemostasia (métodos manual y automatizado), hematología (método automatizado) con 4 indicadores: imprecisión, inexactitud o sesgo, error total y métrica seis sigma. Estos valores se registran en el modelo que recoge el resumen del control de reproducibilidad que aparece en uno de los anexos de la guía. En hematología, solo se determina, manualmente, la imprecisión, mediante el test de Fisher,4 entre las diferencias de 2 grupos de 20 muestras replicadas, el actual y el de 20 días anteriores.
Conclusiones
El control interno de la calidad en el laboratorio clínico es un sistema basado en las ciencias matemáticas que cada laboratorio debe normar y organizar atendiendo a sus posibilidades tecnológicas; asimismo, utiliza varias herramientas estadísticas mediante las cuales se pueden determinar los errores analíticos cometidos en los procesos y procedimientos, así como también permite aplicar mejoras para garantizar resultados confiables y seguridad para los pacientes. Esta guía completa incluida en el software, facilita el diseño del control interno, estandariza y actualiza los criterios y acciones, lo cual permite disminuir las diferencias entre los resultados de los distintos laboratorios.