Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Medicentro Electrónica
versión On-line ISSN 1029-3043
Medicentro Electrónica vol.21 no.1 Santa Clara ene.-mar. 2017
ARTÍCULO ORIGINAL
Actividad gastroprotectora y toxicidad aguda del extracto de hojas de Cnidoscolus Chayamansa Mc Vaugh
Gastroprotective activity and acute toxicity of Cnidoscolus chayamansa Mc. Vaughn leaf extract
Yilka Mena Linares1, Dulce María González Mosquera2, Arianna Valido Díaz1, Raylen Escobar Román3, Arelia Pizarro Espín 1, Orestes Castillo Alfonso1
1. Unidad de Toxicología Experimental. Universidad de Ciencias Médicas Dr. Serafín Ruiz de Zárate Ruiz. Santa Clara, Villa Clara. Cuba. Correo electrónico: yilkaml@infomed.sld.cu
2. Universidad Central de Las Villas. Santa Clara, Villa Clara. Cuba. Correo electrónico: dulcem@uclv.edu.cu
3. Universidad de Ciencias Médicas. Sancti Spíritus. Cuba. Correo electrónico: raylen@infomed.sld.cu
RESUMEN
Introducción: la Cnidoscolus chayamansa Mc Vaugh es una especie originaria del sur de México. Esta especie, vulgarmente conocida como «chaya», es apreciada por su valor nutricional y medicinal.
Objetivo: evaluar la actividad gastroprotectora y la toxicidad aguda de esta especie en un estudio preclínico.
Métodos: se evaluó el efecto gastroprotector en un modelo de etanol absoluto, en dosis de 100, 200 y 400 mg/kg, y la toxicidad aguda oral mediante el procedimiento de dosis fija (2000 mg/kg) de Cnisdoscolus chayamansa Mc. Vaugh, en ratas Sprague Dawley.
Resultados: el peso, como indicador de toxicidad, se comportó dentro de los parámetros establecidos para la curva de crecimiento de la especie y línea del modelo biológico utilizado. Se observó un aumento del porciento de inhibición del grado de ulceración, desde 21 % en dosis de 100 mg/kg, hasta un 99 y 100 % en dosis de 200 mg/kg y 400 mg/kg, respectivamente. Los valores obtenidos no presentaron diferencias estadísticamente significativas con relación al Omeprazol (99 %), utilizado como control positivo.
Conclusiones: se comprobó que la Cnisdoscolus chayamansa posee actividad gastroprotectora y es inocua por vía oral.
DeCS: extractos vegetales, mucosa gástrica/efectos de drogas.
ABSTRACT
Introduction: Cnidoscolus chayamansa Mc. Vaugh is a species from southern Mexico. This species commonly known as "chaya" is appreciated for its nutritional and medicinal value.
Objective: to evaluate the gastroprotective activity and acute toxicity of this species in a preclinical study.
Methods: gastroprotective effect in an absolute ethanol model at the doses of 100, 200 and 400mg/kg and acute oral toxicity was assessed using the Fixed Dose Procedure (2000 mg/kg) of Cnisdoscolus chayamansa Mc. Vaughn in Sprague - Dawley rats.
Results: weight, as an indicator of toxicity, acted within the parameters set by the growth curve of the species and lineage of the biological model used. An increase of the percent inhibition of ulceration degree was observed, from 21 % at the dose of 100 mg / kg, up to 99 and 100% at doses of 200 mg/kg and 400 mg/kg, respectively. The values obtained in this case did not show statistically significant differences in relation to omeprazole (99 %), used as positive control.
Conclusions: according to this study, Cnisdoscolus chayamansa has gastroprotective activity and is harmless orally.
DeCS: plant extracts, gastric mucosa/drug effects.
INTRODUCCIÓN
La Cnidoscolus chayamansa Mc Vaugh es una especie originaria del sur de México, conocida y cultivada en Mesoamérica. Esta especie, vulgarmente conocida como «chaya», es apreciada por su valor nutricional y medicinal. Tradicionalmente se le atribuye, al extracto acuoso de las hojas frescas de la planta, la propiedad de poseer un posible efecto gastroprotector o antinflamatorio; no obstante, se ha informado su utilidad en el tratamiento del cáncer, la gangrena, la hipertensión, las úlceras, la diabetes mellitus, como diurético, en el reumatismo, los trastornos gastrointestinales y los procesos inflamatorios.1
Se ha registrado en la hoja la presencia de proteína, grasas, carbohidratos, diferentes tipos de vitaminas, como A, C, K, el complejo B -excepto la B12_, además de compuestos minerales, como hierro, potasio, fósforo, calcio, y otros componentes, como oligoelementos, enzimas y fibra vegetal.2
La Fitoterapia es una alternativa farmacológica para resolver, de manera complementaria e integral, las necesidades primarias de salud. Como consecuencia del desarrollo de nuevos procesos químicos de síntesis, se ha hecho improbable explotar las potencialidades de un inmenso número de especies vegetales que, sin duda alguna, encierran una amplia diversidad de compuestos químicos desconocidos que podrían llegar a tener un gran valor terapéutico.3,4
La Organización Mundial de la Salud y el Parlamento Europeo han adoptado resoluciones que ponen de manifiesto la necesidad de racionalizar el empleo de los productos derivados de plantas medicinales; su objetivo es limitar la prescripción de aquellos productos de fitoterapia que carezcan de estudios previos para avalar su uso. Por ello, a la ciencia moderna le corresponde conducir el estudio de la medicina tradicional por métodos científicos, que comprueben la eficacia farmacológica en cada caso.3
Como esta planta es empleada en la medicina tradicional como antinflamatoria en diversas afecciones asociadas a procesos inflamatorios,5 pudiera comportarse como protectora de la mucosa gástrica; sin embargo, son muy escasas la investigaciones preclínicas referenciadas que corroboren dicho uso para las hojas de esta planta, ni que avalen su seguridad por vía oral, por lo que es preciso seguir realizando estudios farmacológicos y toxicológicos en este sentido.
Este trabajo científico parte de la hipótesis de que extractos obtenidos a partir de las hojas de la especie C chayamansa poseen efecto gastroprotector, atribuido al uso como antinflamatorio en la medicina tradicional de esta planta; y para ello, el objetivo fundamental fue evaluar, mediante un estudio preclínico, la actividad gastroprotectora y la toxicidad aguda de esta especie.
MÉTODOS
Se realizó un estudio farmacológico y toxicológico, in vivo, en la Unidad de Toxicología Experimental perteneciente a la Universidad de Ciencias Médicas de Villa Clara, donde se emplearon ratas de la línea Sprague Dawley (180-250 g). Para el estudio de toxicidad se utilizaron cinco ratas hembras, mientras que para la técnica de gastroprotección se usaron 40 ratas machos. Los animales de experimentación fueron suministrados por el centro nacional para la producción de animales de laboratorio (CENPALAB).
El período de cuarentena se extendió por siete días, y una vez finalizado, se procedió a la parte experimental. El alimento consistió en pienso peletizado esterilizable, específico para ratas y ratones todo propósito, con fórmula CMO 1000 en forma de pellet, con su correspondiente certificado por el productor (CENPALAB), el cual se suministró a razón de 25 g/animal/día y agua de bebida apta para el consumo humano.
La recolección de las hojas de la C. chayamansa se realizó en horas tempranas de la mañana, en áreas cercanas a la Universidad de Ciencias Médicas, en Santa Clara, provincia de Villa Clara, y una muestra fue depositada en el herbario del Centro de Estudios del Jardín Botánico de la Universidad Central «Marta Abreu» de Las Villas, con el número de serie UCLV 10718. Posteriormente, se realizó el secado del material vegetal, en un horno, a 40°C con aire recirculado.
La droga vegetal fue molinada en un micromolino (IKA-MF 10B, Alemania) de cuchillas a 3000 rpm, pasando el material vegetal molinado por un tamiz interno de 3 mm con un flujo continuo.
Para la obtención del extracto hidroalcohólico, 40 g de droga seca y molinada se sometieron a una extracción por el método de extracción continua por Soxhlet, empleando 300 mL de etanol al 70% en agua, durante 56 horas; se filtró el extracto a través de carbón activado para eliminar la clorofila. Posteriormente, se concentró hasta la sequedad en un rotoevaporador (BUCHI-R-200, Alemania).
Se emplearon los indicadores de control de la calidad establecidos en las normas cubanas ramales de salud para extractos y tinturas.6
Se registraron los promedios diarios de humedad relativa y temperatura, además de controlar el horario de administración, concentración y dosis para administrar el producto.
Se realizó el tamizaje fitoquímico de la C chayamansa para la identificación de los diferentes grupos químicos de metabolitos secundarios presentes en la planta, la cual siguió la técnica establecida por Miranda y Cuellar.7
La metodología empleada para evaluar la toxicidad aguda oral del extracto hidroalcohólico fue el procedimiento de dosis fijas (Fixed Dose Procedure), con la administración de una dosis única de 2000 mg/kg de masa corporal, según la metodología descrita por la guía para el ensayo de sustancias químicas 420 de la Guideline for Testing of Chemicals (OECD, por sus siglas en ingles).
Los animales fueron pesados 24 horas antes de comenzar el estudio. El extracto hidroalcohólico de C chayamnasa se administró en una dosis única por vía oral de 2000 mg/kg, mediante sonda intragástrica 16 G, con ayuno previo de 16 a 18 horas.8
Durante las primeras 4h, los animales de experimentación fueron observados constantemente; la evaluación continuó diariamente durante 14 días. El estudio tuvo previsto registrar las muertes en las primeras 24 h y cualquier signo clínico durante los 14 días de observación; el peso se controló el día primero, a los 7 y 14 días del ensayo de las cinco ratas hembras escogidas para el análisis de toxicidad. Luego del sacrificio de los animales de experimentación, se realizó un estudio anatomopatológico macro- y microscópico de los órganos: estómago, corazón, hígado, bazo, riñones y pulmones.
El modelo experimental de úlcera gástrica aguda inducida por etanol absoluto se encuentra establecido en el manual elaborado por especialistas del programa Iberoamericano de Ciencia y Tecnología para el desarrollo (CYTED), en el subprograma X. Química Fina Farmacéutica.9
Se confeccionaron cinco grupos experimentales de ocho animales cada uno:
Grupo 1: Tratado únicamente con el vehículo, agua destilada (control negativo).
Grupo 2: Tratado con el fármaco patrón, Omeprazol, se disolvió en carboximetilcelulosa (CMC) al 0,05%, la cantidad necesaria para administrar una dosis de 20 mg/kg.
Grupo 3: Extracto dosis de 100 mg/kg.
Grupo 4: Extracto dosis de 200 mg/kg.
Grupo 5: Extracto dosis de 400 mg/kg.
Los productos se administraron a un volumen de 10 mL/kg de peso del animal por vía oral, con cánula intragástrica, media hora antes de la administración del etanol absoluto, sustancia utilizada como agente ulcerogénico a razón de 1 mL/200 g. Transcurrida una hora de la administración del etanol, los animales se sacrificaron por dislocación cervical, e inmediatamente se les efectuó la laparotomía en el tercio anterior de la línea media. Luego se extrajeron los estómagos, los cuales fueron abiertos por la curvatura mayor. Posteriormente, se lavaron cuidadosamente con una corriente suave de agua y se extendieron sobre una tabla de polietileno mediante alfileres. Dicho procedimiento permitió la observación y la cuantificación de las úlceras formadas.
El recuento se efectuó visualmente utilizando un microscopio estereoscópico para la detección de las lesiones; se midió la longitud de las mayores usando un pie de rey y sumándolas.
El grado de ulceración se cuantificó mediante la escala de Marhuenda,9 donde:
- 0: sin lesión.
- 1: Úlceras hemorrágicas, finas, dispersas y de longitud menor de 2 mm.
- 2: Una úlcera hemorrágica fina de longitud mayor de 2 mm.
- 3: Más de una úlcera de grado 2.
- 4: Una úlcera de longitud menor de 5 mm y diámetro menor de 2 mm.
- 5: De una a tres úlceras de grado 4.
- 6: De cuatro a cinco úlceras de grado 4.
- 7: Más de seis úlceras de grado 4.
- 8: Lesiones generalizadas de la mucosa con hemorragia.
Los resultados se expresan en porciento de inhibición respecto al índice de ulceración del lote control, según la siguiente expresión:
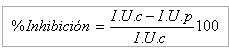
Donde:
I .U.c: Índice de ulceración medio del lote control
I. U.p: Índice de ulceración medio del lote problema o patrón.
El grado o índice de ulceración de cada grupo se obtiene calculando la media ± desviación estándar de cada grupo.
El procesamiento estadístico se realizó a partir de la información obtenida en los modelos de datos primarios, con los cuales se confeccionaron bases de datos para cada una de las técnicas empleadas. Se utilizó el paquete estadístico SPSS, versión 22 para Windows. En el estudio de toxicidad, se realizó un análisis descriptivo de los datos para conocer su naturaleza y sus principales tendencias. Se utilizaron pruebas no paramétricas de comparación debido a la naturaleza de las variables: Wilcoxon y Friedman para muestras pareadas, y U de Mann Whitney para la comparación de grupos independientes. Se trabajó con una confiabilidad del 95 %.
RESULTADOS
Los valores de control de la calidad realizado al extracto hidroalcohólico de la planta fueron: índice de refracción: 1,3652, porcentaje de sólidos totales: 0,359 % y densidad relativa: 0,8252.
En la evaluación cualitativa de la composición química de la planta, se observó un predominio de metabolitos secundarios, como flavonoides, alcaloides, taninos y saponinas.
En el estudio realizado de toxicidad aguda, como resultado de la administración de una dosis única de 2000 mg/kg, se obtuvo un 100 % de supervivencia. Las observaciones sistemáticas diarias no mostraron evidencias de ningún signo de toxicidad, solo se manifestaron síntomas de piloerección en los primeros 30 min posteriores a la administración, que pudieran estar relacionados con la aplicación de la sustancia de ensayo, pero se observó una rápida recuperación de los animales.
El análisis de los signos clínicos de estos evidenció un buen estado general y apariencia normal a partir de las cuatro horas de administrada la sustancia en estudio, caracterizada por pelos brillantes, ojos claros y brillantes, mucosas normocoloreadas. Los signos vitales resultaron normales; no existieron alteraciones en las frecuencias cardíacas ni en las respiratorias. El análisis de la conducta evidenció un comportamiento normal exploratorio. La respuesta a los estímulos fue normal y estuvo caracterizada por una uniformidad en la movilidad del total de los animales al tocar las jaulas y fuera de ellas.
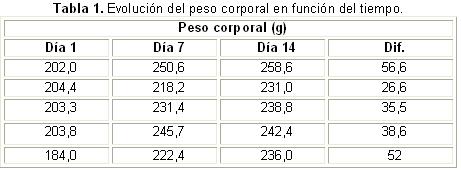
Se determinó, como indicador de toxicidad, el peso corporal en función del tiempo (Tabla 1), donde se evidenció un aumento progresivo y significativo de peso en los animales de experimentación (Friedman, p = 0,009). La ganancia del peso observada entre el peso inicial y el que se obtuvo a los siete días fue significativa (Wilcoxon, p = 0,043) y también lo fue la ganancia observada entre el peso inicial y el obtenido a los 14 días (Wilcoxon p = 0,043); sin embargo, no ocurrió lo mismo con la ganancia entre el peso a los siete días y a los 14 días (Wilcoxon, p = 0,080).
Durante la realización del estudio de toxicidad, se prestó especial atención al consumo diario de agua y alimento, y se observó que estos parámetros trascurrieron de forma normal.
Finalmente se realizó el análisis macro- y microscópico de los órganos, y no se observó afectación en ninguno de ellos. Los estudios anatomopatológicos no mostraron alteración alguna.
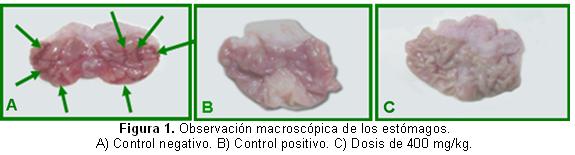
En la evaluación de la actividad gastroprotectora, al realizar el análisis macroscópico a los animales sacrificados del grupo control negativo (Figura 1), se observó distensión estomacal de forma general, sus mucosas estaban enrojecidas y en ocasiones completamente hemorrágicas. Además, se pudo constatar en ellas un número considerable de ulceraciones, la mayoría de estas eran de gran intensidad (Figura 1A). Por el contrario, en los grupos a los que se lesadministraron las dosis del extracto, los estómagos se mostraron menos distendidos, sus mucosas no presentaban enrojecimiento y se apreció en ellas una evidente disminución en el número y la gravedad de las lesiones ulcerosas; incluso, en algunos casos, el estado de la mucosa se mantuvo más conservado en relación con la de los animales que conformaron el grupo patrón (Figuras 1B y C).
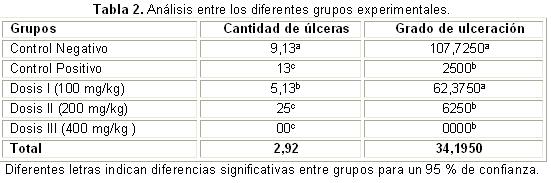
Luego del análisis comparativo de la presencia de úlceras y el grado de ulceración (Tabla 2), se constató que el control negativo y el grupo experimental de 100 mg/ kg presentaron el mayor grado de ulceración promedio (107,7 mm2 y 62,4 mm2); estos no se diferenciaron estadísticamente (U de Mann Whitney, p = 0,083). Por otro lado, tampoco se diferenciaron los grupos experimentales de 200 mg/kg (0,625 mm2), 400 mg/kg (0,00 mm2) y el control positivo (0,25 mm2) (U de Mann Whitney, p = 0,059 y p= 0,721, respectivamente), y todos mostraron diferencias con el grupo control negativo y la dosis de 100 mg/Kg. La dosis de 200 mg/Kg mostró diferencias con el control negativo y con la dosis de 100 mg/Kg (U de Mann Whitney p = 0,000; p = 0,002); la dosis de 400 mg/Kg, con el control negativo y la dosis de 100 mg/Kg (U de Mann Whitney p = 0,002; p = 0,002), y el control positivo con la dosis de 100 mg/Kg y el control negativo (U de Mann Whitney p = 0,002; p = 0,002).
Se pudo observar un aumento progresivo del porciento de inhibición del grado de ulceración, desde un 21 % en la dosis de 100 mg/kg, hasta un 99 y 100 % en las dosis de 200 mg/kg y 400 mg/kg, respectivamente. Con la mayor dosis utilizada, se obtuvo la mayor inhibición. Los valores obtenidos con la dosis de 100 mg/kg no presentaron diferencias estadísticamente significativas con respecto al Omeprazol (U de Mann Whitney p = 0,721) (Tabla 3).
DISCUSIÓN
Fundamentalmente, esta especie está compuesta por metabolitos reductores, como los flavonoides, además de alcaloides, taninos y saponinas, lo cual ha sido informado por varios autores en estudios realizados a esta planta.2
Dentro de la batería de ensayos de primera barrera, se encuentran los estudios de toxicidad aguda, imprescindibles en la estimación del potencial tóxico de una sustancia, referidos como el estudio cuali-cuantitativo de los fenómenos tóxicos y de su aparición en función del tiempo, tras la administración de una dosis única de la sustancia o de varias dosis fraccionadas en el transcurso de 24 horas.3,4
El procedimiento de dosis fijas, validado internacionalmente y adoptado por la OECD # 420, ha permitido la introducción de una nueva variante para la estimación de la toxicidad de una sustancia por vía oral, que tiene como objetivo describir la clase de toxicidad, sin precisar un valor exacto de la dosis letal media (DL50).8
El peso corporal se comportó dentro de los parámetros establecidos para la curva de crecimiento de la especie y la línea del modelo biológico, como se informa en el estudio de Betancourt.4
Como se había comentado anteriormente, se han publicado pocas investigaciones preclínicas referenciadas que avalen su seguridad por vía oral. Un ejemplo de ello fue el estudio realizado por García y colaboradores, donde la toxicidad aguda fue determinada en el rango de 0,5 a 2 g/kg y la subaguda a 28 días, a 1 g/kg; ambos ensayos se realizaron en ratones machos Balb/C, administrando el extracto por vía oral.5 Otro ejemplo es el de Pérez y colaboradores quien, en un estudio realizado al extracto de hojas de esta planta por vía oral, publicó que posee nula toxicidad aguda y subaguda,10 resultados coincidentes con la investigación en cuestión.
Es importante destacar que Torrico y colaboradores, en el 2003, publicaron un estudio de toxicidad aguda de extractos obtenidos de la planta en estudio por tres métodos (decocción, maceración e infusión), en el cual las dosis se incrementaron en orden creciente desde 25 mg/kg hasta 8000 mg/kg durante un tiempo de 90 min mediante el empleo de la vía intraperitoneal. En este estudio se evidenciaron, como principales signos de toxicidad, la contorsión y la piloerección, junto con la diarrea; esta última se observó en menor grado. Esto pudiera estar relacionado con trastornos gastrointestinales, según describe el autor; la piloerección y la diarrea son consecuencias de la contorsión intestinal.11
Los efectos tóxicos observados en la evaluación realizada por vía oral no mostraron signos que pudieran atribuirse a la vía de administración de la planta. En este sentido, puede afirmarse que el extracto de C chayamanasa en las condiciones evaluadas, no induce mortalidad ni aparecen signos de toxicidad, por lo que puede clasificarse, según lo establecido por la OECD, como categoría 5, o sea, no tóxico, al no provocar mortalidad con la dosis ensayada y no evidenciarse alteraciones morfológicas relacionadas con toxicidad. Otros resultados semejantes fueron obtenidos en un estudio de la actividad antinflamatoria y la toxicidad de las hojas de esta planta, realizado por Pérez y colaboradores, donde tampoco se observó alteración, a nivel histológico, de hígado, riñón y bazo, y por tanto, fueron nulas la toxicidad aguda y subaguda. 10 Valenzuela y colaboradores, en una evaluación de toxicidad de la infusión de esta planta, comprobaron que la infusión de hojas de chaya orgánica es considerada no tóxica y segura para ser consumida.12 Similares resultados mostraron los extractos de Argyrochosma,13 Baccharis latifolia y Baccharis papilosa,14 donde se evaluaron dosis únicas de 5000, 4000 y 3000, 5000 mg/kg, respectivamente, y ambas se clasificaron como no tóxicas.
Para la obtención de modelos experimentales productores de úlcera gástrica, se han establecido una serie de investigaciones que permiten profundizar en el conocimiento de los mecanismos de acción de varios agentes ulcerogénicos. La producción de úlceras agudas puede lograrse mediante varios modelos experimentales, y entre los más utilizados se encuentran: el etanol absoluto por vía oral9,15 y la administración oral de indometacina.9
El etanol absoluto reduce la secreción de bicarbonato y la producción de moco, lo que altera la composición glicoproteica, y desestabiliza los lisosomas de las células glandulares que liberan las hidrolasas ácidas. La administración de una dosis única produce un daño que ocupa de un 30 a un 40 % de la superficie total de la mucosa, con bandas hemorrágicas necróticas en la zona del cuerpo del estómago.14
Los resultados obtenidos por Pérez y colaboradores avalan que las dosis orales de la planta en estudio disminuyen los procesos inflamatorios, pero a nivel cutáneo; ellos demostraron que la C chayamansa posee una significativa actividad antinflamatoria;10 esto, a su vez, confirma las propiedades que se evalúan en este ensayo.
En los estudios de gastroprotección, además de la apreciación visual, se tienen en cuenta dos variables: el número de lesiones y su gravedad. El número de úlceras, aunque es indicativo de posible protección en la mucosa, en la mayoría de los casos no se corresponde con el estado de las lesiones,15 por lo que el grado de ulceración es determinante y decisivo en este tipo de técnicas. Bucciarelli y Skliar, al evaluar la actividad gastroprotectora de extractos acuosos, utilizando etanol absoluto como agente ulcerogénico en Artemisia annua, Aloysia gratissima, y Maytenus ilicifolia, reflejan porcientos de inhibición más bajos: 87,6 %, 71,5 % y 68,3 %, respectivamente, que los obtenidos en la investigación en cuestión.
Estos mismos autores también evaluaron la actividad gastroprotectora del extracto de Solidago chilensis en otras de sus investigaciones, la cual arrojó un porciento de inhibición de 91,9 %, muy cercano pero ligeramente inferior al obtenido en esta investigación.16 Similares resultados fueron informados por Pinto y Bustamante, los cuales evaluaron la especie Plantago major en un modelo de etanol absoluto, utilizando dosis de 500 mg/kg para varios extractos, donde el extracto acuoso mostró un 90,72 % de inhibición.17Investigaciones recientes atribuyeron la acción gastroprotectora a la presencia de flavonoides y taninos metabolitos que, como se dijo anteriormente, han sido identificados en la especie objeto de estudio en la presente investigación.2,18 Otro estudio realizado por Céspedes y colaboradores, donde se evalúa la actividad antinflamatoria, antiedema y gastroprotectora de extractos elaborados de la Aristotelia chilensis; también atribuyen las actividades antinflamatoria y gastroprotectora de esta fruta, a la presencia de antocianinas, flavonoides y ácidos fenólicos.19
Por otra parte, los principales metabolitos secundarios a los que se adjudican las propiedades antiulcerosa y antimicrobiana de la Bidens pilosa L son fundamentalmente los taninos y flavonoides.16
Se puede apreciar que los compuestos fenólicos, en especial los flavonoides, parecen ser metabolitos determinantes en la protección de la mucosa gástrica. Numerosos mecanismos han sido propuestos para explicar el efecto gastroprotector de los flavonoides, como el aumento del contenido mucosal de prostaglandinas, la disminución de la secreción de histamina, la eliminación de radicales libres, el aumento de la perfusión vascular y la reducción de la adherencia leucocitaria. Algunos de ellos reducen la motilidad gastrointestinal prolongando el tiempo de contacto de los extractos con las paredes del estómago y aumentando, de esta manera, el efecto gastroprotector. Por tanto, previenen las lesiones en la mucosa gástrica inducida por diferentes métodos y la protegen contra distintos agentes necróticos.16
Investigaciones realizadas por Palomino y colaboradores refieren que en muchos de los compuestos fenólicos se ha comprobado la acción protectora de la mucosa gástrica, los cuales son considerados citoprotectores frente a los rayos ultravioletas, virus, entre otros. Asimismo, se ha comprobado que el tratamiento con una fracción enriquecida de flavonoides induce el incremento de la producción de prostaglandinas, somastostatina y la reducción de gastrina, que participan en el mecanismo bioquímico de protección a la mucosa gástrica, al inhibir la secreción del ácido clorhídrico y estimular la producción de mucus.20
Se observó un incremento del efecto gastroprotector, a medida que se aumentó la dosis; el extracto administrado en la dosis de 400 mg/kg ofreció el mayor porciento de inhibición en el modelo ensayado, lo que demuestra la capacidad protectora de esta planta sobre la mucosa gástrica.
Mediante los estudios de toxicidad aguda y de gastroprotección realizados a la planta tratada en esta investigación, se pudo concluir que el extracto hidroalcohólico de C chayamanasa, en las condiciones evaluadas, puede clasificarse como no tóxico y posee actividad protectora de la mucosa gástrica en las dosis de 200 y 400 mg/Kg, similares al omeprazol, lo que podría constituir una alternativa de tratamiento gastroprotector.
REFERENCIAS BIBLIOGRÁFICAS
1. Loarca Piña G, Mendoza S, Ramos GM, Reynoso R. Antioxidant, Antimutagenic, and Antidiabetic Activities of Edible Leaves from Cnidoscolus chayamansa Mc. Vaugh. J Food Sci. 2010;75(2):68-72.
2. Insuasty SE, Apráez GE, Gálvez CA. Caracterización botánica, nutricional y fenológica de especies arbóreas y arbustivas de bosque muy seco tropical. Cienc Animal. 2013.6:109-24.
3. Bermúdez Toledo D, Escobar Román R, Boffill Cárdenas M, Betancourt Morgado E, Igualada Correa I, Alonso Cáseres B. Evaluación del potencial hepatoprotector de la Mentha piperita L previo a la inducción de hepatotoxicidad con acetaminofén. Bol Latinoam Caribe Plant Med Aromat [internet]. 2014 [citado 21 nov. 2014];13(6):[aprox. 12 p.]. Disponible en: http://www.revistas.usach.cl/ojs/index.php/blacpma/article /viewFile/1852/1724
4. Betancourt Morgado E, González Madariaga Y, Escobar Román R, Bermúdez Toledo D, Blanco Machado F, Martínez Montalbán CM. Evaluación del potencial hipolipemiante de la Cymbopogon citratus S. (Caña santa) en un modelo de hiperlipidemia aguda. Medicent Electrón [internet]. 2015 ene.-mar. [citado 6 dic. 2015];19(1):[aprox. 11 p.]. Disponible en: http://www.medicentro.sld.cu/index.php/medicentro/article /viewFile/1842/1432
5. García Rodríguez RV, Gutiérrez Rebolledo GA, Méndez Bolaina E., Sánchez Medina A., Maldonado-Saavedra O., Domínguez Ortiz MA, et al. 2014. Cnidoscolus chayamansa Mc Vaugh, an important antioxidant, anti-inflammatory and cardioprotective plant from Mexico. J Ethnopharmacol [internet]. 2013 Dec. [citado 19 jul. 2014];3(151):[aprox. 8 p.]. Disponible en: https://www.researchgate.net/profile/Gabriel_Alfonso_Gutierrez/publication/259318101_Cnidoscolus_chayamansa_Mc_Vaugh_an_important_antioxidant_antiinflammatory_and_cardioprotective_plant_from_Mexico/links/544845570cf2d62c3052a38c.pdf
6. Soler B, Méndez G, Brook M, Miranda M. Medicamentos de origen vegetal, extractos fluidos y tinturas. Métodos de ensayos. NRSP 312 MINSAP. La Habana: Editorial Ciencias Médicas; 1992.
7. Miranda M, Cuéllar A. Farmacognosia y productos naturales. 2da. ed. La Habana: Editorial Félix Varela; 2001.
8. Organization for Economic Co-operation and Development (OECD). Guideline 420. Acute Oral Toxicity-Fixed Dose Procedure. Guideline for Testing of Chemicals. Reino Unido-Estados Unidos de América: OECD; 2008.
9. Skilar M, Toso R, Alejandra M.O.M, Wendel G, Pelzer L, Cruz López L, Sánchez LM. Evaluación de la actividad antiulcerosa péptica. En: Martín Calero MJ, Berenguer Froehner B. Manual de técnicas experimentales utilizadas en el estudio preclínico de fármacos con actividad gastrointestinal. España: Proyecto X.10 (CYTED); 1995. p. 85 -94.
10. Pérez González M, García Martínez I, Gutiérrez Rebolledo G, Jiménez Arellanes A. Actividad anti-inflamatoria y toxicidad de las hojas de Cnidoscolus chayamansa. Rev Latinoam Química [internet]. 2015 mayo [citado 18 nov. 2015];(Supl. Especial):[aprox. 176 p.]. Disponible en: http://relaquim.com/archive/2015/MemoriasCompletasMayo2015.pdf
11. Torrico FM, Gabay J, Suárez AI, Compagnone RS. Estudio toxicológico de Cnidoscolus chayamansa. Rev Fac Farm. 2003;66(2):58-66.
12. Valenzuela Soto R, Morales Rubio ME, Verde Star MJ, Oranday Cárdenas A, Preciado-Rangel P, González JA, et al. Cnidoscolus chayamansa hidropónica orgánica y su capacidad hipoglucemiante, calidad nutraceutica y toxicidad. Rev Mex Cienc Agríc [internet]. 2015 mayo-jun. [citado 18 jul. 2015];6(4):[aprox. 12 p.]. Disponible en: http://www.redalyc.org/articulo.oa?id=263138102012
13. Taype Soledad A, Cairo Y, Castillo C. Efecto hipoglicemiante del extracto acuoso de las hojas de Argyrochosma nívea en rattus rattus variedad albinus. ReNut [internet]. 2013 [citado 18 jul. 2015];7(2):[aprox. 6 p.]. Disponible en: http://www.iidenut.org/pronj/kaslos/solidos/pdf_revista_tec/Renut_24 /Renut_24_2013_7_Efecto_hipoglicemiante_del_extracto_acuoso_de_las_hojas.pdf
14. Loza Almanza R, Guarachi LN, López Gavincha Y, Mamani Mamani M, Arias Miranda JL, Almanza Vega G, Gonzales Dávalos E, Bermejo Benito P. Evaluación de la toxicidad de los extractos etanólicos de Baccharis latifolia, Baccharis papillosa en animales de experimentación. Biofarbo [internet]. 2011 jun. [citado 18 jul. 2015];19(1):[aprox. 6 p.]. Disponible en: http://www.revistasbolivianas.org.bo/pdf/rbfb/v19n1/a04.pdf
15. Boffill Cárdenas MA, Valido Díaz A, Pizarro Espín A, Sánchez Álvarez C. Efecto gastroprotector del jugo de zanahoria (Daucus carota), col (Brassica oleracea) y papa (Solanum tuberosum). Medicent Electrón [internet]. 2015 abr.-jun. [citado 21 nov. 2015];19(2):[aprox. 8 p.]. Disponible en: http://www.medicentro.sld.cu/index.php/medicentro/article/viewFile/1790/1550
16. Bucciarelli A, Skliar MI. Medicinal plants from Argentina with gastroprotective activity. Ars Pharm. 2007;48(4):361-9.
17. Pinto Dávalos J, Bustamante García Z. Evaluación de la actividad gastroprotectora de los extractos de llantén (Plantago major). Biofarbo [internet]. 2008 [citado 21 nov. 2014];16(1):[aprox. 8 p.]. Disponible en: http://www.revistasbolivianas.org.bo/scielo.php?script=sci_arttext&pid=S1813-53632008000100007&lng=es
18. Mercado G, Carrillo L, Wall A, López JA, Álvarez E. Compuestos polifenólicos y capacidad antioxidante de especias típicas consumidas en México. Nutr Hosp. 2013;28(1):36-46.
19. Céspedes CL, Alarcon J, Avila Acevedo JG, El Hafidi M. Anti-inflammatory, Antioedema and Gastroprotective Activities of Aristotelia chilensis Extracts, Part 2. Bol Latinoam Caribe Plant Med Aromat [internet]. 2010 [citado 6 dic. 2015];9(6):[aprox. 8 p.]. Disponible en: http://www.journals.usach.cl/ojs/index.php/blacpma /article/viewFile/226/213
20. Palomino Pacheco M, Huamán Gutiérrez ÓG, Béjar Camarena E, Jurado Texeira B, Palomino Pacheco C. Evaluación gastroprotectora del extracto hidroalcohólico de hojas de Guilleminea densa (Hum. Bonpl. ex Willd.) Moq. (Sanguinaria) en úlceras inducidas con etanol. Rev Acad Peru Salud [internet]. 2010 [citado 21 nov. 2014];17(2):[aprox. 6 p.]. Disponible en: http://sisbib.unmsm.edu.pe/bvrevistas/rev_academia/2010_n2 /pdf/a13v17n2.pdf
Recibido: 4 de febrero de 2016
Aprobado: 16 de junio de 2016
Yilka Mena Linares. Unidad de Toxicología Experimental. Universidad de Ciencias Médicas Dr. Serafín Ruiz de Zárate Ruiz. Santa Clara, Villa Clara. Cuba. Correo electrónico: yilkaml@infomed.sld.cu