INTRODUCCIÓN
El coronavirus 2 del síndrome respiratorio agudo grave (SARS-CoV-2) apareció en la provincia de Hubei, China en diciembre de 2020.1 La enfermedad causada por el virus se denominó enfermedad por coronavirus 2019 (COVID-19), se convirtió en una pandemia que hasta el 26 noviembre de 2021 había afectado a 259 502 031 personas y provocado la muerte de 5 183 003 pacientes.1,2
El SARS-CoV-2, antes de replicarse dentro de las células diana, se une a su receptor de membrana, el receptor de la enzima convertidora de angiotensina 2 (ACE2), mediante su proteína de la espícula (S) y con la ayuda de proteasas como la proteasa transmembrana de serina 2, y luego se fusionan las membranas virus-célula para entrar e infectar la célula huésped.3 Por tanto, los órganos que expresen muchos receptores ACE2 o TMPRSS son vulnerables a la infección viral.4
Los receptores ACE2 se expresan en diferentes tejidos incluido el sistema reproductor, lo que explica la gran variedad de tejidos y órganos afectados por la COVID-19.5,6,7 Esto sugiere un riesgo potencial para el tracto reproductivo en pacientes infectados por el SARS-CoV-2. Además, se ha detectado ARN del SARS-CoV-2 en la sangre, la orina, los hisopos faciales/anales, el semen y la secreción vaginal.3,8 Sin embargo, hay poca información sobre la infección por el SRAS-CoV-2 en el tracto reproductivo masculino y femenino, lo que pudiera aportar pruebas sobre la transmisión sexual y los problemas de fertilidad.9,10
El sistema reproductor masculino es 8una diana potencial de la infección por el SRAS-CoV-2, lo que está respaldado por algunas pruebas preliminares. 6 Esto puede suponer una amenaza global para el potencial de fertilidad masculino, ya que los hombres son más propensos a la infección por SARS-CoV-2 que las mujeres, especialmente los que están en edad reproductiva. Los informes preliminares también han indicado la posibilidad de transmisión sexual del SRAS-CoV-2, aunque hay contradicciones y es poco probable.1,6,11
Las pruebas sobre los efectos adversos de la infección por el SRAS-CoV-2 en el sistema reproductor masculino son limitadas y son pocos los estudios que han informado de los resultados de los análisis de semen o de la presencia de ARN viral en las muestras de semen de los hombres infectados.12 No obstante, en algunos pacientes se han notificado alteraciones hormonales, como la disminución del nivel de testosterona con el aumento de la hormona luteinizante (LH).12,13
Los datos disponibles se basan en tamaños muestrales relativamente pequeños con informaciones contradictorias, por lo que para hombres en edad reproductiva, se sugiere evaluación de la función gonadal y del semen.9 En cuanto a la posibilidad de transmisión sexual, no hay evidencia suficiente para respaldar la necesidad de que las parejas asintomáticas eviten las relaciones sexuales para protegerse. Se necesita más investigación para comprender los impactos a largo plazo del SARS-CoV-2 en la función reproductiva masculina, incluidos sus posibles efectos sobre la fertilidad y la función endocrina testicular.
Es evidente que el tema debe ser evaluado más a fondo para determinar el efecto del SARS-CoV-2 en los sistemas reproductivos masculino y femenino,1 los efectos del SARS-CoV-2 sobre estos sistemas se conocen poco, aunque hay indicios de afectación.8 En este estudio, se discutirán las posibles vías de transmisión de la infección por el SARS-CoV-2 en el sistema reproductivo humano, y se describirán los probables efectos del SARS-CoV-2 en el mismo.
DESARROLLO
El SARS-CoV-2 es un coronavirus recientemente descubierto como productor de enfermedad en lo seres humanos, por lo que se está investigando mucho a nivel mundial. Por otra parte, muchas investigaciones tienen limitaciones metodológicas debido, principalmente por muestras relativamente pequeñas y resultados, a veces, contradictorios que tendrán que ser esclarecidos en futuras investigaciones.
Lo que está claro es que la COVID-19 afecta también al sistema reproductor, en especial al masculino, aunque la gravedad y magnitud del daño y sus efectos a largo plazo aún deben definirse. Aquí se expondrán los aspectos donde hay mayor consenso internacional.
MÉTODOS
La revisión bibliográfica se efectuó en:
Google Académico https://scholar.google.com.cu
PubMed Central https://www.ncbi.nlm.nih.gov/pmc
SciELO https://scielo.org/es
Infomed http://www.bvscuba.sld.cu/clasificacion-de-revista/revistas-cubanas
Se utilizaron los descriptores COVID-19, SARS-CoV-2 y sistema reproductor sacados de DeCS - Descriptores en Ciencias de la Salud en https://decs.bvsalud.org/es
Se seleccionaron artículos disponibles a texto completo en español e inglés, de revistas revisadas por pares y páginas de organizaciones internacionales reconocidas. Cada autor realizó la búsqueda por separado en un periodo de 3 meses.
Al final, por consenso se aprobaron las referencias, luego de que cada autor propusiera un número similar de trabajos publicados.
Vías de transmisión de la infección por el SARS-CoV-2 en el sistema reproductivo
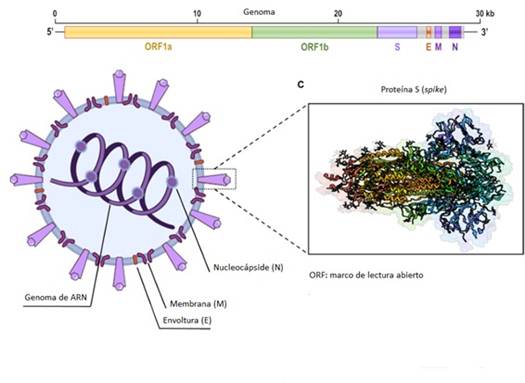
En la figura 1 16 se representa el SARS-CoV-2 con sus cuatro proteínas estructurales, incluyendo la espiga (S), la envoltura (E), la membrana (M) y las proteínas de la nucleocápside (N).9,16 Entre ellas, la proteína S es la que desempeña las funciones más importantes en la fijación, fusión y entrada del virus, y sirve como objetivo para el desarrollo de anticuerpos, inhibidores antivirales y vacunas.5,15
La proteína S se divide en dos subunidades, S1 y S2.15 Mientras la subunidad S1 se une a la ACE2 que es su receptor, la S2 se activa por la proteasa transmembrana de serina 2 asociada a la superficie del huésped (TMPRSS2 por sus siglas en inglés). Juntas, estas acciones fusionan las membranas virus-célula huésped, entrando el ARN viral al interior celular.14 Además, se necesita del concurso de la neuropilina-1 (NRP1).5
Varios resultados han confirmado que NRP1 podría representar un factor potenciador de ACE2, sin embargo, también es posible que el SARS-CoV-2 entre en las células independientemente del receptor cuando las cargas virales son altas.5
Es importante destacar que el perfil de expresión de receptores de la ACE2 se da tanto en el sistema reproductor masculino como en el femenino.9 Por lo tanto, se deduce que las vías de transmisión de la infección por el SARS-CoV-2 en el sistema reproductor podrían estar mediadas por este.
La posibilidad de que el virus SARS-CoV-2 pueda identificarse en el tejido testicular o en el líquido seminal tendría importantes implicaciones, especialmente en lo que respecta a la reproducción asistida, a la criopreservación de gametos y a la posibilidad de transmisión sexual de la enfermedad.9
La transmisión vertical de madre a hijo parece menos probable, aunque dada la escasez de datos de los primeros trimestres, todavía no se puede hacer una evaluación de las tasas de transmisión vertical en los primeros meses del embarazo y del riesgo potencial de la consiguiente morbilidad y mortalidad fetal.16,17
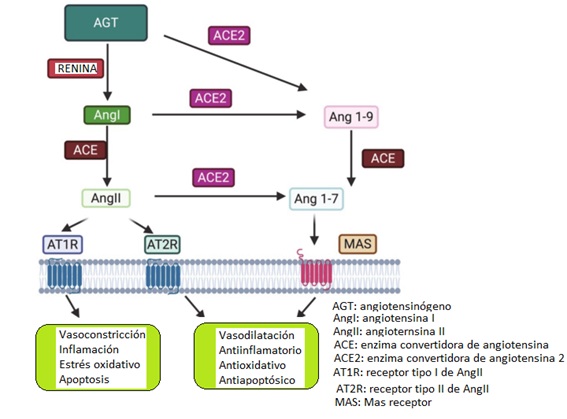
El sistema renina angiotensina (SRA) desempeña un papel destacado en el control de la presión arterial, el tono vascular, la homeostasis hidrosalina y volumen plasmático.11 La renina se libera del riñón en respuesta a la reducción de la presión arterial o de la concentración de sodio, o la activación beta.11 Tras su activación, la renina escinde su sustrato, el angiotensinógeno (AGT), para producir Angiotensina (Ang) I. La conversión de Ang I en Ang II está mediada por la ACE endotelial. En figura 2 11 se muestra un esquema de este proceso.
La Ang II, la ACE2 y la Ang (1-7) regulan funciones básicas en los sistemas reproductivos masculino y femenino.11,18 Dado que el SARS-CoV-2 entra en la célula uniéndose al receptor ACE2, las células reproductivas, al igual que otros tejidos que lo expresan, son potencialmente vulnerables al virus. 18 Después de la invasión viral se reduce la expresión de receptores ACE2, lo que conduce a un aumento de la respuesta proinflamatoria por Ang II.
Los receptores ACE2 son más abundantes en el sistema masculino que en el femenino. La ACE2 se expresa poco en trompa de Falopio, ovario, vagina, cuello uterino y endometrio.18 Por otro lado, la expresión de ACE2 en los testículos es una de las más altas, con una alta expresión en las células de Leydig y Sertoli y una expresión media en las células glandulares de la vesícula seminal.16,19 Como resultado, los testículos parecen más vulnerables que los ovarios a los efectos perjudiciales de una infección por el SARS-CoV-2, aunque los mecanismos de afectación no están totalmente dilucidados.20
Los estudios sobre la vulnerabilidad de la gónada a la infección por SARS-CoV-2 han determinado la presencia del virus en los testículos, pero no en el ovario o el útero.21 Estos estudios sugieren que la infección por el SARS-CoV-2 puede causar una alteración de las hormonas sexuales en los varones; sin embargo, la patogenia y el contagio del virus en el aparato genital siguen siendo desconocidos.
Efecto del SARS-CoV-2 en el sistema reproductor masculino
Uno de los retos para entender el impacto de la infección por SARS-CoV-2 en la salud reproductiva masculina es la variabilidad en la gravedad de la COVID-19 y la respuesta inmunitaria al SARS-CoV-2.22 Se ha planteado que las cargas virales más altas conducen a la propagación hematógena al tracto reproductivo masculino y a una enfermedad grave que trastorna la respuesta inmunitaria testicular.
Entre los mecanismos posibles de afectación de las gónadas masculinas con el SARS-CoV-2 están el eje ACE2 en los testículos, las alteraciones hormonales, los anticuerpos antiespermáticos y posteriormente, la infertilidad inmunológica como complicación de la infección por el SARS-CoV-2.20
De forma similar a otras enfermedades virales como las paperas, el SARS-CoV-2 puede afectar la reproducción masculina.22 La edad avanzada, sexo masculino, raza afroamericana o asiática, diabetes e hipertensión son factores de riesgo para la COVID-19 grave; aunque el 5 % de los casos graves ocurren en jóvenes sanos.22 Independiente de otros factores de riesgo, los hombres son más propensos a tener una enfermedad grave.
La comprensión de la dinámica viral y de la respuesta inmunitaria es limitada. 22 La respuesta innata requiere el reconocimiento del SARS-CoV-2 como patógeno. El SARS-CoV-2 puede presentar una evasión inmunitaria a través de la inhibición de las vías de señalización del interferón (IFN), lo que puede contribuir a la variabilidad de los períodos de incubación.
La activación de las células NK contribuye a la respuesta innata.22 La inmunidad adaptativa contra el SARS-CoV-2 se inicia por las células T auxiliares, que liberan IFN-γ, factor de necrosis tumoral α e interleucina-2 en respuesta a la presentación de antígenos por las células presentadoras de antígenos. La liberación de citocinas por parte de las células T auxiliares activa las células T citotóxicas que destruyen las células del huésped infectadas.
La inmunidad humoral está mediada por las células B activadas que producen anticuerpos IgM e IgG contra la proteína S.22 Una mejor comprensión de la respuesta inmunitaria al SARS-CoV-2 ayudará a dilucidar la susceptibilidad del sexo a la COVID-19 y a identificar nuevas terapias diana.
El nivel más bajo de ACE2 se relaciona con el deterioro severo de la espermatogénesis.23 Algunos descubrieron que la ACE2 abunda en las células de espermatogonia, Leydig y Sertoli.23 Estos hallazgos son importantes en las células de Sertoli, porque estas células son responsables de la biosíntesis de andrógenos y desempeñan un papel esencial en el microambiente testicular.
Además, el SARS-CoV-2 puede causar daños más graves en el testículo de jóvenes que en los pacientes de mayor edad. 23 Debido a que la temperatura corporal es crucial para el desarrollo de las células germinales, los cambios de temperatura testiculares y la fiebre persistente pueden causar la degeneración de las células germinales.
Estos resultados señalan que la ACE2 desempeña un papel importante en el sistema reproductor masculino y que la infección por el SARS-CoV-2 podría dañar este sistema mediado por la ACE2. 5 El impacto de la COVID-19 puede implicar múltiples mecanismos: daño directo de la función espermática o testicular, daño causado por la respuesta inmunitaria y el efecto del nivel hormonal en la fertilidad masculina.24
El efecto del SARS-CoV-2 en el material genético del espermatozoide incluye el daño directo y el daño indirecto de la respuesta inflamatoria virus-inducida.24 El impacto en la descendencia se refleja en la disminución de los parámetros del semen y en el debilitamiento de la función espermática. Si el SARS-CoV-2 puede replicarse en el esperma como el virus de la hepatitis B, su material genético puede transmitirse de padres a hijos.
Hasta la fecha, los estudios han demostrado que los espermatozoides disponen de toda la maquinaria necesaria para unirse a este virus. 24 El SARS-CoV-2 es el mediador de los daños en la cromatina y el ADN de los espermatozoides, lo que provoca cambios en los genomas paternos y quizás resultados anormales en la descendencia, como abortos y malformaciones.
La ACE2 parece desempeñar un papel clave en la espermatogénesis, ya que los niveles testiculares de esta enzima son inferiores en varones con defectos severos en la producción de espermatozoides.14 Por otra parte, la presencia de ACE2 en las células somáticas del parénquima testicular sugiere que desempeñaría un papel en la regulación de la síntesis de andrógenos, modulando el desarrollo de las células germinales y condicionando la función reproductiva.
En relación a la localización de TMPRSS2 en el tejido testicular, se concentra principalmente en espermatogonias y espermátides, considerando la expresión de esta proteasa relativamente escasa en el resto de las poblaciones celulares. 14 Por otra parte, algunas infecciones virales como la parotiditis pueden cursar con orquitis y posibles trastornos reproductivos a largo plazo.14,18,25
Un estudio encontró que la orquitis es una complicación del síndrome respiratorio agudo grave (SARS) y que se afecta la producción espermática.14 Un estudio de los testículos de seis pacientes fallecidos por SARS encontró destrucción difusa de células germinales, disminución de espermatozoides en los túbulos seminíferos, adelgazamiento de la membrana basal e infiltración leucocitaria.
Puesto que la orquitis es una complicación del SARS, y dado que el SARS-CoV y el SARS-CoV-2 comparten gran parte de su secuencia genética y utilizan el mismo receptor para su replicación, se sugiere que el SARS-CoV-2 podría transmitirse por el semen como una ruta de transmisión. 13,14 En un primer momento, no se encontró el virus en el eyaculado de 34 pacientes recuperados tras la infección moderada.14
En la misma línea, otro trabajo tampoco logró detectar el virus ni en el semen de 11 pacientes recuperados, ni en el tejido testicular de un paciente fallecido durante la fase aguda de la infección.14 Una revisión sistemática encontró que el semen es un raro portador de material genético del SARS-CoV-2 durante el periodo de infección, pero no en el semen de los pacientes recuperados.26
Los datos disponibles sobre la presencia del virus en semen son contradictorios.5,6,7,10,27,28 Solo un estudio informó de la presencia de ARN viral en el 15,8 % de enfermos de COVID-19.9 La presencia de ácido nucleico o antígeno en el semen no implica la existencia de virus con capacidad de replicación o infección.9,22,23
En este sentido, el hipotético daño testicular estaría causado bien por infección directa en las células que presentan receptores ACE2, o como consecuencia de una respuesta inflamatoria local secundaria a la infección. 14 En ambos casos, la afectación gonadal podría producir alteraciones en la espermatogénesis, en la función endocrina y aumentar el riesgo de infertilidad.
Un estudio de hombres con la COVID-19 informó que casi una quinta parte (19 %) de los participantes experimentaron molestias escrotales, comparables a las de la orquitis.18 Cuatro informes de casos describieron a varones con dolor testicular como síntoma de presentación atípico de la COVID-19.
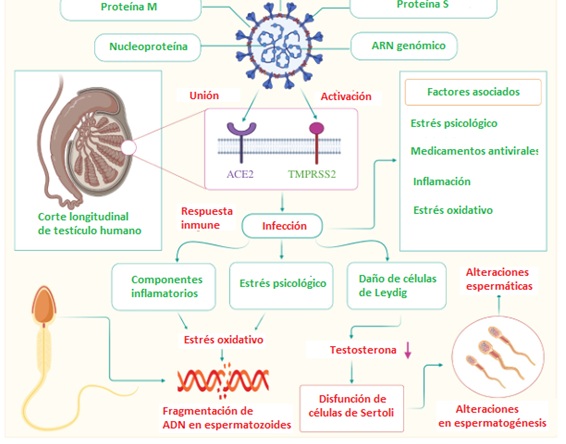
Los hombres con la COVID-19 grave presentaron una posibilidad mayor de orquitis que los pacientes con COVID-19 no grave.8 En la figura 3 6 se resumen los complejos y no bien comprendidos efectos del virus sobre el sistema reproductor masculino.
Hipogonadismo en la infección por COVID-19
El hipotálamo secreta la hormona liberadora de gonadotropina (GnRH) que activa la liberación de la hormona estimulante del folículo (FSH) y la LH de la hipófisis.13 Un nivel bajo de GnRH provoca una disminución de la FSH y la LH, lo que provoca un deterioro de la función de las células de Sertoli y de Leydig.
En hombres con la COVID-19 se incrementa la LH en suero y se reduce la relación testosterona/LH y FSH/LH, congruente con un hipogonadismo subclínico.7,9,29 Al comparar 81 hombres en edad reproductiva con la COVID-19 con 100 hombres sanos de la misma edad, los resultados mostraron un incremento de la LH en suero, pero la relación testosterona/LH y la relación FSH/LH se redujo en los hombres con la COVID-19.13
La testosterona podría reducir la inflamación. De hecho, algunos resultados revelaron que el hipogonadismo se correlacionaba con la regulación al alza de las citocinas proinflamatorias y que el tratamiento con testosterona reducía algunas citocinas.7 De ahí surgió la hipótesis de que la testosterona desempeñaba un papel en la progresión de la infección por el SARS-CoV-2 debido a la tormenta de citocinas.
La regulación ascendente de las citocinas inflamatorias, acompañada de la disminución de andrógenos y estrógenos en los hombres que envejecen, puede establecer una asociación no positiva entre los niveles de testosterona y la mortalidad asociada a la COVID-19.7 Las hormonas sexuales masculinas de los testículos son cruciales para la espermatogénesis. En una cohorte de 45 pacientes masculinos con la COVID-19 crítica, el 68,6 % tenía niveles bajos de testosterona y el 48,6 % tenía niveles bajos de dihidrotestosterona.8
Un estudio retrospectivo de 119 pacientes con COVID-19 y 273 hombres de control emparejados por edad informó que los hombres infectados no presentaban diferencias en los niveles séricos de testosterona y FSH en comparación con los controles.8 Sin embargo, revelaron un mayor nivel sérico de LH y una disminución de las proporciones de testosterona/LH y FSH/LH. Según este estudio el SARS-CoV-2 perjudica la función de las células de Leydig y la disfunción hipotalámica probablemente deteriora la secreción de hormonas sexuales masculinas.
Es necesario seguir investigando la relación entre el nivel de hormonas sexuales masculinas y la infección por el SARS-CoV-2 en estudios prospectivos a largo plazo para evaluar el hipogonadismo y la disfunción sexual causados por niveles anormales de hormonas sexuales.
El hipogonadismo masculino es un factor de riesgo para el SARS-CoV-2. El hipogonadismo causado por la obesidad disminuye los niveles de células T. 30 Además, la disminución de células T conduce al progreso de la tormenta de citocinas y aumento de las citocinas proinflamatorias, que representan los mediadores inflamatorios en la fase aguda del SARS-CoV-2, se asocian al hipogonadismo. Como resultado, el hipogonadismo puede causar SARS-CoV-2 grave y, a la inversa, el SARS-CoV-2 puede causar hipogonadismo.30,31
Impacto del SARS-CoV-2 en la función sexual
El COVID-19 también afecta la función sexual y la actividad sexual. Al principio de la pandemia se informó en un estudio chino que la actividad sexual había disminuido en el 37 % de los encuestados, y el 44 % informó una disminución en el número de parejas sexuales.22 Curiosamente, un estudio de Bangladesh, India y Nepal sugirió un cambio mínimo en la actividad sexual.22
Las prácticas sexuales durante el COVID-19 pueden afectarse por el aislamiento social, el estado de ánimo, estrés, depresión y ansiedad, así como por el miedo a la transmisión.13,22 También se ha sugerido que la enfermedad cardiovascular derivada de la COVID-19 y el tratamiento posterior pueden provocar una disfunción eréctil, y las manifestaciones neurológicas derivadas de la enfermedad cerebrovascular o la hemorragia pueden afectar al deseo sexual, la función eréctil y la eyaculación.
El estrés psicológico se asocia a una menor secreción de globulina fijadora de hormonas sexuales, a una mayor secreción de cortisol y prolactina, a problemas del espermatograma, a una mayor fragmentación del ADN de los espermatozoides y a una disfunción sexual.13 Por lo tanto, además de sus efectos directos en los testículos, el SARS-CoV-2 puede afectar la fertilidad indirectamente a través del sistema nervioso central y la inflamación.
Efecto del SARS-CoV-2 en el sistema reproductor femenino
Los estudios sugieren que el SARS-CoV-2 podría causar disfunción en el sistema reproductor femenino.32 Los efectos adversos directos están relacionados con el impacto citopático de la colonización del virus y los efectos indirectos a la exacerbación causada por el SRA, las reacciones inflamatorias, los trastornos psicológicos y la obesidad.
Se sugiere que los niveles de estrógenos podrían tener un efecto protector, basándose en estudios en animales, en los que los estrógenos disminuían la susceptibilidad y la gravedad de la infección por el SARS-CoV-2, mientras que la ovariectomía o el tratamiento con inhibidores del receptor de estrógenos aumentaban la mortalidad de las hembras de ratones. 14 También se presenta la ACE2 en la vagina; aunque, no se ha reportado la presencia del virus en el aparato reproductor femenino ni en las secreciones vaginales.33
La ACE2 está también presente en el endometrio y en el embrión.14 A nivel endometrial, es más abundante en las células epiteliales y su expresión es mayor en la fase secretora del ciclo menstrual. Por otra parte, en un estudio hallaron la expresión de receptores ACE2 y de la TMPRSS2 en células del epiblasto embrionario y detectaron la presencia de otras proteínas clave en la endocitosis y replicación del virus en todas las fases del desarrollo embrionario.14
Anteriormente, se detectaron receptores de ACE2 en ovarios y ovocitos de mujeres premenopáusicas y posmenopáusicas. 33 Por lo tanto, es posible que el SARS-CoV-2 se dirija a los ovarios y a los ovocitos. En general, la ACE2 se expresa en gran medida en las células epiteliales en comparación con las células estromales del endometrio, y la expresión de la ACE2 es elevada en la fase secretora en comparación con la fase proliferativa del ciclo menstrual.33
El SARS-CoV-2 ataca el tejido ovárico y las células de la granulosa y, por lo tanto, dificulta la función ovárica y la viabilidad de los ovocitos, lo que conduce a la infertilidad y al aborto.33 También puede mutilar las células del endometrio, dificultando la implantación del embrión. En la actualidad, debido a la falta de datos de tejido ovárico humano, varios investigadores han empleado la información de primates como sustitutos de la especie humana; aunque, estos estudios tienen sus limitaciones y no pueden considerarse decisivos.
El riesgo de infección por el SRAS-CoV-2 aumenta en el momento de las técnicas de reproducción asistida para inducir el embarazo. Por lo tanto, es necesario llevar a cabo una investigación exhaustiva en este campo para evaluar la amenaza que supone el SARS-CoV-2 en el sistema reproductivo femenino y, a continuación, diseñar las medidas de seguridad para proteger los gametos.8,33)
Entre las pacientes con anovulación, el síndrome de ovario poliquístico (SOP) es la endocrinopatía más común. 23 La conexión entre el SOP y SRA fue revelada por el aumento de la actividad del SRA en el SOP. La angiotensina 1-7 y la ACE2 de los ovarios se relacionan con la esteroidogénesis, el desarrollo folicular, la apoptosis de las células de la granulosa-luteína, la maduración de los ovocitos y la ovulación.
Herrero et al.34 investigaron los efectos de la infección por el SARS-CoV-2 en la función ovárica comparando el líquido folicular de pacientes de control y de pacientes recuperados de la COVID-19. La mayoría (91,3 %) de los pacientes post COVID-19 eran positivos para la IgG contra el SARS-CoV-2.34 Además, los pacientes con niveles más altos de IgG tenían un menor número de ovocitos recuperados. En conclusión, estos resultados describen que la infección por SARS-CoV-2 afecta negativamente al microambiente folicular, desregulando la función ovárica.
Efectos de tratamientos en el sistema reproductivo
Se pondrán algunos ejemplos para ilustrar este acápite por ser muy amplio su estudio.
El remdesivir (GS-5734), un fármaco prometedor para el tratamiento de la COVID-19, es un análogo de los nucleósidos que inhibe la replicación viral.35 Sin embargo, estos fármacos ejercen potencialmente un efecto deletéreo sobre la función gonadal, la gametogénesis y el desarrollo embrionario.35 Por lo tanto, llama la atención la toxicidad del fármaco para el sistema reproductivo, aunque los estudios clínicos son escasos y se requieren más estudios.
El tratamiento de pacientes con COVID-19 con fármacos antivirales (por ejemplo, ribavirina) reduce los niveles de testosterona, induce el estrés oxidativo, deteriora el epitelio seminífero y provoca la formación de espermatozoides anormales.36
Para el tratamiento de la COVID-19 se recomienda el interferón α, la ribavirina y cloroquina.25 En animales la ribavirina reduce los niveles de testosterona e inhibe la espermatogénesis, mientras que el lopinavir/ritonavir inhibe la espermatogénesis. Además, la cloroquina afecta a la espermatogénesis y a la función del epidídimo en ratas macho.25 Sin embargo, un estudio indica que el tratamiento con favipiravir e hidroxicloroquina no tuvieron ningún efecto a largo plazo sobre la salud reproductiva masculina, aunque debe ser validado por ensayos clínicos.37
La tasa de mortalidad con la infección SARS-CoV-2 en las mujeres es inferior a la de los hombres. El estrógeno ejerce un efecto protector sobre la infección por el SARS-CoV-2 al regular la respuesta inmunitaria, lo que también da lugar a un posible tratamiento para los pacientes con la COVID-19.35 Sin embargo, estas hormonas afectan a la función reproductiva masculina, alterando el equilibrio hormonal, el deseo sexual, la función eréctil o la producción de espermatozoides.
Las tasas de infección por SARS-CoV-2 en pacientes con cáncer prostático tratados con terapia de privación de andrógenos (ADT) son menores que en los pacientes no tratados.35 Sin embargo, este método debe evaluarse para el tratamiento de la COVID-19 porque provoca una deficiencia de andrógenos y aumenta la probabilidad de fugas venosas. Además, los cambios en los niveles hormonales y en el estado neurológico pueden originar la disfunción eréctil y la disminución de la libido, aunque aún no se ha determinado si el daño es reversible.35
Las terapias inmunomoduladoras preocupan por los posibles efectos a largo plazo en la fertilidad masculina.36 El uso crónico de dosis elevadas de corticosteroides pueden inhibir el eje hipotálamo-hipófisis-adrenal (niveles bajos de testosterona) e inducir una disfunción eréctil.
La administración crónica de antiinflamatorios no esteroideos puede afectar a la calidad de los espermatozoides al reducir su movilidad, vitalidad, recuento y morfología.36 Estos efectos son reversibles y dependientes de la dosis.
CONCLUSIONES
La infección por el SARS-CoV-2 causante de la COVID-19 puede afectar múltiples órganos y sistemas corporales, incluido el sistema reproductor.
El sistema reproductor masculino parece ser más vulnerable a la infección por el SARS-CoV-2, a pesar de que el tema es controvertido y que también el sistema reproductor femenino sufre afectación.
La afectación del sistema reproductor pudiera tener implicaciones clínicas importantes para la fertilidad, la descendencia y, aunque menos probable, para la transmisión del virus.
Se requieren más investigaciones con muestras más representativas para evaluar la magnitud del daño y el impacto a largo plazo de la COVID-19 sobre el sistema reproductor humano.