Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Correo Científico Médico
versión On-line ISSN 1560-4381
CCM vol.18 no.1 Holguín ene.-mar. 2014
ARTÍCULO ORIGINAL
Hepatotoxicidad aguda de la decocción de la planta Mimosa púdica en ratas Sprague Dawley
Acute Hepatotoxicity of Mimosa pudica Plant Decoction in Sprague Dawley Rats
Niurka Esther Gómez Trujillo 1, Isell Corella Del Toro 2, Yudelkis Cutié Anido 3, Tania Rodríguez Graña 4, Leticia Salinas Ojeda 4
1. Especialista de Primer Grado en Medicina General Integral y Bioquímica Clínica. Asistente. Universidad de Ciencias Médicas. Holguín. Cuba.
2. Especialista de Primer Grado en Bioquímica Clínica. Asistente. Universidad de Ciencias Médicas. Holguín. Cuba.
3. Especialista de Primer Grado en Medicina General Integral y en Fisiología Normal y Patológica. Asistente. Universidad de Ciencias Médicas. Holguín. Cuba.
4. Especialista de Primer Grado en Medicina General Integral y Bioquímica Clínica. Asistente. Universidad de Ciencias Médicas. Holguín. Cuba.
RESUMEN
Introducción: la enfermedad hepática tóxica es un problema desconcertante debido al amplio número de sustancias capaces de inducir este tipo de reacciones. Datos epidemiológicos y estadísticos demuestran que la Mimosa púdica conocida como moriviví, sensitiva, adormidera es una de las plantas (objeto de abuso) más empleadas como adulterante en los pitillos de marihuana en pacientes drogadictos.
Objetivos: evaluar el comportamiento de los parámetros bioquímicos y describir los hallazgos anatopatológicos en el hígado de ratas por efecto de la planta Mimosa púdica.
Métodos: se realizó un estudio preclínico de hepatotoxicidad aguda con la planta Mimosa púdica en animales de experimentación. Se seleccionaron 25 ratas Sprague Dawley, cinco por cada grupo (control positivo, control y tres grupos experimentales) de experimentación. Se administró una dosis de 500, 1000 y 2000 miligramos por kilogramo de peso corporal de la decocción de la planta a los grupos experimentales respectivamente; tetracloruro de carbono a dosis de 3 mililitros por kilogramo de peso corporal al control positivo y agua estéril al control.
Resultados: aumento de los niveles de transaminasas (TGP y TGO) en los grupos experimentales con respecto al grupo control. Las alteraciones anatomopatológicos observadas fueron: necrosis focal periportal, congestión de venas centrolobulillares y degeneración acidófila del hígado.
Conclusiones: el consumo de la decocción de la planta Mimosa púdica afecta el hígado, lo que provoca alteraciones bioquímicas y anatomopatológicas, de probable importancia en pacientes drogadictos, aunque se requieren más estudios.
Palabras clave: hepatotoxicidad aguda, Mimosa púdica, ratas Sprague Dawley, transaminasas TGP y TGO.
ABSTRACT
Introduction: toxic liver disease is a concerning problem due to the large number of substances that cause such reactions. Epidemiological and statistical data show that Mimosa (Moriviví), known as sensitive and opium poppy is one of the most used plants by drug-addict patients, as an adulterant in marihuana cigarettes drug.
Objectives: to evaluate the behavior of biochemical parameters and describe pathological findings in the liver of rats as a result of Mimosa pudica plant.
Methods: a preclinical study of acute hepatotoxicity with Mimosa pudica plant in experimental animals was performed. Twenty five Sprague Dawley rats, five per group (positive control, group control and three experimental) were selected for the study. A dose of 500, 1000 and 2000 mg administered per kilogram of body weight of the decoction of the plant to the experimental groups respectively; carbon tetrachloride at doses of 3 milliliters per kilogram of body weight to the positive control and sterile water to control.
Results: the results showed an increase of levels of transaminases (SGOT and SGPT) in the experimental groups compared to the control group. The pathological changes observed were focal periportal necrosis, congestion and centrilobular veins acidophilic degeneration of the liver.
Conclusions: the consumption of the decoction of the plant Mimosa pudica affects the liver, causing biochemical and pathological alteration of likely importance in drug patients, although further studies are required.
Keywords: acute hepatotoxicity, Mimosa pudica, Sprague Dawley rats, transaminases SGOT and SGPT.
INTRODUCCIÓN
La enfermedad hepática tóxica es un problema desconcertante debido al amplio número de sustancias capaces de inducir este tipo de reacciones, a la heterogeneidad de la presentación clínica y a la imposibilidad en el momento actual de establecer con certeza el diagnóstico en la inmensa mayoría de los casos 1. En Cuba, el problema del uso indebido de drogas ha comenzado a tener incidencias en los últimos años.
Datos epidemiológicos demuestran que la Mimosa púdica conocida como moriviví, sensitiva, adormidera, es una de las plantas objeto de abuso más empleadas, reportándose en el 4% de los pacientes que acuden al servicio de deshabituación. Además una de las más empleadas como adulterante en los pitillos de marihuana, por lo que el estudio de sus efectos en animales de experimentación sería de utilidad para valorar el daño que provoca en diferentes órganos como el hígado. Esta investigación se diseñó para evaluar el comportamiento de los parámetros bioquímicos y describir los hallazgos anatopatológicos en el hígado de ratas por efecto de la planta Mimosa púdica.
MÉTODOS
Se realizó el estudio preclínico de toxicidad oral aguda para evaluar los efectos que provoca en el hígado el consumo de la decocción de la planta Mimosa púdica en el Centro de Toxicología y Biomedicina (TOXIMED) de la provincia Santiago de Cuba en el periodo comprendido del 13 al 17 de noviembre del 2009. Para el estudio se utilizaron ratas Sprague Dawley, hembras, nulíparas, no grávidas, de 6 a 8 semanas de edad y con un peso entre 150 y 200 gramos.
Procedencia, condiciones de alojamiento y alimentación
Los animales procedentes del Centro Nacional para la Producción de Animales de Laboratorio (CENPALAB, La Habana), al llegar al Vivario de TOXIMED fueron distribuidos e identificados por el método de perforación y muescas en las orejas, respectivamente, pasando a cuarentena, donde permanecieron siete días. Los mismos se mantuvieron en condiciones convencionales con una temperatura de 22 ±3 ºC, humedad relativa de 65% como promedio y un fotoperiodo de 12 h luz y 12 h oscuridad 2. Se mantuvieron individualmente en cajas Makrolon modelo 500, los cuales se identificaron mediante una tarjeta con los siguientes datos: especie, línea o raza, cantidad de animales, sexo, edad, peso, fecha de aplicación de la sustancia, nivel de dosis, fecha de terminación y responsable del ensayo.
La alimentación consistió en pienso concentrado multipropósito convencional procedente y certificado por el CENPALAB, La Habana. Además recibieron agua acidulada potable ad-libitum.
Preparación del producto
La decocción de la planta Mimosa púdica se realizó según la Farmacopea Británica, la USP XXI Farmacopea de los Estados Unidos y Farmacia Práctica de Remington. Se tomaron 500 g de la planta medicinal, finamente fragmentada se colocó en una fuente de calor hasta ebullición por espacio de 10 minutos en 1 000 ml de agua destilada. Luego se retiró, se dejó en reposo, tapado por espacio de 15 min y después se filtró.
La concentración de la decocción se determinó basada en el contenido de sólidos totales de la misma. El tetracloruro de carbono se diluyó en una proporción al 1:1 en aceite de oliva y se administró a los animales del grupo control positivo. Tanto los procedimientos normalizados de trabajo como los protocolos de ambos ensayos, fueron revisados y aprobados por el Comité Institucional de Ética para el cuidado y uso de los animales de laboratorio de TOXIMED, así como la Unidad de Garantía de la Calidad.
Procedimiento experimental
Los animales se dividieron en cinco grupos: control, control positivo y experimentales, en una cantidad de cinco animales por grupo, lo que suma un total de 25 utilizados en el estudio. Se administró al grupo control positivo tetracloruro de carbono a una dosis de tres mililitros por kilogramo de peso por vía intraperitoneal, al control se le administró agua estéril y a los grupos experimentales se les administró la decocción de la planta a una dosis de 500, 1 000, 2 000 miligramos por kilogramo de peso por vía oral a través de una sonda gástrica número 10 respectivamente.
Previo a la administración de las sustancias los animales fueron pesados. Al concluir 72 h de administración, observación y previo ayuno de 12 horas, los animales de los grupos control y experimental fueron enviados a la morgue, donde se sacrificaron mediante narcosis con 50 miligramos de ketamina inyectable por vía intraperitoneal, en dosis de 50 miligramos por kilogramo de peso corporal, se extrajo sangre de la vena de la cola y se colectó en tubos de ensayo sin heparina para los estudios bioquímicos. Luego se les realizó la necropsia. Se determinaron las siguientes variables bioquímicas: enzimas transaminasa glutámico-pirúvico (TGP) o alanina aminotransferasa (ALAT) y transaminasa glutámico-oxalacético (TGO) o aspartato aminotransferasa (ASAT) , se definió como criterio de normalidad al grupo control.
Para el estudio histopatológico se tomó muestra del hígado de los animales de todos los grupos. Las muestras se fijaron en formol al 10% neutro durante 18 a 20 h; luego fueron sometidas a un proceso de deshidratación con alcoholes a diferentes grados y luego la inclusión por el método de parafina. Se colorearon con hematoxilina-eosina y luego se montaron con bálsamo del Canadá para su posterior observación al microscopio.
Se determinaron las siguientes variables anatomopatológicas:
- Macroscópicas: se definió que existió daño siempre que se observó la presencia de tumefacción del hígado y de una coloración parda o carmelita que al corte interesa al parénquima del órgano.
- Microscópicas: se definió daño siempre que se encontró congestión de venas centrolobulillares y necrosis focal periportal con presencia de eosinófilos en la luz de algunos vasos portales, así como infiltrados mononucleares.
Para el análisis de las variables bioquímicas se determinaron las medias y desviaciones estándar, como medidas de tendencia central y variabilidad. Se utilizó la prueba ANOVA se escogió como factores los grupos de animales, y por último en las variables donde se encontraron diferencias, se les aplicó una prueba de Duncan. El nivel de significación fue de 0,05.
RESULTADOS
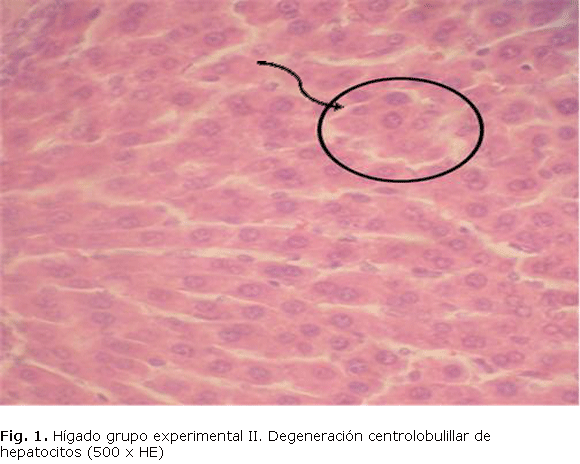
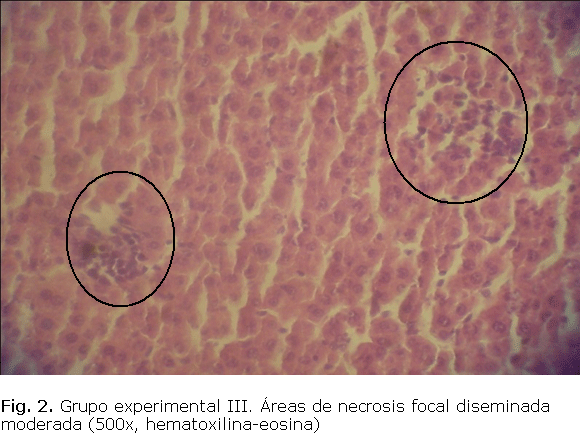
Se encontró un aumento en los niveles de TGP y TGO en los grupos experimentales con respecto al grupo control (tabla). Las alteraciones anatomopatológicos observadas fueron: necrosis focal periportal, congestión de venas centrolobulillares y degeneración acidófila del hígado tanto en el grupo experimental II (fig. 1), como en el grupo experimental III (fig. 2).
Tabla. Comportamiento de las enzimas alanina aminotransferasa o transaminasa glutámico
pirúvico (TGP) y aspartato aminotransferasa o transaminasa glutámico oxalacético (TGO)
| Valores normales | TGP (UI) | TGO (UI) |
| 19,8-55,8 | 143,0-357,4 | |
| Control | 47,20 ± 1,01* | 156,84±30,80* |
| Experimental I (500 mg/kg) | 61,50±4,31 | 181,68±4,71 |
| Experimental II (1000 mg/kg) | 66,74±3,08 | 200,46±5,11 |
| Experimental III (2000 mg/kg) | 87,24±4,52 | 218,44±6,53 |
| CCl4 | 421,2±134,98 | 2277,4±461,73 |
* Valor significativo en relación con los otros grupos (ANOVA, test de Duncan, p < 0,05), expresado como media ± desviación estándar.
DISCUSIÓN
Las células inmunes como las células de Kupffer y los monocitos son activadas por tóxicos como el tetracloruro de carbono, que conlleva a un proceso inflamatorio donde hay secreción de citoquinas y la inducción de proteínas reactantes de fase aguda en el hígado de ratas, las cuales asociadas a las citoquinas producen muerte celular programada o apoptosis 3.
En los grupos experimentales con respecto al grupo control se refleja un aumento en los niveles de TGP y TGO (tabla ), se corresponde con estudios realizados por El. Harith y colaboradores, en 1981, que demuestran que la mimosina administrada a ratas en su alimentación durante tres semanas provocó incremento de las enzimas hepáticas TGO, TGP y glutamato deshidrogenasa 4.
Esto puede explicarse pues la mimosina, principal alcaloide de la planta Mimosa púdica, es un aminoácido no proteico que se biotransforma en el hígado a través de reacciones de fase I o directamente conjugándose con ácido glucurónico en las reacciones de fase II, la misma pasa por una desaminación oxidativa seguido por una reacción de oxidación que da lugar a la formación de un ácido carboxílico; luego se propone un proceso de hidrólisis de la estructura de la mimosina, con lo cual se forma como producto final epóxidos que constituyen uno de los compuestos electrofílicos de mayor toxicidad para el organismo.
En el caso de la mimosina, aunque no fue demostrada su capacidad de inhibir las enzimas citocromos, se reporta que por su capacidad quelante es capaz de formar complejos moleculares con el hierro (Fe3+), que afecta de esta forma la actividad biológica de las biomoléculas del organismo que contengan este ión en su estructura 5-6 éste es el caso de las ferroproteínas, donde se incluye la familia de los citocromos.
En el 2006, Yano y colaboradores al estudiar el mecanismo de los inhibidores sintéticos de la enzima citocromo P-450 2A6, refieren que se formaban complejos de transición con el hierro del grupo hemo de las proteínas.
En el daño hepático causado por el tetracloruro de carbono este compuesto es primeramente deshalogenado por el sistema enzimático del citocromo P-450, y da lugar a la formación del radical triclorometilo, que puede reaccionar con el oxígeno para formar otro radical libre que es el triclorometilperoxi. Ambos radicales pueden reaccionar con los ácidos grasos poliinsaturados de las membranas, lo que produce peroxidación lipídica con la consiguiente afectación de la permeabilidad y ruptura de la membrana plasmática y la posterior salida de las enzimas intracelulares como la alanina aminotransferasa y aspartato aminotransferasas al torrente sanguíneo, aumentando sus niveles séricos 7.
Las alteraciones anatomopatológicas en el hígado de los animales de los grupos experimentales corrobora el aumento de los niveles de transaminasas en el plasma de dichos animales. Estos resultados permitieron esclarecer las alteraciones hepáticas encontradas en los pacientes drogodependientes, que consumían esta planta, y de esta forma responder a la preocupación de los profesionales de la salud encargados de su atención, lo que permitirá tomar una conducta terapéutica adecuada.
Las principales limitaciones de esta investigación fue la no determinación de otras variables bioquímicas como: la bilirrubina, la gamma glutamil transpeptidasa y la lactato deshidrogenasa, importantes para evaluar el daño hepático agudo. Se requieren otros estudios preclínicos a dosis repetidas y la evaluación a largo plazo de los efectos de la planta.
CONCLUSIONES
El consumo de la decocción de la planta Mimosa púdica afecta el hígado y provoca alteraciones bioquímicas y anatomopatológicas, de probable importancia en pacientes drogadictos, aunque se requieren más estudios.
REFERENCIAS BIBLIOGRÁFICAS
1. Stickel F, Kessebohm K, Weimann R, Seitz HK. Review of liver injury associated with dietary supplements. Liver International. 2011[citado 13 sep 2013]; 31(5): 595–605. Disponible en: http://onlinelibrary.wiley.com/doi/10.1111/j.1478-3231.2010.02439.x/full
2. Repetto MR. Toxicología Fundamental. 3ra ed. España: Editorial Científico Médica; 2001.
3. Lee KJ, Choi JH, Khanal T, Hwang YP, Chung YC, Jeong HG. Protective effect of caffeic acid phenethil ester against in mice. Toxicol. 2008 [citado 31 ene 2012]; 248 (1): 18-24. Disponible en: http://www.sciencedirect.com/science/article/pii/S0300483X08001261
4. Harith EA, Mohme H, Meulen U, Bartha M, Günther KD. Effects of mimosine on some serum enzyme activities and amino acid metabolism in the rat. Zeitschrift für Tierphysiologie. Tierernährung und Futtermittelkunde. 1981 [citado 31 ene 2012]; 46 (1-5): 255-263.Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/7342552
5. Ramaiah SK. A toxicologist guide to the diagnostic interpretation of hepatic biochemical parameters. Food and Chemical Toxicology. 2007[citado 31 ene 2012]; 45(9):1551–57. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/17658209
6.Boone L, Meyer D, Cusick P, Ennulat D, Bolliger AP, Everds N. Selection and interpretation of clinical pathology indicators of hepatic injury in preclinical studies. Vet Clin Pathol. 2005[citado 31 ene 2012]; 34 (3):182-8. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/16134065
7. Ozer J, Ratner M, Shaw M, Bailey W, Schomaker S. The current state of serum biomarkers of hepatotoxicity. Toxicol. 2008[citado 31 ene 2012]; 245 (3): 194-205. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/18291570
Recibido: 12 de junio de 2013
Aprobado: 20 de diciembre de 2013
Dra. Niurka Esther Gómez Trujillo. Universidad de Ciencias Médicas, Holguín, Cuba.
Correo electrónico: ngomez@ucm.hlg.sld.cu