Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Correo Científico Médico
versión On-line ISSN 1560-4381
CCM vol.18 no.2 Holguín abr.-jun. 2014
ARTÍCULO DE REVISIÓN
Influencia de las acuaporinas en la génesis de múltiples enfermedades
Aquaporins Influence in the Genesis of Multiple Diseases
Damaris Rodríguez Padrón 1, María Ivonne Carrera Iset 2, Ernesto Pérez Leyva 3, Liset López Pereira 4, Annalia Hernández García 5, Edilio Silva Velazco 6
1. Especialista de Segundo Grado en Medicina General Integral. Asistente. Facultad de Ciencias Médicas Mariana Grajales Coello. Universidad de Ciencias Médicas. Holguín. Cuba.
2. Especialista de Primer Grado en Medicina General Integral. Instructor. Facultad de Ciencias Médicas Mariana Grajales Coello. Universidad de Ciencias Médicas. Holguín. Cuba.
3. Especialista de Primer Grado en Medicina General Integral. Instructor. Facultad de Ciencias Médicas Mariana Grajales Coello. Universidad de Ciencias Médicas. Holguín. Cuba.
4. Médico General. Residente de Fisiología. Facultad de Ciencias Médicas Mariana Grajales Coello. Universidad de Ciencias Médicas. Holguín. Cuba.
5. Médico General. Residente de Farmacología. Facultad de Ciencias Médicas Mariana Grajales Coello. Universidad de Ciencias Médicas. Holguín. Cuba.
6. Máster en Urgencias Médicas. Especialista de Primer Grado en Medicina Interna. Asistente. Hospital Universitario Docente Vladimir Ilich Lenin. Holguín. Cuba.
RESUMEN
Las acuaporinas son una familia de proteínas que forman los canales de agua de la membrana. Están involucradas en una gran variedad de funciones fisiológicas y enfermedades humanas como el glaucoma, cáncer, epilepsia, obesidad entre otras. El descubrimiento de las acuaporinas cambia el panorama con respecto a la comprensión del transporte de agua en las membranas biológicas y a la naturaleza de las proteínas transportadoras en general, porque su estudio demuestra que existen canales en las membranas no sólo permeables a iones y que los movimientos de agua a través de las membranas son regulados por la célula en forma muy diferente a como se pensaba hace una década, esto implica comprender mejor los mecanismos fisiopatológicos que lleven al desarrollo de nuevas medidas terapéuticas y más eficaces para el tratamiento de las enfermedades.
Palabras clave: acuaporinas, canales de agua, membrana celular.
ABSTRACT
Aquaporins are a family of membrane water channels. They are involved in a great variety of physiological functions and human diseases including, glaucoma, cancer, epilepsy, obesity among others. The discovery of the aquaporins have changed the view regarding the understanding of the transportation of water in the biological membranes and to the nature of the transporting proteins in general, because its study has showed that there are canals not only in permeable membranes to ions and the fact that the movements of water through the membranes are regulated by the cell in very different way, comparing to the considerations that existed a decade ago, this allows the understanding of physiopathologic mechanisms that lead to the development of therapeutic new measures better and more effective for the diseases treatment.
Keywords: aquaporins, water channels, cell membrane.
INTRODUCCIÓN
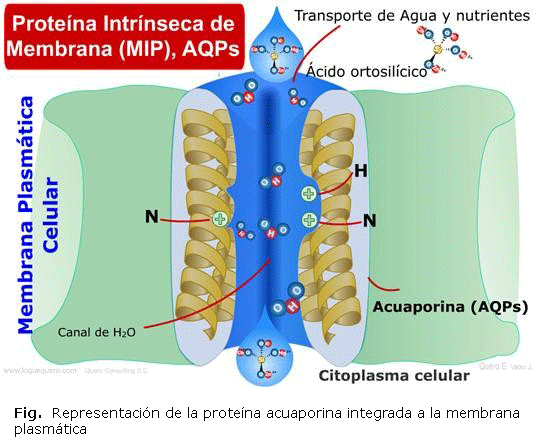
La acuaporina (AQP) es una proteína de membrana encargada de transportar el agua a través de los compartimientos de las células, formada por un haz de seis hélices α, que dejan una estrecha abertura en su interior por la que pueden pasar moléculas de agua, forman tetrámeros, es decir, se agrupan de cuatro en cuatro y transportan el agua y forman una línea de 10 moléculas de agua como fila india que cruza en su interior, pertenecen a la familia de las proteínas integrales de membrana y según estudios, todas las acuaporinas evolutivamente tienen un mismo gen originario 1.
Como en todas las proteínas transmembranales, la superficie de la proteína en contacto con la bicapa lipídica es rica en aminoácidos hidrofóbicos, mientras que los aminoácidos polares se concentran hacia los dos extremos de la proteína. Estas proteínas transmembranales son especializadas, no permiten que los aniones y la mayoría de los cationes grandes puedan atravesarla. Existe, además, un par de aminoácidos catiónicos que actúan como puerta que impiden el paso de cationes pequeños como el ión hidronio 2.
La importancia de las acuaporinas (AQPs) recalca que no solo explican los rápidos cambios del volumen celular causados por la entrada o salida del agua, sino también, las respuestas a los cambios fisiológicos o a alteraciones patológicas 3, 4.
Una diversidad de estudios biomédicos y clínicos han demostrado que un amplio rango de enfermedades pueden estar relacionado con una disfunción en algún tipo de AQP. En teoría, todas las enfermedades relacionadas en una u otra forma con el transporte de agua son susceptibles de ser causadas por la función alterada de estas proteínas. Queda mucho por investigar y discutir, por lo que el estudio de esta temática se hace necesaria e interesante. Funda uno de los polos de desarrollo de la fisiología y la fisiopatología celular en los próximos años, pues es muy probable que las AQPs sean protagonistas de primera línea en la era del enfoque molecular de la medicina actual 5, 6. Esta revisión tiene como objetivo describir brevemente la localización, fisiología y participación en la aparición de algunas enfermedades.
DESARROLLO
Antes del descubrimiento de las AQPs, los científicos asumían que el movimiento del agua a través de las membranas celulares ocurría únicamente porEstudios fisiológicos celulares demuestran que los cambios en el contenido de agua en las células pueden ocurrir rápidamente y revela que la infiltración del agua por las membranas no ofrece un argumento suficiente para explicar su movimiento 7.
A finales de la década de los 80, el laboratorio del Dr. Peter Agre, del Departamento de Biología Celular de la Universidad de Johns Hopkins (Baltimore, Maryland, USA), descubrió las AQPs por casualidad, mientras buscaban aislar el antígeno del factor Rh sanguíneo de los humanos. Durante el aislamiento del polipéptido de Rh, el cual tiene un tamaño de 32 KDa, una segunda proteína de membrana fue aislada, con un tamaño de 28 KDa. El Dr. Agre se reunió con el Dr. John Parker de la Universidad de Duke, con el objetivo de investigar y entender de qué se trataba esta última proteína, el cual le sugirió que podría referirse a una proteína tipo poro para el movimiento de agua 8.
El Dr. Greg Preston, asistente postdoctoral de Dr. Agre, aisló y clonó esta proteína y la expresó en óvulos de rana de la especie Xenopus laevis, los cuales presentan una muy baja permeabilidad innata por el agua. Al exponer los óvulos a un medio hipotónico (bajo en solutos) las diferencias entre los que expresaban la posible AQP frente a los que no la tenían (óvulos control) fue significativo. Los óvulos control permanecieron inalterados, los óvulos que contenían la proteína se hincharon y explotaron en poco tiempo. Por el descubrimiento de las AQPs, el Dr. Agre recibió el premio Nobel en Química en el 2003 9, 10.
Las AQPs son pequeñas proteínas localizadas en las membranas celulares, las cuales han sido identificadas en todos los organismos vivos (bacterias, hongos, plantas y animales) y que tienen la capacidad de mover hasta diez mil millones de moléculas de agua por segundo. Estas proteínas no solo facilitan el movimiento del agua, sino que también pueden facilitar el movimiento de pequeñas moléculas como urea (una forma de nitrógeno asimilable por las plantas), glicerol, dióxido de carbono, entre otras. Por lo cual son muy importantes para el mantenimiento del balance hídrico y osmótico de las células en todos los organismos 11.
Estructura y función de las acuaporinas
El estudio de la arquitectura molecular de las AQPs permitió su incorporación a estructuras de bicapas artificiales de lípidos de las membranas biológicas organizados como están en una capa bimolecular. La obtención de cristales de AQP hizo posible su conocimiento mediante microscopía electrónica, lo que permitió intuir y desarrollar un modelo para su funcionamiento, conocido como reloj de arena 12.
La estructura tridimensional de esta proteína permitió identificar los aminoácidos involucrados en la selectividad para el agua y la regulación de su pasaje a través de ella. Según la imagen del reloj de arena, la AQP estaría constituida por dos regiones repetidas que se pliegan sobre sí mismas y estarían ubicadas en el cuello o el canal de ambos reservorios del reloj de arena que permite, por selección, el pasaje del agua a través de dicho canal 13. La estructura general de las AQPs se representa en la figura (fig) 14.
Mediante la técnica de transfección celular (esto es la introducción en una célula de material genético proveniente de otra distinta), en la que se emplearon ratones transgénicos, se han podido incorporar AQPs en células que originalmente no las expresaban. Hasta la actualidad se han identificado 13 acuaporinas (tabla) 14.
Tabla. Localización de las acuaporinas en diferentes tejidos y órganos
| Acuaporinas | Distribución |
| AQP0 | Ojo (Cristalino) |
| AQP1 | Eritrocitos, cerebro, corazón, riñón, tráquea, placenta, útero, vejiga, uretra, vesícula biliar, testículo, pulmones, bronquios, conductos biliares, piel, endotelio vascular, ojo |
| AQP2 | Riñón (conducto colector) |
| AQP3 | Riñón, tracto gastrointestinal, páncreas, hígado, bazo, próstata, ojo, glándulas sudoríparas y lagrimales, pulmón, útero, eritrocitos, vejiga y uretra. |
| AQP4 | Riñón, tracto gastrointestinal, cerebro, médula ósea, pulmón, músculo esquelético |
| AQP5 | Glándula Salival y lagrimal, tracto gastrointestinal, pulmón, ojo |
| AQP6 | Riñón |
| AQP7 | Espermatozoides, testículos, tejido adiposo, riñón, corazón, músculo esquelético, tracto gastrointestinal |
| AQP8 | Hígado, páncreas, testículo, placenta, útero, glándula salival, intestino delgado, colon, vesícula biliar, corazón |
| AQP9 | tejido adiposo, corazón, colon, leucocitos, hígado, cerebro, riñón, intestino delgado, pulmón, bazo, testículos, médula ósea |
| AQP10 | Intestino delgado |
| AQP11 | Riñón |
| AQP12 | Páncreas, ojos |
Fuente: revisión bibliográfica
Características particulares de las acuaporinas
AQP0. Su denominación destaca el hecho de que fue descrita antes de la AQP1, aunque su relación con esta familia de canales de agua es posterior. Se expresa en las células fibrilares del cristalino, en las cuales cumple un papel primariamente estructural, aunque su función aún está lejos de ser comprendida completamente; fue llamada LMIP (Lens Major Intrinsec Protein), debido a que es una de los péptidos más abundantes en estas células, y constituyen la mitad de todas sus proteínas. No es inhibible por mercuriales y su permeabilidad al agua es baja en proporción con las demás. Se consideró que su función más importante es servir como proteína de adhesión entre las células del cristalino, lo cual se evidenció por la disrupción de los contactos intercelulares en individuos con mutaciones congénitas en el gen de AQP0, con la consecuente desorganización del tejido, que generó la aparición de cataratas de diferente gravedad.
Los mecanismos por los cuales ocurre este proceso son poco claros, aunque se ha identificado que cada molécula de AQP0 se yuxtapone a otra en la membrana vecina, que establece contactos íntimos entre sí. Su actividad como canal de agua es activada por disminución de pH e inactivada por aumentos de calcio intracelular y da lugar a flujos de agua cuando el gradiente osmótico lo permite, lo cual puede jugar un papel importante en la regulación de la forma celular del cristalino 15.
AQP1. Es la AQP más abundante en las membranas animales y posiblemente la de expresión menos selectiva. Ha sido la AQP prototipo, pues fue la primera en ser descrita y es la más estudiada hasta el momento, esto ha permitido conocerla mejor que todos los demás miembros de la familia. Fue descubierta inicialmente en eritrocitos, pero su presencia se ha demostrado en la mayor parte de los epitelios, sobre todo es abundante en túbulo proximal renal y segmento descendente delgado del asa de Henle en el riñón, en todos los tipos de endotelio, en los epitelios de cristalino y córnea y en los colangiocitos. Existen otros epitelios en los cuales se ha demostrado su ausencia como en la nefrona distal y las glándulas salivales. Sin embargo, parece estar presente en la mayoría de membranas, aunque en muchas de ellas su papel funcional permanezca sin ser dilucidado 16, 17.
Esta AQP tiene gran importancia funcional para la reabsorción renal de agua, pues el túbulo proximal renal es responsable por la reabsorción de las dos terceras partes de toda el agua filtrada; su expresión defectuosa o su ausencia produce un riñón incapaz de concentrar la orina en forma eficiente, por la elevada carga de agua que debe manejar la nefrona distal; además, la elevada permeabilidad al agua del segmento descendente delgado del asa de Henle es vital para el mecanismo de contracorriente, fundamental para mantener el gradiente osmolar medular, el cual es el fundamento principal para que se pueda dar la dilución y concentración de orina. Su expresión en algunos lechos endoteliales es regulada por una diversidad de estímulos locales y sistémicos aún en estudio.
En el lecho vascular pulmonar su expresión es incrementada en forma notable por corticosteroides, lo cual ha sido implicado en la maduración pulmonar inducida por éstos. Además, la AQP1 ha sido involucrada en la regulación del flujo de líquido en casi todos los compartimientos del organismo, otorgándole un papel preponderante en condiciones fisiológicas como el intercambio de fluido capilar, la producción de líquido cefalorraquídeo, el humor acuoso o la endolinfa, lo cual necesariamente ha dirigido la atención a buscar su papel en condiciones patológicas relacionadas como el edema cerebral, el edema pulmonar, el edema periférico o el glaucoma 18.
AQP2. Es expresada exclusivamente en membranas apicales en los túbulos distales y colectores renales y es la responsable de la permeabilidad apical al agua de este segmento de la nefrona; es inhibible por mercuriales y su actividad es dependiente de la hormona antidiurética (ADH); está presente en vesículas intracelulares las cuales son inducidas a la fusión con la membrana externa por la ADH; cuando la hormona no está presente los segmentos de membrana con AQP2 son reinternalizados, al parecer a través de un mecanismo similar a la reinternalización de receptores. La ADH se libera desde el hipotálamo en respuesta a estímulos como la hipovolemia o la hiperosmolaridad y al determinar la permeabilidad al agua de la nefrona distal, determina el grado de concentración o dilución de la orina; esta hormona ejerce su efecto a través de la fosforilación mediada por la proteína quinasa A (PKA), secundaria a la activación de su receptor de membrana acoplado a proteínas G, además de promover la expresión de la proteína 19.
AQP3. Es expresada en membranas basolaterales de túbulo distal renal (TDR) y túbulo contorneado renal (TCR), que coexisten con AQP2 en el mismo tipo de células; la función de ambas acuaporinas está acoplada, pues AQP3 es la responsable de la permeabilidad al agua de la membrana basolateral. Puede ser regulada por ADH, pero no es dependiente completamente de su presencia como sucede con AQP2. Esta acuaporina también ha sido encontrada en otros tejidos como epitelios de las vías aéreas, piel y ojo, pero su función en estas células no ha sido estudiada suficientemente, aunque se considera que pudieran participar en la permeabilidad de membranas basolaterales que permiten el movimiento de agua que ha ingresado a la célula por otra acuaporina apical, de manera similar como sucede en la nefrona distal. Es permeable, además, a glicerol, pero el papel fisiológico de esta función no es claro. Es inactivada por disminución de pH y puede ser regulada por fosforilación 20, 21.
AQP4. Es la AQP más abundante en el cerebro, donde fue aislada por primera vez; no es sensible a mercuriales y es activada por fosforilación mediada por diversos sistemas. Es expresada en células astrogliales, que incluye células ependimarias y endoteliales, pero no ha sido identificada en neuronas. Es muy abundante en regiones osmosensibles, como el núcleo supraóptico del hipotálamo, donde está presente en la región que rodea las neuronas secretoras de ADH, por lo cual se cree que interviene en la regulación de su producción. Se localiza con un canal de potasio en células de Müller en la retina en forma muy característica, aunque la significancia fisiológica de este hallazgo no se conoce; puede facilitar la transferencia de líquidos en respuesta a flujos de potasio durante la regulación del volumen intracelular y el balance de las concentraciones de potasio. Interviene, igualmente, en la producción de líquido cefalorraquídeo, al parecer predominantemente en la absorción por lo cual está implicada en la producción de edema cerebral y otras condiciones relacionadas. Se encuentra en fibras musculares esqueléticas, sobre todo las de tipo rápido, en las cuales se ha encontrado una clara asociación con la función del citoesqueleto.
Adicionalmente se ha encontrado en riñón, sobre todo en médula, pero sólo en membranas basolaterales de las células principales del túbulo colector, donde se localiza con la AQP3; no es sensible a ADH ni a ninguna otra hormona; parece intervenir en el flujo basolateral de agua solo bajo máxima estimulación por ADH 22.
AQP5. Está localizada en la membrana apical de las células epiteliales en múltiples glándulas, tales como las sudoríparas, lagrimales, salivales y submucosas respiratorias; su principal papel fisiológico consiste en regular el flujo de agua hacia la luz glandular. Han sido encontradas en los neumocitos tipo I y su disfunción está relacionada con múltiples enfermedades respiratorias como el asma y la bronquitis crónica. Se expresa, también, en el epitelio corneal, donde contribuye a la hidratación de la córnea y al mantenimiento de la transparencia de ésta. Se han encontrado defectos asociados con esta AQP en pacientes con síndrome de Sjögren, aunque la asociación con esta enfermedad aún no es clara 23.
AQP6. Se encuentra principalmente en el túbulo colector renal, aunque se localiza en otros tejidos, con mayor incidencia en los epiteliales. Su expresión en el riñón está limitada a las células intercaladas, en las cuales se sitúa en vesículas intracelulares, localizada con H+-ATPasa, que logran incorporarse a la membrana por un estímulo desconocido. Su permeabilidad al agua es baja, no es inhibible por mercurio y puede ser activada por bajas concentraciones de éste. Es regulable por pH, activada por acidificación e inhibida por alcalinización y se ha demostrado que participa en la secreción de H+ por las células intercaladas, importante en el proceso de balance ácido-base renal, que posiblemente regulara los flujos de agua en respuesta a los flujos de protones y otros iones acompañantes durante el proceso de regulación del pH intracelular. Es permeable a algunos aniones, aunque el significado fisiológico de este hecho no se conoce 24.
AQP7. Es identificada inicialmente en el tejido adiposo donde se expresa ampliamente, aunque también parece estar presente en muchos otros tejidos como espermatocitos y túbulo proximal renal; es permeable al glicerol y parece ser una ruta alterna para la salida de esta sustancia producida durante la lipólisis; sin embargo, su papel fisiológico aún está por ser evaluado.
AQP8. Está presente exclusivamente en las membranas intracelulares; es encontrada en células epiteliales de túbulo proximal renal, túbulo colector renal, yeyuno, íleon, colon, bronquios y glándulas salivales. Además, se considera que esté presente en los hepatocitos y el testículo; es la única AQP que es permeable a la urea, pero su función específica aún permanece en estudio 24, 25.
AQP9. Identificada en los hepatocitos, células en las cuales parece cumplir su principal papel, permeable a iones presentes en el líquido intracelular y extracelular, puede funcionar como una ruta de entrada para el glicerol durante la gluconeogénesis. Su función en situaciones de control metabólico extremo podría ser importante para aumentar la fuente de glicerol en el hepatocito, probablemente funcionando en conjunto con la AQP7 en el tejido adiposo. Se expresa, también, en los leucocitos, donde se ha encontrado que es permeable a arsenita, un agente usado en la quimioterapia de ciertos tipos de leucemia mielocítica, por lo cual su expresión en células tumorales podría tener cierta significancia terapéutica 25.
AQP10. Es la más recientemente informada, fue hallada en duodeno y yeyuno, pero al parecer se encuentra en los epitelios en forma inespecífica, pero aún no hay datos acerca de su significado funcional 26.
AQP11 y 12. Están localizadas permanentemente en las vesículas intracelulares, son más abundantes en el ojo y en el páncreas 27.
Las acuaporinas en la fisiopatología de las enfermedades
Muchas patologías están asociadas a alteraciones en alguna AQP, aunque el tema aun se investiga y tiene aspectos polémicos y controversiales.Entre las diferentes formas de diabetes insípida nefrogénica heredada (NDI) existe una asociada a mutaciones de la AQP2 que hace que esta AQP no funcione como canal de agua o que no pueda moverse hacia la membrana apical de las células del túbulo colector. Como consecuencia, en estos pacientes que tienen grandes poliurias, la respuesta a la ADH está críticamente limitada. Se han registrado casos de NDI adquirida en pacientes psiquiátricos que reciben tratamiento con litio, que presentan obstrucción ureteral bilateral, en hipercalcemia crónica, en hipokalemia, en los que toman agua compulsivamente, en la insuficiencia renal crónica o en la NDI inducida por la edad.
En modelos animales de estos casos hay una expresión reducida de AQP2 en los túbulos colectores. Por el contrario, se observa expresión aumentada de AQP2 en casos de secreción inapropiada de hormona antidiurética, en la insuficiencia cardiaca congestiva y durante el embarazo 28.
En el ojo, donde el transporte de líquidos es tan importante, hay varias AQPs. El mantenimiento de la presión intraocular (AQP1 y 4), de la transparencia de la córnea y del cristalino (AQP0, 1, y 5), la traducción de la señal visual (AQP4), la formación de lágrimas y la función de la barrera conjuntival (AQP3 y 5), requieren la expresión apropiada y la función adecuada de estas AQPs. Ejemplo, mutaciones de la AQP0 están relacionadas con formación de cataratas.
La participación de la AQP4 en la neuromielitis óptica (NMO), una enfermedad neuroinflamatoria desmielinizante, fue inesperada. La NMO y la esclerosis múltiple comparten ciertas similitudes, pero la NMO primordialmente afecta el nervio óptico y la médula espinal, que causan la ceguera y parálisis y tienen características patológicas y clínicas que lo distinguen de la esclerosis múltiple. La NMO es una enfermedad rara en personas caucásicas (la incidencia es de 1 en 100 000) pero es más común en los asiáticos.
Así como en otras enfermedades autoinmunes, las hembras son más afectadas que los varones (la proporción 7:1). La característica decisiva en NMO es la presencia en el plasma sanguíneo de autoanticuerpos (NMO-IgG) dirigidos en contra de epítopes extracelulares en AQP4. La seropositividad de NMO-IgG es altamente específica para NMO y en algunos estudios, los niveles altos de NMO-IgG se correlacionan con actividad de la enfermedad 29, 30.
Se conoce un papel importante del metabolismo del glicerol en las AQP3 y AQP7. En ratones a los que se induce que no tengan AQP7, se observa gran acumulación de grasa y grandes adipocitos en comparación con las cepas normales. Estos experimentos constituyen el fundamento para investigar si la sobre-regulación de AQP7, puede utilizarse como terapia en algunas formas de obesidad 30.
En los accidentes vasculares cerebrales, los tumores cerebrales, los traumatismos, las infecciones virales y algunas enfermedades acompañadas de inflamación cerebral, el edema cerebral es causa importante de mortalidad. Estudios con ratones sin AQP4 (AQP4-knockout) muestran convincentemente que la AQP4 es fundamental en la entrada o salida de agua del cerebro. El conocimiento de la regulación de la función o expresión de AQP4 puede ayudar a controlar el edema cerebral. Se ha mostrado, además, que la membrana de los pies terminales de los astrocitos participa en la eliminación del potasio del espacio sináptico después de intensa actividad neuronal. Modelos animales con distribución alterada de la AQP4 en sus astrocitos muestran incremento en la severidad de sus crisis epilépticas, sugiriendo que la AQP4 puede jugar un papel importante en patologías asociadas con alteraciones en la homeostasis de iones en el cerebro 23.
Las alteraciones en el equilibrio entre las presiones hidrostáticas y osmóticas son consideradas como las responsables para el desarrollo del edema pulmonar en casos de lesión pulmonar aguda; sin embargo, recientemente se informó en modelos experimentales de lesión pulmonar aguda que una de las alteraciones que anteceden el desarrollo del edema pulmonar es la disminución en la expresión de la AQP5 en las células del endotelio microvascular. Como consecuencia, se identificó un incremento en la cantidad de volumen de agua a nivel intersticial y en los espacios alveolares. Este fenómeno se confirmó mediante el análisis histopatológico del tejido pulmonar de animales sometidos a lesión pulmonar aguda por ventilación mecánica 24.
En la actualidad se ha vinculado a las AQP en el proceso del ciclo celular, y en parte pudieran estar relacionadas con la replicación celular no controlada. Se han asociado con incremento en la actividad metabólica e invasión local del cáncer de pulmón. Estos planteamientos se han realizado en modelos experimentales de este tumor, en el que se utilizaron ratones que tienen bloqueada la expresión de AQP1. Las AQP parecen tener un efecto deletéreo aditivo dado que la sobreexpresión de estos canales proteicos en las células tumorales posiblemente facilite el desarrollo de metástasis, así como la proliferación vascular.
En otro modelo de cáncer de pulmón, existe una relación directamente proporcional entre la expresión de AQP3 y la actividad funcional de las células tumorales. Diferentes líneas celulares obtenidas de tejido de pacientes con neoplasia pulmonar han permitido reconocer que tanto el adenocarcinoma como el carcinoma bronquioloalveolar sobreexpresan AQP1; la razón no ha sido completamente dilucidada. La sobreexpresión de AQP1 parece relacionarse con un incremento en la tasa de crecimiento y proliferación celular desempeñando un papel cardinal en la carcinogénesis y en la diseminación tumoral 14.
CONCLUSIONES
La búsqueda de nuevas AQPs y el estudio acerca de las ya identificadas se realizan en muchos laboratorios de investigación en todo el mundo por la gran importancia que estas proteínas tienen en la fisiología del control del volumen celular y los mecanismos de control osmótico que toda célula posee. También su papel en el control del flujo de glicerol y otros solutos y las implicaciones que esto puede tener en la regulación metabólica general constituyen desafíos muy interesantes. Esto podría significar una mejor comprensión sobre los mecanismos fisiopatológicos que lleven al desarrollo de medidas terapéuticas nuevas y más eficaces para el tratamiento de las enfermedades.
REFERENCIAS BIBLIOGRAFÍCAS
1. Hernández CS, Gutiérrez AM, Ruiz V, González E, Echevarría M, Whittembury G. Canales de Agua (Aquaporinas) y Riñón. AVFT. 2002. [citado 28 ene 2013]; 21(1). Disponible en: http:// www.scielo.org.ve/scielo.php?script=sci_arttext&pid=S0798-02642002000100003& lng=es&nrm=iso
2. Whittemburya G, Gutiérreza M, Echevarría M. El volumen celular se regula por canales de agua aquaporinas, proteínas integrales de la membrana celular. Acad Nac Medic Anal. 2006. [citado 28 ene 2013]; 15 (8). Disponible en: http://www.acadnacmedicina.org.pe/publicaciones/Anales2006/ conferencia_%20volumen_celular_canales_agua_whittembury.pdf
3. Hernández Pérez R. Acuaporinas e hidratación cutánea. Dermatol Venezolana.2008. [citado 28 ene 2013]; 46(4).Disponible en: http://svdcd.org.ve/old/content/images/stories/revista/2008_ 46_4/dv.4.08opinio1.pdf
4. Castagnino JM. Premio Nobel de Química 2003. Las acuaporinas. Acta Bioquím Clín Latinoam. 2004. [citado 28 ene 2013]; 38 (4). Disponible en: http://www.scielo.org.ar/pdf/abcl/v38n4/ v38n4a01.pdf
5. Osorio G, Bernabéu J, Echevarría M, Conejo Mir J. Acuaporinas: moléculas revelación en cosmética y oncología cutánea. Investigaciones Biomédicas España.2009. [citado 28 ene 2013]; 24(4). Disponible en: http://www.elsevier.es/es/revistas/piel-formacion-continuada-dermatologia-21/acuaporinas-moleculas-revelacion-cosmetica-oncologia-cutanea-13135489-revisiones-2009?bd=1
6. Sánchez JC. Acuaporinas: proteínas mediadoras del transporte de agua. Colomb Med. 2003. [citado 28 ene 2013]; 34 (4).Disponible en: http://colombiamedica.univalle.edu.co/index.php/ comedica/article/ view/277
7. Esteva Fonta C, Torra Balcells R, Fernández Llama P. Transportadores de sodio y aquaporinas: ¿futuros biomarcadores renales? Med Clin. 2007. [citado 28 ene 2013]; 129 (11).Disponible en: http://zl.elsevier.es/es/revista/medicina-clinica-2/transportadores-sodio-aquaporinas-futuros-biomarcadores-renales-13110477-reviews-2007
8. Fernández Llama P, Botey A. Aquaporinas: canales proteicos de membrana para el agua. Med Clin Barc.1996. [citado 28 ene 2013]; 106 (11). Disponible en: http://www.angelfire.com/ linux/medicina/documentos/ Aquaporinas.pdf
9. Tamargo Menéndez J. Los poros y los canales iónicos regulan la actividad celular. An Real Acad Nac Farm.2004. [citado 28 ene 2013]; 70 (9). Disponible en: http://www.analesranf.com/ index.php/aranf/article/ viewFile/227/258
10. Fernández Llama P. Bases moleculares de la retención hidrosalina en la cirrosis hepática experimental: aquaporinas y transportadores renales de sodio. Med Clin Barc. 2002. [citado 28 ene 2013]; 22 (5). Disponible en: http://www.revistanefrologia.com/revistas/P7-E199/P7-E199-S140-A1488.pdf
11. Fernández Llama P. Aquaporinas, canales de membrana para el agua. Disregulación en los trastornos del balance de agua. Endocrinol Nutr.2000. [citado 28 ene 2013]; 47 (9) Disponible en: http://www.elsevier.es/es/revistas/endocrinologia-nutricion-12/aquaporinas-cana les-membrana-agua-disregulacion-los-trastornos-12588-revisiones-2000
12. Cortés Télles A, Sada Ovalle I, Torre Bouscoulet L. Acuaporinas en el sistema respiratorio. Neumol Cirug Torax.2012. [citado 28 ene 2013]; 71 (1) Disponible en: http://www.medigraphic. com/neumologia
13. Gaspar M. Aquaporinas: de canais de água a transportadores multifuncionais em plantas. Rev Brasil Bot.2011. [citado 28 ene 2013]; 34(4).Disponible en: http://www.scielo.br/pdf/rbb/v34n4/ v34n4a02.pdf
14. Quero Gutiérrez E. Regulación del flujo de agua y nutrientes en los tejidos vegetales. [Internet].México: Dolomita Agrícola de México; 31 mar 2009 [actualizado 31 mar 2009; citado 28 ene 2013]. [Aprox4 p.]. Disponible en: http://loquequero.com/portal/index.php? option=com_content&task=view&id=50&Itemid=2
15. Whittembury G, Hernández CS. Absorción renal de agua. Del nefrón aislado a los canales de agua a Aquaporinas. Rev Med Herediana. 2012. [citado 28 ene 2013]; 8 (4). Disponible en: http://www.upch.edu.pe/famed/revista/index.php/RMH/article/view/1184
16. Agre P. The Aquaporin water channels. Am Thorac Soc. 2005. [citado 28 ene 2013]; 3(1): 5-13.Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2658677/
17.Cubi MA, Kuniyoshi L. Aquaporina. TBQ-RLORC. 2012 [citado 28 ene 2013]; 8 (1). Disponible en: http://www.slideshare.net/TBQ-RLORC/aquaporina
18.Moscote Salazar LR, Polo Torres C. Fisiología molecular de las aquaporinas. Rev Fac Med Unal.2009 [citado 28 ene 2013]; 57 (1).Disponible en: http://www.scielo.org.co/scielo.php? pid=S012000112009000100006&script=sci_ arttext
19. Soto Febles C, Álvarez Valcárcel C, Febles Fernández C, Soto Morlá J. Las Aquaporinas: Estructura e importancia en la Biomedicina. Rev Habanera Cienc Med.2009. [citado 28 ene 2013]; 3(9).Disponible en: http://bvs.sld.cu/revistas/rhab/articulo_rev9/aqporinas.htm
20. Agre P. Aquaporins water channels: molecular mechanisms for human diseases. J Med.2005. [citado 28 ene 2013]; 10 (4).Disponible en: http://es.scribd.com/doc/19046494/Aquaporinas.
21.Verkman AS. Aquaporins in Clinical Medicine. Annu Rev Med. 2012. [citado 28 ene 2013]; 63 (1): 303-316. Disponible en: http://www.ncbi.nlm.nih. gov/pubmed/22248325
22.Gao J, Tan M, Gu M, Marshall C, Ding J, Hu G, et al. Cellular localization of aquaporin-1 in the human and mouse trigeminal systems. Plos One. 2012. [citado 28 ene 2013]; 7(9). Disponible en: http://www.ncbi.nlm.nih. gov/pubmed/23029502
23.Ubels JL, Gipson IK, Spurr Michaud SJ, Tisdale AS, Van Dyken RE, Hatton MP. Gene expression in human accessory lacrimal glands of Wolfring. Invest Ophthalmol Vis Sci. 2012. [citado 28 ene 2013]; 53 (11).Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/22956620
24.Sasaki S. Aquaporin 2: from its discovery to molecular structure and medical implications. Mol Aspects Med. 2012. [citado 28 ene 2013]; 33(6).Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/23078817
25.Alvarenga MP, Alvarenga RM, Alvarenga MP, Santos AM, Thuler LC. Anti-AQP (4) antibody in idiopathic acute transverse myelitis with recurrent clinical course: frequency of positivity and influence in prognosis. J Spinal Cord Med. 2012. [citado 28 ene 2013]; 35(4) Disponible en: http://www.ncbi.nlm.nih. gov/pubmed/22925751
26.Marchissio MJ, Francés DE, Carnovale CE, Marinelli RA. Mitochondrial aquaporin-8 knockdown in human hepatoma HepG2 cells causes ROS-induced mitochondrial depolarization and loss of viability. Toxicol Appl Pharmacol.2012. [citado 28 ene 2013]; 264(2). Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/22910329
27.Li B, Jin L, Zhong K, Du D. Correlation of aquaporin 3 expression with the clinicopathologic characteristics of non-small cell lung cancer. Zhongguo Fei Ai Za Zhi.[Internet].2012. [citado 28 ene 2013]; 15(7). Disponible en:http://www.ncbi.nlm.nih.gov/pubmed/22814259
28.Sugimoto N, Shido O, Matsuzaki K, Ohno Shosaku T, Hitomi Y, Tanaka M, et al. Cellular heat acclimation regulates cell growth, cell morphology, mitogen-activated protein kinase activation, and expression of aquaporins in mouse fibroblast cells. Cell Physiol Biochem. 2012. [citado 28 ene 2013]; 30(2)Disponible en:http://www.ncbi.nlm.nih.gov/pubmed/22814242
28.Shen Y, Wang X, Wang Y, Wang X, Chen Z, Jin M, et al. Lipopolysaccharide decreases aquaporin 5, but not aquaporin 3 or aquaporin 4, expression in human primary bronchial epithelial cells. Respirology. 2012. [citado 28 ene 2013]; 17(7) Disponible en: http://www.ncbi.nlm.nih. gov/pubmed/22809117
30.Ren Z, Wang Y, Duan T, Patel J, Liggett T, Loda E, et al. Cross immunoreactivity between bacterial aquaporin-Z and human aquaporin-4: potential relevance to neuromyelitis optica. J Immunol.2012. [citado 28 ene 2013]; 189(9):4602-11.Disponible en: http://www.ncbi.nlm.nih. gov/pubmed/23008451
Recibido: 1 de mayo de 2013
Aprobado: 6 de noviembre de 2013
Dra. Damaris Rodríguez Padrón. Facultad de Ciencias Médicas Mariana Grajales Coello. Universidad de Ciencias Médicas. Holguín. Cuba.
Correo electrónico: aps@cristal.hlg.sld.cu