Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Correo Científico Médico
versión On-line ISSN 1560-4381
ccm vol.19 no.1 Holguín ene.-mar. 2015
ARTÍCULO DE REVISIÓN
Trastornos de la hemostasia en la enfermedad hepática crónica
Coagulation Disorders in Chronic Liver Disease
Margarita Rodríguez Diéguez 1, Agustín Mulet Pérez 2, Ana María Pérez Berlanga 3, Zulma Miranda Moles 4, Annarelis Pérez Pupo 5
1. Especialista de Primer Grado en Gastroenterología. Asistente. Hospital General Universitario Vladimir Ilich Lenin. Holguín. Cuba.
2. Doctor en Ciencias Médicas. Especialista de Segundo Grado en Gastroenterología. Profesor Titular. Hospital Universitario Vladimir Ilich Lenin. Holguín. Cuba.
3. Especialista de Primer Grado en Laboratorio Clínico. Profesor Auxiliar. Hospital General Universitario Vladimir Ilich Lenin. Holguín. Cuba.
4. Especialista de Primer Grado en Gastroenterología. Asistente. Hospital Provincial Universitario Vladimir Ilich Lenin. Holguín. Cuba.
5. Licenciado en Gestión de la Información en Salud. Asistente. Hospital General Universitario Vladimir Ilich Lenin. Holguín. Cuba.
RESUMEN
El mecanismo de la coagulación normal funciona sobre base la de un complicado balance entre mecanismos procoagulantes, anticoagulantes y sistema fibrinolítico, y el hígado juega un rol esencial en él. Se realizó una revisión con el objetivo de examinar aspectos relacionados con las alteraciones en la hemostasia en los pacientes con hepatopatía crónica, para ello se efectuó una búsqueda bibliográfica sobre el tema en Pubmed, EBSCO, Medline, e Hinari. Se abordaron las alteraciones plaquetarias cuantitativas y cualitativas, déficit en la síntesis de factores de la coagulación, disfibrinogenemia, alteraciones en la fibrinólisis, deficiencia de vitamina K y cambios compatibles con un estado de coagulación intravascular diseminada. Se concluyó que Las alteraciones de la hemostasia en el paciente cirrótico se relacionan con un estado avanzado de la enfermedad, con consecuencias clínicas que constituyen un espectro que incluyen tendencia al sangrado, o a fenómenos de trombosis, y que las pruebas de coagulación habituales no reflejan de manera adecuada las alteraciones de la hemostasia en el paciente con enfermedad hepática crónica. No obstante, los recientes avances en la exploración analítica de estos trastornos constituyen promisorias herramientas para su diagnóstico apropiado en el área clínica.
Palabras clave: hemostasia, hepatopatía crónica, coagulación sanguínea, pruebas de coagulación
ABSTRACT
Normal haemostasis performs based on a complex balance between procoagulant, anticoagulant mechanisms and the fibrinolytic system, in which the liver exerts an important role. A review was performed aimed at examining aspects in relation with the hemostatic alterations in patients with chronic liver disease. A bibliographical review was done to accomplish that purpose in Pubmed, EBSCO, Medline, and Hinari database. Platelet quantitative and qualitative abnormalities and diminished synthesis of clotting factors were approached, as well as dysfibrinogenemia, fibrinolysis disorders, vitamin K deficiency, and a state compatible with disseminated intravascular coagulation. The following conclusions were made: the hemostatic disorders in the patient with cirrhosis are related to an advanced state of the disease, with clinical consequences which are in a wide spectrum from bleeding tendency to thrombosis, and that the standard coagulation tests do not appropriately reflect these phenomena. Nevertheless, recent advances in analytical techniques for the diagnosis of these abnormalities constitute promising tools for their proper identification in the clinical context.
Keywords: hemostasis, chronic liver disease, blood Coagulation, blood coagulation tests.
INTRODUCCIÓN
El mecanismo de la coagulación funciona sobre base la de un complicado balance entre mecanismos procoagulantes, anticoagulantes y el sistema fibrinolítico 1-4. El hígado juega un rol esencial en este mecanismo, debido a que sintetiza la mayoría de los factores de la coagulación (FC) 1, 2, 5, 6 y de las proteínas de la fibrinólisis 7.
El componente procoagulante debe responder al daño endotelial con depósito de fibrina, agregación plaquetaria y formación del coágulo 3, 8, mientras a los eventos anticoagulantes le corresponde prevenir la inconveniente extensión del coágulo 3, en tanto, la fibrinólisis promueve la lisis del coágulo formado. Las vías pro y antifibrinolítica deben también mantener un correcto equilibrio 9. La pérdida definitiva de estos balances en la enfermedad hepática provoca riesgo de sangrado o de fenómenos tromboembólicos 5, 10.
En esta revisión se examinaron aspectos relacionados con las alteraciones en la hemostasia en los pacientes con hepatopatía crónica, a la luz de los progresos expuestos en la literatura científica sobre el tema.
MÉTODOS
Como estrategia de búsqueda de información se realizó una búsqueda bibliográfica sobre el tema en Pubmed, EBSCO, Medline, e Hinari. Se emplearon diferentes combinaciones de los siguientes descriptores con el uso del operador booleano “AND” (tanto en español como en inglés): hemostasia, hepatopatía crónica, coagulación sanguínea, pruebas de coagulación. También se revisaron libros de texto de las especialidades de Gastroenterología y Laboratorio Clínico.
Se realizó un análisis crítico de los artículos recuperados con vistas a seleccionar los de mayor rigor e importancia en el tema, se seleccionaron contribuciones que trataban aspectos como generalidades, clínica y diagnóstico. Finalmente, se incluyeron 43 publicaciones.
DESARROLLO
Breve recuento del mecanismo de la coagulación
La hemostasia primaria comprende los eventos que ocurren hasta la formación del tapón plaquetario, y la secundaria a la llamada “cascada de la coagulación” 10. Esta fue modelada por primera vez en los años 60, y consta de las vías intrínseca y extrínseca. La primera es iniciada por el factor XII (FXII), con participación del quininógeno de alto peso molecular (QAPM) y la calicreína (CAL) 1, y la segunda por el complejo factor VII activado (FVIIa) / factor tisular (FT). Ambas convergen en una vía común a nivel del complejo factor X activado/ factor V activado (FXa/FVa) 1, 5.
Posteriormente, se propone un modelo que tiene más en cuenta la participación de elementos celulares 5los cuales proporcionan factores esenciales que normalmente no están en el plasma y proveen una superficie para el ensamblaje de los complejos enzima-cofactor y su interacción con los sustratos para formar el coágulo de fibrina 11.
Según este modelo, la coagulación se produce en tres etapas interrelacionadas. En la primera (de iniciación), las células que expresan el FT, receptor y cofactor del FVII, se exponen al contacto con la sangre, produciéndose trombina en pequeñas cantidades, tras la activación del FX y FIX en la superficie de las células que expresan FT, por parte, del complejo que forma con este último el FVIIa, y la posterior interacción del FXa con su cofactor, el FV.
Las plaquetas se extravasan y el factor de Von Willebrand (FvW) media la adhesión de estas al colágeno y otros componentes de la matriz extracelular 10, mediante glicoproteínas (GP) de su membrana 1, formándose así, el tapón plaquetario 5.
En la fase 2 se amplifica esta señal, donde la trombina generada provoca máxima activación plaquetaria, se activa también FC en su superficie (FV, FVIII, FIX, FXI), originándose un verdadero “estallido” en la producción de trombina. El FIXa forma un complejo con el FVIIIa, a partir del cual se inicia la tercera fase (de propagación), en la cual empieza a activarse el FX del plasma en las superficies plaquetarias, este se asocia a FVa y así se consigue mayor generación de trombina, estabilizándose el tapón inicial en una malla resistente de fibrina 1, 5.
En contraposición, los factores anticoagulantes operan para evitar la formación de cantidades excesivas de trombina. Entre ellos, se destaca el inhibidor de la vía del FT (tissue factor pathway inhibitor; TFPI), la antitrombina (AT) y la proteína C 5. La primera, en unión con heparinoides endógenos (HE) inhibe la trombina directamente, e indirectamente a través de la inactivación de los FC XI, IX y X activados 10. Esta última requiere para activarse de la trombomodulina (TM), una proteína transmembrana de las células endoteliales, que sirve de receptor a la trombina. Al activarse, la proteína C se une a la proteína S (su cofactor), para prevenir la propagación de la señal procoagulante en el árbol vascular intacto5. El TFPI inhibe directamente el complejo FVIIa/FT 10, e impide que se perpetúe la activación del FX 9.
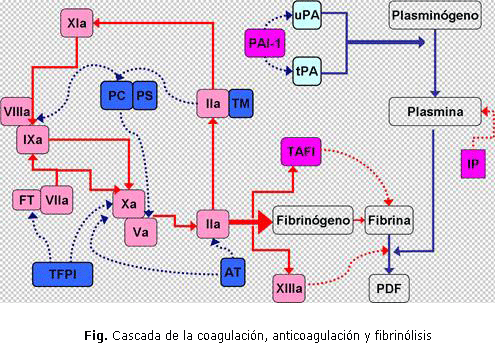
Del mismo modo existe un fino equilibrio entre las vías pro y antifibrinolítica 9. En la conversión del plasminógeno inactivo en plasmina interviene el activador del plasminógeno (tPA) y el activador tipo uroquinasa del plasminógeno (uPA) 3. Estos son contrarrestados por el inhibidor del activador del plasminógeno (PAI-1), el inhibidor de la plasmina (IP) y el inhibidor de la fibrinólisis activado por trombina (TAFI). El TAFI remueve los residuos de lisina de la fibrina y previene así, la unión y activación de plasminógeno en su superficie 6. Los procesos de la cascada de la coagulación, el mecanismo de anticoagulación, y el de remoción del coágulo por la fibrinólisis se muestran a continuación (fig.).
Azul intenso: participa en la vía anticoagulante
Rosado claro: factor de la coagulación
Rosado intenso: vía antifibrinolítica
Líneas quebradas: mecanismo inhibitorio
Líneas continuas: mecanismo activador
PC/PS: proteínas C y S
FT: Factor tisular
TFPI: inhibidor de la vía del FT
TM: trombomodulina
AT: antitrombina
PAI-1: inhibidor del activador del plasminógeno
uPA: activador tipo uroquinasa del plasminógeno
tPA: activador del plasminógeno
IP: Inhibidor de la plasmina
PDF: Productos de degradación de la fibrina
El rol del hígado es esencial en estos procesos. En él se sintetizan, con excepción del FVIII, el resto de los FC 1, 2, 5, 6 y salvo el tPA 9, 12 y el inhibidor del activador del plasminógeno 1 (PAI-1) 12, todas las proteínas de la fibrinólisis 7.
Alteraciones de la coagulación en el paciente con enfermedad hepática crónica (EHC)
En pacientes con EHC se deterioran, tanto la función de síntesis hepática, como la de aclaramiento 5, 10. Esto último debido a la reducción de la masa hepatocitaria funcionante, así como, la disminución del flujo sanguíneo a través del órgano 7. La mermada síntesis va en detrimento tanto de factores procoagulantes (FC e inhibidores de la fibrinólisis) como anticoagulantes (inhibidores de la coagulación y factores profibrinolíticos), creándose gracias a esto y otros cambios compensadores, una especie de re-balance 5-7. Este se pierde en situaciones de prueba, como ocurre ante una sepsis, con la resultante tendencia al sangrado o a la trombosis 5.
De los FC, el FVII, al ser de vida media más corta (unas seis horas), es el primero en disminuir 13. Al avanzar la enfermedad se van afectando otros FC. En cambio, el FVIII y el fibrinógeno aumentan por tratarse de reactantes de fase aguda, por la síntesis extrahepática en el caso del FVIII, (básicamente a nivel endotelial), y a la disminución en su depuración 14, 15. El aumento del FVIII muestra una correlación positiva con el empeoramiento del Child-Pugh 16.
Pese a su elevación, 60-70 % del fibrinógeno puede ser disfuncional (disfibrinogenemia) 10, 17, por exceso de ácido siálico y cadenas α anormales, secundario a reexpresión hepatocitaria del gen fetal de la sialiltransferasa 14, 15. Más adelante, al empeorar la hepatopatía, el fibrinógeno disminuye 10, 15.
Se plantea que en la EHC existe también cierta deficiencia de vitamina K 6, 18, o una síntesis disminuida de la carboxilasa dependiente de la misma 6. Esto explica que la administración parenteral de 10 mg de la vitamina induce, en muchos casos, mejoría de al menos el 30 % del tiempo de protrombina (TP) 18. El fallo en la γ-carboxilación de los FC vitamina K dependientes (II, VII, IX y X) produce proteínas inertes, los llamados precursores inducidos por ausencia de vitamina K (precursors induced by vitamin K absence o PIVKA) 11, 14, que poseen actividad anticoagulante por un mecanismo competitivo sobre los FC carboxilados 11. El déficit de esta vitamina se explica quizá por la desnutrición, sobre todo en etílicos, y por malabsorción, ya que puede haber disminución en la producción de bilis y dificultad en su llegada al intestino 15.
Los pacientes que padecen CH sufren igualmente de defectos plaquetarios cuantitativos (trombocitopenia) 19. Esta presenta grados; el más severo es el IV, con plaquetas por debajo de 25 x 10 9/L 9, así como niveles de 100 x 109/L se consideran un “umbral seguro” 20 La trombocitopenia puede ocurrir por esplenomegalia, (y esta a su vez por hipertensión portal), y por disminución de la trombopoyetina, normalmente producida por el hígado, viéndose afectada su supervivencia y producción, respectivamente 14, 20.
De igual modo, pueden influir la deficiencia de ácido fólico, los efectos tóxicos del etanol en la megacariopoyesis, el consumo aumentado por la activación plaquetaria 20, así como, la destrucción por mecanismos inmunológicos 14. En la hepatopatía por el virus de hepatitis C (VHC), se sugiere además, un efecto citopático directo del virus 21.
Comparten también este mecanismo inmunológico las CH causadas por el virus de la hepatitis B (VHB), la cirrosis biliar primaria y la colangitis esclerosante primaria, donde se encuentra la vida media plaquetaria reducida, y hay presencia de anticuerpos contra las GP IIb-IIIa y GP Ib/I 17. Por último, existen medicamentos de uso más o menos frecuente que engrosan el listado de fármacos con este efecto hematológico 9. Los defectos plaquetarios cualitativos o trombocitopatías pueden también estar presentes. Se afecta la adhesividad plaquetaria, la capacidad de formación del coágulo, la liberación del contenido de los gránulos, entre otras 1.
En la EHC se observa disociación local del FvW con el FVIII 3. Esto se contrarresta por un dramático incremento en los niveles del complejo FVIIIa/FvW, aumenta la adhesividad de las plaquetas 3, 5, y su ubicación, en número hemostáticamente efectivo, en el área dañada 5. La elevación del FvW en la EHC se considera es consecuencia del daño endotelial mediado por la endotoxemia, o por inducción de su síntesis hepática, además por el aumento de la superficie endotelial debido a la formación de vasos colaterales, o por el estímulo de la vasopresina sobre el endotelio 22.
Dicha proteína circula como un grupo de multímeros de diferentes tamaños; los mayores de ultraelevado peso molecular (más de 10 000 kDa) son escindidos por una metaloproteinasa plasmática denominada ADAMTS13 (de su nombre en ingles: a disintegrin-like and metalloprotease with thrombospondin type 1 motifs type 13) 10, 18. Los niveles de esta proteasa no siempre están disminuidos en la CH; en un estudio en pacientes cirróticos se observa una gran variabilidad en los niveles de ADAMTS 13, y una correlación negativa de sus concentraciones con los multímeros de alto peso molecular del FvW 22. Dichos multímeros facilitan excesiva cantidad de sitios de unión para GP de la superficie plaquetaria 10, suscitándose así, su adhesividad 7, 20.
A la luz de los conocimientos actuales, la CH ya no se considera más como un simple estado de hipocoagulación 16, 20. La producción disminuida de anticoagulantes endógenos, como las proteínas C y S, TM, y tPA favorece un estado procoagulante en estos enfermos 3. Recientemente se describe hipercoagulabilidad secundaria al hecho de que en la razón existente entre el FVIII y la proteína C, resulta favorecido el primero 16, 23.
También influye la disminución del aclaramiento hepático de FC activados 24. Otro fenómeno interesante descrito en la EHC es la resistencia a la TM, dificultándose la activación de la proteína C, a favor de la vertiente procoagulante. Esta situación suele empeorar con el avance de la enfermedad 10.
Las alteraciones del balance del sistema fibrinolítico también son propias de la EHC avanzada, con la aparición de eventos hemorrágicos o trombóticos 8. La asociación entre la enfermedad hepática y la hiperfibrinólisis es descrita hace más de 80 años y se observa que la sangre de pacientes con CH, previamente coagulada, vuelve posteriormente a su estado líquido 12. Puede existir disminución del plasminógeno, la α2 antiplasmina, y el TAFI, y aumentos del PAI-1 y tPA 17. Se hace particular énfasis en que bajos niveles del TAFI podrían explicar en gran parte la hiperfibrinólisis en los pacientes cirróticos12. Este fenómeno también se ha relacionado con el paso de ascitis hacia el torrente circulatorio 12, 14, y con los eventos de traslocación de bacterias del intestino 14.
Además de la endotoxemia por traslocación bacteriana, el aumento de HE (en probable relación con las infecciones) 24, 25, la falla renal y la disfunción endotelial 19, 24 modifican la coagulación en estos pacientes. Entre los primeros se destaca el heparán sulfato. Estas sustancias son glicosaminglicanos constituyentes de los vasos, sintetizados fundamentalmente por el endotelio, que aumentan el riesgo de sangrado, similar a lo que ocurre con la administración de heparina 10.
El heparán sulfato realiza su acción anticoagulante incrementando unas mil veces la capacidad de la AT de neutralizar serin-proteasas, particularmente el FXa y la trombina 25. Su aumento no obedece sólo a su producción incrementada por la sepsis, sino a la disminución del aclaramiento por el hígado enfermo 25. Durante las infecciones se reduce, además, la agregación plaquetaria por liberación de óxido nítrico (ON) y prostaciclina 24.
En algunos casos en la EHC puede llegar a producirse un cuadro hematológico compatible con una coagulación intravascular diseminada (CID) 5, 8, que se postula como un estado persistente de CID de bajo grado 3, 14. Este efecto también parece estar potenciado por la presencia de endotoxemia 3.
En este estado se incrementan los fragmentos de protrombina 1+2 (F1+2) y el dímero D, reportándose la reducción significativa de estos en el plasma ante la descontaminación intestinal con antibióticos 20, 26. Sin embargo, hay ciertas reservas en cuanto al hecho de si las alteraciones observadas obedecen a la coagulopatía de consumo o al referido estado de hiperfibrinólisis, 15 y por otro lado, no hay evidencias de deposición de fibrina en los órganos de pacientes fallecidos por esta causa en el estado post mortem 7.
Consecuencias clínicas de las alteraciones de la hemostasia en el enfermo hepático
El evento clínico que tradicionalmente más se teme por la coagulopatía que sufre el paciente con EHC/CH es la tendencia al sangrado. Los sitios anatómicos de sangrado son variables. Este se produce a consecuencia de várices esófago-gástricas (VEG), gastropatía portal, úlcera gástrica, hemorroides, sangrado cutáneo persistente por sitios de puntura, post-biopsia hepática, tras extracciones dentarias 6 hemorragias mucosales, menorragia, petequias, equimosis, epistaxis 10, 15, hematuria, hematomas.
En presencia de hemorragia cerebral signos más sutiles incluyen cambios en el nivel de conciencia, ansiedad, y excitabilidad9. No obstante, el papel de la coagulopatía en el sangrado por VEG en particular, la forma más severa de sangrado en la CH, es sobre todo consecuencia de las alteraciones vasculares locales e incremento de la presión esplácnica. La participación de la coagulopatía se considera cuestionable 6.
Las pruebas de coagulación (PC) guardan poca correlación con las manifestaciones clínicas5. Sí se admite que un TP prolongado, aunque no es un riesgo mayor de sangrado espontáneo, de estar presente incrementa la severidad del mismo 18.
La hiperfibrinólisis o disfibrinogenemia puede ser sospechada si el sangrado es: ejemplo, por mucosas, encías, sobre todo si es tardío, pudiendo suceder varias horas tras la biopsia hepática u otros procedimientos invasivos. Esto indica que el coágulo se ha disuelto prematuramente 27. Esta circunstancia aconseja el cumplimiento con los periodos establecidos de observación post-biopsia hepática.
El estado procoagulante produce manifestaciones clínicas diametralmente opuestas. Se produce enfermedad trombótica macro y microvascular. La macrovascular puede presentarse como trombosis venosa portal (TVP) o de la arteria hepática6, tromboembolismo pulmonar (TEP), trombosis venosa profunda o arterial 13, 17, que incluye desarrollo de enfermedad coronaria y cerebrovascular isquémica. Esta última constata en asociación con disminución de las proteínas C y S 23.
La incidencia de eventos trombóticos en pacientes con EHC alcanzan hasta 1,8 % 9, 28, y en pacientes hospitalizados, hasta del 6,3 % 10, 29, 30. Dos tercios de los casos se manifiestan como TVP, 20 % como TEP y en el 15 % hay formas combinadas 13.
Tras excluir pacientes con carcinoma hepatocelular (CHC) la prevalencia de la TVP sobre la base del diagnóstico netamente ultrasonográfico es de 10 hasta 20 o 25 % 16, 20. Los resultados de un amplio estudio poblacional corroboran el riesgo aumentado de tromboembolismo venoso (TEV) en cirróticos ingresados menores de 45 años, descompensados o no 31.
La TVP en pacientes con enfermedad hepática avanzada se ve favorecida esencialmente por el estado de vasodilatación sistémica, y el estasis vascular en el lecho esplácnico, con reducción de la velocidad del flujo sanguíneo 32. Otros elementos de la llamada triada de Virchow, además, del estasis venoso pueden estar presentes; básicamente la presencia de un endotelio dañado y la hipercoagulabilidad 7, 10, 16, y es así como, la TVP se observa asociada en forma independiente con disminución de proteína C, S y aumento en los niveles de dímero D.
En un estudio realizado en cirróticos las concentraciones del dímero D son significativamente más altas y las de proteína S más bajas en pacientes con TVP asociada a CH, que en los que no tenían esta complicación 23. Pueden concurrir igualmente factores genéticamente determinados, como las alteraciones en el FV de Leiden 6, 14, 33, la mutación G20210A de la protrombina 6, 14, 32 o de la metilen-tetrahidrofolato reductasa C677T 6, 29, dado que estas alteraciones no constituyen una rareza en la población en general, y que además, teóricamente parecen favorecer la EHC 10, 13, 32. Incluso en el CHC la TVP parece responder, además de la invasión tumoral de la porta, a las anomalías de la coagulación 4.
Los hallazgos clínicos de la TVP en la CH son variables, desde asintomáticos hasta sangrado digestivo debido a VEG o gastropatía portal, y dolor abdominal agudo por extensión del trombo hacia la vena mesentérica superior, con el consiguiente infarto intestinal 16. Debido a que la TVP suele ocurrir en pacientes con enfermedad descompensada (Estadio C de Child-Pugh), los síntomas de la misma, tales como empeoramiento de la ascitis o un episodio de sangrado por VEG, puede ser atribuido al empeoramiento de la CH sin reconocer la TVP que subyace 3.
A nivel microvascular la trombosis a nivel del hígado trae como consecuencia la pérdida irreversible de hepatocitos contiguos de una región hepática y su reemplazo por tejido fibrótico, fenómeno dado a conocer como “extinción parenquimatosa” 3, 10, 16, 33, 34. Se cree además que estas microtrombosis toman parte en la aparición de la hipertensión portopulmonar en el cirrótico 3. Esta enfermedad puede cursar asintomática o causar disnea de esfuerzo, ortopnea, entre otros síntomas poco específicos, y edemas. Estos pueden alertar sobre la presencia de esta complicación en un paciente con edemas en miembros inferiores desproporcionados con la magnitud de la ascitis 18. También se reflexiona sobre la implicación de este fenómeno en el síndrome hepatorenal tipo 2 (SHR-2), y la peritonitis bacteriana espontánea 3.
Particularidades del diagnóstico de laboratorio
Se acepta que las PC presentan una correlación pobre con la hemostasia clínica5. Los pacientes podrían exhibir todo un espectro de anomalías analíticas con poca o ninguna expresividad clínica. Por otro lado, se registran eventos trombóticos con pruebas de laboratorio que sugieren riesgo de sangrado. Esto último indica que la habilidad de dichas pruebas para evaluar el riesgo de hemorragia en el enfermo hepático es cuestionable 9, 19. Por tanto, estas pruebas no reflejan de forma adecuada la hemostasia como sucede in vivo 5, 6, 8,15.
Al inicio de la enfermedad hepática hay poca o ninguna alteración de las PC 14. Ya en la cirrosis hepática (CH) estos trastornos son más manifiestos 8. La dosificación de la actividad de los factores sería el método más directo para evaluar el déficit de los FC, pero en la práctica, otras pruebas son más usadas.
El TP, o tiempo de Quick, es desarrollado en 1935 35, y mide el tiempo en que se coagula el plasma tras la adición de FT y cloruro de calcio (CaCl2). Los FC II, VII, y X son activados por la vitamina K. Esta prueba evalúa la función de los FC de la vía extrínseca (II o protrombina, V, VII, X y I o fibrinógeno 9. No hay incremento significativo en ella hasta que la concentración de alguno de los FC cae a menos de 10 % de lo normal 36. Es por esto que las alteraciones del TP constituyen un importante índice de deterioro de la función hepática 1, 2.
La tromboplastina empleada es extraída de cerebro, pulmón o placenta, con sensibilidad variable según su origen 37. El resultado de esta prueba se reporta en segundos 36, en porcentajes de actividad, mediante el cociente TP del paciente/TP normal, o el INR (internacional normalizad ratio) donde este cociente es elevado al índice de sensibilidad internacional (ISI) de la tromboplastina en uso 35:
![]()
El ISI es un valor asignado a cada lote de tromboplastina; es el valor de la pendiente de la recta de regresión logarítmica de los tiempos obtenidos contra un estándar internacional de tromboplastina 38, 39. Así, se obtendrá el valor que se habría conseguido utilizando la tromboplastina de referencia, o sea, el valor del INR 37. Habitualmente cuanto mayor es el ISI, menor la precisión de la prueba 16 y viceversa; a menor ISI (menor cantidad de FT en el reactivo), mayor sensibilidad 15, y más prolongado estará el TP 36.
No obstante el INR tampoco refleja de forma exacta la inhibición de la coagulación en la EHC. En esta la disminución del ISI sólo produce un ligero incremento del TP 36, de modo que el INR en ella probablemente sobreestima el riesgo de sangrado dado que el ISI usado se determina mediante el uso de plasmas de pacientes tratados con antagonistas de la vitamina K 16.
Estos pacientes tienen marcado aumento de la des-γ-carboxiprotrombina (DGCP) y disminuida la protrombina nativa, mientras que los pacientes con hepatopatía tienen sólo niveles ligeramente incrementados de DGCP. Algunas preparaciones de FT son inhibidas por esta sustancia, lo que podría explicar esta circunstancia 36.
Esto no ha limitado su uso, sin embargo, como parte del modelo MELD (Model for end stage liver disease), que predice supervivencia en pacientes con enfermedad hepática en estado terminal, y que define incluso la asignación de órganos para el trasplante hepático 38. Una versión del INR libre del rango de referencia basado en pacientes anticoagulados, el INR-liver, ha probado ser muy reproductible, y por tanto, de utilidad en la práctica clínica 34, 38.
El tiempo de tromboplastina parcial (TTP) evalúa la vía intrínseca y común (VIII, IX, XI, XII, II, V, X, y fibrinógeno) 1, 9; es desarrollada en 1953 y modificada en 1961. Es el tiempo en segundos que necesita un plasma con déficit de plaquetas para coagular cuando se une con un activador soluble del FXII, la pre-calicreína, el QAPM y fosfolípidos (FL) cargados negativamente como sustitutos de las plaquetas 35. Identifica la deficiencia de todos los FC excepto del FVII y FXIII.
En la EHC se altera, por lo general, cuando esta es avanzada, casi nunca en sus estadios iniciales, aunque se especula sobre la posibilidad de que la elevación de FVIII contrarreste los resultados del TTP teóricamente esperado en pacientes con EHC avanzada, y que es por eso que estos pacientes tienden a tener esta determinación en rango normal 14, 15. De cualquier forma, el TP y el TTP no reflejan adecuadamente el nuevo balance en la coagulación en estos pacientes 13, 17 debido fundamentalmente a que solo miden la fase procoagulante 17. Los resultados de estos dos tiempos y además el tiempo de trombina (TT) también pueden alterarse debido a las alteraciones del fibrinógeno en la EHC 10.
De lo anterior, se infiere que no existe una medida de coagulación global con significación clínica para estos enfermos en la práctica clínica usual 19, 34. Son candidatos con este fin la generación de trombina endógena, la tromboelastografía (TEG) y la prueba de función plaquetaria (platelet function assay; PFA) 34.
El test de generación de trombina es una prueba más reciente, basada en el registro continuo de la generación de este producto, y que semeja de modo más cercano este proceso in vivo. En ella se usa FT y FL como sustitutos de plaquetas 8. Esta puede investigarse en presencia de inhibidores de la coagulación, adicionando TM soluble al plasma. Tripodi y colaboradores evalúan esta prueba en cirróticos y obtienen que la cantidad de trombina generada en presencia de TM no tiene diferencias significativas entre pacientes y controles.
Dichos autores consideran que estos resultados se deben a que la disminución de los FC de la vía procoagulante está balanceada en la CH por la reducción de la proteína C y niveles elevados de FVIII 8. Se acepta de modo general que la generación de trombina es normal en la CH 3, 10, pero teniendo como premisa la presencia de valores mínimos de plaquetas de 50 a 60 x 10 9/L 40.
Otro componente habitual del coagulograma, el tiempo de sangría (TS), considerado durante mucho tiempo como el test global para evaluar la hemostasia primaria, está prolongado hasta en el 40 % de los pacientes con CH 9, 19, con reportes poco recientes de un incremento de cinco veces el riesgo de caída de la hemoglobina post-biopsia hepática en pacientes con TS prolongado previo. Esta prueba es una medida, tanto del número, como de la función plaquetaria 20.
La TEG es un estudio dinámico que evalúa el proceso de formación del trombo 13. En esta la sangre coagula en una copa que rota alrededor de un pin suspendido. Los cambios en los movimientos de la copa debido al proceso de coagulación son registrados y esquematizados gráficamente 20. Esta prueba permite además la detección de HE. Esto último, sobre todo, al modificar la prueba mediante el uso de diferentes heparinasas 24. La presencia de hiperfibrinólisis también se pone en evidencia con esta prueba 27. Se reporta en pacientes con EHC tendencia a hipercoagulabilidad con esta prueba 20.
La PFA-100 es una prueba rápida que trata de recrear in vitro cómo sucede la hemostasia primaria in vivo, usando sistemas de grandes velocidades de flujo. La sangre fluye a través de un sistema al vacío a través de un capilar y una apertura microscópica en una membrana recubierta con colágeno / ADP (difosfato de adenosina) o colágeno/epinefrina. El tiempo que demore en cerrar la apertura o tiempo de cierre u obturación (TO) es un indicador de adhesión y agregación plaquetaria. El TO se prolonga en pacientes con EHC 1, 20.
La prueba de agregometría también mide alteraciones cualitativas plaquetarias en cuanto al cambio de forma, la agregación, la movilización y la liberación del contenido de los gránulos 20, 11. Los resultados anormales (disminución en la agregación) de dicha prueba son mayores cuanto más severa es la enfermedad hepática.
Las causas son múltiples; los inhibidores circulantes como el dímero D y disfibrinógeno, degradación de los receptores plaquetarios por la plasmina, aumento en los niveles de ON, defectos en la transducción de señales, entre otros15. Por otro lado, la bilirrubina influye sobre la agregación plaquetaria aumentándola, y su efecto inductor en este sentido es similar al ADP. De modo general, la interpretación de las pruebas de agregación en la CH resulta difícil, debido a la trombocitopenia, ya que dependen del número existente de plaquetas 20.
El test de adhesividad plaquetaria bajo condiciones de flujo estudia la activación plaquetaria por el efecto de cizallamiento 20, (el número de veces que una plaqueta colisiona con la pared vascular) 1. En diferentes estudios se demuestran que la disfunción plaquetaria en pacientes con CH es irrelevante bajo condiciones de flujo, siempre y cuando el número de plaquetas y el hematocrito sean normales 41. Este test se considera un sustituto adecuado para el TS en este tipo de paciente, pero, su uso en la práctica no está generalizado 19.
Hay inmunoensayos disponibles para medir los llamados PIVKA. El más usado mide la DGCP. Esta aporta una ventaja adicional, su uso en el cribado del CHC. En esta enfermedad los niveles aumentados de DGCP se producen por un defecto adquirido en la carboxilación postraduccional de los precursores de la protrombina por las células tumorales 42. Sin embargo, Sherman, a propósito de un artículo que compara la eficacia de ambos marcadores en la detección precoz del CHC, asegura que la DGCP tampoco es ideal para este fin43. La disfibrinogenemia está presente en casi las tres cuartas partes de los pacientes con CH, sin que exista alteración del TP, el TTP, o la cuantificación del fibrinógeno en las PC habituales 14.
La disminución del tiempo de lisis de euglobina, aumento de dímero D y otros productos de degradación de la fibrina (PDF), así como el aumento del tPA en los pacientes cirróticos, son marcadores de hiperfibrinólisis10. El inhibidor del activador del plasminógeno, α2-antiplasmina y el TAFI se encuentran en cifras normales o por debajo de su nivel normal 14, aunque no hay que olvidar que el aclaramiento deficiente de estas sustancias en la EHC avanzada puede hacer que sus niveles parezcan falsamente elevados, y tampoco que la hiperfibrinólisis puede aparecer, de hecho, en el contexto de una CID 6.
En el paciente con EHC la CID está caracterizada por TP y TTP prolongados, trombocitopenia, productos de la fibrina elevados, y elevación del dímero D 9. Existen opiniones compartidas en cuanto a si la CID podría ser excluida con seguridad al encontrar valores del FVIII normales o elevados 15, 18.
CONCLUSIONES
Las alteraciones de la hemostasia en el paciente cirrótico obedecen a la pérdida del rebalance alcanzado por el sistema, y se relacionan con un estado avanzado de la enfermedad. Se presentan alteraciones plaquetarias cuantitativas y cualitativas, déficit en la síntesis de FC, disfibrinogenemia, alteraciones en la fibrinólisis, deficiencia de vitamina K y cambios compatibles con un estado de coagulación intravascular diseminada. Las consecuencias clínicas constituyen un espectro que incluyen tendencia al sangrado, o a fenómenos de trombosis.
Las PC habituales no reflejan de manera adecuada las alteraciones de la hemostasia en el paciente con EHC, y no deben considerarse herramientas infalibles en la predicción del riesgo de sangrado o de complicaciones trombóticas.
REFERENCIAS BIBLIOGRÁFICAS
1. Colina AJ, Carballo TT, Torres IW. Hemostasia normal. En: Suardíaz JH, Cruz CL, Colina A. Laboratorio Clínico. La Habana: Editorial Ciencias Médicas; 2004.p.309-321.
2.Wallach J. Interpretación clínica de las pruebas de laboratorio. 4ª ed. La Habana: Editorial Ciencias Médicas; 2006.
3. Northup PG. Hypercoagulation in liver disease. Clin Liver Dis. 2009[citado 5 abr 2014];31(1):109-116. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/19150315
4. Alkim H, Ayaz S, Sasmaz N, Oguz P, Sahin B. Hemostatic abnormalities in cirrhosis and tumor-related portal vein thrombosis. Clin Appl Thromb Hemost. 2012 [citado 10 abr 2014]; 18(4):409-415. Disponible en: http://cat.sagepub.com/content/18/4/409.full.pdf+html
5. Monroe DM, Maureane H. The coagulation cascade in cirrhosis. Clin Liver Dis. 2009 [citado 10 abr 2014];13(1):1-9. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/19150304
6. Lisman T, Leebeek FWG. Hemostatic alterations in liver disease: a review on pathophysiology, clinical consequences, and treatment. Dig Surg. 2007[citado 10 abr 2014]; 24,(4):250-258. Disponible en: http://www.karger.com/Article/Pdf/103655
7. Lisman T, Porte RJ. Rebalanced hemostasis in patients with liver disease: evidence and clinical consequences. Blood 2010[citado 8 abr 2014]; 116(6): 878-885. Disponible en: http://bloodjournal.hematologylibrary.org/content/116/6/878.full.pdf+html
8. Tripodi A, Salerno F, Chantarangkul V, Clerici M, Cazzaniga M, Primignani M, et al. Evidence of normal thrombin generation in cirrhosis despite abnormal convencional coagulation tests. Hepatology. 2005 [citado 10 abr 2014]; 41(3):553-558. Disponible en: http://onlinelibrary.wiley.com/doi/10.1002/hep.20569/pdf
9. Mackavey CL, Hanks R. Hemostasis, coagulation abnormalities, and liver disease. Crit Care Nurs Clin N Am. 2013 [citado 15 abr 2014];25(4):435-446. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/24267280
10. Yang ZJ, Costa KA, Novelli EM, Smith RE. Venous thromboembolism in cirrhosis. Clin Appl Thromb Hemost. 2014[citado 15 abr 2014];20(2):169-178. Disponible en: http://cat.sagepub.com/content/20/2/169.full.pdf+html
11. Menéndez Alonso E, Rubio Arias S, Sánchez Calvin MT. Visión moderna de la hemostasia: nuevo modelo de coagulación. En: Curso de formación a distancia Nº2. Madrid: Asociación Española de Biopatología Médica; 2011.p. 584-611. Disponible en: http://aebm.org/formacion%20distancia/distancia%202011-2012/Taller/MONOGRAFIAS%202011/2.-%20HEMOSTASIA.pdf
12. Ferro D, Celestini A, Violi F. Hyperfibrinolysis in liver disease. Clin Liver Dis. 2009 [citado 16 abr 2014]; 13(1):21-31. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/19150306
13. Aristizábal Henao N, Madrid Muñoz CA, Restrepo Gutiérrez JC. Hepatopatía crónica: sangrado versus trombosis. Rev Col Gastroenterol.2011 [citado 18 abr 2014]; 26 (4): 285-291. Disponible en: http://www.scielo.org.co/scielo.php?script=sci_arttext&pid=S0120-99572011000400008
14. Téllez Ávila FI, Chávez Tapia NC, Torre Delgadillo A. Trastornos de coagulación en el cirrótico. Rev invest Clín.2007 [citado 19 abr 2014]; 59(2). Disponible en: http://www.scielo.org.mx/pdf/ric/v59n2/v59n2a10.pdf
15. Ng VL. Liver disease, coagulation testing and hemostasis. Clin Lab Med. 2009 [citado 23 abr 2014]; 29(2):265–282. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/19665678
16. Tsochatzis EA, Senzolo M, Germani G, Gatt A, Burroughs AK. Systematic review: portal vein thrombosis in cirrosis. Aliment Pharmacol Ther. 2010 [citado 25 abr 2014]; 31:366-374. Disponible en: http://onlinelibrary.wiley.com/doi/10.1111/j.1365-2036.2009.04182.x/pdf
17. Saavedra González JA, Ovadía Cardona LM, Muñoz Maya OG, Correa Arango G. Alteraciones de la coagulación en cirrosis, viejos y nuevos paradigmas. Rev Col Gastroenterol. 2012. [citado 5 may 2014]; 27(2): 104-111. Disponible en: http://www.scielo.org.co/scielo.php?script=sci_arttext&pid=S0120-99572012000200008
18. Feldman M, Friedman LS, Brandt LJ. Sleisenger and Fordtran's gastrointestinal and liver disease. 9th Ed. Philadelphia: Elsevier; 2010.
19. Tripodi A, Primignani M, Mannucci PM. Abnormalities of hemostasis and bleeding in chronic liver disease: the paradigm is challenged. Intern Emerg Med. 2010 [citado 7 may 2014]; 5(1):7-12. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/19714443
20. Violi F, Basili S, Raparelli V, Chowdary P, Gatt A, Burroughs AK. Patients with liver cirrhosis suffer from primary haemostatic defects? Fact or fiction? J Hepatol. 2011 [citado 7 may 2014]; 55(6):1415-1427. Disponible en: http://www.sciencedirect.com/science/article/pii/S0168827811004995
21. Mauss S, Berg T, Rockstroh J, Sarrazin C, Wedemeyer H. Hepatology.4 ed. Germany: Flying Publisher; 2014.[citado 7 may 2014]Disponible en: http://www.flyingpublisher.com/9004.php
22. Lisman T, Bongers T, Adelmeijer J, Janssen HLA, de Maat MPM, de Groot PG. Elevated levels of von willebrand factor in cirrhosis support platelet adhesion despite reduced functional capacity. Hepatol.2006 [citado 10 may 2014]; 44:53-61. Disponible en: http://onlinelibrary.wiley.com/enhanced/doi/10.1002/hep.21231/
23. Zhang DL, Hao JY, Yang N. Value of D-dimer and protein S for diagnosis of portal vein thrombosis in patients with liver cirrhosis. J Int Medic Res. 2013 [citado 10 may 2014];41(3): 664-672. Disponible en: http://imr.sagepub.com/content/41/3/664.full.pdf+html
24. Smalberg JH, Leebeek FWG. Superimposed coagulopathic conditions in cirrhosis: infection and endogenous heparinoids, renal failure, and endothelial dysfunction. Clin Liver Dis. 2009 [citado 12 may 2014];13(1):33-42. Disponible en:
http://www.ncbi.nlm.nih.gov/pubmed/?term=Superimposed+Coagulopathic+Conditions+in+Cirrhosis%3A+Infection+and+Endogenous+Heparinoids%2C+Renal+Failure%2C+and+Endothelial+Dysfunction
25. Zambruni A, Thalheimer U, Coppell J, Riddell A, Mancuso A, Leandro G, et al. Endogenous Heparin-like Activity Detected by Anti-Xa Assay in Infected Cirrhotic and Non-Cirrhotic Patients. Scand J Gastroenterol.2004 [citado 12 may 2014]39(9):830-6. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/?term=Endogenous+Heparin-like+Activity+Detected+by+Anti-Xa+Assay+in+Infected+Cirrhotic+and+Non-Cirrhotic+Patients
26. Kalambokis G, Tsianos EV. Endotoxaemia in the pathogenesis of cytopenias in liver cirrhosis. Could oral antibiotics raise blood counts? Med Hypotheses.2011 [citado 12 may 2014]; 76(1):105-109. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/?term=Endotoxaemia+in+the+pathogenesis+of+cytopenias+in+liver+cirrhosis.+Could+oral+antibiotics+raise+blood+counts%3F+Med+Hypotheses
27. Shah NL, Caldwell SH, Berg CL. The Role of Anti-fibrinolytics, rFVIIa and other pro-Coagulants: prophylactic versus rescue? Clin Liver Dis.2009 [citado 12 may2014];13:87-93. Disponible en: http://download.journals.elsevierhealth.com/pdfs/journals/1089-3261/PIIS1089326108000949.pdf
28. Aldawood A, Arabi Y, Aljumah A, Alsaeedi A, Rishu A, Aldorzi H, et al. The incidence of venous thromboembolism and practice of deep venous thrombosis prophylaxis in hospitalized cirrhotic patients. Thromb J.2011 [citado 12 may 2014];9:1. Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3033790/
29. Saleh T, Matta F, Alali F, Stein PD. Venous thromboembolism with chronic liver disease. Am J Med.2011 [citado 12 may 2014]; 124(1):64-68. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/21187186
30. Al-Dorzi HM, Tamim HM, Aldawood AS, Arabi YM. Venous Thromboembolism in critically ill cirrhotic patients: practices of prophylaxis and incidence. Thromb. 2013 [citado 12 may 2014]; 2013: 1-7; Disponible en: http://downloads.hindawi.com/journals/thrombosis/2013/807526.pdf
31. Wu H, Nguyen GC. Liver cirrhosis is associated with venous thromboembolism among hospitalized patients in a Nationwide US study. Clin Gastroenterol Hepatol. 2010 [citado 12 may 2014]; 8:800-805. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/?term=Liver+cirrhosis+is+associated+with+venous+thromboembolism+among+hospitalized+patients+in+a+Nationwide+US+study
32. García Pagan JC, Valla DC. Portal vein thrombosis: A predictable milestone in cirrhosis? J Hepatol. 2009 [citado 15 may 2014]; 51(4):632–634. Disponible en: http://ac.els-cdn.com/S0168827809004449/1-s2.0-S0168827809004449-main.pdf?_tid=79af656c-bc22-11e3-8019-00000aab0f26&acdnat=1396634380_c4ad7b75704c5c4659dba0356561ba5d
33. Anstee Q, Wright M, Glodin R, Thursz MR. Parenchymal Extinction: Coagulation and Hepatic Fibrogenesis. Clin Liver Dis. 2009 [citado 8 abr 2014];13(1):117–126. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/19150316
34. Caldwell SH, Sanyal AJ. Coagulation disorders and bleeding in liver disease: future directions. Clin Liver Dis. 2009 [citado 15 may 2014];13:155-157. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/?term=Coagulation+disorders+and+bleeding+in+liver+disease%3A+future+directions
35. Tripodi A. Tests of coagulation in liver disease. Clin Liver Dis. 2009 [citado 15 may 2014];13:55-61. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/19150309
36. Dufour DR, Lott JA, Nolte FS, Gretch DR, Koff RS, Seeff LB. Diagnosis and monitoring of hepatic injury. I. Performance characteristics of laboratory tests. Clin Chem. 2000 [citado 15 may 2014]; 46(12): 2027–2049. Disponible en: http://www.clinchem.org/content/46/12/2027.full.pdf+html
37. Mulet Batista D, Ramírez Pérez C, Abreu Sera G, Pérez Mir J, Pérez González JA. Coeficiente internacional normalizado, útil herramienta en la terapia anticoagulante oral. Medisur. 2012 [citado 15 may 2014]; 10(3): 184-187. Disponible en: http://www.medisur.sld.cu/index.php/medisur/article/view/1778
38. Kamath PS, Kim WR. The international normalized ratio of prothrombin time in the Model for End-Stage Liver Disease Score: A reliable measure. Clin Liver Dis.2009 [citado 16 may 2014];13(1):63-66. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/19150310
39. Arjal R, Trotter JF. International normalized ratio of prothrombin time in the model for end-stage liver disease score: an unreliable measure. Clin Liver Dis. 2009 [citado 16 may 2014];13(1):67-71. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/19150311
40. Argo CK, Balogun RA. Blood Products, Volume control, and renal support in the coagulopath in liver disease. Clin Liver Dis. 2009 [citado 16 may 2014];13:73-85. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/?term=Blood+Products%2C+Volume+control%2C+and+renal+support+in+the+coagulopath+in+liver+disease.
41. Hugenholtz GC, Porte RG, Lisman T. The platelet and platelet function testing in liver disease. Clin Liver Dis. 2009 [citado 16 may 2014]; 13(1):11–20. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/19150305
42. Lok AS, Sterling RK, Everhart JE, Wright EC, Hoefs JC, Di Bisceglie AM, et al. Des-γ-Carboxy prothrombin and α-fetoprotein as biomarkers for the early detection of hepatocellular Carcinoma. Gastroenterol. 2010 [citado 16 may 2014]; 138(2):493-502. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/19852963
43. Sherman M. Serological surveillance for hepatocellular carcinoma: Time to quit. J Hepatol 2010 [citado 16 may 2014]; 52:614-615. Disponible en: http://ac.els-cdn.com/S0168827810000036/1-s2.0-S0168827810000036-main.pdf?_tid=3aa26ba2-bc28-11e3-bbf7-00000aacb35e&acdnat=1396636852_40bc3bd0318fd687577eb7eb5310b11b
Enviado: 22 de mayo de 2014
Aceptado: 18 noviembre de 2014
Dra. Margarita Rodríguez Diéguez. Hospital General Universitario Vladimir Ilich Lenin. Holguín. Cuba.
Correo electrónico: margarita@hvil.hlg.sld.cu