Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Correo Científico Médico
versión On-line ISSN 1560-4381
ccm vol.20 no.3 Holguín jul.-set. 2016
ARTÍCULO ORIGINAL
Purificación del toxoide pertúsico de Bordetella pertussis
Pertussis Toxoid Purification of Bordetella pertussis
Manuel Hernández Muñoz 1, Elba Daisy Rivas Rodríguez 2, Honorio Daniel Llanos Rivas 3, Manuel Alaín Álvarez Blanco 4
1. Licenciado en Bioquímica y Biología Molecular. Centro Nacional de Investigaciones Científicas. Cuidad de la Habana. Cuba.
2. Licenciada en Enfermería. Asistente. Filial de Ciencias Médicas Urselia Díaz Báez. Banes. Holguín. Cuba.
3. Doctor en Medicina General. Residente de primer año en Medicina General Integral. Policlínica Docente Darío Calzadilla Ángulo. Banes. Holguín. Cuba.
4. Licenciado en Educación. Máster en Educación Superior. Profesor Auxiliar. Filial de Ciencias Médicas Urselia Díaz Báez. Banes. Cuba.
RESUMEN
Introducción: el toxoide pertúsico es una proteína muy utilizada en las vacunas acelulares contra la tosferina. Desarrollar un protocolo para su purificación con pocos pasos y con parámetros de purificación adecuados, es muy importante para su caracterización química y la valoración de los efectos adversos que puede provocar al inocular principalmente a ratones. Los protocolos de purificación descritos en la literatura científica involucran varios pasos de purificación y bajos rendimientos.
Objetivo: desarrollar un protocolo de purificación del toxoide pertúsico que garantice un grado de pureza alto y un rendimiento de más de 80% a partir de cultivos de un mutante de B. pertussis obtenido en el Centro Nacional de Investigaciones Científicas (CNIC).
Métodos: para purificar el toxoide se usó una columna de intercambio catiónico Fractogel EMD SO-3 y se eluyó incrementando el pH y la concentración salina por pasos hasta obtener los resultados esperados. La determinación de proteínas totales se realizó mediante el micrométodo linealizado de Bradfor10 usando como patrón albúmina de suero bovina (BSA).
Resultados: se obtuvo 3,28 mg de toxoide por cada litro de cultivo con un rendimiento de 86,7% y un grado de pureza de 96,7%.
Conclusiones: el procedimiento de purificación descrito permite obtener el toxoide pertúsico con un rendimiento mayor que el 80% y alto grado de pureza, lo que garantiza la calidad requerida para su caracterización bioquímica e inmunológica.
Palabras clave: Vacunas acelulares, protocolo de purificación, parámetros de purificación, Bordetella pertussis.
ABSTRACT
Introduction: pertussis toxoid is a widely used in acellular vaccines against pertussis protein. Develop a protocol for purification with few steps and with parameters suitable purification is very important for chemical characterization and assessment of adverse effects that can lead to inoculate mainly mice. Purification protocols described in scientific literature involve several purification steps and low yields.
Objective: to develop a protocol for purification of pertussis toxoid to ensure a high degree of purity and a yield of over 80% from cultures of a mutant of B. pertussis obtained at the National Center for Scientific Research (CNIC).
Methods: for purifying the toxoid cation a Fractogel EMD SO-3 cationic interchange column was used by increasing the pH and salt concentration to obtain the expected results. The total protein determination was performed using linearized macromethod of Bradfor10 using as bovine serum albumin standard (BSA).
Results: 3.28 mg toxoid was obtained per liter of culture with a yield higher than 86.7% and a purity of 96.7%.
Conclusions: the purification process described allows for the pertussis toxoid with a higher yield than 80% and high purity, ensuring the quality required for biochemical and immunological characterization.
Keywords: acellular vaccines, purification protocol parameters purification, Bordetella pertussis.
INTRODUCCIÓN
La tosferina o pertussis es una enfermedad respiratoria aguda y altamente contagiosa, causada por la bacteria Gram negativa Bordetella pertussis 1. Este microorganismo patógeno coloniza el tracto respiratorio superior del ser humano y se transmite por vía aérea. Esta enfermedad afecta fundamentalmente niños de grupos sociales de bajo poder adquisitivo y recién nacidos sin anticuerpos antipertussis maternos.
Aunque la Organización Mundial de la salud (OMS) recomienda la inmunización de los niños para la prevención y evitar la diseminación de la enfermedad 2, este objetivo aún no se ha alcanzado. Si bien la vacuna tradicional de células inactivadas confiere un alto grado de protección, la inducción de efectos adversos en Europa y Asia genera cierto rechazo a la vacunación2, lo cual incrementa la incidencia de la enfermedad y hace necesario la implementación de nuevas vacunas mejor definidas en su composición. Los efectos adversos de la inmunización con vacunas de células completas varían desde un simple catarro hasta daños neurológicos permanentes o la muerte 3.
Estas vacunas son desplazadas en muchos países por variantes acelulares menos reactogénicas y más eficaces, compuestas solo por algunas proteínas bacterianas. Un componente importante de este tipo de vacunas es el toxoide pertússico (PT), derivado de una proteína que cumple el principal rol en la patogénesis de la tosferina y se cree que es el principal antígeno protector de B. pertussis 4. PT es una proteína con actividad ADP-ribosiltransferasa y es una exotoxina compuesta por cinco subunidades designadas S1, S2, S3, S4 y S5, respectivamente. La subunidad S1 de la toxina constituye la subunidad activa catalíticamente y es activada mediante la reducción de puentes disulfuro 5.
Dentro de los efectos biológicos atribuidos a PT se encuentra la sensibilización a la histamina y el aumento de la secreción de insulina. Un método que se utiliza para eliminar estos efectos adversos de las vacunas acelulares lo constituye la detoxificación de PT mediante mutagénesis dirigida 6, para producir un toxoide con actividad tóxica atenuada. Algunos de los efectos adversos provocados por PT son desconocidos, por lo que es muy importante su caracterización tanto física como química para entender la patogénesis de la bacteria y para modificar la vacuna de forma tal que se tenga un preparado vacunal sin riesgos para la salud. Para este propósito es necesario aislarla del sobrenadante del cultivo.
Se describen muchos procedimientos de purificación de PT los cuales se caracterizan por múltiples pasos y bajo rendimiento 7-9, por lo cual se planteó como problema. ¿Cómo obtener el toxoide pertúsico con parámetros de purificación de más de 80% de rendimiento simplificando el proceso? Teniendo en cuenta estos antecedentes el siguiente trabajo tuvo como objetivo:
Desarrollar un protocolo de purificación del toxoide pertúsico que garantice un rendimiento de más de 80% a partir de cultivos de un mutante de B. pertussis obtenido en el Centro Nacional de Investigaciones Científicas (CNIC).
MÉTODOS
Microorganismo
Se trabajó con la cepa bacteriana de B. pertussis LPA 0311, mutante obtenido en el Departamento de Biología Molecular del CNIC. La mutación consistió en la sustitución del codón de Arg 9 a Lys y Glu 129 a Gly, en la subunidad S1, la cual fue reportada previamente 6.
Crecimiento del microorganismo
Se dispersó 10 µL de la suspensión de la cepa LPA-0311, con asa de siembra sobre la superficie de una placa de agar de charcoal. Se incubó la placa a 35ºC, en cámara húmeda durante 48-72 horas. La biomasa crecida se inoculó en 10 ml de SS, se le determinó la densidad óptica a una longitud de onda de 600 nm en un Biofotómetro 6131 (Eppendorf). A partir de un cultivo, se inoculó en SS con estreptomicina (Str, 100 µg/mL) para alcanzar una densidad óptica a 600 nm de 0,1 o mayor. Cada cultivo se incubó a 35ºC durante 24 h.
Purificación de proteínas por cromatografía de intercambio catiónico
Se partió de un cultivo de Bordetella pertussis en caldo SS (de 24 h) el cual presentaba una densidad óptica mayor de 1,0. Se centrifugó 20 minutos a 3 500 rpm en una centrifuga marca (Mlwk70dL). Se separó el sobrenadante y se esterilizó a través de un filtro (Nalgene) de 0,2 µm de poro con presión negativa. Seguidamente se midió el pH al filtrado y se ajustó a pH 6 con HCL diluido, previo a la aplicación a la matriz catiónica Fractogel EMD SO3 - . Esta matriz había sido equilibrada anteriormente con solución tamponada de fosfato de sodio 50mM, pH 6. La muestra se aplicó mediante el uso de una bomba peristáltica (Pump P-1, Pharmacia) a un flujo de 2,0 mL/min. El perfil cromatográfico fue seguido por el registro de la absorbancia a 280 nm
Detector: Single Path, Monitor UV-1, en un procesador de datos C-R4A (Cromatopac Shimadzu). Las proteínas no enlazadas al gel se removieron con tampón de equilibrio hasta que la señal de absorbancia llegó a la línea base de partida. La elusión del toxoide se llevó a cabo incrementando el pH y la concentración salina por pasos hasta obtener los resultados esperados. Se aplicó a la columna el buffer fosfato de sodio a una concentración de 100 mM a pH 7,0 y después se aplicó el mismo buffer 100 mM a pH 7,6 y se realizó un lavado de la columna con solución tamponada fosfato de sodio 100 mM, pH 7,6 adicionando NaCl 500 mM para regenerar la columna. De las fracciones colectadas en cada etapa cromatográfica se extrajo 1 ml para analizar el perfil proteico en una electroforesis en condiciones desnaturalizantes y 1,3 ml para determinar la concentración de proteínas totales y específicas.
Determinación de la concentración de proteínas totales
La determinación de proteínas totales se realizó mediante el micrométodo linealizado de Bradfor 10 usando como patrón albúmina de suero bovina (BSA).
Determinación del perfil proteico
La corrida electroforética se realizó en condiciones desnaturalizantes usando geles al 12% de poliacrilamida (SDS-PAGE), preparados según Laemmli 11 en presencia de tampón de corrida Tris-glicina. Las proteínas disueltas en buffer fosfato-salino (PBS) y buffer de muestra se desnaturalizaron por 10 minutos en agua de ebullición y se aplicaron al gel. Los geles fueron revelados con azul Coomassie. El patrón de peso molecular empleado fue el de Bio-red (catálogo No.161-0363) y se corrió en las mismas condiciones de las muestras.
Determinación de proteínas específicas mediante ELISA
La determinación cuantitativa del toxoide pertúsico se determinó en una placa de polietileno de 96 pocillos (Nunc), la cual se recubrió durante 2 h a 35ºC con 100 µL/ pozo de fetuina (Sigma, código F2379) a una concentración de 0,04 mg/ml, disuelta en carbonato de sodio 0,1 M a pH 9,4. Tras retirar la solución remanente, se adicionaron 150 µL/pozo de leche descremada al 2% en PBS y se incubó durante 1 h a 35ºC. Luego de tres lavados con 250 µL de PBS-T, en una cantidad de 100 µL/pozo. Se realizaron diluciones seriadazas a partir de una dilución, media de una solución de referencia de PT (NIBSC, código 90/518), ajustada a una concentración inicial de 5 µg/mL.
Luego de tres lavados, se añadieron 100 µL/pozo del anticuerpo policlonal de carnero anti PT (NIBS, código 97/572) a una disolución de 1/10 000, seguido de una incubación a 35ºC durante 1 h. Las placas se lavaron nuevamente con PBS-T tres veces y se incubaron 1 h a 35ºC, en presencia 100 µL /pozo de conjugado anti-IgG de carnero-peroxidasa (sigma, código A-9452), diluido 1/10 000 en PBS-T.
Después de tres lavados con PBS-T se añadieron 100 µL de 3’3’5’5’ tetramethylbenzidina a una concentración de 0,16 mg/mL y peróxido de hidrógeno 0,006% en disolución tampón sustrato (acetato de sodio 0,11 M a pH 5,5). Después de 10 min de reacción, se adicionaron 100 µL/pozo de ácido sulfúrico 2,5 M y seguidamente se determinó la D.O 450 nm. Se consideró que una muestra contenía toxoide si su D.O promedio fue mayor o igual al doble del valor promedio de la D.O obtenida para el blanco. La concentración del toxoide se determinó por la interpolación de la D.O en los valores de la curva estandarizada.
Determinación del PT mediante western blotting
Las proteínas precipitadas previamente se corrieron en un SDS-PAGE junto con un patrón de peso molecular (Bio-Rad catálogo No. 161-0363). Se aplicó 5 µL/pozo de solución de verde malaquita antes de parar la corrida y se dejó correr hasta el gel separador. Luego las proteínas se transfirieron durante 1 h a una membrana de nitrocelulosa, eliminando toda la parte del gel concentrador u otra zona que no sea de interés.
La transferencia se realizó en una minicámara (Bio-Rad) con buffer de transferencia durante 1h a 100 V, 350 mA. La membrana con las bandas transferidas se incubó con solución rojo Punceau 10 min y se lavó tres veces con H2O Tween 20 al 0,05% (v/v) en PBS. Posteriormente se incubó 30 min en solución de bloqueo usando leche descremada al 5% en PBS-T y se lavó nuevamente.
Finalmente la membrana con el anticuerpo anti-PT 97/572 NIBSC (1/1000) se incubó con agitación durante una hora, seguido de una hora con el conjugado anti carnero, unido a peroxidasa (Sigma, 9452) diluido 1/4000. Entre los diferentes pasos se realizaron lavados sucesivos con H2O Tween 20. Se reveló con una solución de revelado con diaminobenzidina (DAB) (5mg de DAB, 40mL de solución tamponada sustrato y 40 µL de H2O2) en la oscuridad.
RESULTADOS
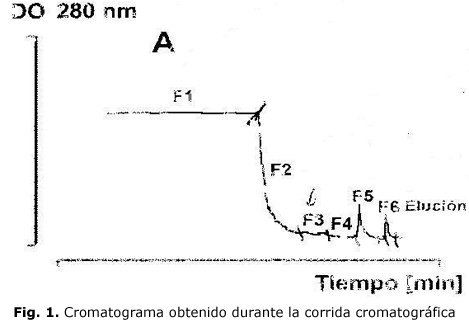
El cromatograma obtenido durante la corrida cromatográfica muestra las diferentes fracciones colectadas según los picos obtenidos. Purificación del toxoide pertúsico por cromatografía de intercambio iónico. Panel A: Cromatograma de purificación con la matriz Fractogel EMD SO3. La identidad de cada fracción colectada se muestra en el cromatograma. Figura 1C: Identificación por western-blotting con anticuerpo anti-PT 97/572 NIBSC (1/1000) del toxoide pertúsico. La aplicación de las muestras en el gel es igual que en el SDS-PAGE (fig. 1).
Electroforesis de proteínas en condiciones desnaturalizantes (SDS-PAGE) en gel de archilamida al 12%. Carril 1: patrón de pesos moleculares (PM 10-225 kDa), carriles 2-7 cultivo aplicado a la matriz: F1, fracción no enlazada colectada durante la aplicación: F2, lavado-1: F3, lavado -1a: F4, lavado-2: F5, lavado 2a y F6, elusión (fig. 2).
En el perfil proteico de cada una de las fracciones colectadas (fig. 2) se observó que el toxoide eluyó con buffer fosfato 100 mM a pH 7,6, con un pico bien definido que al ser aplicado a SDS-PAGE se perciben todas la bandas características de todas las subunidades del toxoide. Estas bandas tienen una migración electroforética entre 11-26 kDa, la cual se corresponde con la talla reportada previamente para cada una de ellas. Estas bandas no aparecen en el resto de las fracciones colectadas y no se observa bandas contaminantes lo que evidencia un gran rendimiento con un gran porcentaje de pureza.
Todas las fracciones se analizaron por Western blot (fig. 3) y la reacción antígeno y anticuerpo solo tuvo lugar en la fracción de elusión este resultado permite corroborar lo anteriormente dicho.
En el resumen del proceso de purificación del toxoide se evaluó la eficiencia del protocolo mediante los parámetros de control de la purificación (tabla I). Se valoró el rendimiento y el grado de pureza, calculados según indica a continuación:
Rendimiento (%) = mg el toxoide obtenido en la elusión / mg del toxoide en el sobrenadante.
Grado de pureza = mg del toxoide / mg proteínas totales obtenidas el la etapa. La actividad específica no se determinó por tratarse de un toxoide carente de toxicidad.
Tabla I. Resumen del proceso de purificación del toxoide pertúsico para un litro de cultivo
| Paso | Proteína total (mg) | Toxoide (mg) | Pureza | Rendimiento % |
| Sobrenadante del cultivo filtrado | 45,8 | 3,78 | 0,073 |
|
| Elución | 3,39 | 3,28 | 0,967 | 86,7 |
Fuente: datos de los autores
DISCUSIÓN
Varias son las matrices cromatográficas empleadas anteriormente en la purificación de esta proteína por otros autores. Entre ellas se encuentran matrices de intercambio iónico, hidrofóbicas y de afinidad. En la gran mayoría de los protocolos de purificación descritos se usa la combinación de dos o más matrices para obtener la proteína con el grado de pureza requerido. Para la purificación del toxoide se trató de reproducir estos protocolos pero no se obtuvieron los resultados esperados y en muchas ocasiones alejados de los resultados reportados por los autores. Conociendo de antemano que la cromatografía de intercambio iónico es una técnica muy robusta, eficiente y altamente usada en la purificación de proteínas se decidió usar la matriz catiónica Fractogel EMD SO-3.
Los resultados indican que con un solo paso cromatográfico pueden obtenerse cantidades suficiente del toxoide con elevado grado de pureza y rendimiento (tabla I ). Se obtuvo un rendimiento de 86,7% superior al 75% reportado por Sekura y cols 9 y al 85% y al reportado por Sato y cols 8. La pureza obtenida (96,7%) fue similar al 98% reportada por Sato y cols 9.
Este resultado es muy importante porque demuestra que nuestro protocolo representa un ahorro de recursos y tiempo considerable, obteniéndose parámetros de purificación similares, alcanzando algunos de estos parámetros valores superiores, a los parámetros de purificación reportados por otros investigadores que utilizan varias matrices para la purificación de PT.
CONCLUSIONES
Se obtuvo un procedimiento que permite purificar de forma rápida, sencilla y reproducible el toxoide pertúsico. El procedimiento de purificación descrito permite obtener el toxoide pertúsico con un rendimiento de 86% y un grado de pureza de 96,7%, lo que garantiza la calidad requerida para su caracterización bioquímica e inmunológica.
REFERENCIAS BIBLIOGRÁFICAS
1. Ulloa MT. Bordetella pertussis. Rev Chilena Infectol. 2008 [citado 31 mar 2015]; 25 (2): 115-115. Disponible en: http://www.scielo.cl/scielo.php?script=sci_arttext&pid=S0716-10182008000200005&lng=en&nrm=iso&tlng=en
2. Mattoo S, Cherry JD. Molecular pathogenesis, epidemiology, and clinical manifestations of respiratory infections due to Bordetella pertussis and other Bordetella subspecies. Clin Microbiol Rev. 2005 [citado 31 may 2011]; 18(2):326-382. Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC1082800/
3. Landys Chovel M, Figueroa JM, Perdomo V. Limitaciones del ensayo de toxicidad específica para el componente pertussis de células completas. Vaccimonitor. 2008. [citado 21 mar 2014]; 17(3): 6-12. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1025-028X2008000300002&lng=es&nrm=iso
4. Uhl MA, Miller JR. Central role of the BvgS receiver as a phosphorylated intermediate in a complex tow-component phosforelay. J Biol Chem. 1996 [citado 21 mar 2014]; 271 (52): 33176-33180. Disponible en: http://www.jbc.org/content/271/52/33176.full.pdf
5. Locht C, Antoine R, Jacob Dubuisson F. Bordetella pertussis, Molecular pathogenesis under multiple aspects. Curr Opin Microbiol.1992 [citado 21 mar 2014]; 4(1):82-89. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/?term=.+Bordetella+pertussis.+Molecular+pathogenesis++under+multiple+aspects
6. Nencioni L, Pizza MG, Volpini G, De Magistris MT, Giovannoni F, Rappuoli R. Properties of the B oligomer of pertussis toxin. Infect Immun. 1991 [citado 21 mar 2014]; 59(12):4732-4734 Disponible en: http://iai.asm.org/content/59/12/4732.abstract
7. Özcengiza E, Kılınçb K, Büyüktanıra Ö, Günalp A.Rapid purification of pertussis toxin (PT) and filamentous hemagglutinin (FHA) by cation-exchange chromatography. Vaccine. 2004 [citado 21 mar 2011]; 22(11-12): 1570-1575. Disponible en: http://www.sciencedirect.com/science/article/pii/S0264410X03007552
8. Sato Y, Kimura M, Fukumi H. Developmen of pertussis component vaccine in japan. Lancet.1984 [citado 21 mar 2011]; 1(8369):122-126.Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/6140441
9. SeKura. RD, Fish F, Manclark CR, Meade B, Zhang YL. Pertussis toxin. Affinity Purification of a new ADP-ribosyltransferase. J Biol Chem. 1983 [citado 21 mar 2014]; 258(23):14647-14651 Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/6315733
10. Falero Morejón A, Jiménez L, Fando R .Aplicación del método de Bradford en la determinación de proteínas en el proceso de purificación de la toxina pertúsica. VI Congreso virtual sobre gestión de calidad en laboratorios; 2011 feb 1-sep 15.España: IBEROLAB; 2011. Disponible en: http://www.magrama.gob.es/es/ministerio/servicios/publicaciones/IBEROLAB_2011_primeras_p%C3%A1ginas_tcm7-208996.pdf
11. Laemmli UK. Cleavage of structural proteins during assembly of the head of bacterophage T4. Nature. 1970 [citado 21 mar 2014]; 227: 680-685 Disponible en: http://www.nature.com/nature/journal/v227/n5259/pdf/227680a0.pdf
Recibido: 15 de enero de 2015
Aprobado: 17 de julio de 2016
Lic. Manuel Hernández Muñoz. Centro Nacional de Investigaciones Científicas. Cuidad de la Habana. Cuba.
Correo electrónico: manuelhm@banes.hlg.sld.cu