Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Correo Científico Médico
versión On-line ISSN 1560-4381
ccm vol.22 no.1 Holguín ene.-mar. 2018
ARTICULO ORIGINAL
Cepario autóctono de leptospiras en la prueba de micro - aglutinación
Micro - agglutination test of Autogenous leptospirosis
Berlis Gómez Leyva 1, Alfredo Saltarén Cobas 2, María Teresa Díaz Armas 3, María Paulina Robalino Valdivieso 4, Silvia Aracely Lucero Proaño 5
1. Máster en Enfermedades Infecciosas. Especialista de Primer Grado en Microbiología. Escuela Superior Politécnica de Chimborazo. Chimborazo. Ecuador.
2. Máster en Microbiología. Licenciado en Biología. Centro Provincial de Higiene y Microbiología. Holguín. Cuba.
3. Máster en Asesoramiento Genético. Especialista en Medicina General Integral. Asistente. Escuela Superior Politécnica de Chimborazo. Chimborazo. Ecuador.
4. Especialista en Pediatría. Escuela Superior Politécnica de Chimborazo. Chimborazo. Ecuador.
5. Especialista en Medicina Interna. Escuela Superior Politécnica de Chimborazo. Chimborazo. Ecuador.
RESUMEN
Introducción: leptospirosis. Zoonosis más frecuente en Cuba, como enfermedad infecto-contagiosa.
Objetivos: identificar las cepas de leptospiras aisladas localmente, para ser empleadas en la prueba de microaglutinación. Apreciar su comportamiento serológico frente a las cepas de referencia.
Método: estudio experimental, de sueros de pacientes presuntivos de padecer Leptospirosis, con 60 muestras, en el Instituto Carlos J. Finlay, de La Habana. Identificación de 40 sueros reactores a la hemaglutinación pasiva. Identificación de 34 cepas, de un total de 250 aislamientos, a partir de hemocultivos, de pacientes con antisueros policlonales a serogrupos y anticuerpos monoclonales a serovar. Se conformaron cinco cepasrepresentativas de los serovares: Ballum Ballum, Canicola Canicola, Pomona Pomona, Hebdomadis Wolffi e Icterohaemorrhagiae Copenhageni, como las de mayor circulación en la región. Se realizó la prueba de microaglutinación con las cepas aisladas localmente, y las de referencia de forma paralela.
Resultados: mayor reactividad con las cepas locales, y conformación de cinco cepas representantes de los serovares: Ballum Ballum, Canicola Canicola, Pomona Pomona, Hebdomadis Wolffi e Icterohaemorrhagiae Copenhageni, como las de mayor circulación en la región. Se encontró una concordancia de 86,36% en la reactividad.
Conclusiones: los resultados mostraron mayor reactividad con las cepas locales que con las de referencia, elevada concordancia e incremento de los títulos de anticuerpos de los sueros reactores usando cepas locales, y disminución del promedio de las reacciones cruzadas cuando se utilizaron las cepas locales. Se demostró su utilidad en la evaluación de estudios inmunológicos.
Palabras clave: leptospirosis, cepario autóctono, microaglutinación, hemaglutinación pasiva, sueros reactores.
ABSTRACT
Introduction: leptospirosis, a contagious infectious disease considered the most common zoonosis in Cuba.
Objectives: to identify locally isolated leptospirosis strains for micro- agglutination test. To evaluate their serological behavior against the reference strains.
Method: an experimental study of 60 presumptive Leptospirosis patients’ serum samples. Forty sera reactive to passive hemagglutination. To isolate 250 blood cultures of patients. To show 34 strains identified at the Carlos J. Finlay Institute, with polyclonal antisera to serogroups and monoclonal antibodies to serovar. Five strains represented by the serovars: Ballum Ballum, Canicola Canicola, Pomona Pomona, Hebdomadis Wolffi and Icterohaemorrhagiae Copenhageni, were the most circulating strains in the region. The microagglutination test was performed in parallel form to locally isolated strains and reference strains
Results: greater reactivity with the local strains. Five strains representing the serovars: Ballum Ballum, Canicola Canicola, Pomona Pomona, Hebdomadis Wolffi and Icterohaemorrhagiae copenhageni as the most circulating in the region. The reactivity showed 86.36% concordance.
Conclusions: there was greater reactivity with the local strains than the reference strains. A higher concordance increased the titers of antibodies of the reactive sera, by the use of local strains. The average of cross reactions decreased when the local strains were used. The evaluation of immunological studies was demonstrated.
Key words: leptospirosis, autogenous ceparium, microagglutination, passive hemagglutination, reactive sera.
INTRODUCCION
La leptospirosis, enfermedad infecto-contagiosa, se considera la zoonosis más frecuente en Cuba. El clima tropical y la práctica de la producción agrícola, favorecen su propagación. Esta enfermedad infecta gran cantidad de animales salvajes y domésticos, los que lo excretan en su orina. El agente biológico es un microorganismo del género leptospira.
El hombre se infecta de forma directa al ponerse en contacto con la orina o tejidos de un animal infectado, o de forma indirecta mediante el contacto con agua, terrenos y vegetación contaminada. Las puertas de entrada son: la piel, las mucosas expuestas, asiento de pequeñas excoriaciones, y, menos frecuente, la ingestión de alimentos contaminados con orina de roedores infectados, o la ingestión de aguas contaminadas por roedores, cerdos, ganados y perros. 1, 2
El diagnóstico microbiológico de la leptospirosis, al igual que el de otras enfermedades infecciosas, ha experimentado un impulso en los últimos años. La Revolución Científico Técnica incluye la variabilidad en cuanto a la presentación de Kit de diagnóstico y la microaglutinación (MAT) con antígenos vivos. La prueba de referencia técnica, se considera, por la Organización Mundial de la Salud (OMS), como la regla de oro,debido a su sensibilidad y a la información que brinda en cuanto a serogrupos y serovares. Además, sirve de base para evaluar cualquier otro método serológico, con antígenos vivos en medios líquidos, que incluyen los serovares representativos de todos los serogrupos presentes en el área. 3
La identificación y el aislamiento de cepas de leptospiras, es esencial en los estudios epidemiológicos para determinar la presencia de leptospirosisen la naturaleza. Sirven como reservorios de cepas que puedan infectar al hombre y a los animales, así como para el conocimiento de los serogrupos y serovares, que circulan, con mayor frecuencia, en nuestro medio.
Entre los métodos de identificación de cepas se pueden señalar las pruebas de aglutinación cruzada, la prueba de aglutinación–absorción cruzada, el análisis del factor suero, entre otras. 4 La obtención de sueros hiper-inmunes a partir de conejos inmunizados con cepas de referencia, y su posterior utilización mediante la MAT frente a cepas aisladas permiten, también, la identificación de serogrupos y serovares.
La provincia de Holguín ha sido una de las más afectadas por la leptospirosis, debido a las grandes extensiones de tierra dedicadas a la agricultura: la caña de azúcar, frutos menores, viandas y hortalizas.
Estos cultivos provocan la existencia de zonas bajas pantanosas, así como la utilización de diversas fuentes y sistemas de regadío, para garantizar la humedad del suelo. Dentro del territorio, se encuentran varias unidades pecuarias con sistemas de conducción y tratamiento de residuales inadecuados. Unido a esto, un sector importante de la población rural se dedica a la crianza de animales domésticos, práctica que favorece el aumento de la población de roedores que habitan los cultivos de caña de azúcar. El incremento de la leptospirosis en los últimos años, ha motivado la realización de investigaciones con fines epidemiológicos, diagnósticos, y profilácticos, con el propósito de reducir la morbi-mortalidad, y mejorar la calidad de vida de la población. 5, 6
En la provincia de Holguín, se han realizado numerosos aislamientos de cepas de leptospiras, que han sido identificadas hasta serovar, en diferentes laboratorios especializados del país. Estas conforman el banco de cepas como objetos de estudio. Los aislamientos locales, incluidos en la batería de antígenos en la realización de la MAT en la profilaxis de la leptospirosis, con fines epidemiológicos, son de gran importancia, ya que nos permiten conocer los serovares que circulan en la región.
Esta investigación se ejecutó con el propósito de identificar las cepas de leptospiras aisladas localmente para emplearlas en la prueba de MAT, y para poder apreciar su comportamiento serológico frente a las cepas de referencia.
MÉTODOS
Se realizó un estudio experimental con 250 muestras de sueros, seleccionados por muestreo aleatorio simple, de pacientes con sospecha clínica y epidemiológica de leptospirosis, en distintas áreas de salud de la provincia de Holguín. Las muestras del Laboratorio de Leptospiras del Centro Provincial de Higiene Epidemiología y Microbiología, de Holguín, Cuba, se obtuvieron en el período 2012-2013.
Se realizó una selección de 60 muestras de sueros, con criterios de exclusión, la turbidez que evidencia, contaminación microbiana, y la presencia de hemólisis. Fueron estudiados previamente con la técnica serológica de Hemaglutinación Pasiva (HA). Los resultados correspondieron a 40 sueros reactores y 20 no reactores.
Todas las muestras se conservaron en congelación hasta la realización de los estudios microbiológicos. A las muestras de sueros se les realizó la técnica de MAT, utilizando cepas de leptospiras aisladas en la provincia, provenientes de hemocultivos conservados en el Centro Provincial de Higiene, Epidemiología y Microbiología de Holguín.
Fueron identificados en serogrupos y serovares, en el Laboratorio de Leptospiras del Centro de Investigación y Producción de Vacunas y Sueros Carlos J. Finlay, en La Habana.
Durante el período comprendido entre enero del 2012 y diciembre del 2013, se enviaron al Centro de Investigación Carlos J. Finlay, 86 cepas aisladas a partir de hemocultivos. Dichas cepas fueron sub-cultivadas en medio EMJH, con albúmina bovina sérica, y polisorbato 80 (Tween 80). Al lograr las características culturales necesarias para la realización de la MAT, se procedió a la selección de 34 cepas correspondientes a los serogrupos y serovares, encontrados durante su identificación. Para la clasificación en serogrupos se emplearon, primeramente, antisueros policlonales de referencia, y para la clasificación hasta serovar se utilizó un panel de monoclonales, conformado por los siguientes: F152C8 (Canicola); F70C24 (Copenhageni); F46C9 (Mozdok) y F74C7 (Ballum).
Conformación del cepario local a partir de las cepas identificadas
Para la conformación del cepario local, las cepas por emplear en la MAT, fueron utilizadas con 7 días de crecimiento en la etapa logarítmica, con una concentración celular de 2 x 108 células/ml, libre de agregados, teniendo en cuenta aquellas cepas que obtuvieron una mayor concentración de anticuerpos homólogos.
Se utilizaron 12 cepas de referencia correspondientes a serovares, de igual número de serogrupos, coincidentes con las de mayor circulación en el país, con las que cuenta el Laboratorio Nacional de Leptospira:
| CEPA | SEROGRUPO | SEROVAR |
| RGA | Icterohaemorrhagiae | Icterohaemorrhagiae |
| H. Utrecht IV | Canicola | Canicola |
| Mus 127 | Ballum | Ballum |
| Ballico | Australis | Australis |
| Butembo | Autumnales | Autumnales |
| Pomona | Pomona | Pomona |
| Worsfold | Hebdomadis | Wolffi |
| Moskva V | Grippotyphosa | Grippotyphosa |
| Swart | Bataviae | Bataviae |
| Parepelicin | Tarassovi | Tarassovi |
| Salinem | Pyrogenes | Pyrogenes |
| Patoc I | Semaranga | Patoc |
Realización de la técnica de microaglutinación, utilizando como antígenos vivos las cepas locales identificadas y las de referencia.
La MAT consistió en enfrentar cada suero en diluciones al doble, con medio Buffer Fosfato Salino (PBS) y pH 7,2-7,4 desde 1/100 hasta 1/400, a cada una de las cepas de referencia. A las cepas del cepario local paralelamente se incubaron a 37 ºC, por una hora, y se les realizó una lectura por microscopía de campo oscuro, con microscopio Olympus y aumento de 150 X (utilizando oculares de 15 X y objetivo de 10 X). Se consideró como reactiva hasta la última dilución en que aparecieron el 50% o más de leptospiras aglutinadas o muertas. A los sueros que resultaron reactores hasta 1/400, se le realizaron diluciones al doble, hasta 1/25600, para determinar el punto final de reactividad.
RESULTADOS
En la Tabla I se muestran los resultados de la identificación en serogrupos con los antisueros poli-clonales, y en serovares con los anticuerpos monoclonales. Mostró mayor correspondencia el serogrupo Ballum con el 38,24%, al reaccionar, 13 de los aislamientos, dentro del mismo serogrupo. Entre estos se destacan los serovares Ballum Ballum, que reaccionaron en el 23,52% de las cepas; y los Ballum Arborea reaccionaron con 3 cepas, para el 8,82%. Dos aislamientos reaccionaron, dentro del serogrupo, pero no lo hicieron con los anticuerpos monoclonales para serovar. Le siguió en orden, el serogrupo Canicola, con 8 cepas (23,52%), el 14,70% perteneció al serovar Canicola Canicola, y en otros 3 sólo pudo determinarse el serogrupo. De igual forma se comportó la identificación al serogrupoPomona, en el que reaccionaron 8 cepas con los sueros policlonales, el 23,52%. De ellos, 4 corresponden al serovar Pomona Pomona, y 3 a Pomona Mozdok, para el 8,82% y 11,76%, respectivamente.
En la clasificación, 4 cepas (11,76%) se identificaron como pertenecientes al serogrupo Hebdomadis; específicamente al serovar Hebdomadis Wolffi. Mostraron una correspondencia de 3 (8,82%), y una no reaccionó con los anticuerpos monoclonales.
Se encontró una cepa correspondiente al serogrupo Icterohaemorrhagiae serovar Copenhageni.
Tabla I. Distribución por serogrupos y serovares de las cepas identificadas
| Serogrupo | n | % | Serovar | n | % |
| Ballum | 13 | 38,24 | Ballum | 8 | 23,52 |
|
|
|
| Arborea | 3 | 8,82 |
|
|
|
| sp | 2 | 5,88 |
| Canicola | 8 | 23,52 | Canicola | 5 | 14,70 |
|
|
|
| Sp | 3 | 8,82 |
| Pomona | 8 | 23,52 | Pomona | 4 | 11,76 |
|
|
|
| Mozdok | 3 | 8,82 |
|
|
|
| Sp | 1 | 2,94 |
| Hebdomadis | 4 | 11,76 | Wolffi | 3 | 8,82 |
|
|
|
| Sp | 1 | 2,94 |
| Icterohaemorrhagiae | 1 | 2,94 | Copenhageni | 1 | 2,94 |
| Total | 34 | 100 |
| 34 | 100 |
Fuente: Informe enviado del Centro de Investigaciones Carlos J. Finlay
En la Tabla II se observa la relación de cepas identificadas, a partir de muestras de hemocultivos enviadas al Instituto Finlay, para seleccionar las representantes para la prueba de MAT. Con este objetivo se realizó la evaluación de 34 cepas, las que clasificaron atendiendo a una concentración de leptospiras de 2 x 108 celulas/mL, grado de pureza adecuado, ausencia de auto-aglutinaciones para uso como antígenos vivos en la prueba de MAT.
Se realizó la identificación de cepas aisladas de la región de la forma siguiente: 25002 clasificada como serovar Ballum Ballum, 76403 perteneciente al serovar Canicola Canicola, 83701 fue identificada como serovar Pomona Pomona, y las cepas 701 y 26703 se ubicaron dentro de los serovares Icterohaemorrhagiae Copenhageni y Hebdomadis Wolffi, respectivamente.
Tabla II. Relación de cepas por analizar para seleccionar representantes en la microaglutinación
| Cepas identificadas | Concentración | Pureza | Cepas identificadas | Concentración | Pureza | Cepas identificadas | Concentración | Pureza |
| 83701 P. Pomona | +++ | - | 60401 Canicola sp | *+++ | 1/k | 41302 B. Ballum | *+++ | - |
| 99401 B. Ballum | *+++ | 1/k | 701 I .Copenhageni | +++ | - | 26703 Hebdomadis Wolffi | +++ | - |
| 109201 B.Ballum | ++ | - | 13602 B. Arborea | +++ | - | 40103 Ballum sp | +++ | - |
| 100601 C. Canicola CCcCACanicola Canicola | ++ | 1/k | 802 B. Ballum | +++ | - | 41403 B. Ballum | *++ | 1/k |
| 63601 C. Canicola | +++ | - | 11102 B. Arborea | *++ | 1/k | 203 P. Mozdok | ++ | 1/k |
| 60401 H. Wollfi | +++ | - | 25002 B, Ballum | +++ | - | 76403 Canicola | +++ | - |
| 71101 Canicola Canicola | +++ | 1/k | 71002 C. Canicola | ++ | - | 81603 P. Pomona | ++ | - |
| 68201 Heb.Wolffi | *+++ | - | 43702 Ballum sp | +++ | 1/k | 84503 Caninola Canicola | +++ | 1/k |
| 42601 B. Ballum | ++ | - | 79702P. Pomona | *+++ | - | 20103 P. Mozdok | ++ | 1/k |
| 58601 B. Arborea | ++ | 1/k | 94202 B. Ballum | +++ | 1/k | 81103 Canicola sp | *+++ | 1/k |
| 62001 P. Pomona | *+++ | - | 77302 C. Canicola | *+++ | - | 67001 P. Mozdok | ++ | - |
+++ 400 a 800 leptospira/campo (2x108 células/mL) ++ 100 a 200 leptospira/campo * Autoaglutinación
1/k Contaminación mínima
Fuente: Registro de Laboratorio Leptospira. Centro Provincial de Higiene, Epidemiología y Microbiología de Holguín, Cuba.
En la Tabla III se observa que cinco cepas locales de leptospiras seleccionadas, para ser empleadas en la prueba de MAT, coinciden con los serovares encontrados con mayor número en los cinco serogrupos obtenidos de la clasificación.
Tabla III. Conformación de las cepas locales identificadas
| Cepas | Serogrupo | Serovar |
| 701 | Icterohaemorrhagiae | Copenhageni |
| 76403 | Canicola | Canicola |
| 25002 | Ballum | Ballum |
| 83701 | Pomona | Pomona |
| 26703 | Hebdomadis | Wolffi |
Fuente: Registro de Laboratorio Leptospira. Centro Provincial de Higiene,
Epidemiología y Microbiología de Holguín, Cuba
La reactividad de las muestras de sueros, cuando se enfrentaron a las cepas locales y a las de referencia a través de la microaglutinación, demostró que en las 60 muestras de sueros analizados con el cepario de referencia, y con las cepas aisladas localmente de forma comparativa, tuvo mayor reactividad con las cepas locales, al reaccionar 28 sueros, 46,66%, mientras que con las cepas de referencia, 22 muestras para un 36,66%.
En el presente trabajo se encontró una concordancia de 86,36% en los resultados serológicos de la MAT, al emplear las cepas de la región con la misma prueba. En las cepas de referencia, la cepa Pomona, tuvo un resultado totalmente concordante en ambos ceparios (100%). El serovar Canicola Canicola mostró concordancia del 83,33%, seguido de la cepa representante del serogrupo Ballum, que reaccionó de forma concordante en el 81,81%, sin concordancia en la representación de Icterohaemorrhagiae y Hebdomadis. En el primer caso, solo reaccionó una muestra con cepario autóctono y bajos títulos de anticuerpos (1/100), resultado que reafirma la detección de bajas concentraciones de anticuerpos, por los aislamientos locales, y frescos empleados en la MAT, a diferencia de las cepas de referencia mantenidas en el laboratorio por largos períodos de tiempo. Con el serovar Hebdomadis Wolffi reaccionaron 4 sueros, solamente con las cepas locales.
Es conocido que este serogrupo muestra con frecuencia reacciones cruzadas con Pomona y con las muestras de sueros, tomadas en etapas tempranas de la leptospirosis. Diversos serovares tienen los comportamientos serológicos paradójicos, lo que conlleva incluso a la ocurrencia de reacciones frente a distintos tipos, aún sin que estos constituyan el serovar infectante, el que prevalece en una segunda muestra serológica.
Tabla IV. Porcentaje de concordancia para microaglutinación en reacciones homólogas
con cepas locales frente a las de referencia
| Cepas representantes | Referencia | Referencia y locales | % de concordancia |
| Icterohaemorrhagiae | 0 | 0 | 0 |
| Canicola | 6 | 5 | 83,33 |
| Ballum | 11 | 9 | 81, 81 |
| Pomona | 5 | 5 | 100 |
| Hebdomadis | 0 | 0 | 0 |
| Total | 22 | 19 | 86,36 |
Fuente: Registro de Laboratorio Leptospira. Centro Provincial de Higiene,
Epidemiología y Microbiología de Holguín, Cuba
En la Tabla V se muestra el comportamiento de los títulos de anticuerpos en las muestras de suero, cuando enfrentamos las cepas de referencia y las locales, por medio de la microaglutinación. Al comparar los resultados de la MAT con cepas locales y las de referencia, en cuanto a la aparición de mayores títulos de anticuerpos obtenidos, frente a los sueros por cada cepa representante, se observa que, el 35,70% reacciona en un rango de diluciones entre 1/1600 y 1/12800 con las cepas locales al reaccionar 10 sueros, mientras que sólo el 18,17% de los sueros lo hace con las cepas de referencia. Esto demuestra una mayor afinidad en cuanto a los anticuerpos producidos por el sistema inmune de los pacientes, frente a las cepas nativas.
Tabla V. Comportamiento de los títulos de anticuerpos en las muestras de suero frente
a las cepas de referencia y locales por microaglutinación
| DILUCIONES DEL SUERO | ||||||||
| Cepas | 1/100 – 1/800 | 1/1600 – 1/12 800 | ||||||
| Cepas de referencia | Cepas locales | Cepas de referencia | Cepas locales | |||||
| React. | *% | React. | **% | React. | *% | React. | **% | |
| B. Ballum | 10 | 45,45 | 6 | 21, 42 | 2 | 9, 09 | 6 | 21, 42 |
| C. Canicola | 5 | 22, 72 | 5 | 17, 85 | 1 | 4, 54 | 1 | 3, 57 |
| P. Pomona | 3 | 13, 63 | 3 | 10, 71 | 1 | 4, 54 | 1 | 3, 57 |
| Hebdomadis Wolffi | 0 | 0 | 3 | 10, 71 | 0 | 0 | 1 | 3, 57 |
| I. Copenhageni | 0 | 0 | 1 | 3, 57 | 0 | 0 | 1 | 3, 57 |
| Total | 18 | 81, 80 | 18 | 64, 26 | 4 | 18, 17 | 10 | 35, 70 |
*%: Por ciento en base a 22 sueros reactores con cepario de referencia
**%: Por ciento en base a 28 sueros reactores con cepario autóctono
Fuente: Registro de Laboratorio Leptospira. Centro Provincial de Higiene,
Epidemiología y Microbiología de Holguín, Cuba
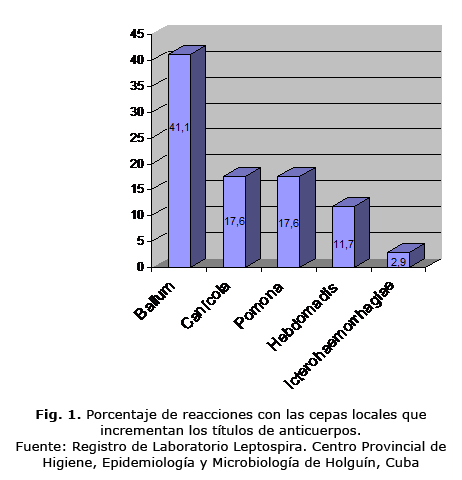
En total se incrementaron los títulos de anticuerpos en el 91,1% de los sueros, comportamiento esperado según la literatura para el uso de MAT con aislamientos locales. Además, 3 sueros bajaron sus títulos, con las cepas en estudio para el serogrupo Ballum (8,8%), una con Canicola, otra con Pomona y una permanece igual (Fig. 1).
La reducción del número de reacciones cruzadas de 70, con las cepas de referencia a 18, con las locales, representa un promedio de reacciones cruzadas por sueros reactores de 3,51, con empleo de la MAT a 1,82, con las cepas de referencia y las cepas locales, lo que significa el 51,1% de reducción.
DISCUSIÓN
La prueba de MAT es, generalmente aceptada, como la prueba de referencia o regla de oro para la demostración de anticuerpos anti-leptospirales y la validación de otras pruebas. Su uso requiere de una batería de cepas, representativas de los distintos serovares, obtenidas de centros de referencias internacionales, que circulan con más frecuencia en la región. Generalmente, se emplean 12 cepas o más, en la batería de antígenos.
Distintos serovares de este microorganismo comparten antígenos comunes o principales. Ellos permiten establecer patrones con fines prácticos, y unirlos en serogrupos. Esto garantiza que las reacciones de aglutinación se verifiquen según la afinidad que presentan, al utilizar cepas como serovares, representantes del serogrupo. 7 También otros investigadores 8, 9 refieren que, para el diagnóstico serológico mediante la MAT, es aconsejable el uso de aislamientos locales antigénicamente autentificados.
Otros trabajos 10 en la India, coinciden en afirmar que los aislamientos locales de identidad conocida, sean incluidos en la batería de cepas de la micro-aglutinación, ya que está demostrado que su práctica, incrementa tanto la sensibilidad como la especificidad de la técnica.
Reportes realizados en el país concuerdan con la aparición de estos serogrupos como posibles cepas circulantes, fundamentalmente en la región norte-oriental, donde se han realizado investigaciones de este microorganismo. 7 Diversos autores recomiendan que la lista de dichos antígenos debe ser modificada, de acuerdo con la experiencia local y las necesidades, al sustituir las cepas de referencia por los aislamientos locales, una vez que hayan sido tipificadas debidamente, lo que proporciona la microaglutinación de una mayor sensibilidad. 9-11
Estos resultados sugieren que los serovares identificados en la provincia de Holguín, a partir de cepas aisladas localmente, con los serovares que circulan con mayor frecuencia en Cuba, ayudarían a la validación de los estudios inmunológicos en la leptospirosis. Estos resultados coinciden con los serogrupos y serovares que circulan con mayor frecuencia, y según recomienda Ospina-Pinto 12, las cepas autóctonas representantes para la MAT deben mantener concentraciones de 400 a 800 leptospiras/campo, sin autoaglutinaciones y libre de contaminación.
Este comportamiento resulta particularmente importante, si se tiene en cuenta que las cepas de referencia se han mantenido durante décadas mediante réplicas periódicas, al realizarles sub-cultivos para mantenerlas con crecimiento y concentraciones adecuadas. Esto evita su contaminación en el medio de cultivo, lo que coincide con Adler 9 y Faine, 5 que afirman que, después de realizar varios sub-cultivos a las cepas en los laboratorios, comienzan a presentar variabilidad en sus reacciones serológicas. Cambios fenotípicos no heredables pueden producirse por la influencia del medio sobre el microorganismo, tanto tiempo como permanezca la cepa sometida a dicha condición y regrese a sus condiciones originales, luego que el medio deja de actuar.
Otras referencias sobre este comportamiento serológico plantean que cepas locales y aislamientos frescos, tienden a reaccionar mejor que cepas de referencias, para el mismo serovar. 12-14
La concordancia entre los principales serogrupos reaccionantes en el estudio realizado, ratifica la posibilidad de emplear cepas locales en sustitución de las cepas de referencias o adicionarlas a estas, para incrementar la sensibilidad de la microaglutinación. Esto demuestra que, independientemente de la mayor reactividad de las cepas locales frente a las de referencia, contra los sueros estudiados en la prueba de MAT, se han encontrado evidencias de un comportamiento serológico similar. De ahí que, deben usarse preferentemente para la MAT, cepas frescas y locales, una vez que estas hayan sido debidamente identificadas. 15-16
Hay que señalar, que en todas las cepas locales empleadas para la microaglutinación, hubo un incremento de los títulos de anticuerpos de forma diferente, según el serogrupo. En estudios serológicos para microaglutinación los resultados discordantes son atribuidos, en ocasiones, a la falta de una estandarización, la subjetividad en la lectura de la aglutinación microscópica, y determinación del punto final de la titulación. 17-18
Las reacciones heterólogas con la MAT se incrementan, cuando las leptospiras permanecen creciendo en medios que contienen proteínas y los aislamientos locales muestran menos reacciones cruzadas, al haber estado sometidas menos tiempo a la influencia del medio. 15 La estructura antigénica, a nivel de las capas superficiales de las leptospiras, pueden ser variadas por la adherencia de las proteínas, lo que determina un incremento marcado de las reacciones cruzadas en las cepas de referencia, si permanecen, por mucho tiempo, en réplicas periódicas con medios de Korthof y EMJH, suplementado con suero de conejo y albúmina bovina respectivamente. 19-21
CONCLUSIONES
Con la identificación de cepas de leptospiras, aisladas localmente para su uso en la microaglutinación, se determinó la circulación en orden de frecuencia de los serovares: Ballum Ballum, Canicola Canicola, Pomona Pomona, Hebdomadis Wolffi, Icterohaemorrhagiae Copenhageni. Así se que logró conformar el cepario local, para su uso en la microaglutinación.
Existió un marcado incremento de los títulos de anticuerpos en los sueros estudiados, con cepas aisladas localmente para la microaglutinación, y se obtuvo una concordancia adecuada de los resultados de las muestras de sueros con las cepas locales y de referencia, lo que ratifica la posibilidad de emplear cepas locales en sustitución de las cepas de referencia, o adicionarlas a este cepario. Se redujeron las reacciones cruzadas a más de la mitad con la microaglutinación, cuando se emplean aislamientos locales.
REFERENCIAS BIBLIOGRÁFICAS
1. Lemus Quintana JM, Cabezas Alfonso HC. Anticuerpos antileptospirales en Intacglobín nueva posibilidad terapéutica para tratar la leptospirosis. Rev Cien Méd. 2015[citado 9 nov 2017]; 19(4): 660-666.Disponible en: http://scieloprueba.sld.cu/scielo.php?script=sci_arttext&pid=S1561-31942015000400010&lng=es
2. Hartskeerl RA, Collares‐Pereira M, Ellis WA. Emergence, control and re‐emerging leptospirosis: dynamics of infection in the changing world. Clin Microbiol Infect. 2011[citado 9 nov 2017]; 17(4): 494-501. Disponible en: http://onlinelibrary.wiley.com/doi/10.1111/j.1469-0691.2011.03474.x/pdf
3. Valle Pimienta T, Lago Díaz Y, Cabrera Prado A, Linares Medina OL, Ramos Ibarra M. Epidemiología de la leptospirosis humana: propuesta de intervención educativa. Rev Cien Méd.2014 [citado 26 oct 2017]; 18(4):555-565.Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1561-31942014000400002&lng=pt
4. Zavala Velazquez J, Pinzón Canterell J, Flores Castillo M. La leptospirosis en Yucatán. Estudio serológico en humanos y animales. Sal Púb México. 2014[citado 26 oct 2017]; 26(3):254-259. Disponible en: http://saludpublica.mx/index.php/spm/article/view/537
5. Faine S. Leptospira and leptospirosis. Estados Unidos: CRC Press Inc; 1994.
6. Martínez P, Ortega D, Salinas K. Evolución de la leptospirosis según el Sistema de Vigilancia Epidemiológica Nacional, Chile 2003-2009. Rev chil Infectol. 2012 [citado 9 nov 2017]; 29(6): 648-654.Disponible en: http://www.scielo.cl/scielo.php?script=sci_arttext&pid=S0716-10182012000700010&lng=es
7. Cabezas Alfonso H, Mederos Blanco A, Fernández Barroso Y, Cabezas Maya L. Ensayo comparativo entre Ag inactivado macroaglutinante y Ags vivos microaglutinantes en el diagnóstico de leptospirosis. Rev Cien Méd. 2017 [citado 10 nov 2017]; 21(1):54-61. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1561-31942017000100010&lng=es
8. Terpstra WJ, Korver H, van Leeuwen J, Klatser PR, Kolk AH. The classification of Sejroe group serovars of Leptospira interrogans with monoclonal antibodies. Zentralbl Bakteriol Mikrobiol Hyg A 1985[citado 10 Nov 2017]; 259(4):498-506. http://www.sciencedirect.com/science/article/pii/S0176672485800821
9. Adler B, Faine S. Species- and genus-specific antigens in Leptospira, revealed by monoclonal antibodies and enzyme immunoassay. Zentralbl Bakteriol Mikrobiol Hyg A. 1983[citado 10 nov 2017]; 255(2-3):317-322. Disponible en: https://www.sciencedirect.com/science/article/pii/S0174303183801723
10. Sambasiva RR, Gupta N, Bhalla P, Agarwal SK. Leptospirosis in India and the rest of the world. Braz J Infect Dis. 2003 [citado 10 nov 2017]; 7(3):178-193. Disponible en: http://www.scielo.br/scielo.php?script=sci_arttext&pid=S1413-86702003000300003&lng=en
11. Ginebra GO. Microorganismo espirilares. En: Llop HA, Valdés Dapena VM, Zuazo SJ. Microbiología y Parasitología Médicas: T.I. La Habana: Ciencias Médicas; 2001: 405-414.
12. Ospina Pinto MC, Hernández Rodríguez P. Utilidad de las herramientas moleculares para la identificación de Leptospira spp. En muestras humanas, animales y ambientales. Rev Cubana Med Trop. 2015 [citado 10 nov 2017]; 67(3). Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0375-07602015000300011&lng=es
13. Faine S. Guidelines for the control of leptospirosis. Melbourne, Australia: World Health Organization; 1982[citado 10 Nov 2017]: Disponible en: http://apps.who.int/iris/bitstream/10665/37219/1/WHO_OFFSET_67_%28p1-p98%29.pdf
14. Cuba Romero Y, Gainza Santos N, Saltaren Cobas A, Naranjo Medina M. Evaluación de la inmunogenicidad y la capacidad protectora homóloga de un candidato vacunal tetravalente de Leptospira, para uso veterinario. VacciMonitor. 2016[citado 9 nov 2017]; 25(3). Disponible en: http://vaccimonitor.finlay.edu.cu/index.php/vaccimonitor/article/view/153
15. Cruz R. Programa Nacional de Prevención y Control de la Leptospirosis. Informe del Programa de Zoonosis, Resultados 2010.La Habana: MINSAP; 2010.
16. Céspedes M, Balda L, González D, Tapia R. Situación de la leptospirosis en el Perú 1994-2004. Rev Peruana Med Exp Sal Pub. 2006[citado 9 nov 2017]; 23(1):56-66.Disponible en: http://www.scielo.org.pe/scielo.php?pid=S1726-46342006000100009&script=sci_arttext
17. Naranjo M, Batista N, Valdés Y, González M, Infante, Sierra G. vax-SPIRAL®, vacuna trivalente (Canicola-Icterohaemorragiae-Pomona). Capacidad protectogénica cruzada frente al reto con L. Ballum de alta patogenicidad en el modelo Hámster Sirio Dorado. Vaccimonitor. 2008[citado 9 nov 2017]; 17(2):14-19.Disponible en: http://scieloprueba.sld.cu/scielo.php?script=sci_arttext&pid=S1025-028X2008000200003&lng=es
18. Molina Tamayo LE, Bermúdez Garcell AJ, Serrano Gámez NB, González Sarduy Á. Comportamiento clínico-epidemiológico de los pacientes con leptospirosis. CCM.2012 [citado 9 nov 2017]; 16(2).Disponible en: http://www.revcocmed.sld.cu/index.php/cocmed/article/view/580
19. Duany Badell LE, Achón García M, Varen Álvarez A, Badell Taquechel E, Morales Pérez N, Bolaños Valladares T. Aspectos clínicos y epidemiológicos de pacientes con leptospirosis en Cienfuegos. 2001 - 2010. Medisur. 2014 [citado 9 nov 2017]; 12(4):601-608. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1727-897X2014000400005&lng=es
20. Verdasquera Corcho D, Pérez Soler K, Norales Mejía AD, Vázquez Pérez A. Estratificación del riesgo de enfermar y morir por leptospirosis humana. Rev Cubana Med Trop. 2013[citado 9 nov 2017]; 65(2):191-201. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0375-07602013000200006&lng=es
21. Cobos Valdes D, de Valle Fernández Y, Labañino Mulet N, Martínez Martínez W, Peña Rojas L, Santos Cancino MC. Elementos generales para analizar sobre las zoonosis. CCM. 2014 [citado 9
Nov 2017]; 18(4): 709-724. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1560-43812014000400011&lng=es
Recibido: 21 de junio de 2017
Aprobado: 10 de noviembre 2017
MSc. Berlis Gómez Leyva. Escuela Superior Politécnica de Chimborazo. Chimborazo. Ecuador
Correo electrónico: berlis1972@gmail.com