Introducción
El antígeno prostático específico (PSA, por sus siglas en inglés) data desde mediados de 1980.
Se considera, desde entonces, el biomarcador más utilizado para medir el riesgo presente y futuro de desarrollar cáncer de próstata, para su detección temprana, su respuesta a tratamientos y la recidiva en todos los estadios de la enfermedad.1
Luego de su descubrimiento, este antígeno se ha generalizado como indicador para el cribado poblacional del cáncer de próstata en las consultas médicas.2La detección precoz del cáncer es el objetivo básico en el cribado, para lo que se establece como criterio que: el tratamiento en estado presintomático disminuye mucho más la morbimortalidad que el tratamiento, en estado sintomático.3
Desde 1990, el PSA quedó establecido como marcador y se utilizó el corte de 4 ng/ml como probabilidad para establecer los pacientes que serían candidatos a biopsia, con el rango de 4-10 ng/ml como zona gris, pero aún en nuestros días los pacientes con cifras mayores de 10 ng/ml se asocian frecuentemente con tumores prostáticos.4
Desarrollo
En 1960, Rubin Flocks, en estudios inmunológicos realizados sobre la próstata, descubrió la presencia del PSA. Otros investigadores, como Hara y Ablin, identificaron en el fluido prostático a este antígeno, pero sin caracterizarlo. La tecnología de aquellos tiempos impedía mayores avances en el perfeccionamiento molecular; aunque paulatinamente, los investigadores Li y Beling, junto a Sensabaugh, se aproximaron al actual PSA.5
En 1979, el profesor T Ming Chu (6 publicó sus resultados y posteriormente recibió la patente por el descubrimiento e identificación del “antígeno purificado de próstata humana”. El PSA se encontraba en otros tejidos y fluidos, por lo que no era específico de la próstata. Le siguieron múltiples estudios (Papsidero y Stamey), los que esparcieron la indicación del PSA.5En 1991, Catalona lo empleó como marcador para cáncer de próstata. LaFood and Drug Administration(FDA), de Estados Unidos, en 1994, lo aprobó para su diagnóstico.
El PSA se sintetiza en el epitelio de la glándula prostática y se encuentra normalmente en el semenm pero no es más que una proteasa de serina, que sirve para separar y licuar el coágulo seminal que se forma tras la eyaculación.7En los varones saludables existe una cantidad mínima de PSA circulando en el suero.
El PSA se ha relacionado con múltiples factores que le pueden provocar modificaciones, como volumen, procesos inflamatorios, actividad física, edad, tratamientos, exploraciones o variaciones en el propio test. La relativa baja especificidad del PSA abre las puertas al estudio de diversas formas moleculares para mejorar su exactitud: densidad del PSA de la zona de transición, PSA libre, PSA complejo, PSA específicos de la edad, velocidad del PSA y tiempo de doblamiento del PSA, Pro-PSA y PSA, en combinación con otros biomarcadores de proteínas.8,9
Sin embargo, el PSA como marcador tumoral presenta los siguientes problemas: la medición del PSA es una prueba poco sensible (la sensibilidad estimada de un corte de PSA de 4,0 ng/ml fue del 21% para detectar cualquier cáncer de próstata) y tiene una capacidad discriminatoria más baja en los hombres con hiperplasia prostática benigna sintomática.
En estos casos, la edad y el mayor volumen prostático pueden explicar niveles altos de PSA, sin que haya presencia de un cáncer de próstata, ya que dadas las circunstancias, los valores normales de PSA pueden alterarse discretamente y crear situaciones de falsa alarma.10)
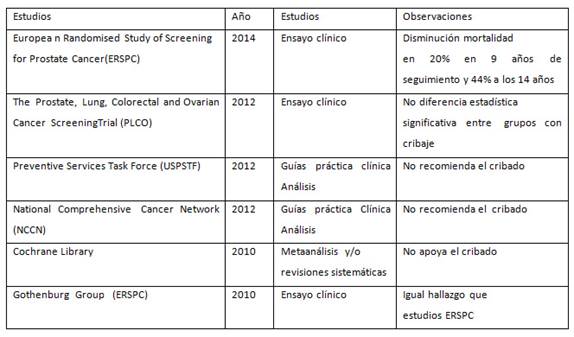
Se han consultado 6 sumarios de evidencia a partir de ensayos clínicos, meta-análisis y/o revisiones sistemáticas y guías de práctica clínica, todos relacionados con el cribado en el cáncer prostático. La consulta de la fuente bibliográfica se hizo a partir de Medline. El período estuvo comprendido desde el año 2012 hasta el 2014. Se confeccionó una tabla para analizar los resultados (Tabla I).
El cáncer de próstata tiene una prevalencia alta, por lo que el PSA es de inestimable valor, a la vez que resulta importante su utilidad clínica y la valoración del costo, que debe ser sostenible. El PSA empleado como método de despistaje sistemático representa un gran desafío para ser validado en este sentido.11,12,13,14
Con el objetivo de aclarar las discrepancias sobre la utilidad del cribado, se han efectuado numerosos estudios, por lo cual hemos escogidos los principales con menos defectos metodológicos en su concepción.15,16,17,18,19
Múltiples factores pueden influir en el resultado de estos grandes estudios. Las diferencias entre estos muestran si existe una mejoría en la mortalidad específica de los pacientes sometidos a control con PSA, sobre aquellos que no han sido controlados. Algunos de los sesgos pueden venir de la propia selección, el adelanto a un diagnóstico o el fenómeno de alargar el diagnóstico previo y, por lo tanto, definir la mejoría.
En muchos de los casos el límite del PSA ha sido otro de los factores cambiantes, menor de 4 mayor o igual a 4, pacientes perdidos, frecuencia de revisiones y técnicas de biopsia. Muchos de estos factores pueden alterar los resultados y provocar una contaminación directa o indirecta; 20si bien han sido desarrollados para asumir un nivel de hasta el 20% de contaminación.21En todo caso, alguno de los datos recogidos del desarrollo en la actualidad del screening delThe Prostate, Lung, Colorectal, and Ovarian (PLCO) Cancer Screening Trial, pueden ser preocupantes, pues el volumen de sobrediagnóstico se estima entre el 29% al 44%, valores ciertamente preocupantes.22
Mientras que la detección de un cáncer de próstata aumenta en 1 por cada 11 a 1 por cada 6 individuos, el riesgo de muerte por cáncer de próstata se ha mantenido alrededor de 1 por cada 34, tras la llegada de la prueba de PSA. Sin embargo, la prostatectomía radical y las terapias de radiación pueden conducir a complicaciones inmediatas: la mortalidad quirúrgica es aproximadamente del 0,5% al 1,1 %. La prostatectomía radical puede disminuir sustancialmente la función sexual hasta del 20% al 70% de los hombres y conducir a problemas urinarios del 15% al 50%.23
La radioterapia ha causado disfunción eréctil del 20% a 45% de los hombres con función eréctil previamente normal; incontinencia urinaria del 2% a 16% de los hombres, previamente continentes; y disfunción intestinal del 6% al 25% de los hombres con intestino normal.24
Actualmente, los ensayos clínicos son insuficientes para resolver esta cuestión, aunque en laEuropean Randomised Study of Screening for Prostate Cancer(ERSPC)15 se encontró inicialmente un beneficio en la supervivencia con el cribado solo en el grupo de varones de 55 a 69 años. Si bien la detección del cáncer de próstata con PSA puede reducir la mortalidad por cáncer de próstata,25)la reducción absoluta del riesgo es muy pequeña.
Sigue existiendo la duda de si los beneficios de la detección precoz no estén compensados por los posibles daños en la calidad de vida, incluyendo los riesgos del sobrediagnóstico y las complicaciones del tratamiento.26 En los momentos actuales, resulta fundamental que el paciente participe en la toma de decisiones,27,28por lo que los hombres candidatos potenciales al cribado deben ser capaces de decidir, previamente informados.
Como consecuencia de los anteriores estudios, algunas sugerencias son: los varones con una esperanza de vida inferior a los 10 años no se beneficiarán de la detección del cáncer. Al comenzar las deliberaciones en hombres con promedio de edad de 50 años (grado 2B), y en hombres con alto riesgo de cáncer de próstata de 40 a 45 años; incluyendo a los hombres de raza negra, hombres con antecedentes familiares de cáncer de próstata (particularmente en parientes menores de 65 años) y aquellos hombres a los que se conoce o probablemente tienen BRCA1 o mutaciones BRCA2 (grado 2C).
Descartar el examen rectal digital (TR) como parte del examen (grado 2C). La interrupción de la detección a los 65 años puede ser apropiada, si el nivel de PSA es inferior a 1,0 ng/ml. Los hombres con un examen rectal digital (TR) anormal -si se realiza- o con un nivel de PSA superior a 7 ng/ml deberían ser sometidos directamente a una biopsia transrectal. Los hombres con un nivel entre 4 ng/mL y 7ng/ ml deben repetir la medición varias semanas más tarde (grado 2C) y los que tengan biopsias negativas extensas deben ser tratados de manera similar a quienes no han sido previamente sometidos al cribado (grado 2C).
En septiembre de 2010, los mismos autores publican en el BMJ la revisión “Screening for prostate cancer: systematic review and meta-analysis of randomised controlled trials”, cuya conclusión fue que no se encontró un impacto significativo de la detección del cáncer de próstata en la mortalidad global o la muerte por cáncer de próstata.29
Sus hallazgos sugieren que, el cribado conduce a un aumento en el diagnóstico de cáncer de próstata en estadio temprano; el que no parece traducirse en un beneficio en la supervivencia global y supervivencia específica para el cáncer de próstata.11
El hallazgo de que un aumento de la tasa de diagnóstico no se traduce en mejores tasas de mortalidad global y específica de la enfermedad; sino que es probablemente multifactorial, y se relaciona en parte con el curso natural prolongado y relativamente lento en muchos pacientes; particularmente en aquellos con cáncer de próstata de un grado bajo.30 Los estudios anteriores tienen puntos comunes con el hecho de que el cribado de cáncer prostático con PSA aumenta el número de hombres diagnosticados con esta patología; pero no reduce la mortalidad específica del cáncer de próstata de forma significativa.
Conclusiones
Aunque la detección del cáncer de próstata con PSA puede reducir su mortalidad, la reducción absoluta del riesgo es muy pequeña. Sigue existiendo la duda de si los beneficios de la detección precoz no están compensados por los posibles daños en la calidad de vida, incluyendo los riesgos del sobrediagnóstico y las complicaciones del tratamiento.
Se sugiere que las discusiones en hombres con alto riesgo de cáncer de próstata comiencen desde los 40 a 45 años; incluyendo a los hombres de raza negra, hombres con antecedentes familiares de cáncer de próstata (particularmente en parientes menores de 65 años), y hombres en los que se conoce o probablemente tienen BRCA1 o mutaciones BRCA2 (g rado 2C).
No se debe recomendar el cribado del cáncer de próstata en varones asintomáticos, a partir de los 50 años. No obstante, en aquellos pacientes que presenten especial interés o pertenezcan a grupos de riesgo, existe una recomendación clara en la participación del paciente en la toma de decisiones compartidas.
Un país con pobres recursos económicos debe ser muy cuidadoso al escoger un screening de cáncer de próstata, para aplicarlo a su población, en grandes proporciones.