Introducción
Las dislipidemias son alteraciones en las concentraciones de lípidos sanguíneos que incluyen hipercolesterolemia, hipertrigliceridemia y lipoproteína de alta densidad-colesterol (HDL-C) bajo, que a menudo aparecen en el síndrome metabólico, acompañando a otros factores de riesgo cardiovascular. 1,2,3
Las dislipidemias son afecciones frecuentes en todo el mundo, Latinoamérica y en Cuba, tanto en niños y adolescentes como jóvenes, adultos mayores y personas con enfermedades sistémicas, como hipertensión arterial, obesidad, diabetes mellitus tipo 2 (DM2) y trastornos autoinmunes. (4,5,6,7,8,9
Las dislipidemias se deben a factores genéticos y sobre todo ambientales y relacionados con los estilos de vida. Se ha comprobado que las modificaciones en las dietas y el incremento de la actividad física, asociado al control de peso corporal o no, favorecen un perfil lipídico beneficioso y reduce el riesgo cardiovascular. 10,11,12,13
El control de las concentraciones de lípidos sanguíneos es una estrategia satisfactoria para la prevención de la enfermedad aterosclerótica. 14 Los ensayos clínicos con fármacos para disminuir el colesterol, con estatinas solas o combinadas con ezetimiba e inhibidores de la paraproteína convertasa subtilisina/kexina tipo 9 (PCSK9), han demostrado que cuanto más bajo es el valor de lipoproteína de baja densidad-colesterol (LDL-C) conseguido con el tratamiento, mayor es el efecto preventivo, 15 por lo que es comprensible el desarrollo de nuevos enfoques dirigidos a los lípidos, aunque quedan por resolver numerosas cuestiones.
Por otra parte, el control de la concentración de LDL-C en el paciente con enfermedad ateroesclerótica es muy escaso, lo que se asocia con un aumento del riesgo de complicaciones cardiovasculares y el riesgo será mayor, cuanto más tarde se logren esos objetivos. 15
La investigación sobre los lípidos se ha incrementado en los últimos tiempos con nuevos agentes terapéuticos. 16 Las nuevas terapias persiguen: reducir el riesgo de enfermedad aterosclerótica con la disminución de partículas aterogénicas, como LDL, lipoproteína (a) y lipoproteína de muy baja densidad (VLDL) y sus remanentes y disminuir el riesgo de pancreatitis en pacientes con hipertrigliceridemias severas.
Aunque el tratamiento estándar reductor de lípidos es satisfactorio en numerosos pacientes, los nuevos fármacos pueden emplearse también en las dislipidemias no tratables con estos medicamentos, como la hipercolesterolemia familiar homocigótica, el síndrome de quilomicronemia o la lipoproteína (a) elevada.
A pesar del significativo progreso en el tratamiento de las dislipidemias, todavía existe un considerable riesgo residual de eventos cardiovasculares.17 Por tanto, las intervenciones farmacológicas se dirigen a diferentes vías moleculares del metabolismo de los lípidos. En esta revisión se detallarán las nuevas terapias modificadoras de lípidos más prometedoras en diferentes fases de estudio.
Desarrollo
Búsqueda de información
Se emplearon los descriptores dyslipidemia and treatment en US National Library of Medicine National Institutes of Health (https://www.ncbi.nlm.nih.gov/pubmed) y se encontraron de los últimos 5 años 11 858 artículos y en PubMed Central (https://www.ncbi.nlm.nih.gov/pmc), 69 978 artículos publicados.
En Scientific Electronic Library Online SciELO (https://scielo.org/es), con los mismos descriptores en español, se localizaron 77 artículos a texto completo.
En Clinical Key (https://www.elsevier.com/es), con el término “tratamiento de dislipidemia”, se situaron 259 artículos en revistas. Con ese término en inglés (dislipidemia treatment) se hallaron 362 trabajos en revistas.
Inhibidores de PCSK9
Una vez secretada la PCSK9 se une con el receptor de LDL, lo que permite la degradación del receptor y como resultado se reducen los receptores de LDL, se incrementan las concentraciones sanguíneas de LDL-C y se produce hipercolesterolemia. 18,19
Se encuentran en el mercado dos anticuerpos monoclonales humanos contra PCSK9: alirocumab y evolocumab. Ambos se usan en monoterapia o combinados con estatinas o ezetimiba. 19El desarrollo del bococizumab se detuvo porque los anticuerpos contra el medicamento limitaban su eficacia como inhibidor. 14
Estos medicamentos muestran una consistente reducción de LDL y se han probado sus beneficios en diversos ensayos clínicos (evolocumab) o se están probando en un ensayo (alirocumab). 20 El LY3015014, anticuerpo monoclonal de larga duración, aplicado cada 4-8 semanas reduce las concentraciones de LDL-C comparables al efecto de los otros inhibidores PCSK9 aprobados. 14
El inclisiran (ALN-PCS) es un ARN de interferencia de acción prolongada que actúa sobre ARN m de PCSK9 para reducir las concentraciones de LDL-C. 19 Inclisiran, en un ensayo clínico en fase 1, redujo el LDL-C hasta el 75%. Los descensos en las concentraciones de PCSK9 y LDL-C se mantuvieron por 6 meses sin efectos adversos graves.14 Un ensayo multicéntrico ORION 1, en fase 2, también obtuvo buenos resultados. 17,19
Es indudable que el inclisiran es un prometedor agente para reducir el riesgo cardiovascular residual en pacientes con elevado LDL-C y la ventaja de que se administra una vez cada 3-8 meses es más satisfactorio para los pacientes.
Los candidatos a inhibidores de la PCSK9 son pacientes con hipercolesterolemia familiar, en tratamiento con las estatinas a dosis máximas que no alcanzan las metas o no toleran el tratamiento con las estatinas por sus efectos adversos. 18
También se exploran otros enfoques, como la alteración permanente de PCSK9 con la edición del genoma o la vacunación anti-PCSK9. 14 En esta década, la nueva tecnología de edición de genes CRISPR-Cas9 permite modificar, con facilidad y precisión, la secuencia del ADN en el genoma (edición del genoma) de cualquier célula eucariota. 21 Con este sistema, la pérdida de función del gen PCSK9 en hígados de ratones disminuyó el 40% el colesterol sérico. Una amplia explicación de la edición genómica aparece en Zhang et al. 22
Inhibidores de la proteína transferidora de ésteres de colesterol
Los inhibidores de la proteína transferidora de ésteres de colesterol (CETP) se han probado en ensayos clínicos. Al inicio, estos inhibidores se desarrollaron para incrementar el HDL-C y luego, cuando los estudios genéticos indicaron que la elevación de HDL-C por sí sola no traía los beneficios esperados, se focalizaron en su papel reductor de LDL-C.14
Sin embargo, fallaron el torcetrapib (efectos indeseables), dalcetrapib (no reduce LDL-C) y evacetrapib (futilidad), cuyos ensayos clínicos terminaron prematuramente. 23
Los resultados del ensayo REVEAL (Randomized Evaluation of the Effects of Anacetrapib Through Lipid Modification) en más de 30 000 pacientes y un seguimiento medio de 4 años demostró que el anacetrapib disminuye apoB y el colesterol no unido a HDL (no HDL-C), con una reducción del riesgo (-9%), aunque este medicamento todavía no está disponible y su uso clínico está limitado por su corta vida media. 24 Los estudios en ratones muestran que persiste en el tejido adiposo hasta 35 semanas después de su administración. 23
Proteínas semejantes a angiopoyetina
La proteína semejante a angiopoyetina 3 (ANGPTL3) y la proteína semejante a angiopoyetina 4 (ANGPTL4) forman una familia de proteínas secretoras estructuralmente similares a las angiopoyetinas (regulan la angiogénesis). Ambos factores desempeñan un papel importante en el metabolismo de los lípidos.
La deficiencia genética de ANGPTL3 protege contra la aterosclerosis. 14 Estos pacientes tienen bajas concentraciones de triglicéridos y LDL-C. Aunque el efecto sobre los triglicéridos se explica por el papel de ANGPTL3 sobre el metabolismo de la lipoproteína lipasa, no está claro su rol sobre LDL-C.
Un ensayo en fase 2 en personas con hipertrigliceridemia mostró reducciones de triglicéridos y otras fracciones lipídicas con la inhibición de ANGPTL3 y el anticuerpo contra ANGPTL3 evinacumab, resultado similar a la reducción lipídica en personas con mutaciones de ANGPTL3 y pérdida de función. Este inhibidor específico de ANGPTL3 reduce los triglicéridos, no HDL-C y LDL-C en voluntarios sanos y pacientes con hipercolesterolemia familiar homocigótica. 25
Otro enfoque investigado es la inhibición de la síntesis de ANGPTL3 con oligonucleótidos sin sentido, que reducen las lipoproteínas aterogénicas en humanos y ratones y en animales disminuyen la aterosclerosis. 14
La ANGPTL4 regula la actividad de lipoproteína lipasa de forma análoga a ANGPTL3, por un mecanismo no bien definido. 26 Además, interviene en otras condiciones, como la diferenciación celular, inflamación y carcinogénesis y no está claro si pudiera ser una diana medicamentosa.
La ANGPTL4 genéticamente atenuada se asocia a favorables perfiles glicémicos y lipídicos y reducción de la enfermedad cardiovascular. 26 Los roedores con anticuerpo anti-ANGPTL4 desarrollan adenitis mesentérica e incrementan la grasa corporal.
Pemafibrato
Los receptores activados por el proliferador de peroxisoma (PPARs) son sensores moleculares que regulan el metabolismo de lípidos. 17
Los fibratos se usan para tratar la dislipidemia, en particular la hipertrigliceridemia y HDL-C bajo; sin embargo, los fibratos convencionales tienen una baja selectividad para PPARα (alfa) y causan efectos adversos, como alteraciones hepáticas e incremento de creatinina sérica. 27 En ensayos clínicos a gran escala muestran resultados negativos en la prevención de las enfermedades cardiovasculares.
Pemafribrato (K-877) es un modulador selectivo de PPARα que muestra mayor actividad y selectividad por PPARα que los agonistas PPARα previos (fibratos), menos interacciones medicamentosas y puede emplearse en pacientes con insuficiencia renal, por su excreción biliar.27
Pemafibrato tiene importantes efectos reductores de triglicéridos en monoterapia o combinado con estatinas sin incremento de los efectos adversos. Sin embargo, a pesar de sus efectos y su buena tolerancia, deberá mostrar sus beneficios clínicos en ensayos.
Un gran ensayo PROMINENT (Pemafibrate to Reduce Cardiovascular OutcoMes by Reducing Triglycerides IN patiENts With diabeTes) con pemafibrato está en progreso en unos 10 000 pacientes con DM2 e hipertrigliceridemia. 26,27
Inhibidor de acetil-CoA carboxilasa
Gemcabene es una pequeña molécula oral que en ratas incrementa el HDL-C, aparentemente por reducción de síntesis e incremento de la eliminación de lipoproteínas ricas en triglicéridos. 16
Se desarrollan ensayos clínicos en pacientes con hipercolesterolemia, hipercolesterolemia familiar homocigótica e hipertrigliceridemia severa. 14 Pequeños ensayos clínicos han demostrado que gemcabene reduce LDL-C, apoB y triglicéridos.
Un ensayo clínico fase 2 en hombres y mujeres posmenopáusicas encontró que gemcabene con estatinas produjo reducciones de LDL-C y de la proteína C reactiva, comparado con el placebo. 28
Se requieren nuevos ensayos para evaluar si este medicamento se puede usar en las formas más frecuentes de dislipidemia.
ETC-1002
El ETC-1002 o ácido bempedoico inhibe la ATP citrato liasa y reduce la síntesis de colesterol y ácidos grasos por inhibición de la síntesis de acetil-CoA. 16,19 La activación de la proteína quinasa, dependiente de AMP, inhibe por fosforilación a la HMG CoA reductasa y mejora el perfil glucémico. 17 Primero se probó en pacientes diabéticos, con intolerancia a las estatinas y tolerantes a estatinas. En monoterapia, ETC-1002 reduce el LDL-C en 30% y combinado con ezitimibe hasta el 50%.
En un ensayo fase 2A, ETC-1002, se mostró seguro y bien tolerado en la reducción significativa de LDL-C hasta 27% en pacientes con hipercolesterolemia.17 En otro ensayo fase 2A redujo el LDL-C y la proteína C reactiva en pacientes con hipercolesterolemia y DM2, sin afectar el control glucémico. Además, fue efectivo en la reducción de LDL-C en pacientes intolerantes a estatinas o tratados con estatinas o ezetimiba.
Los resultados del ensayo fase 3 (CLEAR Wisdom Trial) se presentaron en las sesiones de American Collage of Cardiology 2019 con efectos similares a los anteriores. 17
Los estudios en animales indican que ETC-1002 reduce la aterosclerosis, 14 por lo que se necesitan estudios de seguimiento para evaluar con precisión el papel del ácido bempedoico en la disminución del riesgo cardiovascular.
Inhibidores de diacilglicerol aciltransferasa
Las diacilglicerol aciltransferasas (DGAT) intervienen en la síntesis de triglicéridos y, por tanto, en la formación de lipoproteínas ricas en triglicéridos. La inhibición de estas enzimas disminuye las concentraciones plasmáticas de triglicéridos.
Pradigastat y AZD7687 son inhibidores orales de la DGAT1 (tipo 1), que interviene en la absorción de grasa y en la síntesis de triglicéridos en el intestino.26 La DGAT1 no es una diana validada genéticamente para la hipertrigliceridemia severa y el riesgo cardiovascular. En 6 pacientes con hipercolesterolemia familiar el pradigastat redujo los triglicéridos en ayunas el 70% y en pacientes obesos con moderada dislipidemia mejoró el perfil lipídico. La reducción de grasa y de la dosis mitiga las diarreas y náuseas, pero son frecuentes los efectos adversos.
Estos resultados contrastan con estudios previos con inhibidores de DGAT1 (AZD7687) que provocaban considerables efectos adversos gastrointestinales. 26 También se explora la DGAT2 (tipo 2) con oligonucleótidos sin sentido.
CSL112
El CSL112 es una apo A1 humana reconstituida en las lipoproteínas. 14 Su infusión (apo A1) favorece teóricamente el eflujo de colesterol llevando a estabilidad y regresión de la placa aterosclerótica. 16 Se ha evaluado en voluntarios sanos y en pacientes después de infarto miocárdico agudo.
CSL-112 en ensayo fase 2A en pacientes con enfermedad aterosclerótica estable se mostró segura y bien tolerada. 17
Inhibidores de apo CIII
Apo C-III, sintetizada en hígado y en menor cantidad en intestino, se secreta a la circulación con las HDL y lipoproteínas ricas en triglicéridos (quilomicrones, VLDL y lipoproteína de densidad intermedia-IDL). 26,29 Se demostró inicialmente que su sobreexpresión en ratones provocaba hipertrigliceridemia, mientras su disminución en plasma reducía los triglicéridos.
La apo C-III es un inhibidor de la lipoproteína lipasa, 29 con funciones adicionales en el metabolismo de lipoproteínas ricas en triglicéridos, por lo que su inhibición disminuye los triglicéridos hasta en pacientes con deficiencia de lipoproteína lipasa. Los inhibidores de apo C-III se desarrollan como medicamentos para la hipertrigliceridemia.
El oligonucleótido sin sentido de apo C-III, volanesorsen, muestra reducciones de triglicéridos en pacientes diabéticos con dislipidemia e hipertrigliceridemia severa. También beneficia a los pacientes diabéticos con sensibilidad a la insulina y se asocia a reacciones en el sitio de inyección y trombocitopenia. 26
En un ensayo fase 2, el volanesorsen en monoterapia presentó significativas reducciones de apo C-III, triglicéridos y VLDL-C e incremento de HDL-C, con un buen perfil de seguridad. 30 En ambos estudios combinados, COMPASS y APPROACH, se produjeron menos casos de pancreatitis. 26
La US Food and Drug Administration (FDA) no aprobó el volanesorsen para el síndrome de quilomicronemia familiar, mientras la European Medicines Agency la autoriza con recomendaciones. 26
IONIS-APO(a)Rx
El gen LPA se expresa en el hígado y codifica apo(a). 29 Cuando se une covalentemente a apo B100 (principal proteína de LDL) forma una partícula semejante a LDL, nombrada lipoproteína (a). Aunque los nuevos inhibidores de PCSK9 y de CETP también disminuyen las concentraciones de lipoproteína (a), no existen medicamentos específicos que reduzcan las concentraciones plasmáticas de esta lipoproteína, a pesar de su estrecho vínculo con la aterosclerosis.
Se están evaluando los oligonucleótidos sin sentido de apo (a), por su efecto en la reducción de la síntesis de apo (a) y de lipoproteína (a). 14 En pacientes con lipoproteína (a), normal o elevada, reduce las concentraciones hasta 50%. 14 IONIS-APO(a)Rx se está evaluando en ensayos fase 3.
IONIS-APO(a)Rx, evaluado en ratones transgénicos y ensayos fase 1, reduce la lipoproteína (a).31En ensayo fase 1 en voluntarios sanos disminuyó la lipoproteína (a) de manera dosis dependiente y la reacción adversa más frecuente es infección en el sitio de inyección. Otros ensayos confirmaron los resultados positivos en cuanto a eficacia y seguridad.
ASGR1
El gen ASGR1 codifica la subunidad mayor de los receptores de asialoglicoproteínas (ASGPR). 32 Estos receptores son proteínas transmembranales tipo II que desempeñan un papel crítico en la homeostasis de glicoproteínas séricas, al mediar la endocitosis y degradación lisosomal de estas proteínas. Sin embargo, los ligandos endógenos del receptor y su función no se han determinado. 33
Variantes recientes del ASGR1 se asocian con riesgo reducido de enfermedad de las arterias coronarias en pacientes con bajas concentraciones de no HDL-C, de LDL-C y de triglicéridos.14 El mecanismo de estos cambios no se conoce. Además, las variantes ASGR1 parecen presentar un efecto mayor sobre la aterosclerosis que lo predicho por sus efectos sobre los lípidos, lo que indica que otros mecanismos están involucrados.
Teóricamente, ASGR1 representa una interesante diana para la modulación del metabolismo de lípidos y la prevención de la aterosclerosis.
Lomitapida
Es una pequeña molécula aprobada (FDA, European Medicines Agency y otras agencias reguladoras) para la hipercolesterolemia familiar homocigótica que inhibe la proteína microsomal de transferencia de triglicéridos (MTP).16 La MTP actúa en el ensamblaje de lipoproteínas con apo B, como los quilomicrones, VLDL y LDL.34 Aunque los ensayos clínicos en fases iniciales con lomitapida mostraron una alta prevalencia de trastornos gastrointestinales, hígado graso y elevación de transaminasas, se observó una reducción del riesgo cardiovascular y una mejoría de la calidad de vida. 16
Los ensayos fase 2 y 3 han demostrado la capacidad de la lomitapida, conjuntamente con terapias reductoras estándar de lípidos, para reducir LDL-C el 45-50% de los valores basales durante 26 semanas de terapia y el mantenimiento de las reducciones durante 78-128 semanas.35
Para pacientes con mutaciones hereditarias que afectan negativamente el metabolismo de LDL y no responden a otras terapias, la lomitapida ofrece una terapia efectiva. El monitoreo de lípidos en respuesta al fármaco y sus potenciales efectos sobre la función hepática pueden optimizar su empleo en pacientes con hipercolesterolemia familiar homocigótica. 34
Aunque la lomitapida no se ha aprobado para su uso en edades pediátricas, una serie de casos (multicéntrico) demostró efectividad en pacientes con hipercolesterolemia familiar homocigótica, con un perfil clínico similar al de los pacientes adultos. 36
Ácidos grasos omega- 3
STRENGTH (Statin Residual Risk Reduction with EpaNova in High Cardiovascular Risk Patients with Hypertriglyceridaemia) es un ensayo en fase 3 de > 13 000 pacientes sobre el desenlace cardiovascular con 4 g diarios de ácidos omega 3 y reducción significativa de triglicéridos. 26
Recientes ensayos clínicos han demostrado los beneficios de los ácidos grasos omega-3 sobre el riesgo cardiovascular: 37 VITAL (Vitamin D and Omega-3 Trial), ASCEND (A Study of Cardiovascular Events in Diabetes) y REDUCE-IT (the Reduction of Cardiovascular Events with Icosapent Ethyl-Intervention Trial). Los ácidos grasos omega-3 reducen el riesgo cardiovascular, principalmente por la disminución de triglicéridos y lipoproteínas aterogénicas.
Sin embargo, un metanálisis encontró una asociación significativa de los omega-3 con concentraciones reducidas de apo A-II, triglicéridos y HDL y mejoría de la glucemia en ayunas en pacientes diabéticos; además, se relaciona con incrementos de LDL-C en pacientes con enfermedad cardiovascular.38 Otros biomarcadores pueden experimentar reducciones beneficiosas en pacientes diabéticos y cardiópatas. Estas discrepancias deberán investigarse en el futuro.
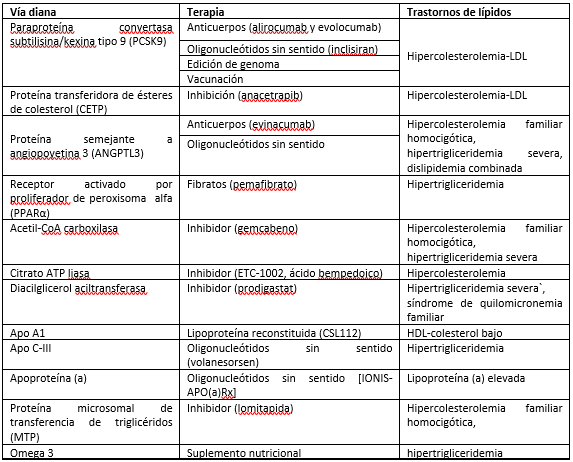
En la (tabla I) se resumen las nuevas terapias reductoras de lípidos para el tratamiento de las dislipidemias.
Conclusiones
Las enfermedades cardiovasculares ateroscleróticas son la causa mundial más importante de mortalidad prematura y pérdida de años de vida por discapacidad. Las causas de estas condiciones son multifactoriales y algunos factores de riesgo son modificables, como es la dislipidemia aterogénica.
Se necesitan nuevas terapias lipídicas para las dislipidemias severas refractarias a los tratamientos convencionales, para pacientes que no toleran o con efectos adversos graves a las terapias estándar y para pacientes con riesgo residual de enfermedad cardiovascular, a pesar de una respuesta aceptable al tratamiento convencional de numerosos pacientes.
Recientes estudios, con nuevos anticuerpos monoclonales, oligonucleótidos sin sentido y pequeñas moléculas que actúan sobre el metabolismo de los lípidos, son prometedores en estos pacientes que no pueden usar la terapéutica tradicional. Sin embargo, estas investigaciones deberán continuarse para valorar la eficacia y la seguridad de estos enfoques a largo plazo.