Introducción
La enfermedad cardiovascular es responsable de elevadas tasas de morbilidad y mortalidad entre personas adultas en el mundo y su principal causa es la aterosclerosis. 1,2
La aterogénesis, es un proceso multifactorial donde están implicados factores genéticos y ambientales, que se desarrolla durante mucho tiempo antes de dar manifestaciones clínicas (prolongado periodo de latencia) y donde intervienen diferentes factores de riesgo, entre los cuales las lipoproteínas y los lípidos juegan un papel esencial. 3,4,5
Las placas de ateromas se desarrollan en las arterias de mediano y gran calibre, lo que causa engrosamiento de la pared arterial con un significativo estrechamiento del lumen arterial y trastornos en la hemodinámica. 6 Por causas desconocidas, las placas ateromatosas pueden romperse cuando son pequeñas y provocar trombosis oclusiva con infarto de miocardio agudo o trombosis cerebral.
Las dislipidemias son afecciones frecuentes, caracterizadas por alteraciones del metabolismo de los lípidos y las lipoproteínas, con repercusión en las concentraciones circulantes de colesterol y triglicéridos (TG). 7,8,9,10
El incremento de los valores de lipoproteínas de baja densidad (LDL) en plasma es el más importante factor de riesgo para el desarrollo de aterosclerosis y la subsiguiente enfermedad cardiovascular. 6 Por otra parte, las lipoproteínas de alta densidad (HDL) tienen un efecto cardioprotector. Los ensayos clínicos con medicamentos reductores de lípidos revelan una reducción de hasta 30% en los principales eventos coronarios, lo que confirma que la hiperlipidemia es el principal factor de riesgo de aterosclerosis.
Esta revisión se enfocará en el papel de los lípidos y las lipoproteínas en la aterosclerosis con énfasis en el papel de las LDL, las HDL, las lipoproteínas ricas en TG (TRL) y sus remanentes en el aumento del colesterol y los TG en sangre. Se conoce menos sobre el rol de la lipoproteína (a) en la aterosclerosis y la enfermedad cardiovascular. Se aclara que existe polémica y debate científico sobre este tema.
Desarrollo
Búsqueda de información
Se emplearon los descriptores atherosclerosis and lipids en US National Library of Medicine y National Institutes of Health (https://www.ncbi.nlm.nih.gov/pubmed) se encontraron de los 8 080 artículos y en PubMed Central (https://www.ncbi.nlm.nih.gov/pmc) 29 755 artículos publicados. Todos de los últimos 5 años.
En Scientific Electronic Library Online SciELO (https://scielo.org/es) con los mismos descriptores en español se localizaron 34 artículos a texto completo.
En Clinical Key (https://www.elsevier.com/es) con el término atherosclerosis se encontraron 13 868 artículos en revistas.
Se realizó un análisis crítico de la bibliografía consultada.
Metabolismo de las lipoproteínas
Los lípidos (fosfolípidos, TG y colesterol), al no ser solubles en el plasma, se unen a proteínas específicas (apoproteínas) para circular en la sangre formando las lipoproteínas. Estas constituyen macromoléculas metabólicamente diferentes, heterogéneas, que contienen lípidos apolares o hidrófobos en su interior (TG y colesterol esterificado), mientras que la superficie externa está constituida por lípidos polares (colesterol no esterificado y fosfolípidos) y apoproteínas. (11,12)
Las diferentes clases de lipoproteínas plasmáticas han sido individualizadas principalmente mediante dos técnicas: la ultracentrifugación por flotación y la electroforesis. Se clasifican en: HDL, LDL, de muy baja densidad (VLDL), de densidad intermedia (IDL), lipoproteína (a) y los quilomicrones. 13
Además de esta clasificación, se han logrado distinguir subclases de fracciones de lipoproteínas. En el grupo de las LDL se han encontrado la LDL1 (beta-1) y LDL2 (beta-2), y partículas de HDL ricas en colesterol (alfa-1, alfa-2, prealfa-1 y prealfa-2), así como partículas HDL pobres en colesterol, prebeta-1 y alfa-3. 14,15
El metabolismo de las lipoproteínas es complejo por el intercambio entre apoproteínas y lípidos entre las diferentes partículas que repercute en su composición y funciones biológicas y por la interrelación que se establece entre los diferentes tejidos como adiposo, hepático y células periféricas a través de las lipoproteínas. 16,17
Los quilomicrones son las lipoproteínas más grandes y menos densas debido a su gran contenido de TG y bajo de apoproteínas; transportan los lípidos dietéticos (principalmente TG) procedentes de la absorción intestinal y son degradados por la lipoproteína lipasa del endotelio vascular hasta remanentes o partículas residuales. Contienen apo B-48. 12
Las VLDL tienen menor contenido de TG y mayor de apoproteínas con respecto a los quilomicrones; transportan los lípidos sintetizados en el hígado (TG endógenos) a diferentes tejidos donde la lipoproteína lipasa hidroliza sus TG y las convierte en IDL o remanentes de VLDL.18
Las IDL son captadas por receptores hepáticos o convertidas en LDL por la acción de la triglicérido lipasa hepática (HTGL, por sus siglas en inglés).
Las LDL procedentes de la degradación intravascular de las VLDL transportan el colesterol a los diferentes tejidos donde es utilizado, previa unión a sus receptores. Las LDL no solamente modifican su contenido de lípidos, van perdiendo sus apolipoproteínas hasta quedar solamente con la apoB-100. En la hipercolesterolemia familiar esencial la falta de receptores de LDL dificulta el catabolismo de las LDL, aumenta su concentración sanguínea y se favorece el proceso de aterosclerosis.
Las lipoproteína (a), rica en ésteres de colesterol y fosfolípidos, se asemeja en su composición a la LDL, pero la diferencia esencial entre ambas radica en que la lipoproteína (a) presenta una apolipoproteína, la apo(a), que está unida a la apo B-100 por un puente disulfuro, y es estructuralmente parecida al plasminógeno, similitud estructural que le confiere la capacidad de unirse con la fibrina y a las proteínas de las membranas celulares, por lo que impide la fibrinólisis.19
La lipoproteína (a) también puede favorecer los depósitos de lípidos y estimular el crecimiento de células musculares lisas, lo cual favorece la aterogénesis, por lo que constituye un factor genético de riesgo para la aterosclerosis. Se cree que sus altas concentraciones son heredables y no responden a los cambios dietéticos; se reportan altos niveles en mujeres, pues al parecer la testosterona masculina ejerce una cierta protección.20,21,22,23)
Los mecanismos del catabolismo de la lipoproteína (a) no están bien determinados; se ha demostrado que se une a receptores de LDL específicos, aunque con menor afinidad. Su depuración plasmática está mediada por la apo(a) y ocurre principalmente en el hígado y en menos medida en los riñones. 19
Las HDL, formadas en el intestino y el hígado, transportan el colesterol desde los tejidos y paredes arteriales hasta el hígado donde se produce su excreción biliar, mecanismo que tiene el organismo para eliminar el colesterol, por lo que se consideran lipoproteínas antiaterogénicas y su aumento en sangre reduce el riesgo de aterosclerosis. 24
Las HDL nativas son complejos de apo A-1 y fosfolípidos que adquieren el colesterol de las células periféricas por interacción con los canales de colesterol como ABCA1 (del inglés, ATP-binding cassette transporter A1) y ABCG1 (del inglés, ATP-binding cassette transporter G1), de acuerdo a su estado de maduración. 24 La lecitina colesterol aciltransferasa (LCAT) esterifica el colesterol, lo que contribuye a la maduración de las HDL. Otras proteínas como la proteína transferidora de ésteres de colesterol (CETP) y la proteína de transferencia de fosfolípidos (PLTP), determinan la composición de las HDL al intercambiar TG y fosfolípidos con otras lipoproteínas.
Además del transporte inverso de colesterol, las HDL también inhiben la oxidación lipídica, restauran la función endotelial, ejercen acciones antiinflamatorias y antiapoptósicas en modelos animales, propiedades que contribuyen considerablemente a los efectos antiaterogénicos de estas partículas. 25)
Papel de las lipoproteínas de baja densidad en aterogénesis
Algunos factores de riesgo como la hipertensión arterial y el hábito de fumar contribuyen a la disfunción endotelial y a la aterosclerosis. 26)
La hipótesis de la retención arterial de colesterol vinculado con la hipercolesterolemia como contribuyente a la aterosclerosis fue propuesta por Nikolai Anitschkow hace 100 años. 1 Brown y Goldstein fueron los primeros en proponer que las LDL debían ser oxidadas para que fuesen internalizadas por los macrófagos para convertirse en células espumosas.
La acumulación de células espumosas en la íntima arterial origina las lesiones primarias y precoces en la progresión aterogénica (estrías grasas). 6 Las células espumosas se denominan por la apariencia espumosa de su citoplasma, casi completamente cargado de inclusiones lipídicas. Por tanto, la retención de LDL por las células espumosas en la pared arterial es el proceso clave en el desarrollo de la placa aterosclerótica.
También, la retención intracelular de LDL se acompaña de acelerada migración y actividad proliferativa de las células musculares lisas, macrófagos, linfocitos, neutrófilos y células dendríticas y el incremento de los componentes de la matriz extracelular por las células subendoteliales. 6
Adicionalmente, está involucrada la respuesta inmune en la hiperlipidemia. La interacción entre las células B y T CD4+ es crucial para una óptima respuesta adaptativa. 27 La respuesta inmune participa en la promoción de la inflamación crónica y la interacción entre estas células aumenta su carácter aterogénico en la aterosclerosis. Los cristales de colesterol probablemente amplifican la cascada inflamatoria, pero no la inician. 26
Las LDL circulantes son la principal fuente de lípidos que se acumulan en las placas ateroscleróticas. 1,28 Sin embargo, no todas las LDL son aterogénicas. En el plasma de los pacientes ateroscleróticos, las partículas de LDL sufren modificaciones enzimáticas y no enzimáticas que determinan su aterogenicidad.
Los monocitos infiltrados en la íntima maduran a macrófagos en respuesta al factor estimulante de colonias de macrófagos (M-CSF) y el factor estimulante de colonias de macrófagos y granulocitos (GM-CSF). 29 Las LDL son modificadas por oxidación (oxLDL), procesamiento enzimático, desacilación y agregación.
Los macrófagos se diferencian en células espumosas después de internalizar las oxLDLs por los receptores barrendera incluyendo SR-A, CD36, LOX-1, SR-PSOX y SR-B1. Sin embargo, las oxLDLs agravan la inflamación en la placa. 29
El desbalance entre la captación y salida de colesterol lleva a la acumulación citoplasmática de colesterol y la aparición de las células espumosas cargadas de lípidos. 26 El colesterol precipita como cristales en las células y provoca la apoptosis o necrosis. La apoptosis y la necrosis secundaria desarrollan un núcleo necrótico dentro de la lesión arterial. Este núcleo, compuesto principalmente de detritus celulares y material lipídico, es altamente trombogénico y está separado de la sangre por una capa fibrosa.
La ruptura de la capa fibrosa inicia una trombosis que eventualmente lleva a eventos agudos como los síndromes coronarios agudos o la enfermedad cerebrovascular. 26,30,31 La ruptura de esta cápsula fibrosa es más probable cuando es delgada o está infiltrada por células espumosas.
Después de las etapas iniciales, las placas progresan a lesiones avanzadas compuestas por goticas de lípidos, células espumosas, macrófagos y linfocitos. 29 Estas células producen una plétora de citoquinas y mediadores con importante papel en la progresión aterosclerótica. La proliferación de las células musculares lisas y la síntesis de colágeno, metaproteinasas de la matriz, fibronectina y elastina también contribuyen al desarrollo de la placa.
Los factores genéticos y epigenéticos parecen jugar un papel en la aterosclerosis, pero todavía quedan muchas preguntas pendientes de respuesta. 32
En la fig. 1 se esquematizan las múltiples modificaciones que sufren las LDL en la aterosclerosis y en la fig. 2 se resumen los principales eventos de la aterosclerosis.
Papel de las HDL
Las HDL desempeñan su papel protector contra la aterosclerosis por distintos mecanismos que pueden agruparse en dos grandes categorías: los relacionados al transporte reverso de colesterol y los que influyen en la protección endotelial.
Transporte reverso de colesterol: el colesterol es transportado al hígado o a los tejidos esteroidogénicos para su utilización, degradación y posterior excreción con las sales biliares. En este complejo proceso intervienen una serie de sistemas enzimáticos y transportadores como es el caso de transportador de proteínas unido al ATP que facilita el paso del colesterol libre desde el interior de las células no hepáticas hasta las partículas de HDL primitivas.
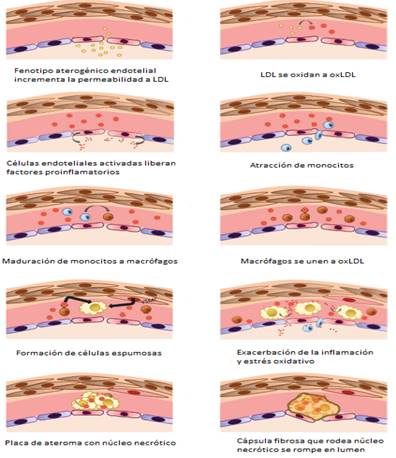
Fig. 2 Etapas en la formación de la placa de ateroma desde la disfunción endotelial hasta la ruptura en el lumen 33
En el interior de la HDL, la enzima LCAT esterifica el colesterol libre. Este colesterol esterificado transforma las partículas de HDL de ovoidales a esféricas. Bajo esta forma, el colesterol es transportado al hígado y otros tejidos esteroidogénicos (glándula adrenal, testículos, ovarios) para su degradación o utilización.
El proceso de captación del colesterol en estos destinos puede ocurrir por tres rutas diferentes:
En la primera, el colesterol esterificado de HDL es transferido a las TRL por la CETP y luego estos remanentes son removidos de la circulación por los receptores en el hígado.
La segunda vía es la captación selectiva de las partículas de HDL por receptores "basureros" clase B tipo I (SR-BI), sin degradación concomitante de la proteína del HDL.
Por último, puede ocurrir la captación de la partícula HDL y degradación de las proteínas que la conforman, como la apo A-1.
Protección endotelial: las HDL y la apo A-1 ejercen una decisiva protección del endotelio, y en consecuencia del proceso aterogénico y sus complicaciones, a través de diversos mecanismos resultantes de sus propiedades antioxidantes, antiinflamatorias y antitrombóticas, puestas en evidencias en estudios experimentales.
Por otro lado, tanto las HDL como la apo A-1 incrementan la resistencia de la célula endotelial contra las LDL oxidadas y previene su efecto tóxico involucrado en la muerte celular. Este mecanismo protector de la oxidación de LDL es importante, ya que una vez que aparezca un rasgo de oxidación en las LDL, se inhibe la actividad plasmática de la LCAT y se deteriora el metabolismo de la HDL y el transporte inverso de colesterol.
El papel antiaterogénico de las HDL pueden conducir a que la placa aterosclerótica vulnerable, que es susceptible de fracturarse o fisurarse y desencadenar un evento vascular, reduzca el contenido de la matriz lipídica y la densidad de los monocitos/macrófagos, haciendo que la placa sea más estable con un menor riesgo de complicaciones. (34,35,36
Un pequeño ensayo encontró que la dieta rica en grasa insaturada incrementa la aparición plasmática de HDL que contiene apo E, una partícula activa en el transporte inverso de colesterol, lo que revela un nuevo mecanismo para la protección cardiovascular de las grasas insaturadas. 37 Otros le dan mayor importancia a las caracteríticas funcionales de las lipoproteínas, sobre todo LDL y HDL, en vez de su cantidad en el plasma. 28
Papel de los triglicéridos en la aterosclerosis
El rol de los TG en la aterosclerosis es controversial y está sujeto a mucho debate científico; sin embargo, hay consenso de que la hipertrigliceridemia juega un papel en la formación de las placas de ateroma. Aunque el mecanismo es complejo y muy interrelacionado por la implicación de múltiples factores, se puede resumir de la siguiente manera.
En los estados de resistencia a la insulina, como se observa durante la obesidad adbominal, se produce un incremento del flujo de ácidos grasos desde la grasa visceral al hígado con dos consecuencias principales: se incrementa la síntesis de TG y se acumula en el órgano (esteatosis) y aumenta la formación de VLDL.
Las VLDL, ricas en TG, producen hipertrigliceridemia por un incremento de la síntesis hepática y una reducción de su degradación por la lipoproteína lipasa, enzima endotelial dependiente de la insulina, una hormona cuya actividad está reducida en los estados de resistencia a la insulina.
La hipertrigliceridemia repercute en el patrón de lipoproteínas, porque se incrementa la actividad de la CETP, que intercambia colesterol esterificado desde las HDL por TG desde las VLDL, lo que enriquece en colesterol a las VLDL y aumenta los TG de las HDL. Esto favorece la formación de partículas remanentes más aterogénicas y que las LDL sean más pequeñas y densas y puedan penetrar con más facilidad en la íntima arterial y sean oxidadas, lo que facilita la formación de las células espumosas y el proceso de aterogénesis.
Los pacientes con resistencia a la insulina tienden a presentar más bajos valores de HDL debido a una baja actividad de lipoproteína lipasa y el enriquecimiento de TG.24 En la hipertriglieridemia, el equilibrio se desplaza hacia el empobrecimiento de colesterol y al aumento de TG.
Esto conlleva a un mayor número de partículas de HDL pequeñas con elevadas tasas catabólicas, lo que origina bajo HDL. Recientes estudios demuestran, contrario a HDL que HDL-TG son marcadores de riesgo cardiovascular. 24
La resistencia a la insulina y la hipertrigliceridemia propician un estado infamatorio de bajo grado crónico que acompaña la aterosclerosis y en estas circunstancias el riesgo cardiovascular es mayor, debido, además, a un estado protrombótico.
La lipemia postprandial, una de las principales caracteríticas de la dislipidemia aterogénica, junto a la hipertrigliceridemia en ayunas, HDL bajo y el incremento de HDL pequeñas y densas, se considera un factor causal de enfermedad aterosclerótica y de todas las causas de mortalidad. 38
Las TRL comprenden los quilomicrones, las VLDL y sus remanentes. 39,40 Se ha demostrado una correlación significativa entre el riesgo de enfermedad cardiovascular y las concentraciones de TG mediante dos probables mecanismos: los remanentes de TRL y las VLDL son capaces de penetrar la íntima arterial, pueden ser internalizados por los macrófagos y convertirlos en células espumosas y durante la lipólisis de las TRL se liberan un número de lípidos inflamatorios que alteran la biología del endotelio.
Aplicación práctica de estos conocimientos
La identificación de biomarcadores de aterosclerosis es crucial para prevenir el desarrollo y las complicaciones de la enfermedad. 33 El más reconocido biomarcador inflamatorio no específico es la proteína C reactiva de alta sensibilidad (CRP). La CRP es una proteína plasmática sintetizada por el hígado y en menor grado por las células endoteliales y del ateroma, liberada en respuesta a estímulos inflamatorios. La CRP es proaterogénica, al actuar en las etapas iniciales de la formación de los ateromas y unirse a oxLDL, activar los monocitos y macrófagos, alterar la vasodilatación y promover la disfunción endotelial.
El descubrimiento del papel de la LDL en el desarrollo de la aterosclerosis ha llevado al diseño e implementación de estrategias efectivas reductoras de lípidos y la disminución de la morbilidad y mortalidad cardiovasculares. 26
Entre los medicamentos empleados para reducir el colesterol de LDL se encuentran las estatinas, fármacos que inhiben la enzima reguladora de la síntesis de colesterol, la HMG COA reductasa, lo que disminuye la disponibilidad de colesterol dentro de las células y aumenta la entrada intracelular de LDL, lo que repercute en las concentraciones sanguíneas de LDL y colesterol.
Aunque el control de la hipercolesterolemia con terapias reductoras de lípidos reduce la inflamación, la elucidación del rol de la inmunidad en la aterosclerosis permite estrategias preventivas efectivas, como el empleo de un antinflamatorio puro, canakinumab, anticuerpo anti IL-1 beta, en la prevención secundaria de síndromes coronarios agudos. 26
Los anticuerpos anti-LDL modificadas también son aterogénicos. 1 Las propiedades moleculares de las LDL modificadas pueden servir como biomarcadores diagnósticos y pronósticos y dianas moleculares para el desarrollo de medicamentos antiateroscleróticos.
Conclusiones
La aterosclerosis es una enfermedad inflamatoria crónica, caracterizada por disfunción endotelial, depósito de lípidos en la íntima, proliferación de las células musculares lisas, apoptosis y necrosis celular e inflamación local y sistémica que involucra contribuciones clave de la inmunidad innata y adaptativa.
El balance entre las respuestas proaterogénica inflamatoria y antiinflamatoria ateroprotectora se modula por una compleja red de interacciones entre los componentes vasculares e inmunes que incluyen monocitos, macrófagos, células dendríticas y células espumosas; estas interacciones modulan la posterior progresión y estabilidad de las lesiones ateroscleróticas.
Aunque el proceso de aterosclerosis es complejo y no bien comprendido por su carácter multifactorial, los lípidos desempeñan un rol importante en su desarrollo, principalmente el colesterol y los TG. Los trastornos en el metabolismo de los lípidos, en especial de las lipoproteínas, provocan dislipidemias que favorecen el proceso aterosclerótico.
El papel de los lípidos y las lipoproteínas en la fisiopatología de la aterosclerosis es de utilidad práctica para el diseño de biomarcadores de diagnóstico y pronóstico de la aterosclerosis en etapas tempranas y para la fabricación de medicamentos que actúan sobre dianas moleculares específicas implicadas en la formación de las placas de ateromas.















