Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Endocrinología
versión On-line ISSN 1561-2953
Rev Cubana Endocrinol v.13 n.3 Ciudad de la Habana sep.-dic. 2002
Instituto Nacional de Endocrinología
Validación de un juego de reactivos (CUALINEN-HCG) para la detección cualitativa de gonadotropina coriónica humana en el embarazo
Lic. Gema E. García Dafonte,1 Lic. Celeste M. Arranz Calzado,2 Lic. Berta Rodríguez Pendás,2 Lic. Isabel Almeida Zaldívar,3 Dr. Roberto M. González Suárez,4 Lic. Remigio Coto Rodeiro,5 Dr. Sergio Santana Porbén6 y Dr. Armando Lozano Guadarrama7
Resumen
Se presentaron los resultados de la estandarización de un juego de reactivos (CUALINEN-HCG) para la detección de la gonadotropina coriónica humana (HCG) en muestras de orina de mujeres embarazadas y de su validación diagnóstica en el nivel primario. CUALINEN-HCG es un microELISA de doble captura, que cuenta con un anticuerpo monoclonal específico para la subunidad b de la hCG (AcM-b hCG-IG1) y de conjugados enzimáticos con el sustrato colorimétrico correspondiente, obtenido y purificado en el Instituto Nacional de Endocrinología. Los resultados de la validación analítica del CUALINEN-HCG mostraron que era capaz de distinguir entre muestras de orinas positivas y negativas con una relación positivo/negativo de 10 veces; se obtuvieron coeficientes de variación del 6 % en estudios de precisión (interensayos e intraensayos) realizados para el control positivo. Se procesaron 91 muestras de orina matutina de mujeres con amenorrea de entre 4 y 16 sem a partir de la última fecha de menstruación. En las que el embarazo fue diagnosticado posteriormente. Se logró la validación en el nivel primario del CUALINEN-HCG con una sensibilidad y especificidad diagnóstica de 85 y 95 %, respectivamente y una exactitud diagnóstica del 90 %. Se recomendó su uso como herramienta auxiliar para el diagnóstico del embarazo en nivel primario a partir de la primera semana de ausencia de la menstruación (5 sem de amenorrea).
DeCS: GONADOTROPINAS CORIONICAS; TEST DE ELISA; ANTICUERPOS MONOCLONALES; ORINA; TECNICAS DE DIAGNOSTICO OBSTETRICO Y GINECOLOGICO; EMBARAZO.
La detección de embarazo en estadios iniciales constituye un problema de los servicios de salud primarios en Cuba, por la carencia de métodos inmunoquímicos que puedan ser utilizados por el médico, como proceder diagnóstico antes de las 6 sem de amenorrea, momento en el cual el ultrasonido y el tacto vagino-abdominal resultan ineficientes. Esto no solo es importante en la atención temprana de la maternidad, sino que, es vital para disminuir la mortalidad y las complicaciones asociadas con embarazos ectópicos.1
La detección de la gonadotropina coriónica humana (hCG) constituye el fundamento de las pruebas inmunoquímicas realizadas en suero y orina para el diagnóstico del embarazo normal o patológico.2 Esta hormona se produce, en condiciones normales, por el tejido trofoblástico de la placenta3 y pertenece a la familia de las gonadotropinas glucoprotéicas, tiene alta homología estructural con la hormona luteotrópica (hLH) con la cual comparte no sólo la subunidad alfa, como el resto de las hormonas glicoproteicas de origen pituitario, sino gran parte de la beta.4 Los inconvenientes analíticos asociados a la similitud estructural de la hCG y LH que ocasionaron en el pasado confusiones entre el diagnóstico de embarazos, picos ovulatorios y amenorreas posmenopáusicas, fueron erradicados con la aplicación, en este campo,5-9 de los anticuerpos monoclonales (AcM) descritos por vez primera por Kohler y otros en 1975.10 El desarrollo tecnológico unido a la presencia de concentraciones elevadas de hCG en orina de embarazadas a partir del primer día de ausencia de la menstruación11 ha favorecido la introducción de técnicas cualitativas para el diagnóstico temprano del embarazo.12,13
Los objetivos de este trabajo son demostrar que el juego de reactivo CUALINEN-HCG es una alternativa diagnóstica simple para la detección de embarazo, que excluye el uso de colorímetros o fluorímetros, lo que lo hace accesible a servicios de asistencia médica con menos recursos, manteniendo los niveles de calidad analíticos requeridos, y contribuir de esta forma a la detección de embarazos ectópicos en las primeras 6 sem de gestación disminuyendo los riesgos asociados con esta patología.
Métodos
Reactivos
- Patrón de hCG secundario: preparación de hCG donado por la Empresa "Mario Muñoz", purificado en el Instituto Nacional de Endocrinología (INEN) y calibrado contra el segundo estándar internacional de hCG de la OMS, en concentraciones de 25, 50, 100 y 200 UI/mL, evaluado por RIA comercial, Amerlex-HCG (Amersham, UK).
- Control positivo de hCG: muestras de orina de mujeres embarazadas ajustada su concentración a 100 UI/L.
- Control negativo de hCG: muestras de orina de mujeres no embarazadas (< 5 UI hCG/L).
- Anticuerpo monoclonal AcM-bhCG-IG1 obtenido y purificado en el INEN (10 µg/mL).1,2
- Anticuerpo policlonal que reconoce a la hCG (AcP-hCG) producido en conejo, obtenido y purificado en el INEN (10 µg/mL).
- Conjugado enzimático: enzima peroxidasa de rábano picante RZ=3 (Fluka), conjugada con inmunoglobulinas tipo G de carnero,14 según el método del peryodato.15
El resto de los reactivos empleados en la preparación de soluciones fueron obtenidos de la Merck.
Composición del CUALINEN-HCG
Se diseñó un juego de reactivos (CUALINEN-HCG) que contiene la cantidad de reactivos suficientes para procesar 10 muestras de orina por duplicado con los 2 controles por duplicado:
R1: 2 tiras de polivinilo (PVC), utilizadas como fase sólida recubiertas con 10 µg/mL de AcP-hCG.
R2: Bulbo con control positivo, liofilizado (100 UI/L).
R3: Bulbo con control negativo, liofilizado (< 5 UI/L).
R4: Bulbo con AcM-bhCG-IG1, liofilizado (10 µg/mL).
R5: Bulbo con conjugado antirratón-peroxidasa, líquido (predilución 1/200). Dilución final de trabajo 1/3 000.
R6: Bulbo con ortofenildiamina, liofilizado.
R7: Bulbo con tampón diluente de R6, líquido (fosfato-citrato-H2O2).
R8: Bulbo con 2 mL de tampón TRIS-Tween concentrado (10X), líquido.
Los reactivos se manipularon según el prospecto del CUALINEN-HCG incluido en cada juego, el diseño general del inmunoensayo (IE) se muestra en la figura 1.
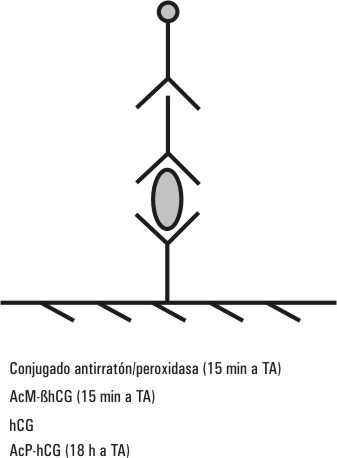
FIG.1. Procedimiento del CUALINEN-HCG.
Validación analítica
Previamente a la validación clínica se validaron estos reactivos, para lo cual se utilizaron 14 muestras de orina de mujeres embarazadas ya confirmadas con la clínica y otras 9 negativas o de mujeres no embarazadas.
Límite de detección
Para establecer por apreciación visual la menor concentración de hCG detectada, se evaluaron patrones con concentraciones de 12,5 - 25 - 50 y 100 UI/L en R8 (tampón TRIS-Tween) conjuntamente con R2 (control positivo) y diluciones 1/2, 1/4 y 1/8 de R2 con R3 (control negativo); posterior a los 15 min de incubación con el sustrato enzimático (R6+R7), se comparó la intensidad del color desarrollado (coloración amarilla) para cada preparación con respecto al R3. La concentración menor que mostró una coloración superior al R3 se clasificó con una cruz (+) y se consideró arbitrariamente como la menor concentración de hCG capaz de diferenciarse del R3 en 15 min. Las muestras con densidad óptica (DO) mayor que R2 se consideraron con 2 cruces (++).
Comparación espectrofotométrica de muestras positivas y negativas
Se comparó la DO a 492 nm obtenida en 14 muestras de orina de mujeres embarazadas con respecto a la obtenida en las 9 de mujeres no embarazadas, con el propósito de registrar las diferencias en DO 492 nm de estas 2 poblaciones.
Estudio de precisión
La precisión intraensayo e interensayo se evaluó determinando el valor de DO 492 nm en un espectrofluorímetro computadorizado SUMA (modelo 121-b, marca registrada, CIE) a R2 y R3, mediante el cálculo de la desviación en las lecturas de DO de 8 réplicas de los controles positivo y negativo procesadas dentro de una misma corrida (intra) y de 2 réplicas para cada control ejecutadas en 15 corridas independientes (inter).
Estudio de linealidad
Se analizaron muestras de suero, orina, sin diluir y con diluciones seriadas, desde 1:2 hasta 1:250 en R8 correspondiente a una mujer con 8 sem de embarazo normal.
Validación diagnóstica
CUALINEN-HCG se utilizó en un protocolo de validación diagnóstica aplicado en el nivel primario en el que participaron el consultorio del médico de la familia (CMF 80-2), responsable de la colección de la muestra de orina, captación de la embarazada y seguimiento de la misma hasta confirmar o no el embarazo. El hospital materno-infantil de 10 de Octubre, responsable de colectar, conservar y procesar las muestras de orina provenientes del CMF 80-2 y el Instituto Nacional de Endocrinología como autor y productor del juego de reactivos y promotor principal de la validación externa del mismo.
Se procesaron 91 muestras de orina pertenecientes a mujeres en un rango de edad entre 15 y 49 años que refirieron retraso menstrual entre 4 y 10 sem, a partir de la última menstruación.
- Resultados positivos por CUALINEN-HCG y tacto vagino-abdominal. Cuando la mujer optó por la interrupción del embarazo, se examinó macroscópicamente el material aspirado en búsqueda de material de aspecto ovular; las que decidieron proseguir con el embarazo fueron remitidas al médico de familia y se confirmó posteriormente el resultado de la prueba inmunoquímica.
- Resultados negativos por CUALINEN-HCG y amenorrea mantenida. Se reconsultó a la mujer a la semana siguiente, se realizó nuevamente tacto vagino-abdominal y prueba inmunoquímica. Todos los resultados se evaluaron contra los resultados de la clínica (tacto vaginal y examen del material aspirado) utilizado como criterio de certeza.
Para el análisis de los resultados se confeccionaron tablas de contingencia de doble entrada y se evaluaron las características operacionales del juego de reactivos CUALINEN-HCG en términos de su sensibilidad (S), especificidad (E) y exactitud (A) diagnóstica.15 La significación estadística de los resultados se evaluó mediante técnicas estadísticas tradicionales.16
Estudio de estabilidad de la HCG en la orina
Se realizó un estudio de estabilidad de la HCG en 13 orinas positivas las cuales fueron conservadas a diferentes temperaturas de menos 20 °C, 4 °C, temperatura ambiente (20 °C) y 37 °C. Las muestras se conservaron a estas temperaturas y se procesaron el mismo día de su recolección (considerando este como el tiempo 0), a las 48, 72 y 168 h (1 sem después), para comparar los resultados.
Resultados
Validación analítica
La concentración de 100 UI/L del patrón y del R2 mostró diferencias evidentes (++) con respecto al R3 a los 15 min de incubación con el sustrato; también se detectó visualmente la aparición de un amarillo menos intenso (+), pero diferenciable de R3 para el patrón correspondiente a la concentración de 25 UI/L y dilución 1/4 de R2 estableciendo de manera arbitraria la concentración de 25 UI/L como la mínima detectable.
Las diferencias registradas de los valores de DO obtenidos para las muestras positivas (DO = 1,5 ± 0,72) y las negativas (DO = 0,14 ± 0,06), demuestran que es evidente la diferenciación visual de estas 2 poblaciones. El rango de valores de DO para las muestras positivas, oscila entre 0,78 (X - DE) y 2,2 (X + DE) y son superiores a los registrados para R2 (tabla 1) que oscila entre 0,72 a 0,92 (X ± 2DE) por lo que establecimos 100 UI/L como límite de clasificación de la positividad.
Tabla 1. Estudio de precisión del CUALINEN-HCG
| Controles |
Repetibilidad | Reproducibilidad (n =15) | ||
| (X ± DE) | CV % | (X ±DE) | CV % | |
| Positivo (R2) | 0,70 ± 0,04 | 6,0 | 0,82 ± 0,05 | 6,0 |
| Negativo (R3) | 0,15 ± 0,03 | 20,0 | 0,11 ± 0,05 | 45,0 |
Precisión
CUALINEN-HCG presentó valores de CV % intraensayo e interensayo para el control R2 inferiores al 10 %, catalogado como óptimo para este tipo de IE (tabla 2), no ocurrió así con el CV % del R3 por los valores de DO registrados en la zona de imprecisión del equipo.
Estudio de linealidad
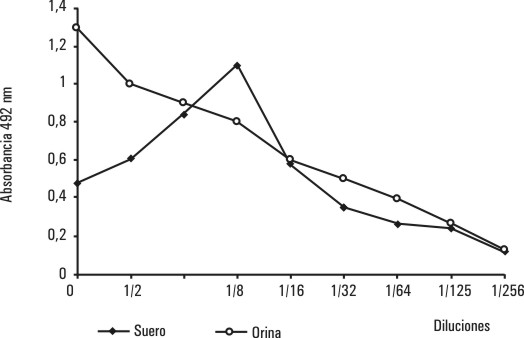
El resultado de este estudio (fig. 2), en el caso de la orina, reportó valores de densidad óptica proporcionales a la dilución, describió una línea recta, sin embargo, en la muestra de suero sin diluir fueron, menores (0,5) y no alcanzaron el valor máximo hasta una dilución de 1:8 de la muestra, lo que sugiere la no utilización de este tipo de muestra en esta prueba.
FIG.2. Estudio de la linealidad en muestra de orina de una mujer embarazada.
Validación diagnóstica
Los resultados de la validación diagnóstica en el escenario escogido dieron un valor de exactitud diagnóstica del 90 %, para una S y E de 85 y 95 %, respectivamente (tabla 2).
Tabla 2. Estudio de sensibilidad y especificidad diagnóstica del CUALINEN-HCG en la atención primaria
| CUALINEN-HCG | Criterio de certeza | Total | |
| Positivos | Negativos | ||
| Positivos | 41 | 2 | 43 |
| Negativos | 7 | 41 | 48 |
| Total | 48 | 43 | 91 |
S = Verdaderos positivos ´ 100 /verdaderos positivos +falsos negativos.
S = 41 ´100 / 41 + 7
S = 85 %
E = Verdaderos negativos ´ 100 / verdaderos negativos + falsos positivos.
E = 41 ´ 100 / 41 + 2
E = 95 %
En la siguiente tabla se muestra la estabilidad de la hCG en la orina, según su conservación y el tiempo en que se realizó la determinación de la hormona, el porcentaje de positividad de las muestras disminuye al pasar el tiempo de recolección de la muestra (tabla 3).
Tabla 3. Estudio de estabilidad de la HCG en la orina (n=13)
| Temperatura de conservación (°C) | Tiempo 0 Diag + (%) | Tiempo 48h Diag +/- (%) | Tiempo 72h Diag +/- (%) | Tiempo168 h Diag +/- ( %) |
| - 20 | 13 (100) | 13/0 (100) | 12/1 (92,3) | 10/3 (76,9) |
| 4 | 13 (100) | 12/1 (92,3) | 12/1 (92,3) | 9/4 (69,2) |
| 20 | 13 (100) | 12/1 (92,3) | 12/1 (92,3) | 8/5 (61,5) |
| 37 | 13 (100) | 11/2 (84,6) | 9/4 (69) | 5/8 (38,5) |
Discusión
El logro principal de este trabajo fue el desarrollo y puesta a punto de un juego de reactivos para la detección de embarazo (CUALINEN-HCG) aplicable en el nivel primario, el cual demostró ser lo suficientemente robusto para funcionar adecuadamente bajo las condiciones de trabajo de un laboratorio de rutina.
Los resultados de la validación analítica y diagnóstica en el nivel primario corroboran lo anterior en opinión de los propios evaluadores;17 la S y E diagnóstica fue del 85 y 95 %, respectivamente, para una exactitud diagnóstica del 90 % utilizando 100 UI/L como límite de clasificación de la positividad.
Se demostró que el límite de clasificación de la positividad en 100 UI/L no resultó conveniente en el escenario ensayado, por cuanto 15 mujeres de cada 100 tendrán un diagnóstico de embarazo negativo aún en presencia de este; por otra parte, los estimados de la S fueron inferiores a los referidos en la literatura,18 donde se plantean que la S y E diagnósticas deben ser superiores al 90 %.
Por lo anterior, Lozano y otros17 han sugerido la realización de estudios futuros orientados a reajustar el límite positivo de clasificación del CUALINEN-HCG, donde se evalúen la S, E y exactitud diagnóstica, a diferentes límites positivos de clasificación entre embarazo y no embarazo19 y se llegue a un compromiso que garantice la captación de todas las mujeres con sospechas de embarazos a partir del primer día de la ausencia de la menstruación, para una E constante o ligeramente disminuida con respecto al valor estimado en este estudio.20
No obstante, otras variables relacionadas con la forma de colección de la muestra y su conservación, merecen ser analizadas para evaluar la magnitud de su influencia sobre los resultados y evitar errores en estudios posteriores. Se conoce que la colección de la primera orina de la mañana garantiza los niveles de hCG requeridos para detectar la concentración real de la hormona21 por lo que recomendamos, al inicio de este estudio, la colección de la primera orina matutina, y posteriormente, se aceptó el procesamiento de la segunda, para incrementar las muestras del estudio. El tiempo de almacenamiento de las orinas entre 8 y 15 °C, antes de ser procesadas, no fue controlado, si se conoce que en muchos casos fue más de 8 d hasta lograr completar las muestras suficiente para las tiras, por lo que el análisis retrospectivo de los resultados falsos negativos y la estabilidad de hCG en esas muestras de orina no pudo realizarse.
Experiencias anteriores de nuestro grupo de trabajo en condiciones controladas de laboratorio donde se colectó la segunda orina matutina de embarazadas con tiempos de amenorrea menores de 6 sem procesadas el mismo día de su colección dieron resultados positivos verdaderos por lo que pensamos que la S = 85 % está más relacionada con la estabilidad de la hormona en la muestra de orina que con la sensibilidad del CUALINEN-HCG.
Se ha reportado que la estabilidad de la hormona disminuye al aumentar la temperatura de almacenamiento, pasa a sus formas melladas y libres22,23 y que las formas melladas, conservadas en refrigeración por más de 2 sem, se disocian a sus subunidades libres y alteran los resultados en la cuantificación de hCG.24,25 Estos procesos de disociación son mucho más importantes en matrices con bajo contenido proteico como la orina, donde los procesos de disociación de la hCG se aceleran.26 Las muestras en trabajos anteriores fueron procesadas, por lo general, el mismo día, pero se demostró además que para los anticuerpos y estándares utilizados la estabilidad se mantuvo al menos en 6 meses en que se realizaron los estudios de estabilidad en condiciones de conservación de congelación a -20 °C, y conservación de liofilización para los controles.27,28
Estimamos que estos 2 factores, colección de la segunda orina matutina y condiciones de preservación de las muestras, influyeron de manera decisiva en la S = 85 %.
Esto se aprecia en la tabla 3 en la cual se muestran los resultados de las muestras procesadas después de diferentes tiempos y distintas temperaturas de conservación.
La estabilidad de la molécula de hCG depende del tiempo y la temperatura de conservación por lo que las muestras no congeladas disminuyeron su porcentaje de positividad en todos los casos de temperatura de conservación excepto a -20 °C durante 48 h y que fue muy significativo la disminución de la positividad por debajo del 70 % cuando fueron almacenadas por períodos de 168 h o sea 1 sem. Por tales motivos recomendamos procesar las orinas frescas y de lo contrario conservarlas en congelación (-20 °C) no más de 48 h, para asegurar así la estabilidad de esta hormona.
La linealidad del método fue demostrada para las muestras de orina, no así para el suero, por lo que se recomienda no utilizar este para la detección del embarazo.
La utilización de este kit diagnóstico representa un ahorro por concepto de divisas ya que si tenemos en cuenta que una tira reactiva para una sola prueba de embarazo cuesta alrededor de 50 centavos dólar, y en este caso los reactivos producidos en el INEN tienen un bajo costo, solo se compararía con el costo de la placa de ELISA que es de alrededor de un dólar, pero con la cual se pueden realizar 40 muestras, vemos que además del ahorro, esto representa un impacto social pues en el país no se ofrece este servicio en otros hospitales.
Summary
The results of the standardization of a Kit of reagents (CUALINEN-HCG), for the detection of the Human Chorionic Gonadotropin (HCG) in urine and their diagnostic validation at primary level are presented. CUALINEN-HCG is a double capture micro ELISA that involves the participation of a specific monoclonal antibody for the b subunit of the hCG (AcM-bhCG-IG1) and the enzymatic conjugated with the corresponding colorimetric substrate, obtained and purified in the National Institute of Endocrinology. The results of the analytic validation of the CUALINEN-HCG showed that it was able to distinguish between positive and negative urines samples, with a ratio positive/negative of 10; it was obtained coefficients of variation of 6 % in studies of precision (inter and intra assays) carried out for the positive control. 91 samples of matutinal urine from women who had been with amenorrhea between 4 and 16 weeks, starting from the last date of menstruation, were processed. Pregnancy was diagnosted later among these women. We performed the validation at primary level of the CUALINEN-HCG with a diagnostic sensibility and specificity of 85 % and 95 % respectively and a diagnostic accuracy of 90 %. Their use is recommended as auxiliary tool for the diagnostic of the pregnancy to primary level starting from the first week of absence of the menstruation (5 weeks of amenorrhoea).
Subject headings: GONADOTROPINS; CHORIONIC; ENZYME-LINKED IMMUNOSORBENT ASSAY; ANTIBODIES, MONOCLONAL; URINE; DIAGNOSTIC TECNIQUES, OBSTETRICAL AND GYNECOLOGICAL; PREGNANCY.
Referencias bibliográficas
- Braffman BH, Coleman BG, Ramchandani P. Emergency department screening for ectopic pregnancy: a prospective US study. Radiology 1994;190:797-802.
- Chard T. Pregnancy tests: a review. Hum Reprod 1992;7:701-10.
- Canfiel RE, O´Conner JF, Chen Y. The clinical utility of the measurement of urinary hCg and its fragments. Structure-funtions Relationship of Gonadotropins 1979;65:297-308.
- Birken S, Canfield RE. Chemistry and immunochemistry of human chorionic gonadotropin. En: Segal SJ, Ed. Chorionic Gonadotropin New York:Plenum Press, 1998. P.65-88.
- Gupta SK, Talwar GP. Development of hybridoma secreting anti-human chorionic gonadotropin antibodies. Ind J Exp Biol 1980;18:1361-5.
- García GE. Obtención de anticuerpos monoclonales anti-gonadotropina coriónica humana (hCG) y su aplicación en métodos radioinmunológicos. II Congreso de Patología Clínica 1989.
- Díaz E. Proceso de Purificación a escala de laboratorio del anticuerpo monoclonal 1G1 anti hCG. Tesis de Maestría. 1998.
- Stuart MC, Underwood PA, Harman DF, Payne K, Rathjen DA, Razziudin S. The production of monoclonal antibodies to human chorionic gonadotropin and its subunits. J Endocrinol 1983;3:323-30.
- Khazaeli MB, England BG, Dieterle RC, Nordblom GD, Kabza GA, Beierwaltes WH. Development and characterization of a monoclonal antibody which distinguishes the B-subunit of human chorionic gonadotropin (BhCG) in the presence of the hCG. Endocrinology 1984;109:1290-2.
- Kohler G, Milstein C. Continuous cultures of fused cells secreting antibodies of predefined specificity. Nature 1975;256:495-7.
- Chart T, Iles R, Wathen N. Why is there a peak of human chorionic gonadotrophin (hCg) in early pregnancy? Human Reproduction 1995;10:1837-40.
- Bandi ZL, Jasper P, Schoen J. The use of qualitative RIA for beta hCG in the emergency room. Clin Chem 1983;29:1161.
- Christensenn H, Thyssen HH, Schebye O, Berget A. Three highly sensitive bedside serum and urine tests for pregnancy compared. Clin Chem 1990;36:1686-8.
- Díaz E, Rodríguez Y. Preparación de un conjugado anti-ratón peroxidasa para la detección de anticuerpos en ensayos inmunoenzimáticos. Biotecnología Aplicada 1997; 15(2):101-7.
- Tijssen P. Practice and Theory of Enzyme Immunoassays. Laboratory techniques in biochemistry and molecular biology. Vol.15. Amsterdam, Netherland: Elsevier Science Publishers B.V. 1993;P:329-44.
- Martínez H, Santana S. Manual de procedimientos bioestadísticos. La Habana: Editorial Ciencias Médicas; 1990:38-43.
- Lozano A, Martínez F, Santana S, Coto R, García GE. Diagnóstico precoz de embarazo en la atención primaria mediante determinación cualitativa de gonadotropina coriónica humana. Rev Cubana Med Gen Integr 1998;14:439-9.
- Daviaud J, Fournet D, Ballongue C, Guillem GP, Leblanc A, Casellas C. Reliability and feasibility of pregnancy home-use tests: laboratory validation and diagnostic evaluation by 638 volunteers. Clin Chem 1993;39:56-9.
- Zweig MH, Campbell G. Receiver-Operating Characteristics (ROC) Plots: A fundamental evaluation tool in Clinical Medicine. Clin Chem 1993;39:561-77.
- Griner H. Tests Selection and Use. Ann Int Med 1981;94:559-63.
- Bandi ZL, Schoen Y, DeLara M. Highly sensitive qualitative methods for serum choriogonadotropin (hCG): Clinical specificity studies. Clin Chem 1987;33:677-81.
- Stone SJ, Henley R. The stability of blood samples for the measurement of the free beta subunit of chorionic gonadotropin. Prenat Diagn 1995;15:95-6.
- Kardana A, Cole LA. The stability of HCG and free B in serum samples. Prenat Diagn 1997;17:141-7.
- Kardana A, Cole LA. Polypeptide nicks cause erroneous results in assays of human chorionic gonadotropin free B-subunit. Clin Chem 1992;38:26-33.
- Kovalevskaya G, Birken S, Kakuma T, Schlatterer J, O'Connor JF. Evaluation of nicked human chorionic gonadotropin content in clinical specimens by a specific immunometric assay. Clin Chem 1999;45:68-77.
- Butler SA, Cole LA, Chard T, Iles RK. Dissociation of human chorionic gonadotropin into its free subunits is dependent on naturally occurring molecular structural variation, sample matrix and storage conditions. Ann Clin Biochem 1998;35:754-60.
- Arranz MC, Almeida I, Rodríguez B, García G, De Dios R, González-Suárez R. Caracterización y aplicación de un anticuerpo monoclonal anti-gonadotropina coriónica humana. Rev Cubana Endocrinol 1997; 8(1):46.
- García Dafonte G. Aplicación de un anticuerpo monoclonal en inmunoensayos para la detección de embarazo. Tesis de Maestría en Bioquímica, 1997. Facultad de Biología, U.H. C. Habana Cuba.
Recibido: 4 de noviembre de 2002. Aprobado: 19 de diciembre de 2002.
Lic. Gema E. García Dafonte. Instituto Nacional de Endocrinología, Zapata y D, El Vedado, Ciudad de La Habana, Cuba.
1 Licenciada en Bioquímica. Máster en Ciencias Biológicas. Investigadora Agregada. Laboratorio Bioquímica Clínica. Instituto de Medicina del Deporte, Ciudad de La Habana.
2 Licenciada en Bioquímica. Investigadora Auxiliar. Laboratorio de Diabetes. Instituto Nacional de Endocrinología, Ciudad de La Habana.
3 Licenciada en Laboratorio Clínico. Laboratorio Bioquímica Clínica. Hospital Militar "Carlos J. Finlay", Ciudad de La Habana.
4 Especialista de II Grado en Bioquímica Clínica. Investigador y Profesor Titular. Instituto Nacional de Endocrinología, Ciudad de La Habana.
5 Licenciado en Bioquímica. Laboratorio Bioquímica Clínica. Hospital Materno-Infantil "10 de Octubre", Ciudad de La Habana.
6 Especialista de II Grado en Bioquímica Clínica. Laboratorio Clínico. Hospital "Hermanos Ameijeiras", Ciudad de La Habana.
7 Especialista de I Grado en Medicina General Integral. Hospital General Docente "Enrique Cabrera". Ciudad de La Habana.