Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Endocrinología
versión On-line ISSN 1561-2953
Rev Cubana Endocrinol v.14 n.1 Ciudad de la Habana ene.-abr. 2003
Trabajos originales
Instituto Nacional de Endocrinología
Validación analítica de un juego de reactivos para cuantificar la tirotropina humana sérica
Lic. Pavel Melo Cala,1 Lic. Julio César Rodríguez González,2 Ing. Luis Pizarro Lou,2 Lic.Anel Hernández Garcés1 y Lic. María Teresa Marrero Rodríguez1
Resumen
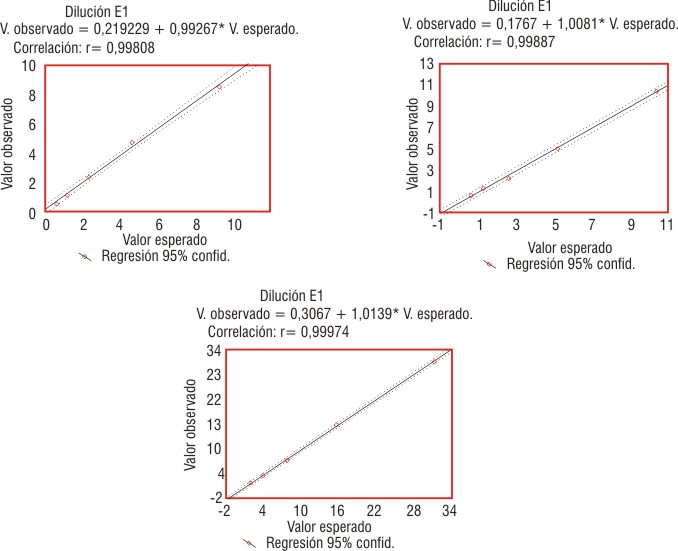
Se presentan los resultados de la evaluación analítica de un ensayo de segunda generación (IRMA-I125-hTSH-BGTâ) producido y comercializado por el Centro de Isótopos. Se determina la sensibilidad analítica y funcional, intervalo de referencia, imprecisión y exactitud del diagnosticador. El método presentó sensibilidad analítica de 0,014 mUI/ L y funcional de 0,11 mUI/L. La imprecisión intraensayo fue de 4,34; 4,04 y 1,60 % y la imprecisión interensayo de 12,96; 4,30; 5,98 y 10,21 % para 4 sueros controladores de la calidad con concentraciones de 0,42; 9,77; 27,03 y 1,31 mUI/L, respectivamente. Los estudios de exactitud mostraron en la prueba de linealidad y paralelismo, rectas y coeficientes de correlación muy cercanos a 1 (E1, m = 0,992; r = 0,998 -C2, m = 1,008; r = 0,998 - C3, m =1,013; r = 0,999), sin que existieran diferencias significativas (p < 0,05) entre las pendientes ni entre las varianzas de las rectas descritas. Estas fueron paralelas entre sí; la recuperación media fue de 105,50 % y la exactitud promedio de 102,75. El intervalo de referencia fue de 0,52-3,92 mUI/L; n = 215 y 95,33 %. El método presenta sensibilidades analítica y funcional, correspondientes a los ensayos de hTSH de segunda generación, y es preciso y exacto. Dicho diagnosticador reúne los criterios analíticos para su comercialización en la red de laboratorios con servicios de endocrinologìa y medicina nuclear del país.
DeCS: TIROTROPINA; ENSAYO INMUNORADIOMÉTRICO/ métodos; JUEGO DE REACTIVOS PARA DIAGNOSTICO.
La tirotropina humana (hTSH) es una glicoproteína de peso molecular 28 000, secretada por la adenohipófisis. Contiene una cadena a y otra b ligadas por enlaces no covalentes. Las subunidades b son responsables de la especificidad inmunológica y biológica de esta hormona. La síntesis de la TSH es controlada por los niveles circulantes de las hormonas tiroideas, tiroxina y triyodotironina y la hormona liberadora de tirotropina.1
La hTSH resulta el indicador por excelencia de la integridad del eje hipotálamo-hipófisis-tiroides y de la acción reguladora de los niveles circulantes de las hormonas tiroideas para un estado tiroideo estable, por lo cual su cuantificación tiene considerable importancia dentro del conjunto de pruebas funcionales tiroideas.2
El surgimiento de los ensayos inmunométricos (IMAs) ha permitido, por su sensibilidad, la cuantificación de niveles subnormales de hTSH con una mayor precisión que los ensayos radioinmunoanalíticos (RIAs), los cuales en su generalidad no la poseen.3,4 Dentro de esta categoría, se encuentran los ensayos inmunorradiométricos (IRMAs) que emplean I125 como marcador de, al menos, un anticuerpo en el sistema4 y tiene la posibilidad de mejorar en 10 veces las sensibilidades analíticas (0,01 mUI/L-0,1 mUI/L) y funcional (0,1 mUI/L- 0,2 mUI/L) con respecto a los RIAs.3
El objetivo de este trabajo es determinar las características analíticas y de control de la calidad del diagnosticador IRMA-I125-hTSH-GBT®, producido en el Centro de Isótopos (CENTIS), Cuba, a través de la determinación de la sensibilidad analítica y la funcional, la imprecisión y exactitud de las determinaciones; así como el intervalo de referencia en una población cubana supuestamente sana.
Métodos
Ensayo inmunorradiométricoPara determinar las concentraciones de hTSH en suero utilizamos un ensayo IRMA que involucra dos anticuerpos monoclonales de alta afinidad (fig.1) Los patrones preparados y las muestras a analizar reaccionan con una mezcla de anticuerpos monoclonales contra hTSH; ambos están siempre en exceso con respecto a la concentración de hTSH. Uno de estos, marcado con I125 (anticuerpo señal), ataca específicamente un sitio de unión de la molécula de hTSH; el segundo anticuerpo está biotinilado y se enlaza a la hTSH por un sitio específico diferente al sitio del anticuerpo señal, sirve como anticuerpo de enlace o puente para la precipitación indirecta del inmunocomplejo y forma un sandwich. Después de 2 horas de incubación a temperatura ambiente, se adiciona en exceso el inmunosorbente magnético (ISM) constituido por moléculas de avidina acopladas a partículas de hierro magnetizadas, las cuales se enlazan muy específicamente con el inmunocomplejo por medio de la unión de muy alta afinidad (10-15 M) entre biotina y avidina5 y todo es precipitado al aplicar un campo magnético. Un simple paso de lavado reduce los enlaces no específicos al mínimo para incrementar la precisión y la especificidad del análisis.6 La respuesta es directamente proporcional a la actividad enlazada al ISM y al incremento de la concentración de la hormona. Para la medición de la radiactividad se utilizó un contador gamma calibrado para el trabajo con I125 (LKB 1275 minigamma, Finlandia). La concentración de hTSH es calculada haciendo uso del paquete de programas RIACALC2 RM, versión 2,65 (Pharmacia-Wallac).
FIG 1. Fundamento y protocolo del ensayo IRMA-I125-hTSH-BGT®.
Leyenda: Anticuerpo monoclonal (AcM), biotina (B), avidina (A), inmunosorbente magnético (ISM), partícula magnética (PM).
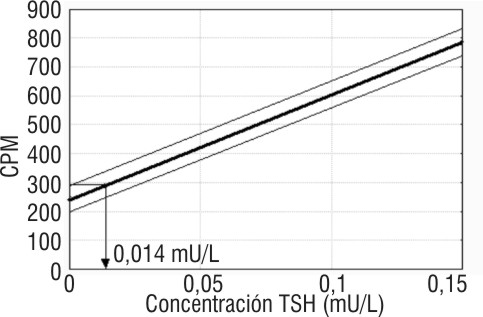
El límite mínimo de detección es la concentración mínima detectable diferente de 0, y se determinó gráficamente, con un 95 % de confianza, como la concentración correspondiente a la actividad límite superior de la distribución Gaussiana de veinte réplicas del estándar de concentración 0 mUI/L (B0 + 2 SD, n= 20) mediante un ensayo (sensibilidad analítica),7 así como la concentración mínima de hTSH con un 20 % de CV calculado a partir del perfil de imprecisión acumulado para al menos 10 ensayos (n =13), sensibilidad funcional.3
Intervalo de referenciaSe evaluaron muestras de suero de 218 individuos donantes voluntarios de diferentes bancos de sangre de Ciudad de La Habana, supuestamente sanos. Para determinar el rango de valores de referencia se utilizó una transformación logarítmica y se definió para un intervalo de confianza del 95 %.8
ImprecisiónPara determinar la imprecisión del diagnosticador, se emplearon dos pruebas: repetibilidad (imprecisión intraensayo) y reproducibilidad (imprecisión interensayo).9 La repetibilidad se calculó como la medida de dispersión (% CV) al evaluar 10 réplicas de 3 controles (C1, C2 y C3) procedentes de BIORAD, Ltd (EUA) cuyos rangos de confianza para el 95 % (media ± 2 SD) son: C1, 0,32-0,52 mUI/L; C2, 9,04-10,88 mUI/L; C3, 25,19-32,11 mUI/L. La reproducibilidad se determinó como la medida de dispersión (% CV) al evaluar los 3 controles de BIORAD, Ltd y un suero control (Sc, 1,05-1,68 mUI/L) de IZOTOP, Ltd (Hungría), en 18 ensayos no consecutivos diferentes.
ExactitudLa exactitud se determinó a través de un ensayo de dilución seriada y de recuperación.10,11 Las muestras controles C2, C3 y E1 (CENTIS) fueron diluidas 1:2 utilizando como matriz suero humano libre de hTSH (estándar 0 mUI/L). Se determinó la concentración de las diluciones y se analizaron los parámetros de las rectas de regresión y la prueba estadística de paralelismo entre la curva dosis - respuesta (0 mUI/L -100 mUI/L) y las descritas para los controles diluidos.10 La recuperación analítica se realizó adicionando hTSH exógena (estándares de hTSH del juego de reactivo: 0 - 0,15 - 0,6 - 2,50 - 15,0 - 100 mUI/L) en cantidades equivolumétricas (100 µl de muestra + 100 µl de estándar hTSH) y variables (0,075 - 0,30 - 1,25 - 7,50 - 50,0 mUI/L de hTSH) para cubrir un intervalo amplio de concentraciones, a E1, C1 y C2. Los valores de hTSH se determinaron antes y después de la adición de hTSH exógena en un mismo ensayo y se calculó el porcentaje de recuperación.11
Resultados
Límite mínimo de detecciónLos resultados del límite mínimo de detección evaluado en términos de sensibilidad analítica se muestran en la figura 2. La interpolación gráfica del límite superior de 95 percentil de la distribución Gaussiana de la respuesta obtenida a 0 mUI/L para n = 20 correspondió con un valor de 0,014 mUI/L. El límite mínimo de detección evaluado como sensibilidad funcional correspondiente a la concentración mínima de hTSH con un CV del 20 % obtenido del perfil de imprecisión acumulado fue de 0,11 mUI/L, n = 13.
FIG. 2. Sensibilidad analìtica del diagnosticador IRMA-
I125-hTSH-GBT®.
Determinación del intervalo de referencia
Un histograma de frecuencia permitió comprobar que los valores obtenidos de concentración de hTSH en suero no corresponden con una distribución Gaussiana, p=0,01, por lo que se utilizó una transformación logarítmica. Como se observa en la figura 3, la distribución de frecuencia de la transformación logarítmica de los valores de concentración de hTSH en suero sigue una distribución Gaussiana. El intervalo de valores de referencia obtenido para un 95,33 % de confianza (p = 0,372) estuvo entre 0,52 mUI/L y 3,92 mUI/L, n= 215.
FIG. 3. Distribución de frecuencia y campana de Gauss de 215 valores de logaritmo de concentración de hTSH sérica.
ImprecisiónEn la tabla 1 se muestran los coeficientes de variación intraensayo e interensayo de los estudios de repetibilidad y reproducibilidad, respectivamente. Los coeficientes de variación intraensayo e interensayo fueron < 5 y < 15 %, respectivamente.
Tabla 1. Estudio de imprecisión
| Imprecisión | Muestra | Número de mediciones | Concentración media de hTSH (mUI/L) | Desviación estándar (mU/L) | CV (%) |
| Intraensayo | C1 | 10 | 0,42 | 0,02 | 4,34 |
| C2 | 10 | 9,49 | 0,38 | 4,04 | |
| C3 | 10 | 27,80 | 0,44 | 1,60 | |
| Interensayo | Sc | 18 | 1,31 | 0,13 | 10,21 |
| C1 | 18 | 0,42 | 0,05 | 12,96 | |
| C2 | 18 | 9,77 | 0,42 | 4,30 | |
| C3 | 18 | 27,03 | 1,62 | 5,98 |
En la figura 4 se muestran los resultados de las pruebas de dilución con el estándar 0 mUI/L de los tres controles utilizados (E1, C2 y C3). La correlación estadística efectuada entre los valores observados y los valores reales mostraron pendientes y coeficientes de correlación cercanos a 1. Los análisis estadísticos de los resultados obtenidos del ensayo de linealidad y paralelismo, mostraron que no existían diferencias significativas (p< 0,05) entre las pendientes ni entre las varianzas de la curva dosis -respuesta y las curvas descritas por los tres controles utilizados, lo que demuestra que las rectas obtenidas son paralelas entre sí.
FIG. 4. Rectas de regresión lineal de las pruebas de dilución de E1, C2 y C3.
En la tabla 2 se muestran los porcentajes de exactitud de los controles evaluados en las pruebas de dilución y de recuperación. Se obtuvieron valores promedios de 100,03 y 105,5 % en la prueba de dilución y recobrado o recuperación respectivamente. El porcentaje promedio de exactitud obtenido fue 102,75 %.
Tabla 2. Resultados de los porcentajes de exactitud en las pruebas de dilución y recuperación
| Prueba de dilución | Prueba de recuperación | ||||||
| Factor de dilución | E1 (%) | C2 (%) | C3 (%) | Muestra + hTSH exógena (mUI/L)/2 | E1(%) | C2(%) | C1(%) |
| 0 | 100,00 | 100,00 | 100,00 | Muestra | 100,00 | 100,00 | 100,00 |
| 2 | 111,87 | 95,57 | 102,09 | (Muestra + 0) /2 | 108,81 | 102,03 | 84,44 |
| 4 | 112,81 | 82,85 | 93,81 | (Muestra + 0,15) /2 | 110,62 | 96,76 | 96,67 |
| 8 | 112,81 | 97,88 | 90,09 | (Muestra + 0,60) /2 | 110,21 | 98,45 | 106,67 |
| 16 | 110,93 | 97,11 | 92,40 | (Muestra + 2,50) /2 | 106,63 | 98,37 | 102,37 |
|
| | | | (Muestra + 15,0) /2 | 98,00 | 103,75 | 106,67 |
|
| | | | (Muestra +100,0) /2 | 99,12 | 118,84 | 129,42 |
| Promedio | 109,68 | 94,68 | 95,68 | | 104,92 | 103,23 | 108,36 |
Discusión
El desarrollo de la tecnología analítica en los procedimientos para cuantificar hTSH en suero surgió de la necesidad de contar con procederes más sensibles, específicos, precisos y exactos, a partir del propósito inicial de distinguir entre trastornos tiroideos primarios y los de origen pituitario (ensayo de estimulación con TSH para medir captación tiroidea de I 131), teniendo en cuenta el surgimiento en 1973 de las RIAs de hTSH, que aumentó grandemente la especificidad de las determinaciones, pero con la incapacidad de poder distinguir solamente entre valores normales y valores incrementados (hipotiroideos) de hTSH, por la limitada sensibilidad de los RIAs. Se presentó así, un reto tecnológico. Finalmente el desarrollo en la década de los años 80 de los ensayos IMAs en sus diversas versiones y diseños, permitió considerar y reafirmar que la determinación de hTSH por métodos altamente sensibles de segunda y tercera generación,3 es la prueba de primera línea en la evaluación de la función tiroidea, en la mayor parte de las situaciones clínicas de esta enfermedad.2,3
Este estudio confirma la importancia que tiene la determinación de las características analíticas, y dentro de estas la determinación de la sensibilidad constituye una premisa de gran significación. La evaluación de las potencialidades de los ensayos de hTSH, en cuanto a su sensibilidad, ha sido muy estudiada a lo largo de estos últimos años, de tal forma que se recomienda más que la evaluación de la sensibilidad analítica, la evaluación de la sensibilidad funcional.6 Esta última se considera como la expresión más realista de la capacidad que tiene el método de poder diferenciar la concentración mínima detectable que sea estadísticamente diferente de 0 y un reflejo de la influencia que ejerce una variedad de factores analíticos durante el empleo de rutina del método en la práctica médica asistencial.2, 3, 6, 12 Por esta razón, en ocasiones se ha considerado la sensibilidad funcional como la sensibilidad clínicamente útil y es actualmente un factor de primordial importancia en la evaluación analítica de los métodos IMAs de hTSH de segunda y tercera generación, independientemente de que las casas comerciales productoras de estos juegos de reactivos continúen evaluando y reportando la sensibilidad analítica. El problema de la determinación de la sensibilidad funcional ha rebasado los marcos de los IMAs de hTSH y se ha extendido en el campo de las investigaciones.
Teniendo en cuenta los valores obtenidos en nuestro estudio analítico referente a la determinación del límite mínimo de detección, evaluado como sensibilidad analítica y sensibilidad funcional, consideramos este método como sensible, al cumplir los parámetros de sensibilidad analítica y funcional reportados para hTSH de la segunda generación de ensayos IMA,2,3 en la cual se incluyen los denominados IRMA con rangos de sensibilidades analítica y funcional de 0,01 mUI/L - 0,1 mUI/L y de 0,1 mUI/L - 0,2 mUI/L, respectivamente. 2, 3, 6
El intervalo de referencia obtenido en la población cubana supuestamente sana en estudio, está en correspondencia con los resultados obtenidos en muestras representativas de dicha población (0,43 mUI/L - 4,21 mUI/L, n = 120) utilizando un ensayo IRMA desarrollado y validado por el Instituto Nacional de Endocrinología (INEN), La Habana, Cuba,4 sólo que se estrecha ligeramente el intervalo de referencia, y con otro estudio realizado en la mencionada institución mediante el uso de este mismo ensayo (0,53 mUI/L - 4,15 mUI/L, n= 192),13 así como lo reportado por otros laboratorios con diferencias en el tipo de población, juegos de reactivos comerciales o de producción nacional, procedimientos y tecnologías empleadas para el desarrollo de los reactivos primarios, así como el grado de automatización del ensayo.14-23
Los resultados obtenidos sobre la imprecisión nos indican que este diagnosticador se comporta como un ensayo preciso, pues los porcentajes de CV no superan los límites permisibles para cada tipo de estudio.19, 20, 23-27
Teniendo en cuenta los resultados de la evaluación de la exactitud, se puede inferir la ausencia de error sistemático en la determinación de la concentración de hTSH, al demostrarse estadísticamente el paralelismo de las rectas descritas en el estudio correspondiente al ensayo de linealidad o dilución. Por otro lado, los porcentajes de exactitud obtenidos en los análisis de dilución y recuperación están en los rangos establecidos,10, 11, 27 lo que nos permite inferir que las muestras de pacientes se comportan de manera similar a los estándares del juego de reactivos ante los anticuerpos utilizados.
Concluimos que el juego de reactivo IRMA-I125-hTSH-GBTâ reúne las condiciones adecuadas para la cuantificación de hTSH en suero, y es un procedimiento sensible, preciso y exacto, adecuado para su comercialización y uso en la asistencia médica endocrinológica en el país.
Summary
The results of the analytical evaluation of a second-generation assay (IRMA-I125-hTSH-BGT®)) produced and commercialized by the Center of Isotopes are presented. Analytical and functional sensitivity, reference interval, imprecision and accuracy of the diagnostic method were determined. The method had an analytical and functional sensitivity of 0,014 mUI/ L and 0,11 mUI/L respectively. The intra-assay imprecision was 4,34; 4,04 y 1,60 % and the interassay imprecision was 12,96; 4,30; 5,98 y 10,21 % for 4 quality control sera at concentrations of 0,42; 9,77; 27,03 y 1,31 mUI/L respectively. The accuracy studies showed in the linearity and parallelism test straight lines and correlation coefficients very close to 1 (E1, m= 0,992; r= 0,998 -C2, m= 1,008; r=0,998 - C3, m=1,013; r=0,999), without significant differences (p<0,05) among the slopes or among the variances of the described straight lines; they were parallel to each other. The median recovery was 105,50% and average accuracy was 102,75%. The reference interval was 0.52-3,92 mUI/L; n=215; 95,33%. The method presents analytical and functional sensitivity rates that match those of the second-generation hTSH assays in addition to being precise and accurate. This diagnostic method complies with the analytical criteria for it being commercialized in the laboratory network that provides endocrinology and nuclear medicine services throughout the country.
Subject headings:THYROTROPIN; INMUNORADIOMETRIC ASSAY/methods; REAGENT KITS; DIAGNOSTIC.
Referencias bibliográficas
1. Gayton AC, Hall JE. Tratado de Fisiología Médica. Unidad XIV. Endocrinología y reproducción. Cap 76. Hormonas metabólicas tiroideas 1998; 1033-44.
2. Rodríguez González JC. Ensayos sensibles de TSH y su repercusión en la evaluación de la función tiroidea. Rev Cubana Endocrinol 1997; 8 (2):150-64.
3. Spencer CA, Takeuchi M, Kazarosyan M. Current status and performance goals for serum thyrotropin (TSH) assays. Clin Chem 1996; 42 (1):140-5.
4. Blanca S, Rodríguez JC, Rodríguez ME, González D. Desarrollo de un ensayo inmunorradiométrico para determinar tirotropina humana en suero. Nucleus 1997;22:17-22.
5. Odell WD, Griffin J, Zahradnik R. Two-monoclonal-antibody sandwich-type assay for thyrotropin, with use an avidin-biotin separation technique. Clin Chem 1986;32 (10):1873-78.
6. Spencer C. Futher developments in TSH tecnology. Exp. Clin Endocrinol 1994;102:12-22.
7. Rodbard D. Statistical estimation of the minimal detectable concentration ("sensitivity") for radioligand assays. Anal. Biochem 1978; 90:1-12.
8. Solberg HE. Establishment and use of reference values. En: Burtis CA, Ashwood ER, eds. Tietz texbook of clinical chemistry 3rd ed. Philadelphia: WB Saunders Company; 1999; 336-56.
9. Seth J. Laboratory management and quality control. En: Hunter WM, Corrie JET, eds. Immunoassays for clinical chemistry. Edinburgh: Churchill Livingstone, 1983; p.3-24.
10. Koch DO, Peters T. Selection and evaluation of methods. En: Burtis CA, Ashwood ER, eds. Tietz texbook of clinical chemistry 3rd ed. Philadelphia: WB Saunders Company, 1999; p.320-35.
11. Burnet RW. Quantitative evaluation of liniarity. Clin Chem 1980; 26: 44-6.
12. Nisembaum Alas AM, Rodríguez González JC, Blanca Fernández S, Bacallao Fernández K. Evaluación de la calidad analítica de un ensayo inmunorradiométrico para tirotropina sérica, en condiciones de rutina, durante un año. LABORAT~acta 1999; 11:107-12.
13. Rodríguez González JC, Marrero Rodríguez MT, Melo Cala P, Pizarro Lou LA. Intervalo de referencia para tirotropina humana en suero utilizando el juego de reactivos IRMA-I125-hTSH-GBT®. Nucleus (en prensa).
14. Paterson N, Biggart EM, Chapman RS, Beastall GH. Evaluation of a time resolved immunofluorimetric assay of serum thyroid stimulating hormone. Ann Clin Biochem 1985; 22: 606-11.
15. Watanabe Y, Amino N, Tamaki H. Highly sensitive immunoenzymometric assay for human thyrotropin. Clin Chem 1985; 31: 634-36.
16. Ross DS. New sensitive immunoradiometric assays for thyrotropin. Ann Inter Med 1986; 104:718-20.
17. Ross DS, Daniels GH, Goveia D. The use and limitations of a chemiluminiscente thyrotropin assay as a single thyroid function test in and out patient endocrine clinic. J Clin Endocrinol Metab 1990; 71: 764-69.
18. Taimela E, Alto M, Viikari J, Nuutila P, Irjala K. Third generation time-resolved immunofluorimetric TSH assay for automatic immunoassay system evaluated. Scand J Clin Lab Invest 1995; 55:537-41.
19. Sgoutas DS, Tuten TE, Verras AA, Love A, Barton EG. Aqualiteâ bioluminiscence assay of thyrotropin in serum evaluated. Clin Chem 1995; 41:1637-43.
20. Libeer JC, Simonet L, Gillet R. Analytical evaluation of twenty assays for determination of thyrotropin (TSH). Ann Biol Clin 1989;47: 1-11.
21. Bonte HA, Vermes I, Sluijs-Veer G. Analytical and clinical evaluation of three sensitive thyrotropin assays. Ann Clin Biochem 1989; 26:508-16.
22. Riviera HN, Clavert JT, Patel MT, Ball RT, Rigl CT, Smith DF. Third generation bioluminescent TSH immunoassay using Aequorin (Aqualiteâ) as the label. 47th Annual Meeting of American Association of Clinical Chemistry. Clin Chem 1995; 41 (S6 part 2): S 42
23. Kraiss S, Lenz H, Rotter A, Smmeth M, Franken N. Electrochemiluminescent 3rd generation TSH assay using the randong acces analizer Elecsysâ. 47th Annual Meeting of American Association of Clinical Chemistry. Clin Chem 1995; 41 (S6 part 2): S 52.
24. Jeffcoate SL. Standarization desing and ruggedness of immunoassay methods.En: Efficiency and effectiviness in the Endocrine Laboratory.ed Academic Press, Inc. Newyork, 1981:p.150-70.
25. Sufi S. Quality assurance of immunoassay. WHO Special Programme of Reasearch, Development and Training in Human Reproduction. Programme for Provision of Mached Assay Reagents for Immunoassay of Hormones. Londres Ed S. Sufi. HRP/WHO, 1995: 9-15.
26. Cekan SZ, Sufi SB, Wilson EW. Internal quality control for assays of reproductive hormones: guidelines for laboratories. Ed Special Programme of Research, Development and Research Training in Human Reproduction. World Health Organization. Geneva, 1993:5-6.
27. Pillai MRA, Bhandarkar SD. Chapter 5. Statistics of RIA. En: Pillai MRA, Bhandarkar SD, eds.Radioimmunoassay. Principles and Practice. Third, revised and enlarged edition. Mumbai. Isotope Division, Bhabha Atomic Research Centre.Devi Printers and Binders,Thane, India, 1999; 34-48.
Recibido: 10 de febrero de 2003. Aprobado: 23 de mayo de 2003.
Lic.Pavel Melo Cala. Centro de Isótopos (CENTIS). Ave. Monumental y Carretera la Rada km 3. Guanabacoa, Ciudad de La Habana, Cuba. e-mail:isotopo@centis.edu.cu
1 Aspirante a Investigador.
2 Investigador Agregado.