Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Endocrinología
versión On-line ISSN 1561-2953
Rev Cubana Endocrinol v.16 n.2 Ciudad de la Habana Mayo-ago. 2005
Instituto Nacional de Endocrinología
Evaluación de niveles séricos de citocinas proinflamatorias y marcadores de estrés oxidativo en mujeres embarazadas a término
Dra. Milena Rodríguez Álvarez,1 Dra. Leticia C. Sosa González,2 Dr. Antonio Marcos Rodríguez,3 Dr. Manuel de J. Araña,4 Dra. Alina Alerm González5 y Dr. Abel León Pimentel6
Resumen
El conocimiento acerca del papel del sistema inmune y el estrés oxidativo en el embarazo normal puede contribuir a profundizar en los mecanismos fisiopatológicos y en el tratamiento de las enfermedades asociadas a la gestación. Se realizó un estudio por el método de observación, transversal y descriptivo, con el objetivo de describir diferencias entre las concentraciones y la detectabilidad sérica de interleucina 6, el factor de necrosis tumoral-alfa, el ó xido nítrico y la enzima glutation peroxidasa en 10 embarazadas sanas a término, respecto a 18 mujeres no embarazadas . Se encontraron niveles detectables de interleucina 6 en el 80 % de las embarazadas y solo en el 22,2 del grupo de mujeres no embarazadas, para un valor de Chi cuadrado = 8,763 (p = 0,005). La diferencia de la detectabilidad de f actor de necrosis tumoral-alfa entre ambos grupos fue no significativa (p = 0,515) para un valor de Chi cuadrado = 0,016. No existieron diferencias significativas entre las medias de ambos grupos para óxido nítrico y glutation peroxidasa. En conclusión se encontró una mayor detectabilidad sérica de interleucina 6 , lo cual relacionamos con sus fuentes productoras aumentadas en el embarazo normal, el favorecido patrón Th2 y la activación de la inmunidad innata materna.
Palabras clave : Citocinas, IL-6, TNF, embarazo, estrés oxidativo, óxido nítrico, gpx.
El estudio e investigación de los eventos relacionados con el sistema inmune materno y el estrés oxidativo durante la gestación constituyen áreas de particular interés por su impacto en el desarrollo de una maternidad saludable.
Se considera que durante el embarazo ocurren procesos complejos que demandan la adaptación fisiológica de todos los sistemas maternos, incluyendo el sistema endocrino e inmune. En los últimos años, a propósito del paradigma T cooperador tipo 1 (Th1, del inglés helper)/T cooperador 2 (Th2), se ha postulado que la tolerancia de los tejidos fetales por la madre es consecuencia de la instauración de un predominante patrón de secreción de citocinas Th2 y de una consecuente inhibición de la respuesta Th1,1-8 lo que ha sido vinculado con modificaciones hormonales típicas del embarazo.9-11 En contraste, la existencia de un predominio Th1 se ha asociado con abortos recurrentes.12-14 Sin embargo, actualmente se plantea que esta dicotomía Th1/Th2 simplifica las modificaciones de la inmunidad materna.14-16 Se ha demostrado que ciertamente existe una tendencia al aumento de citocinas Th2 como IL-4 e IL-10, con disminución de IFN-gamma, aunque esta interleucina parece ser esencial al inicio del embarazo.17 También se observa un aumento de TGF-beta, que se considera un patrón Th3.1,13,14,16 Otra modificación importante es la exacerbación de la inmunidad innata asociada a una respuesta inflamatoria generalizada, con producción de citocinas proinflamatorias como interleucina 6 (IL-6), interleucina 1 beta (IL-1-beta), interleucina 8 (IL-8), factor de necrosis tumoral-alfa (TNF-alfa) y activación de monocitos y granulocitos, lo que contribuye a fortalecer la defensa de la madre ante las infecciones.14,18,19
El incremento de citocinas proinflamatorias y de la actividad de monocitos y granulocitos, asociado al aumento de los requerimientos de las necesidades de oxígeno durante el embarazo, favorece la producción de especies reactivas de oxígeno (EROs) y nitrógeno (ERNs), como los peróxidos y el óxido nítrico (ON) que, de saturar las defensas antioxidantes (cofactores y enzimas como la glutation peroxidasa (GPX), resultarían en una condición denominada estrés oxidativo.20-22
El estrés oxidativo y el aumento de algunas citocinas proinflamatorias son eventos también relacionados con trastornos en diferentes momentos de la gestación como el aborto recurrente, la preeclampsia, la ruptura prematura de membrana, y las infecciones.23-28
El conocimiento del papel del sistema inmune y el estrés oxidativo en el embarazo normal puede contribuir a profundizar en los mecanismos fisiopatológicos y en el tratamiento de las enfermedades asociadas a la gestación. De esta forma se decidió determinar la concentración de ON, la actividad específica de GPX y la detectabilidad sérica de IL-6 y TNF-alfa en un grupo de embarazadas aparentemente sanas a término, con fines fundamentalmente descriptivos.
Métodos
Se realizó un estudio por el método de observación, transversal y descriptivo, en embarazadas a término (entre 37 y 41 semanas) con cesárea electiva programada, sin haber comenzado trabajo de parto (n=10), provenientes del Hospital General Docente ¨Enrique Cabrera¨. Como grupo control se incluyeron mujeres no embarazadas, aparentemente sanas (n=18, trabajadoras del Hospital). Las muestras de suero se obtuvieron por punción venosa periférica en la región antecubital del brazo. Para ambos grupos del estudio se excluyó: padecer en los últimos 6 meses enfermedades agudas o crónicas que comprometan al sistema inmunológico como infecciones o procesos inflamatorios de cualquier naturaleza, haber consumido medicamentos inmunosupresores o inmunomoduladores en un período mínimo de 6 meses, ser fumadora o alcohólica y no haber estado de acuerdo con participar en la presente investigación. Para las embarazadas incluidas fue requisito indispensable no haber presentado ninguna complicación o enfermedad durante todo el período de gestación.
Ensayo de actividad específica de la enzima (GPX)
La actividad de la GPX extracelular glicocilada, presente en el plasma sanguíneo, se determinó mediante la cuantificación de la velocidad de oxidación del glutation reducido (GSH) por el hidroperóxido de cumeno, la cual es proporcional a la generación de glutation oxidado, al consumo de este por la glutation reductasa presente en la mezcla de reacción y al consumo de NADPH. Las especificaciones se detallan a continuación:
| GPX | |
| Mezcla de reacción | 800 µL solución X* 100 µL muestra o blanco** Incubación durante 5 min 100 µL hcumeno 10 mmolL-1 |
| ? (nm) Tiempo (s) | 150 kNADPH= 6,22
|
| *Solución X: Fosfato de sodio 0,1 molL-1/GSH 125 molL-1/NADPH 187,5 mmolL-1/GRD 0,3 UmL-1/ EDTA Na2 1 mmolL-1/NaN3 2 mmolL-1. | |
Cálculos:
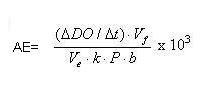
Donde:
AE: actividad específica (nmol min-1mg-1), ?DO/ ?t: diferencia de las variaciones de la densidad óptica en el tiempo entre la muestra y el blanco (min-1), Vf: volumen final en la cubeta (mL), Ve: volumen de muestra (mL), k: coeficiente de extinción (Lmmol-1 cm-1), P: concentración de proteína (mg/mL-1), b = 1,0 cm: ancho de la cubeta (cm).
Para el cálculo de P fue necesaria la cuantificación de proteínas totales, que se realizó como sigue: 100 mL de muestra de albúmina de suero bovino o de Tris 50 mmolL-1/EDTA 0,1 mmolL-1 pH 7,60 (blanco). Fueron mezclados mediante agitación en vórtex con 2,0 mL de azul brillante de Coomassie 0,1 mg/mL en H3PO4 8,5 %/etanol 0,05. La densidad óptica a 595 nm se midió en el espectrofotómetro utilizando una cubeta de vidrio de 1,0 mL de capacidad y 1 cm de paso de luz 45. Cada día de análisis se realizó la calibración con soluciones de la albúmina a concentraciones de 0,045, 0,089, 0,134 y 0,178 mg/mL-1 determinadas estas a partir del coeficiente de extinción a 280 nm (k = 0,68 mL mg-1).
Determinación de los niveles séricos de ON
La determinación de ON se realizó de manera indirecta a través de la cuantificación de nitritos por la reacción colorimétrica de estos con el reactivo de Griess (V/V1 % sulfonilamida en 2,5 de ácido fosfórico, 1,0 de naftilendiamina en agua). El montaje de esta técnica se realizó en placas Costar de 96 pocillos y fondo plano, donde se incluyó por réplicas una curva patrón estándar de nitrito de sodio (500 mM)) en tampón fosfato de pH=7,5 (15 mM K2 HPO4, 31 mM KH2PO4 [6:1]). Las muestras de suero se diluyeron 1 en 2 en tampón fosfato y se aplicaron 50 µL por réplica, y posteriormente se le añadió la enzima nitrato reductasa (Roche). La placa se incubó 1 h en la oscuridad a temperatura ambiente para después revelarse con 200 µL de reactivo de Griess (15 min de incubación). Finalmente se midió la absorbancia a una densidad óptica de 540 nm en un lector de placas.
Determinación de citocinas
Ensayo para cuantificación de TNF-alfa humano. Este es un ensayo tipo ELISA (enzyme linked immunosorbent assay) que utiliza como anticuerpo de captura un monoclonal específico para TNF alfa humano (61E71) y como segundo anticuerpo, un policlonal de conejo anti-TNF-alfa humano purificado por inmunoafinidad (Hy cult biothecnology b.v., Uden, Holanda). Placas de 96 pozos (Costar, USA) se recubrieron con el anticuerpo 61E71 (2,5 µg/mL) diluido (1:1 000) en buffer fosfato (PBS), por incubación durante 18 h a 4 ºC en cámara húmeda. Luego, se decantó el contenido de las placas y se adicionaron 125 µL/pozo de PBS con albúmina de suero bovina (ASB) al 1 % y se incubó por 90 min a temperatura ambiente. Al término de esta incubación, se eliminó el contenido de las placas y se adicionaron las muestras a evaluar, así como la curva patrón de TNF-alfa humano (10 ng a 25 pg/mL), obtenida por dilución seriada 1:2 en PBS con BSA al 0,1 %. Las placas se incubaron por 1 h a temperatura ambiente, se decantó su contenido y se adicionó el anticuerpo policlonal de conejo anti-TNF diluido (1:1 000) en PBS con ASH al 0,1 %. Luego, se desechó el contenido de los pozos y se adicionaron 100 µL de anticuerpo de carnero antiinmunoglobulina de conejo conjugado a peroxidasa (anticonejo peroxidasa), diluido 1:5 000 en PBS con ASB al 0,1 %. La placa se incubó por 1 h a temperatura ambiente, se decantó su contenido y se lavó 5 veces con Tween 20 al 1 % en agua destilada y se mantuvo en reposo durante 1 min entre cada paso de lavado. La actividad peroxidasa se determinó por adición de la solución sustrato [dihidrocloruro de 3,3´, 3,5´-tetrametilbencidina (Sigma St. Louis, MO) al 0,01 %, peróxido de hidrógeno al 0,025, en solución tampón citrato-fosfato 0,05 M pH 5,5. Transcurridos 15 min a temperatura ambiente, la reacción se detuvo por adición de 100 µL/pozo de ácido sulfúrico 1 M. La absorbancia se determinó por espectrofotometría a 450 nm en un lector de placas (Sensident Scan, Merck, Alemania). El mínimo nivel de detección utilizado fue de 25 pg/mL. Valores inferiores a esta concentración se consideraron indetectables.
Ensayo para cuantificación de IL-6 humana
Los niveles de IL-6 se determinaron por un ensayo tipo ELISA que utiliza como anticuerpo de captura un monoclonal específico para IL-6 humana (5E1) y como segundo anticuerpo un policlonal biotinilado anti IL-6 de conejo (Hy cult biothecnology b.v., Uden, Holanda). Las placas de 96 pozos (Costar-corning, Cambridge, MA) se recubrieron con el anticuerpo 5E1 diluido 1:2000 en PBS, por incubación durante 18 h a 4 ºC en cámara húmeda. Luego, se removió el sobrenadante de las placas, se adicionaron 125 µL de PBS con ASB al 1 % y se incubaron las placas por 90 min a temperatura ambiente. Al término de esta incubación, las placas se lavaron 5 veces con solución de lavado (Tween 20 al 0,1 % en agua destilada) y se mantuvieron en reposo durante 1 min entre cada paso de lavado. Seguidamente se añadieron las muestras a evaluar y las correspondientes a la curva patrón de IL-6 (10 ng/mL a 25 pg/mL), obtenida por diluciones seriadas 1:2 en PBS con ASB al 0,1 %. Transcurridas 2 h de incubación a temperatura ambiente, se removió el sobrenadante de las placas, se lavaron 5 veces con solución de peroxidasa (Sigma St. Louis, MO), diluido 1:5 000 en PBS con ASB al 0,1 %. Las placas se incubaron nuevamente por 1 h a temperatura ambiente, se lavaron 5 veces y para medir la actividad de la peroxidasa se adicionó la solución de sustrato. Después de 15 min de incubación a temperatura ambiente, la reacción se detuvo por adición de 100 µL por pozo de ácido sulfúrico 1 M. La absorbancia a 450 nm se determinó por espectrofotometría con lector de placas (Sensident Scan, Merck, Alemania). El límite de detección del ensayo fue de 25 pg/mL, por lo que los valores inferiores a esta concentración se consideraron indetectables.
Procesamiento estadístico
Se verificó el ajuste a la normalidad de todas las variables cuantitativas continuas incluidas en el estudio, con el uso del Test de Kolmogorov-Smirnov. Para explorar la asociación entre la presencia de citocinas detectables (TNF-alfa e IL-6) en suero en embarazadas y mujeres no embarazadas, se utilizó Chi cuadrado. Se realizaron análisis de covarianza para determinar la diferencia entre medias en los 2 grupos estudiados: la actividad específica de GPX y óxido nítrico. Se utilizó como covariante la edad para remover su efecto, por ser el envejecimiento un estado fisiológico modificador de efectos. Para procesar estadísticamente los resultados se utilizó el sistema computarizado SPSS 10.0. Para todas las pruebas estadísticas se utilizó el nivel de significación de 0,05.
Resultados
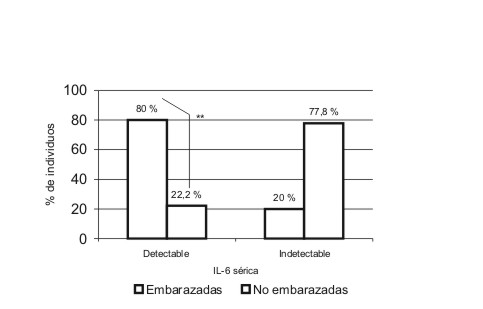
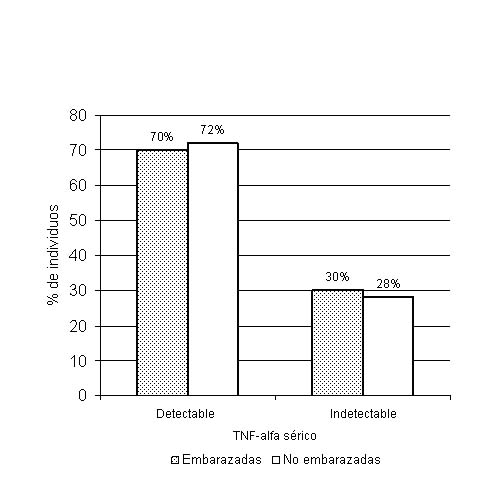
En la tabla se describen las medidas de localización de las variables cuantitativas incluidas en el estudio. Se encontraron niveles detectables de IL-6 en un 22,2 % (4/18) de las mujeres no embarazadas y en un 80 % (8/10) de las embarazadas. Esta diferencia en las proporciones explica un valor de 2 = 8,763 muy significativo (p = 0,005). Se detectaron niveles séricos de TNF-alfa en el 70 % (7/10) de las embarazadas y en un 72,2 (13/18) en mujeres no embarazadas para un valor de 2 = 0,016 no significativo, responsable de una p = 0,515 (figs. 1 y 2).
Tabla. Medidas descriptivas de variables cuantitativas para ambos grupos
| Variables | Embarazadas | No embarazadas | ||
| Media | DE | Media | DE | |
| Edad (años) | 24,200 | 4,2374 | 40,021 | 8,915 |
| Edad G (meses) | 38,200 | 1,5055 | - | - |
| GPX (nmol/min) | 1,967 | 0,5774 | 1,758 | 0,4464 |
| ON ( mol/L) | 44,150 | 23,391 | 37,62 | 22,633 |
GPX: Glutation peroxidasa.
ON: Óxido nítrico.
DE: Desviación estándar.
Edad G: Edad gestacional.
FIG. 1. Niveles detectables de IL-6 en mujeres embarazadas y no embarazadas. Se muestra una diferencia significativa entre el número de embarazadas y no embrazadas con niveles detectables de IL-6 (p < 0,01).
FIG. 2. Niveles detectables de TNF-alfa en mujeres embarazadas y no embarazadas. Se muestra ausencia de diferencia significativa entre el número de embarazadas y no embrazadas con niveles detectables de TNF-alfa.
El cálculo de diferencia entre medias, según ANCOVA, arrojó una media de la actividad específica de GPX discretamente mayor para embarazadas (tabla) respecto al grupo control. Esta diferencia no fue significativa (F = 0,021, p = 0,8997). Algo similar ocurre con el ON, donde se encuentra la media mayor en embarazadas sin ser significativamente diferente (F = 0,102, p = 0,75).
Discusión
Detectabilidad sérica de IL-6 y TNF-alfa
La detectabilidad de IL-6 en embarazadas fue superior respecto a las mujeres no embarazadas. En la bibliografía se ha reportado un aumento de la producción basal de IL-6 durante el embarazo normal respecto a mujeres no embarazadas.2,29,30 Esta citocina es producida por varios tipos celulares y durante la gravidez es además secretada por membranas fetales y células deciduales, lo que suministra un aporte extra a las concentraciones séricas de IL-6.2,31-33 Durante el tercer trimestre se ha descrito una mayor concentración de IL-6 en células mononucleares periféricas respecto a células deciduales, y puede ser esta la fuente fundamental de esta citocina en este trimestre.2 La mayor detectabilidad de IL-6 en embarazadas pudiera también justificarse por la activación de la inmunidad innata materna, que ocurre en el embarazo normal como parte de los cambios en el sistema inmune de la madre y desencadena, entre otros elementos, un aumento en la producción de citocinas proinflamatorias.14,18,19
A pesar de ser también el TNF-alfa una citocina proinflamatoria, en el presente estudio no se encontró una mayor proporción de sus niveles detectables en plasma de embarazadas. En la literatura ha sido reportado un aumento de su concentración basal plasmática durante el embarazo.34,35 Otros autores han descrito disminución de su concentración en comparación con mujeres no embrazadas,36-39 lo que se ha acompañado de un aumento en la producción de esta citocina por células de sangre periférica al ser retadas por endotoxina inductora de TNF-alfa con respecto a un grupo control.36,40
Esta diferencia en la detectabilidad sérica de TNF-alfa e IL-6 pudiera estar en las fuentes de producción de ambas citocinas. El TNF-alfa no es abundantemente producido por membranas fetales y deciduas. Su fuente principal son monocitos y macrófagos que, aunque preparados para responder enérgicamente ante un reto como parte de la exacerbación de la inmunidad innata materna, se encuentran durante el embarazo bajo la influencia de un predominante perfil de secreción de citocinas Th2 con inhibición Th1,1-11 por lo que existiría un ambiente que no favorece la producción de TNF-alfa y sí de IL-6.5
Al manipularse los niveles detectables de citocinas como variables cualitativas y tratarse de muestras pequeñas para ambos grupos, resulta imposible remover el efecto de la influencia de la diferencia de la edad en los resultados. Sin embargo, en este sentido el envejecimiento trae consigo un aumento basal de citocinas proinflamatorias,41-43 por lo que hubiera podido esperarse un mayor número de mujeres no embarazadas con niveles detectables de TNF e IL-6, a diferencia de lo encontrado.
Actividad de GPX y niveles de ON en el suero
La media ligeramente superior de GPX encontrada en embarazadas pudiera vincularse con reajustes propios de la gestación, así como la vitaminoterapia precoz indicada durante el embarazo. Sin embargo, esta superioridad en la media de GPX no fue significativa. Nos inclinamos a suponer que esta ausencia de diferencias no existiría en muestras mayores. En la literatura se ha reportado una disminución de esta enzima en el primer trimestre, normalizada hacia el final de la gestación.44 También ha sido descrito su aumento en el tercer trimestre del embarazo normal.45,46 Otros autores han encontrado niveles de GPX similares en todos los trimestres del embarazo.47 Finalmente, ha sido asociada la disminución de la GPX con la aparición de preclampsia y otras complicaciones durante la gestación.48,49
El ON, además de sus propiedades como radical libre, es un potente vasodilatador liberado por las células endoteliales que, durante la gravidez, juega un importante papel en la modulación del tono vascular materno fetal.50 Algunos autores han descrito que la concentración en sangre periférica y orina de nitratos/nitritos durante el embarazo permanece estable.51 Otros, sin embargo, han referido un aumento de la concentración de ON en sangre periférica con respecto a mujeres no embarazadas.50,52-54 En el presente estudio, sin ser significativa la diferencia, la media de embarazadas resultó un poco mayor.
En conclusión, nuestros resultados demostraron una mayor detectabilidad sérica de IL-6 y no de TNF en embarazadas a término sin complicaciones respecto al grupo control, lo cual relacionamos con las fuentes productoras de IL-6 aumentadas en el embarazo normal, el favorecido patrón Th2 y la activación de la inmunidad innata materna. Este último elemento, unido al aumento de las necesidades de oxígeno durante el embarazo, induce un incremento en la producción de ROS y REN y un aumento probablemente compensatorio de las defensas antioxidantes; sin embargo, no se encontró significación en el aumento de ON ni GPX, resultados que pudieran estar condicionados por la exigüidad de la muestra. Sería interesante realizar otros estudios donde se puedan cuantificar estas variables en los 3 trimestres del embarazo normal con una muestra mayor, y asociar grupos de pacientes con diabetes gestacional y preclampsia, entre otras patologías asociadas al embarazo, donde se ha descrito la inflamación como fenómeno subyacente.
Summary
Evaluation of the serum levels of proinflammatory cytokines and oxidative stress markers in term pregnant women
The knowledge about the role of the immune system and of oxidative stress in normal gestation, can contribute to go deep into the physiopathological mechanisms and in the treatment of diseases associated with pregnancy. An observational descriptive study was carried out in order to describe differences among the concentrations and the plasmatic detectable levels of interleukine 6, tumor necrosis factor-alpha, nitric oxide and glutathione peroxidase enzyme in ten healthy term pregnant women that were compared with 18 non-pregnant women. Detectable interleukine 6 levels were found in 80 % of the pregnant women and only in 22.2 % of the control group for a Chi square value of 8,763 (p<0,005). The difference in the detectable levels of tumor necrosis factor-alpha between both groups was not significant (p = 0.515) for a Chi square value of 0.016. There were no significant differences between the means of both groups for nitric oxide and glutathione peroxidase. To conclude, it was observed a higher detectable serum level of interleukin 6, which was related to its producing sources increased during normal pregnancy, the favored Th2 pattern and the activation of the maternal innate immunity.
Key words : Cytokines, IL-6, TNF, pregnancy, oxidative stress, nitric oxide, gpx.
Referencias bibliográficas
1. Wilczynski JR, Tchorzewski H, Banasik M, Glowacka E, Wieczorek A, Lewkowicz P, et al. Lymphocyte subset distribution and cytokine secretion in third trimester decidua in normal pregnancy and preeclampsia. Eur J Obstet Gynecol Reprod Biol 2003;109(1):8-15.
2. Wilczynski JR, Tchorzewski H, Glowacka E, Banasik M, Szpakowski M, Wieczorek A, et al. "In vitro" cytokine secretion by peripheral blood and decidual lymphocytes during the third trimester of normal pregnancy. Gynecol Obstet Invest 2003;55(2):68-72.
3. Gilman-Sachs A, Thaker P, Beaman KD, Beer AE, Kwak-Kim J. Expression of intracellular Th1 and Th2 cytokines in women with recurrent spontaneous abortion, implantation failures after IVF/ET or normal pregnancy. Am J Reprod Immunol 2002;48(2):77-86.
4. Taylor DD, Sullivan SA, Eblen AC, Gercel-Taylor C. Modulation of T-cell CD3-zeta chain expression during normal pregnancy. J Reprod Immunol 2002;54(1-2):15-31.
5. Matthiesen L, Khademi M, Ekerfelt C, Berg G, Sharma S, Olsson T, et al. In-situ detection of both inflammatory and anti-inflammatory cytokines in resting peripheral blood mononuclear cells during pregnancy. J Reprod Immunol 2003;58(1):49-59.
6. Vizi ES, Szelenyi J, Selmeczy ZS, Papp Z, Nemeth ZH, Hasko G. Enhanced tumor necrosis factor-alpha-specific and decreased interleukin-10-specific immune responses to LPS during the third trimester of pregnancy in mice. J Endocrinol 2001;171(2):355-61.
7. Wilczynski JR, Tchorzewski H, Banasik M, Glowacka E, Wieczorek A, Lewkowicz P, et al. Lymphocyte subset distribution and cytokine secretion in third trimester decidua in normal pregnancy and preeclampsia. Eur J Obstet Gynecol Reprod Biol 2003;109(1):8-15.
8. Dealtry GB, O'Farrell MK, Fernández N. The Th2 cytokine environment of the placenta. Int Arch Allergy Immunol 2000;123(2):107-19.
9. Piccinni MP, Scaletti C, Maggi E, Romagnani S. Role of hormone-controlled Th1 and Th2 type cytokines in successful pregnancy. J Neuroimmunol 2000;109(1):30-3.
10. Szekeres-Bartho J, Faust ZS, Varga P. The immunological pregnancy effect of progesterone is manifested vía controlling cytokine production. Am J Reprod Immunol 1996;35:348-51.
11. Plevyak M, Hanna N, Mayer S, Murphy S, Pinar H, Fast l, et al. Deficiency of decidual IL-10 in first trimester missed abortion: A lack of correlation with the decidual immune cell profile. Am J Reprod Immunol 2002;47(4):242-50.
12. Daher S, de Arruda Geraldes Denardi K, Blotta MH, Mamoni RL, Reck AP, Camano L, et al. Cytokines in recurrent pregnancy loss. J Reprod Immunol 2004;62(1-2):151-7.
13. Coulam C. Understanding The immunobiology of pregnancy and applying it to treatment of recurrent prgnancy loss. Early pregnancy. Biology and Medicine 2000;4(1):19-29.
14. Luppi P. How immune mechanisms are affected by pregnancy. Vaccine 2003; 21:3352-57.
15. Zenclussen A, Fest S, Busse P, Joachim R, Klapp B, Arck P. Questioning the Th1/Th2 paradigm in reproduction: Peripheral levels of IL-12 are down-regulated in miscarriage patients. Am J Reprod Immunol 2002;48:245-51.
16. Margni RA, Zenclussen A. During Pregnancy, in the context of a Th2-type cytokine profile, Serum IL-6 levels might condition the quality of the synthesized antibodies. Am J Reprod Immunol 2001;46:181-87.
17. Ashkar AA, Di Santo JP, Croy BA. Interferon gamma contributes to initiation of uterine vascular modification, decidual integrity, and uterine natural killer cell maturation during normal murine pregnancy. J Exp Med 2000;192(2):259-70.
18. Luppi P, Haluszczak C, Betters D, Richard CA, Trucco M, DeLoia JA. Monocytes are progressively activated in the circulation of pregnant women. J Leukoc Biol 2002;72(5):874-84.
19. Luppi P, Haluszczak C, Trucco M, Deloia JA. Normal pregnancy is associated with peripheral leukocyte activation. Am J Reprod Immunol 2002;47(2):72-81.
20. Hensley K, Robinson KA, Gabbita P, Salsman S, Floyd RA. Reactive oxygen species, cell signaling and cell injury. Free Rad Biol Med 2000;28:1456-62.
21. Beckman JS, Koppenol WH. Nitric oxide, superoxide and peroxynitrite: the good, the bad and the ugly. Am J Physiol 1996;271(Cell Physiol 40):C1424-37.
22. Abbas AK, Lichtman AH, Pober JS. Mecanismos efectores de las reacciones inmunitarias mediadas por las células T. En: Inmunología celular y molecular. Boston. Massachusetts, McGraw 1999.p.309-29.
23. Smulian JC, Bhandari V, Vintzileos AM, Shen-Schwarz S, Quashie C, Lai-Lin YL. Intrapartum fever at term: serum and histologic markers of inflammation. Am J Obstet Gynecol 2003;188(1):269-74.
24. Rein DT, Breidenbach M, Honscheid B, Friebe-Hoffmann U, Engel H, Gohring UJ, et al. Preeclamptic women are deficient of interleukin-10 as assessed by cytokine release of trophoblast cells in vitro. Cytokine 2003;23(4-5):119-25.
25. Maternal-placental interactions of oxidative stress and antioxidants in preeclampsia. Semin Reprod Endocrinol 1998;16(1):93-104.
26. Vaughan JE, Walsh SW. Oxidative stress reproduces placental abnormalities of preeclampsia. Hypertens Pregnancy 2002;21(3):205-23.
27. Orhan H, Onderoglu L, Yucel A, Sahin G. Circulating biomarkers of oxidative stress in complicated pregnancies. Arch Gynecol Obstet 2003;267(4):189-95.
28. Pyska W, Klejewski A, Karolkiewicz J, Szczesniak L, Szczesniak-Chmielecka A, Nowak A. Imbalance of pro-oxidants-antioxidants in blood of pregnant women with pregnancy induced hypertension. Ginekol Pol 2002;73(1):14-8.
29. Terana E, Escuderob C, Moyab W, Floresb M, Vallancec P, Lopez-Jaramillo P. Elevated C-reactive protein and pro-inflammatory cytokines in andean women with preeclampsia. International J Obstet Gynecol 2001;75:243-49.
30. López-Jaramillo P, Casas JP, Serrano N. Preeclampsia: from epidemiological observations to molecular mechanisms. Brazilian Journal of Medical and Biological Research 2001;34:1227-35.
31. Mazzucchelli L, Avanzini MA, Ciardelli L, Pagani S, Greco R, Belloni C, et al. Human amniotic fluid cells are able to produce IL-6 and IL-8. Am J Reprod Immunol 2004;51(3):198-203.
32. Kauma-SW; Wang-Y; Walsh-SW. Preeclampsia is associated with decreased placental interleukin-6 production. J-Soc-Gynecol-Investig 1995;2(4):614-7.
33. El-Shazly S, Makhseed M, Azizieh F, Raghupathy R. Increased expression of pro-inflammatory cytokines in placentas of women undergoing spontaneous preterm delivery or premature rupture of membranes. Am J Reprod Immunol 2004;52(1):45-52.
34. Melczer Z, Banhidy F, Csomor S, Kovacs M, Siklos P, Winkler G, et al. Role of tumour necrosis factor-alpha in insulin resistance during normal pregnancy. Eur J Obstet Gynecol Reprod Biol 2002;105(1):7-10.
35. Daher S, Fonseca F, Ribeiro OG, Musatti CC, Gerbase-DeLima M. Tumor necrosis factor during pregnancy and at the onset of labor and spontaneous abortion. Eur J Obstet Gynecol Reprod Biol 1999;83(1):77-9.
36. Rigo J, Szelenyi J, Selmeczy Z, Papp Z, Vizi ES. Endotoxin-induced TNF-alpha production changes inversely to its plasma level during pregnancy. Eur J Obstet Gynecol Reprod Biol 2004;114(2):236-8.
37. Molina Vílchez R, Romero Adrián T, Ruiz A, González E, Estévez J, Atencio R. Concentraciones séricas de factor de necrosis tumoral alfa en el embarazo normal. Rev Venezolana Obstet Ginecol 1999;59:167-171.
38. Molina R, Romero T, Bermúdez I, Flores J, Fuenmayor J, Núñez JR, et al. Factor de necrosis tumoral-alfa en el suero de embarazadas normales y preeclámpticas. Caracas. Gac Méd 2001;109 No. 4.
39. Beckman I, Visser W, Strujik P, Van Dooren M, Glavimans J, Wallemburg H. Circulating bioactive tumor necrosis factor-alpha inducible cell? receptors, fibronectin and tumor necrosis factor-alpha factor- adhesion molecule VCAM-1 in uncomplicated pregnancy. Am J Obstet Gynecol 1997;177:1247-52.
40. Vizi ES, Szelenyi J, Selmeczy ZS, Papp Z, Nemeth ZH, Hasko G. Enhanced tumor necrosis factor-alpha-specific and decreased interleukin-10 specific immune responses to LPS during the third trimester of pregnancy in mice. J Endocrinol 2001;171(2):355-61.
41. Bruunsgaard H, Pedersen M, Pedersen BK. Aging and proinflammatory cytokines. Curr Opin Hematol 2001;8(3):131-6.
42. Penninx BW, Kritchevsky SB, Newman AB, Nicklas BJ, Simonsick EM, Rubin S, et al Inflammatory markers and incident mobility limitation in the elderly. J Am Geriatr Soc. 2004;52(7):1105-13.
43. Cesari M, Penninx BW, Pahor M, Lauretani F, Corsi AM, Rhys Williams G, et al. Inflammatory markers and physical performance in older persons: the InCHIANTI study. J Gerontol A Biol Sci Med Sci. 2004;59(3):242-8.
44. Toescu V, Nuttall SL, Martin U, Kendall MJ, Dunne F. Oxidative stress and normal pregnancy. Clin Endocrinol 2002;57(5):609-13.
45. Ohyama K, Yuan B, Bessho T, Yamakawa T. Progressive apoptosis in chorion laeve trophoblast cells of human fetal membrane tissues during in vitro incubation is suppressed by antioxidative reagents. European Journal of Biochemistry 2001;268(23):6182.
46. Chen X, Scholl TO, Leskiw MJ, Donaldson MR, Stein TP. Association of glutathione peroxidase activity with insulin resistance and dietary fat intake during normal pregnancy. J Clin Endocrinol Metab 2003;88(12):5963-8.
47. Funai EF, MacKenzie A, Kadner SS, Roque H, Lee MJ, Kuczynski E. Glutathione peroxidase levels throughout normal pregnancy and in pre-eclampsia. J Matern Fetal Neonatal Med 2002;12(5):322-6.
48. Orhan H, Onderoglu L, Yucel A, Sahin G. Circulating biomarkers of oxidative stress in complicated pregnancies. Arch Gynecol Obstet 2003;267(4):189-95.
49. Pyska W, Klejewski A, Karolkiewicz J, Szczesniak L, Szczesniak-Chmielecka A, Nowak A. Imbalance of pro-oxidants-antioxidants in blood of pregnant women with pregnancy induced hypertension. Ginekol Pol 2002;73(1):14-8.
50. Ozerol E, Ozerol I, Gokdeniz R, Temel I, Akyol O. Effect of smoking on serum concentrations of total homocysteine, folate, vitamin B12, and nitric oxide in pregnancy: a preliminary study. Fetal Diagn Ther 2004;19(2):145-8.
51. Schiessl B, Strasburger CJ, Bidlingmaier M, Spannagl M, Ugele B, Kainer F. Decreasing resistance in the maternal uterine and peripheral arterial system is apparently unrelated to plasma and urinary levels of nitrite/nitrate and cyclic-guanosinmonophosohate during the course of normal pregnancies. J Perinat Med 2003;31(4):281-6.
52. Choi JW, Im MW, Pai SH. Nitric oxide production increases during normal pregnancy and decreases in preeclampsia. Ann Clin Lab Sci 2002;32(3):257-63.
53. Von Mandach U, Lauth D, Huch R. Maternal and fetal nitric oxide production in normal and abnormal pregnancy. J Matern Fetal Neonatal Med 2003;13(1):22-7.
54. Goodrum LA, Saade GR, Belfort MA, Moise KJ, Jahoor F. Arginine flux and nitric oxide production during human pregnancy and postpartum. J Soc Gynecol Investig 2003;10(7):400-5.
Recibido: 4 de febrero de 2005. Aprobado: 25 de abril de 2005.
Dra. Milena Rodríguez Álvarez. Instituto Nacional de Endocrinología. Zapata y D, Vedado, Ciudad de La Habana, Cuba.
1 Especialista de I Grado en Inmunología.
2 Especialista de I Grado en MGI y en Inmunología. Sección de Inmunohematología. Instituto Nacional de Hematología e Inmunología.
3 Especialista de I Grado en MGI y en Inmunología. Instructor. Departamento de Ciencias Fisiológicas. Facultad de Estomatología del Instituto Superior de Ciencias Médicas de La Habana.
4 Especialista de II Grado en Inmunología. Doctor en Ciencias Médicas. Investigador Titular.
5 Especialista de II Grado en Fisiología Normal y Patológica y en Inmunología. Profesor Titular. Vicedecanato de Investigación y Postgrado. Instituto de Ciencias Básicas y Preclínicas ¨Victoria de Girón¨.
6 Especialista de I Grado en Medicina Interna. Hospital ¨Hermanos Aimejeiras¨.