Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Endocrinología
versión On-line ISSN 1561-2953
Rev Cubana Endocrinol v.21 n.3 Ciudad de la Habana sep.-dic. 2010
ARTÍCULOS ORIGINALES
Características clínicas de los episodios de hipoglucemia en niños y adolescentes con diabetes tipo 1 atendidos en el Hospital Pediátrico "William Soler"
Clinical features of hypoglycemic episodes in children and adolescents presenting with type 1 diabetes seen in "William Soler" Children Hospital
Pedro González FernándezI; Ciro González FernándezII; Miguel Ángel Álvarez GonzálezIII; Julieta García SáezIV
IEspecialista de II Grado en Endocrinología. Profesor e Investigador Auxiliar. Hospital Pediátrico Docente "William Soler". La Habana, Cuba.
IILicenciado en Matemáticas. Máster en Estadística Aplicada. Investigador Titular. Facultad de Ciencias Médicas "Julio Trigo López". La Habana, Cuba.
IIILicenciado en Psicología. Doctor en Ciencias. Investigador Titular. Instituto Nacional de Neurología y Neurocirugía. La Habana, Cuba.
IVEspecialista de I Grado en Medicina General Integral y en Endocrinología. Hospital Pediátrico Docente "José Luis Miranda". Villa Clara, Cuba.
RESUMEN
INTRODUCCIÓN: la hipoglucemia es la complicación más frecuente en el tratamiento de la diabetes mellitus, y para algunos constituye el problema más grave asociado a la enfermedad.
OBJETIVO: determinar la frecuencia y las características clínicas de la hipoglucemia en un grupo de niños y adolescentes diabéticos tipo 1.
MÉTODOS: se realizó un estudio retrospectivo en 48 niños y adolescentes con diagnóstico de diabetes mellitus tipo 1, atendidos en el Servicio de Endocrinología del Hospital Pediátrico Docente "William Soler", en el período comprendido entre Enero de 1987 y Enero de 2000. Se tomaron de las historias clínicas los datos generales del paciente, el régimen de insulinoterapia y la dosis total diaria de insulina, los resultados de la hemoglobina glucosilada, así como los episodios referidos de hipoglucemias, los que se clasificaron en ligeras y severas.
RESULTADOS: se encontró una frecuencia elevada de episodios de hipoglucemias severas (56,25 %). La primera hipoglucemia severa se registró con mayor frecuencia en el grupo de edad de menor de 5 años, mientras que las hipoglucemias ligeras fueron más frecuentes en el de mayor de 5 años. El primer episodio de hipoglucemia severa ocurrió antes del primer año de realizado el diagnóstico de la diabetes mellitus. Los pacientes con régimen intensivo sufrieron un mayor porcentaje de episodios de hipoglucemia severa, que los pacientes con régimen convencional. El control metabólico no influyó en la ocurrencia de los episodios de hipoglucemia severa.
CONCLUSIONES: los episodios de hipoglucemia ocurrieron con una elevada frecuencia, con predominio de las severas, con una mayor frecuencia en la madrugada, y con mayor afectación en el grupo de menores de 5 años de edad, lo que constituye un riesgo de afectación del neurodesarrollo en este grupo de edad.
Palabras clave: Hipoglucemia, diabetes mellitus tipo 1, hipoglucemia insulínica, hipoglucemia nocturna.
ABSTRACT
INTRODUCTION: hypoglycemia is the more frequent complication in the treatment of diabetes mellitus and for some it is a more serious problem associated with the disease.
OBJETIVE: to determine the frequencies and the clinical features of hypoglycemia in a group of diabetic children and adolescents diagnosed with type 1 diabetes mellitus seen in the Endocrinology of the "William Soler" Children Hospital from January, 1987 and January, 2000. Medical records, general data of patient, insulin therapy , results of glycosylated hemoglobin were registered, as well as the recounted hypoglycemia episodes which were classified as slight and severe.
RESULTS: there was a high frequency of hypoglycemia episodes (56,25 %). The first severe hypoglycemia was registered as more frequent at the age group of 5 years. The first severe hypoglycemia episode occurred before the first year of diagnosis of diabetes mellitus. Patients under a intensive regime had a greater percentage of episodes of severe hypoglycemia than those under a conventional regime. The metabolic control not influenced in occurrence of severe hypoglycemia episodes.
CONCLUSIONS: the above mentioned episodes had a high frequency with predominance of the severe ones during the dawn and with more involvement in the group aged under 5 being a neurodevelopmental affection of development in this age group.
Key words: Hypoglycemia, type 1 diabetes mellitus, insulin hypoglycemia, nocturnal hypoglycemia.
INTRODUCCIÓN
La hipoglucemia es la complicación más frecuente en el tratamiento de la diabetes mellitus tipo 1 (DM 1), y para algunos constituye el problema más grave asociado a la enfermedad.1,2 Si bien es cierto que en los últimos años se ha llegado a mejorar el tratamiento con insulina mediante la aplicación de un régimen intensivo con dosis múltiple o sistemas de infusión continua, así como el uso de sus análogos que remedan la secreción pancreática de esta hormona en sujetos no diabéticos, la amenaza de los episodios de hipoglucemia (EH) continúa siendo hoy día una barrera difícil de vencer.3 Por otra parte, es conocido que en aquellas personas en edades extremas de la vida (niños y ancianos) los EH son aún más graves en sus consecuencias.4-6
En los niños menores de 5 años la posibilidad de daño irreversible en el neurodesarrollo es un peligro que constituye un desafío para todos los endocrinólogos pediatras.7 Los estudios en niños sobre la prevalencia e incidencia de complicaciones a largo plazo (retinopatía, neuropatía y nefropatía) son abundantes en la literatura médica de estos últimos años, pero no ocurre igual acerca de las consecuencias a largo plazo que produce la hipoglucemia, aunque en los últimos años hay una tendencia a focalizar los estudios en estos aspectos.8
Por todo lo anterior nos decidimos a realizar este trabajo, con la finalidad de determinar la frecuencia y describir algunos aspectos clínicos de la hipoglucemia en un grupo de niños y adolescentes diabéticos tipo 1.
MÉTODOS
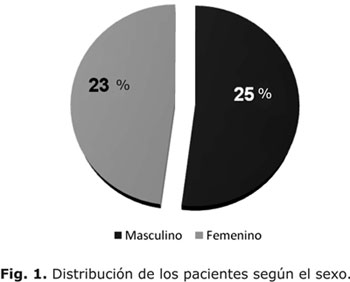
Se realizó un estudio retrospectivo y descriptivo de corte transversal en el que se revisaron las historias clínicas de 48 niños y adolescentes (25 pacientes del sexo masculino y 23 pacientes del sexo femenino) con diagnóstico de DM 1, con edades entre los 2 y los 19 años, atendidos en el Servicio de Endocrinología del Hospital Pediátrico Docente "William Soler", en el período comprendido entre Enero de 1987 y Enero de 2000.
Se tomaron de las historias clínicas los datos generales de los pacientes (nombre y apellidos, fecha de nacimiento, sexo, fecha de diagnóstico de la DM 1, peso corporal en kg y la dosis diaria promedio de insulina), tipo de tratamiento con insulina (convencional o intensivo), así como el tipo de insulina o análogos. Se tomaron los resultados con menos de 4 meses a la fecha de realizada la determinación de la hemoglobina glucosilada (HbA1c), cuyo resultado se expresó en porcentaje. Se consideró buen control metabólico £7 % y mal control metabólico >7 %.9
La dosis promedio de insulina utilizada se obtuvo sumando la dosis total diaria de insulina administrada y dividida entre el peso corporal en kg. Las glucemias referidas en las historias clínicas fueron realizadas por el método de la glucosa-oxidasa,10 y para la glucemia capilar el equipo sensor de glucemia GlucoDr manufacturado por All Medicus Co. Ltd., Korea. Para la determinación de la HbA1c se utilizó la técnica de Fluckiger y Winterharlter.11
Se tomaron todos los EH referidos y se agruparon de acuerdo con los horarios siguientes: de 12:00 am a 6:00 am, de 6:00 am a 12:00 m, de 12:00 m a 6:00 pm y de 6:00 pm a 12:00 am. Se clasificaron en:
- Diurnos: aquellos que ocurrieron entre las 6 am y las 12 pm.
- Nocturnos: aquellos que ocurrieron entre las 12 pm y las 6 am.
- Ligeros: aquellos diurnos con manifestaciones autonómicas que no requirieron ingreso ni de la asistencia de una segunda persona para su solución.
- Severos: todas las hipoglucemias nocturnas o en cualquier otro horario con pérdida de la conciencia, convulsión u otra manifestación neuroglicopénica, hospitalización, uso de glucagón, dextrosa endovenosa o ambos, asistencia de una segunda persona por no percatarse el paciente, o glucemia <3,5 mmol/L.
Para el análisis estadístico los pacientes se agruparon de acuerdo con la edad, intensidad del episodio de hipoglucemias, régimen de insulina, tiempo de evolución de la diabetes y control metabólico. Se confeccionó un modelo para la recolección de los datos obtenidos de las historias clínicas y se creó una base de datos. Para el análisis estadístico se utilizaron los estadígrafos siguientes: promedio en serie simple (0), rangos, desviación estándar (DS), porcentaje (%), chi cuadrado (X2) con un nivel de significación de p<0,05. Se utilizó una computadora personal y el paquete estadístico Statistica para Windows versión 5.
RESULTADOS
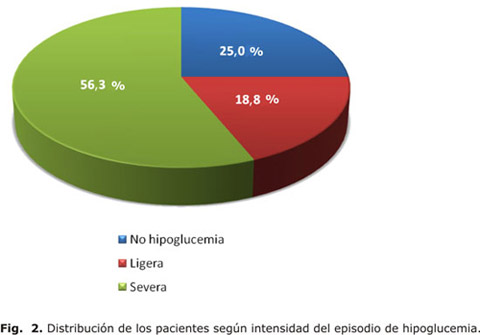
Los 48 pacientes estudiados no mostraron diferencias significativas en su distribución por sexo (figura 1). En cuanto a la distribución de los pacientes de acuerdo con la intensidad del EH (figura 2) se encontró un predominio de pacientes con episodios severos (56,3 %) con respecto a los que sufrieron hipoglucemias ligeras (18,8 %), o aquellos que no la refirieron (25 %).
La edad e intensidad de manifestación del primer EH (tabla 1) estuvo relacionada con la edad del paciente. No hubo diferencias significativas en cuanto al predominio de intensidad del primer episodio, aunque hubo un número significativamente mayor de pacientes en el grupo de edad de menores de 5 años y mayores de 15 cuyo primer EH fue severo, mientras que las hipoglucemias ligeras fueron significativamente más frecuentes en los grupos de edad de 5 a 14 años (p<0,05).
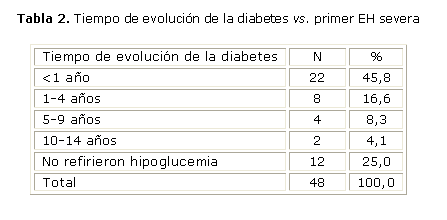
El primer EH severa ocurrió casi en la mitad de los pacientes (45,8 %) antes que hubiera transcurrido un año del diagnóstico de la DM 1 (tabla 2), y en casi la totalidad de ellos (30 pacientes) se presentó antes de los 4 años después del diagnóstico de DM. Cuando se comparó la frecuencia de EH de hipoglucemia severa con las necesidades diarias de insulina por kg de peso corporal (tabla 3), no se hallaron diferencias significativas entre ambas variables. En nuestro grupo de estudio ninguno de los pacientes utilizaron análogos de la insulina. Las insulinas utilizadas fueron, como insulina de acción rápida, la actrapid, y la NPH como insulina de acción intermedia.
De los 38 pacientes que utilizaron régimen convencional (tabla 4), 20 de ellos presentaron episodios de hipoglucemias severas (52,60 %), mientras que de los 10 pacientes que recibieron régimen intensivo, 7 pacientes (70 %) presentaron episodios similares. A pesar de que los porcentajes de episodios de hipoglucemia fueron mayores en los pacientes con el régimen intensivo de insulina, la diferencia no fue estadísticamente significativa. Cuando se comparó el control metabólico con los episodios de hipoglucemias severas (tabla 5) no se encontró relación estadísticamente significativa entre ambas variables.
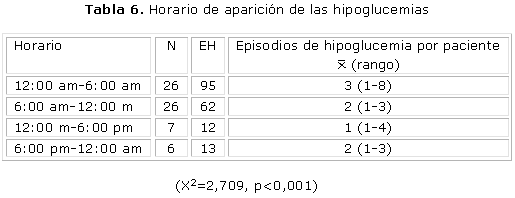
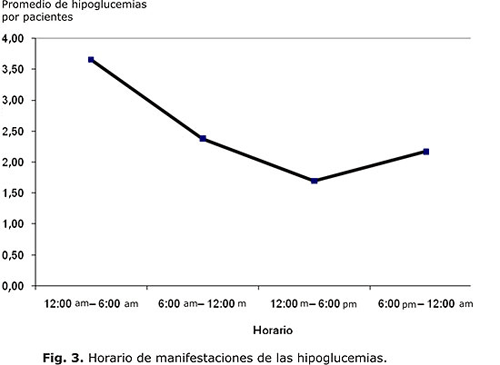
Se aprecia en la tabla 6 que la mayoría de los EH fueron nocturnos (95 episodios), y los diurnos ocurrieron con mayor frecuencia en el horario antes de almuerzo (62 episodios, 1/3 menos de episodios que las nocturnas), afectando a igual cantidad de pacientes. El promedio de episodios por paciente, así como el rango de ocurrencia, fue mayor en el grupo de las hipoglucemias nocturnas comparadas con las diurnas. La frecuencia de EH disminuye en la medida que el horario del día avanza, y aumenta posteriormente hacia las horas de la noche y la madrugada, lo que se observa más evidentemente en la figura 3.
DISCUSIÓN
La hipoglucemia es la complicación aguda más frecuente en los pacientes con DM 1. En estudios realizados en adultos y niños con DM 1 se han señalado como principal secuela la afectación funcional y anatómica del sistema nervioso.12-14
Es conocido que en los niños más pequeños, en los que aún no ha terminado el desarrollo y maduración del sistema nervioso central, es donde los EH producen un efecto más devastador, de manera que, determinar su frecuencia y los posibles factores relacionados con ellos, sean de importancia para poder tomar medidas futuras para evitarlos.2,3,13 Por otra parte, en nuestro país los informes de EH en niños y adolescentes relacionados con su frecuencia y características clínicas son muy escasos, lo que nos motivó, entre otros aspectos, a realizar este estudio en nuestro centro.
La frecuencia de los EH encontrada en los diferentes estudios realizados en niños es muy variable, debido, principalmente, a los parámetros tomados en consideración en las diferentes investigaciones. Winter15 halló una frecuencia de hipoglucemias severas (HS) de 18 % en una muestra de pacientes con una dosis de insulina de acción intermedia al día, de manera similar otros autores señalan una frecuencia de 34 % en pacientes con pobre control metabólico y 27 % en pacientes con régimen de insulina convencional, respectivamente.16,17
Swalwitz y otros18 encontraron en 135 pacientes con edad promedio de 14 años y HbA1c entre 9,4 y 19,6 % una incidencia de EH de 14,4 % a las 2 am, y de 6,7 % a las 6 am. Recientemente, un estudio multicéntrico en la región del Pacífico Oeste19 informa una frecuencia de 73 episodios de HS por cada 100 pacientes al año, mientras que otros autores en pacientes de entre 2 y 18 años, con buen control metabólico, señalan frecuencias tan elevadas como 22 episodios en 9 meses y más de 3 veces esa frecuencia durante la noche.20
En nuestro país son pocos los estudios relacionados con la frecuencia de EH en niños. Vera y otros21 en un estudio multicéntrico en 3 hospitales pediátricos de Ciudad de La Habana, encontraron una frecuencia de 74 % de episodios de hipoglucemia ligera y 25 % de severa en una muestra de 100 niños y adolescentes. Debemos señalar que este estudio fue retrospectivo, y se tomó solamente lo ocurrido en un mes, por esta razón pensamos que hallaron una frecuencia tan baja de la severa. En nuestro estudio encontramos una frecuencia de 56 % de este último episodio, y de 18 % de ligera, lo que coincide con otros estudios con muestras de similares características a la nuestra.22,23
La verdadera frecuencia de los EH en el paciente diabético es muy difícil de determinar, ya que la mayoría de los episodios son ligeros y prácticamente inevitables, lo que conlleva a que, en su mayoría, sean olvidados o no se le dé importancia después de un tiempo prolongado de sufrir de diabetes, y por ello, en los estudios retrospectivos se dificulta la recogida de este dato, lo que ocurrió en nuestro estudio y explica nuestros resultados. En cambio, los episodios severos son una experiencia difícil de olvidar, y por ende, fácil de recordar, además de que son los episodios que tienen mayor probabilidad de dejar secuelas neurológicas, razón por la cual se enfatiza su búsqueda. Es importante determinar la edad en que mayormente ocurren las HS, ya que la intensidad de la repercusión sobre el sistema nervioso es mayor en las edades extremas de la vida.
Los niños menores de 5 años constituyen el grupo de mayor riesgo, pues mientras más pequeño es el niño disminuyen las posibilidades de que pueda percibir y reconocer los síntomas de hipoglucemia y resolverla por sí mismo o solicitar ayuda de algún adulto; además, antes de los 5 años de edad aún no ha terminado el desarrollo y la maduración del sistema nervioso central.24 Ly y otros23 en 656 pacientes hallaron el grupo de edad menor de 6 años con mayor frecuencia de HS. Por otra parte, el DirecNet Study Group encontró que los pacientes más pequeños y los adolescentes eran los grupos de edad con mayor probabilidad de desarrollar hipoglucemia severa, debido a su asociación a fallo autonómico.25
Nuestro estudio evidenció que la intensidad de la primera hipoglucemia es dependiente de la edad del paciente, pues hubo un número significativamente mayor de pacientes menores de 5 años y mayores de 15 en los que su primer EH fue severo, mientras que los ligeros fueron significativamente más frecuentes en los grupos de edad de 5 a 14 años. No solamente atribuimos estos hallazgos a que en ambos grupos de edad, como ha sido descrito,26,27 la ocurrencia de EH asociado a fallo autonómico es mayor, sino además porque en los niños menores de 5 años el control es más lábil debido a que la actividad física es difícil de controlar y prever, la alimentación es errática, la identificación del EH por el propio niño está comprometida, y además, el tejido celular subcutáneo es más delgado lo que contribuye a que la absorción de la insulina sea más acelerada.28
En el caso de los adolescentes sucede que las características de esta edad contribuyen a un mayor rechazo y menos adhesión al tratamiento, como ha sido descrito por diferentes autores.29-31 Se plantea que después de iniciado el tratamiento con insulina es indefectible la aparición de los EH, de manera que se llega a afirmar que todos los pacientes con DM 1 sufren de ellos en algún momento de su vida.32
Beck y otros,30 al estudiar pacientes con DM 1 con edades entre 1 y 18 años, tratados con régimen convencional y con multidosis de insulina, encontraron un mayor incremento de los EH en el primer año después del diagnóstico de la DM 1. Resultados similares han sido hallados por otros autores.33,34 Durante los primeros meses después de realizado el diagnóstico de la DM existen condiciones que pueden favorecer la aparición de estos episodios, como son, el poco tiempo para haber recibido los suficientes conocimientos acerca de la enfermedad y el tratamiento de la dosis de insulina en determinadas situaciones, como las enfermedades intercurrentes, período de remisión, además de las características de la edad del paciente, entre otros aspectos.35
Por otra parte, varios autores señalan de que el hecho de que hayan sido recién diagnosticado, e inclusive tratados con régimen intensivo utilizando bombas de infusión continua de insulina, no favorece necesariamente la aparición de EH, sobre todo los severos, que son las que tienen consecuencias mayores.36,37 En relación con nuestros resultados, en este aspecto consideramos que existe en el primer año después del diagnóstico una elevada frecuencia de episodios severos que podrían deberse a inexperiencia o inadecuada información de los familiares y pacientes sobre la DM, su control y los EH, lo que ha sido señalado con anterioridad.38
Las necesidades diarias de insulina constituyen un parámetro muy importante en el tratamiento de la DM 1 en niños y adolescentes, de manera que, tanto una dosis diaria baja o alta de insulina, pueden ocasionar una inadecuada insulinización del paciente y provocar síntomas de deficiencia o exceso de insulina respectivamente. Ambas condiciones son expresión de un incorrecto control metabólico.39 Se ha señalado que aquellos pacientes que al diagnóstico de la DM 1 han tenido cetosis o cetoacidosis, requieren una dosis diaria de insulina de 1 U/kg, mientras que en los pacientes puberales las necesidades son de 1 a 1,5 U/Kg.40 Por otro lado, Rabbone y otros,41 en 46 niños menores de 6 años tratados con bombas de infusión continua, encontraron que requerían una dosis diaria de insulina 0,84±0,29 U/kg. Wiegand y otros,39 por su parte, en su estudio con 22 177 pacientes con DM 1 con edades entre 3 y 25 años hallaron en los menores de 5 años de edad necesidades de 0,72 U/kg, entre 6 a 10 años de edad necesidades de 0,8 U/kg y en los puberales dosis de 0,9 U/kg.
En la revisión realizada por nosotros no fueron abundantes los trabajos relacionados con las necesidades o requerimientos de insulina y EH. Dixon y otros,42 al estudiar niños con DM 1 menores de 6 años de edad tratados con análogos de insulina de acción prolongada (glargina) y con insulina NPH, hallaron una reducción significativa de los EH y de hipoglucemia severa en los que recibían tratamiento con análogos, a pesar de que los necesidades de insulina se incrementaron en los que fueron tratados con análogos. Autores como Chiou y otros43 tampoco encuentran diferencias entre la frecuencia de EH y la dosis total de insulina. Resultados similares han sido hallados por otros autores con el uso de régimen intensivo de insulina por infusión continua.44,45 En nuestro estudio se agruparon los pacientes en 2 grupos de acuerdo con las necesidades de insulina (mayores y menores de 0,1 U/kg), sin hallar diferencias significativas entre las necesidades de insulina y los EH.
El hecho de que nuestro estudio fue retrospectivo influyó en nuestros resultados, así como el punto de corte de 1 unidad por kg de peso, amén de otros factores. La dosis total diaria de insulina es un elemento importante para criterios, como, período de remisión, sobreinsulinización, resistencia a la insulina, entre otros,46-51 pero su relación con los EH se hace complejo durante el análisis si no se toman en cuenta otras variables, como son, régimen de tratamiento utilizado y tipo de diabetes, así como elementos individuales, como es el grado de sensibilidad a la insulina, entre otros.51-54
Se ha sugerido que los regímenes intensivos de insulina son más proclives a desencadenar EH, así como que esta posibilidad se incrementa con la reducción de la HbA1c, sin embargo, en los últimos años diversas investigaciones realizadas en niños y adolescentes con régimen intensivo de insulina con bombas de infusión continua y reducción de la HbA1c, arrojan que no se incrementan estos episodios,55-57 incluso en pacientes menores de 6 años de edad.41 Por otra parte, se ha señalado que no existen diferencias significativas en cuanto a la frecuencia de hipoglucemias si se utiliza desde el momento del diagnóstico de la DM 1 régimen intensivo con multidosis o régimen convencional.30
Existe el criterio de que el régimen de infusión continua de insulina ofrece mayor flexibilidad, así como una entrega de insulina más precisa que las inyecciones diarias múltiples, y que, además, puede reducir la frecuencia de EH severa, sin embargo, cuando estos regímenes de infusión continua de insulina se han comparado con las inyecciones diarias múltiples en ensayos cruzados aleatorios en niños o adolescentes, no se encontraron diferencias significativas en relación con la HbA1c.57-59 Independientemente de que haya ocurrido un porcentaje mayor de EH severas en los pacientes con régimen intensivo, lamentablemente la distribución de la muestra de acuerdo con el tipo de tratamiento con insulina, no nos permitió realizar una comparación adecuada entre el régimen intensivo y el convencional. Por otra parte, no hallamos relación entre el control metabólico y la ocurrencias de EH severos.
Si bien es cierta la afirmación que cuando el control metabólico está cercano a las concentraciones de sujetos no diabéticos, la probabilidad de que ocurra un EH es elevada, esta no constituye la única razón. En el control metabólico de los pacientes influyen, además de las características de la edad del paciente, la motivación y la adhesión al tratamiento, entre otros aspectos psicológicos, la actitud de los padres en relación con la diabetes, así como el nivel de conocimiento que se tenga sobre la enfermedad y su tratamiento.27,29 En nuestro grupo estos elementos pueden haber influido, pero como realizamos un estudio retrospectivo tomando los datos de las historias clínicas, estos aspectos resultaron difíciles de recoger.
Por otra parte, el punto de corte tomado para la HbA1c, además de la técnica utilizada para su determinación, debe considerarse también como un elemento influyente en nuestros resultados, ya que hay autores que sugieren un valor HbA1c más elevado para los pacientes más pequeños.40 Por ello, pueden existir pacientes con mal control metabólico debido a los aspectos mencionados, y que en determinadas ocasiones se administren una dosis de insulina improcedente sin ingerir las calorías adecuadas, o realicen una actividad física inoportuna, o ambas cosas a la vez, y coexistan con el mal control los EH.60-62
Las horas de sueño asociadas al ayuno son el talón de Aquiles de los regímenes de insulinoterapia, ya que no hay una insulinemia basal satisfactoria como la que ocurre en los sujetos no diabéticos. Las insulinas de acción intermedia y prolongada provocan una curva parabólica, a diferencia del nivel basal constante en sujetos no diabéticos, lo que es debido, entre otros factores, a la variabilidad en la absorción de la insulina, lo que puede ocasionar una diferencia en los niveles de insulina libre de un 50 % en el mismo sujeto en 2 noches diferentes, aunque en los últimos años se ha señalado reducción de las hipoglucemias nocturnas con el uso de análogos de insulina de acción intermedia, tanto en el tratamiento con dosis múltiple como el de infusión continua.63,64
Por otra parte, la hipoglucemia nocturna puede perdurar por 6 h o más, y un hallazgo importante en todos los estudios es que en las ¾ partes de todos estos episodios no son percibidos por el paciente (unawareness hypoglycemia), aunque en la mitad de ellos el observador puede detectar frialdad, diaforesis u otros signos reveladores.9 Otro elemento que agrava el hecho de sufrir hipoglucemia nocturna es que incrementa en 6 veces la posibilidad de sufrir otros episodios de características similares en cualquier horario del día, aunque este hecho puede ser reversible en 2 ó 3 semanas si se logra un buen control de la glucemia sin ocurrencia de EH.25
Por todas estas razones expuestas los EH nocturnos constituyen un evento de sumo interés en cualquier estudio que se realice para determinar la frecuencia de hipoglucemia, y más aún en nuestro país que no hallamos reportes previos. En estudios realizados en pacientes adultos con DM 1 han mostrado una frecuencia de hipoglucemia nocturna entre un 30 y 50 % en todas las noches estudiadas.65 Porter y otros66 en 61 niños con edades entre 2,6 y 8,5 años durante una noche tomada al azar en el hogar, encontraron un 57 % de hipoglucemias nocturnas en menores de 5 años y de 28,5 % en los mayores de 5 años. Por otro lado, Simell y otros67 en un grupo de niños de 2 a 4 años de edad con buen control metabólico hallaron 14 % de hipoglucemias nocturnas a las 3 am, y una frecuencia de 50 % en los niños de 5 a 8 años de edad, pero fue realizado en el hospital y por ello no refleja las verdaderas condiciones de vida del hogar, y excluye variables como la actividad física y las meriendas, entre otras.
En los niños, las hipoglucemias nocturnas sintomáticas son una experiencia aterradora para los padres y los propios niños.68 Las hipoglucemias asintomáticas, sobre todo en los niños más pequeños, son peores porque dañan el normal desarrollo del cerebro y el funcionamiento neuropsicológico,69,70 por lo que se han diseñado dispositivos de alarma con la intención de monitorizar los episodios nocturnos de hipoglucemia.71 En una investigación en que se evaluaron 71 padres de niños entre 2 y 6 años se halló que aproximadamente un tercio de los padres supervisaban regularmente la glucemia después que su niño estaba dormido, lo que generaba interrupción del sueño y generaba ansiedad en padres y niños, así como que la glucemia nocturna estaba positivamente asociada con el régimen de la dosis basal administrada antes de acostarse y la evolución más larga de la diabetes.72
Nuestros resultados arrojan que las hipoglucemias fueron más frecuentes en el horario de la madrugada, entre 12:00 am y 6:00 am, y disminuyeron su frecuencia en la medida que avanza el día, lo que coincide con lo señalado en otros trabajos. Es conocido que este horario favorece la aparición de unawareness hypoglycemia, lo que está potenciado por un fallo autonómico concomitante,26 además de que ese horario es el común para el sueño. Todo lo antes mencionado hace que el evento resulte más difícil de identificar por el sujeto, ya que al no desencadenar una respuesta autonómica adecuada, los síntomas no lo despierten, todo lo cual contribuye a la frecuencia elevada encontrada en nuestro estudio.
Se puede concluir que nuestros hallazgos muestran una elevada frecuencia de EH con predominio de los severos, sobre todo en horario de la madrugada, así como que el grupo de edad más afectado fue el menor de 6 años, lo que constituye un riesgo para el normal neurodesarrollo en los niños de este grupo de edad, lo que, asociado a que los trabajos sobre este tema en niños y adolescentes con DM 1 en nuestro país son escasos, nos anima para realizar posteriores investigaciones que completen nuestro conocimiento sobre aquellos factores que contribuyen a desencadenar estos episodios, y posteriormente sugerir estrategias que ayuden a disminuir su ocurrencia.
REFERENCIAS BIBLIOGRÁFICAS
1. Kodl CT, Seaquist ER. Cognitive dysfunction and diabetes mellitus. Endocr Rev. 2008;29:494-511.
2. Shehata G, Eltayeb A. Cognitive Function and Event-Related Potentials in Children with Type 1 Diabetes Mellitus. J Child Neurol. 2009. Disponible en: http://jcn.sagepub.com/cgi/content/abstract/0883073809341667v1 Consultado, 9 de febrero de 2010.
3. Cryer PE, Davis SN, Shamoon H. Hypoglycemia in diabetes. Diabetes Care. 2003;26:1902-12.
4. Miller CD, Phillips LS, Ziemer DC, Gallina DL, Cook CB, El-Kebbi IM. Hypoglycemia in patients withh type 2 diabetes mellitus. Arch Intern Med. 2001;161:1653-9.
5. Berbel-García A, Porta-Etessam J, Martínez-Salio A, Ballesta F, Sáiz-Díaz RA, Pérez-Martínez DA, et al. Edema cerebral transitorio asociado a hipoglucemia. Rev Neurol (España). 2004;39:1030-3.
6. Dagogo-Jack S. Hypoglycemia in type 1 diabetes mellitus. Treat Endorinol. 2004;3:91-103.
7. Naguib JM, Kulinskaya E, Lomax CL, Garralda ME. Neuro-cognitive performance in children with type 1 diabetes-a meta-analysis. J Pediatr Psychol. 2009;34:271-82.
8. Rossetti P, Porcellati F, Bolli GB, Fanelli CG. Prevention of hypoglycemia while achieving good glycemic control in type 1 diabetes. Diabetes Care. 2008;31 (suppl 2):S113-S20.
9. Clarke W, Jones T, Rewers A, Dunger D, Klingensmith GJ. Assessment and management of hypoglycemia in children and adolescents with diabetes. Pediatric Diabetes. 2009;10 (Suppl. 12):134-45.
10. Trinder P. Determination of glucose in blood using glucose oxidase with an alternative oxygen acceptor. Ann Clin Biochem. 1969;6:24-7.
11. Fluckiger R, Winterhalter KH. In vitro synthesis of hemoglobin ALC. FEBS Lett. 1976;71:356-60.
12. Kodl CT, Seaquist ER. Cognitive Dysfunction and Diabetes Mellitus. Endocrine Reviews. 2008;29:494-511.
13. Cryer EP. The barrier of hypoglycemia in diabetes. 2008;57:3169-76.
14. Hershey T, Perantie DC, Wu J, Weaver PM, Black KL, White NH. Hippocampal Volumes in Youth With Type 1 Diabetes. Diabetes. 2010;59:236-41.
15. Winter RJ. Profiles of metabolic control in diabetic children: frequency of asymptomatic nocturnal hypoglycemia. Metabolism. 1981;30:666-72.
16. Whincup G, Milner RD. Prediction and management of nocturnal hypoglycemia in diabetes. Arch Dis Child. 1987;62:333-7.
17. Pczynski S, Wolfson D. Frequency and poor predictability of nocturnal hypoglycemia (abstract). Diabetes. 1993;42:27.
18. Shalwitz RA, Farkas-Hirsch R, White NH, Santiago JV. Prevalence and consequences of nocturnal hypoglycemia among conventionally treated children with diabetes mellitus. J Pediatr. 1990;116:685-9.
19. Craig ME, Jones TW, Silink M, Ping YJ. Diabetes care, glycemic control, and complications in children with type 1 diabetes from Asia and the Western Pacific Region. J Diabetes Complications. 2007;21:280-7.
20. Chase HP, Dixon B, Pearson J, Fiallo-Scharer R, Walravens P, Klingensmith G, et al. Reduced hypoglycemic episodes and improved glycemic control in children with type 1 diabetes using insulin glargine and neutral protamine Hagedorn insulin. J Pediatr. 2003;143:737-40.
21. Vera M, Álvarez MA, González P, Morales E, Chiong D, Prieto M, et al. Hipoglucemia en el niño y adolescente diabético: aspectos clínicos. Estudio multicéntrico de la Ciudad de La Habana. Rev Assoc Latinoamer Diabetes. 1999;8:209-16.
22. Beregszászi M, Tubiana-Rufi N, Benali K. Nocturnal hipoglycaemia in children and adolescents with insulin dependent diabetes mellitus: prevalence and risk factors. J Pediatr. 1997;131:27-33.
23. Ly TT, Gallego PH, Davis EA, Jones TW. Impaired awareness of hypoglycemia in a population-based sample of children and adolescents with type 1 diabetes. Diabetes Care. 2009;32:1802-6.
24. Lteif AN, Schwenk WF. Mayo Clin Pro. 1999;74:211-6.
25. Diabetes Research in Children Network (DirecNet) Study Group, Tsalikian E, Tamborlane W, Xing D, Becker DM, Mauras N, Fiallo-Scharer R, et al. Blunted counterregulatory hormone responses to hypoglycemia in young children and adolescents with well-controlled type 1 diabetes. Diabetes Care. 2009;32:1954-9.
26. Cryer PE. Mechanisms of Hypoglycemia-Associated Autonomic Failure and Its Component Syndromes in Diabetes. Diabetes. 2005;54:3592-601.
27. Churchill JN, Ruppe RL, Smaldone A. Use of continuous insulin infusion pumps in young children with type 1 diabetes: a systematic review. Pediatr Health Care. 2009;23:173-9.
28. Szypowska A, Lipka M, Blazyk M, Groele L, Pañkowka E. Insulin requirement in preschoolers treated with insulin pumps at onset of type 1 diabetes mellitus. Acta Pediátrica. 2009;98:527-30.
29. Di Battista AM, Hart TA, Greco L, Gloizer J. Type 1 Diabetes Among Adolescents. Reduced Diabetes Self-Care Caused by Social Fear and Fear of Hypoglycemia. 2009;35:465-75.
30. Beck JK, Lewis TV, Logan KJ, Harrison DL, Gardner AW, Copeland KC. Intensive vs conventional insulin management initiated at diagnosis in chlidren with diabetes: should payer source influence the choice of therapy? Pediatric Diabetes. 2009;10:368-73.
31. Kakleas K, Kandyla B, Karayianni C, Karavanaki K. Psychosocial problems in adolescents with type 1 diabetes mellitus. Diabetes Metab. 2009;35:339-50.
32. Graveling AJ, Frier BM. Hypoglycaemia: an overview. Prim Care Diabetes. 2009;3:131-9.
33. Churchill JN, Ruppe RL, Smaldone A. Use of continuous insulin infusion pumps in young children with type 1 diabetes: a systematic review. Pediatr Health Care. 2009;23:173-9.
34. Tamborlane WV. Fulfilling the promise of insulin pump therapy in childhood diabetes. Pediatr Diabetes. 2006;7 Suppl 4:4-10.
35. Weitzel D, Pfeffer U, Dost A, Herbst A, Knerr I, Holl R. Initial insulin therapy in children and adolescents with type 1 diabetes mellitus. Pediatr Diabetes. 2010;11:159-65.
36. Cengiz E, Swan KL, Tamborlane WV, Steil GM, Steffen AT, Weinzimer SA. Is an automatic pump suspension feature safe for children with type 1 diabetes? An exploratory analysis with a closed-loop system. Diabetes Technol Ther. 2009;11:207-10.
37. Hanas R, Adolfsson P. Insulin pumps in pediatric routine care improve long-term metabolic control without increasing the risk of hypoglycemia. Pediatr Diabetes. 2006;7:25-31.
38. Coffen RD. The 600-step program for type 1 diabetes self-management in youth: the magnitude of the self-management task. Postgrad Med. 2009;121:119-39.
39. Wiegand S, Raile K, Reinehr T, Hofer S, Näke A, Rabl W, et al. Daily insulin requirement of children and adolescents with type 1 diabetes: effect of age, gender, body, mass index and mode of therapy. European J Endocrinol. 2008;158:543-9.
40. Haller MJ, Atkinson MA, Schatz D. Type 1 Diabetes Mellitus: Etiology Presentation, and Management. Pediatr Clin N Am. 2005;52:1553-78.
41. Rabbone I, Scaramuzza A, Bobbio A, Bonfanti R, Iafusco D, Lombardo F, et al. Insulin pump therapy management in very young children with type 1 diabetes using continuous subcutaneous insulin infusion. Diabetes Technol Ther. 2009;11:707-9.
42. Dixon B, Peter Chase H, Burdick J, Fiallo-Scharer R, Walravens P, Klingensmith G, et al. Use of insulin glargine in children under age 6 with type 1 diabetes. Pediatr Diabetes. 2005;6:150-4.
43. Chiou JB, Lin SY, Yen CH, Sheu WH, Jeng CY. Efficacy and safety of a mixture of two different brands of insulin products in patients with type 1 diabetes mellitus. J Chin Med Assoc. 2005;68:517-21.
44. Minkina-Pedras M, Jarosz-Chobot P, Polanska J, Kalina MA, Marcinkowski A, Malecka-Tendera E. Prospective assessment of continuous subcutaneous insulin infusion therapy in young children with type 1 diabetes. Diabetes Res Clin Pract. 2009;85:153-8.
45. Abaci A, Atas A, Unuvar T, Demir K, Bober E, Büyükgebiz A. A comparison of multiple daily insulin therapy with continuous subcutaneous insulin infusion therapy in adolescents with type 1 diabetes mellitus: a single-center experience from Turkey. J Pediatr Endocrinol Metab. 2009;22:539-45.
46. Mortensen HB, Hougaard P, Swift P, Hansen L, Holl RW, Hoey H, et al. New definition for the partial remission period in children and adolescents with type 1 diabetes. Diabetes Care. 2009;32:1384-90.
47. Zmyslowska A, Mlynarski W, Szadkowska A, Bodalski J. Prediction of clinical remission using the C-peptide level in type 1 diabetes in children. Pediatr Endocrinol Diabetes Metab. 2007;13:71-4.
48. Hofman PL, Lawton SA, Peart JM, Holt JA, Jefferies CA, Robinson E, et al. An angled insertion technique using 6-mm needles markedly reduces the risk of intramuscular injections in children and adolescents. Diabet Med. 2007;24:1400-5.
49. Bowden SA, Duck MM, Hoffman RP. Young children (<5 yr) and adolescents (>12 yr) with type 1 diabetes mellitus have low rate of partial remission: diabetic ketoacidosis is an important risk factor. Pediatr Diabetes. 2008;9(3[1]):197-201.
50. Maloney N, Britt RC, Rushing GD, Reed SF, Cole FC, Collins JN. Insulin requirements in the intensive care unit in response to infection. Am Surg. 2008;74:845-8.
51. Szadkowska A, Pietrzak I, Mianowska B, Bodalska-Lipiñska J, Keenan HA, Toporowska-Kowalska E, et al. Insulin sensitivity in type 1 diabetic children and adolescents. Diabet Med. 2008;25:282-8.
52. Park JY, Chong AY, Cochran EK, Kleiner DE, Haller MJ, Schatz DA, et al. Type 1 diabetes associated with acquired generalized lipodystrophy and insulin resistance: the effect of long-term leptin therapy. J Clin Endocrinol Metab. 2008;93:26-31.
53. Acharya SH, Philip S, Viswanath AK, Boroujerdi M, Waugh NR, Pearson DW. Glycaemic control and body mass index in late-adolescents and young adults with type 1 diabetes mellitus: a population-based study. Diabet Med. 2008;25:360-4.
54. Shashaj B, Sulli N. Difference in insulin usage patterns with pubertal development in children with type 1 diabetes during transition from multiple daily injections to continuous subcutaneous insulin infusion (CSII) and through the CSII treatment. Diabetes Technol Ther. 2009;11:767-74.
55. Smart CE, Ross K, Edge JA, Collins CE, Colyvas K, King BR. Children and adolescents on intensive insulin therapy maintain postprandial glycemic control without precise carbohydrate counting. Diabet Med. 2009;26:279-85.
56. Juvenile Diabetes Research Foundation Continuous Glucose Monitoring Study Group. The effect of continuous glucose monitoring in well-controlled type 1 diabetes. Diabetes Care. 2009;32:1378-83.
57. Raccah D, Sulmont V, Reznik Y, Guerci B, Renard E, Hanaire H, et al. Incremental value of continuous glucose monitoring when starting pump therapy in patients with poorly controlled type 1 diabetes: the Real Trend study. Diabetes Care. 2009;32:2245-50.
58. Shalitin S, Phillip M. The use of insulin pump therapy in the pediatric age group. Horm Res. 2008;70:14-21.
59. Jeitler K, Horvath K, Berghold A, Gratzer TW, Neeser K, Pieber TR. Continuous subcutaneous insulin infusion versus multiple daily insulin injections in patients with diabetes mellitus: systematic review and meta-analysis. Diabetologia. 2008;51:941-51.
60. Mehta SN, Volkening LK, Anderson BJ, Nansel T, Weissberg-Benchell J, Wysocki T, et al. Dietary behaviors predict glycemic control in youth with type 1 diabetes. Diabetes Care. 2008;31:1318-20.
61. Wysocki T, Iannotti R, Weissberg-Benchell J, Laffel L, Hood K, Anderson B, et al. Diabetes problem solving by youths with type 1 diabetes and their caregivers: measurement, validation, and longitudinal associations with glycemic control. J Pediatr Psychol. 2008;33:875-84.
62. Nansel TR, Anderson BJ, Laffel LM, Simons-Morton BG, Weissberg-Benchell J, Wysocki T, et al. A multisite trial of a clinic-integrated intervention for promoting family management of pediatric type 1 diabetes: feasibility and design. Pediatr Diabetes. 2009;10:105-15.
63. Deiss D, Kordonouri O, Hartmann R, Hopfenmüller W, Lüpke K, Danne T. Treatment with insulin glargine reduces asymptomatic hypoglycemia detected by continuous subcutaneous glucose monitoring in children and adolescents with type 1 diabetes. Pediatr Diabetes. 2007;8:157-62.
64. Monami M, Marchionni N, Mannucci E. Long-acting insulin analogues vs. NPH human insulin in type 1 diabetes. A meta-analysis. Diabetes Obes Metab. 2009;11:372-8.
65. Schopman JE, Geddes J, Frier BM. Prevalence of impaired awareness of hypoglycaemia and frequency of hypoglycaemia in insulin-treated type 2 diabetes. Diabetes Res Clin Pract. 2010;87:64-8.
66. Porter PA, Keating B, Byrne G, Jones TW. Incidence and predictive criteria of nocturnal hypoglycemia in young children with insulin dependent diabetes mellitus. J Pediatr. 1997;130:366-72.
67. Simell T, Simell O, Lammi EM, Kaprio EA, Hakulinen A, Hakalax J, et al. Glucose profiles in children two years after onset of type 1 diabetes. Diabetic Medicine. 1993;10:524-9.
68. Kashmer L, Clarke W, Gurka M, Elchuri S, Nyer M, Gonder-Frederick L. Predictors of parental interest in continuous glucose monitoring for children with type 1 diabetes. Diabetes Technol Ther. 2009;11:373-8.
69. Seaquist ER. The Final Frontier: How does Diabetes Affect the Brain? Diabetes. 2010;59:4-5.
70. Naguib JM, Kulinskaya E, Lomax CL, Garralda ME. Neuro-cognitive performance in children with type 1 diabetes -a meta-analysis. J Pediatr Psychol. 2009;34:271-82.
71. Skladnev VN, Ghevondian N, Tarnavskii S, Paramalingam N, Jones TW. Clinical Evaluation of a Noninvasive Alarm System for Nocturnal Hypoglycemia. J Diabetes Sci Technol. 2010;4:67-74.
72. Monaghan MC, Hilliard ME, Cogen FR, Streisand R. Nighttime caregiving behaviors among parents of young children with type 1 diabetes: associations with illness characteristics and parent functioning. Fam Syst Health. 2009;27:28-38.
Recibido: 29 de junio de 2010.
Aprobado: 23 de septiembre de 2010.
Pedro González Fernández. Calle 39 No. 873, entre avenida 26 y 24, Nuevo Vedado, municipio Plaza, Ciudad de La Habana, Cuba. E mail: gonzalez@infomed.sld.cu