Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Endocrinología
versión On-line ISSN 1561-2953
Rev Cubana Endocrinol vol.22 no.2 Ciudad de la Habana Mayo.-ago. 2011
Variantes polimórficas Ala513Pro y Gly972Arg del gen IRS-1 no se asocian a la diabetes mellitus tipo 2 en un grupo de la población cubana
The Ala513Pro and Gly972ARg polymorphous variants of IRS-1 gen are not associated with type diabetes mellitus in a group of the Cuban population
Luis Miguel Pérez,I Aimée Álvarez,II Emma Domínguez,III José Antonio Juí,IV Janet Rodríguez,V Yovana Pereira,VI José Hernández,VII Roberto Manuel González,VIII Eva Julia Díaz,IX Carmen Valenti,X Manuel Ayras,XI Siegmund Gehrisch,XII Werner JarossXII
IEspecialista de II Grado en Endocrinología. Investigador Titular. Profesor Consultante del Instituto Nacional de Endocrinología. La Habana, Cuba.
IILicenciada en Bioquímica. Máster en Bioquímica. Investigadora Auxiliar. Asistente del Instituto Nacional de Endocrinología. La Habana, Cuba.
IIIEspecialista de II Grado en Bioestadística. Investigadora Auxiliar. Asistente del Instituto Nacional de Endocrinología. La Habana, Cuba.
IVEspecialista de I Grado en Endocrinología. Instituto Nacional de Endocrinología. La Habana, Cuba.
VLicenciada en Tecnología de la Salud. Especialista en Laboratorio Clínico. Instituto Nacional de Endocrinología. La Habana, Cuba.
VILicenciada en Bioquímica. Máster en Bioquímica. Investigadora Auxiliar. Instituto Nacional de Endocrinología. La Habana, Cuba.
VIIEspecialista de II Grado en Endocrinología. Asistente. Instituto Nacional de Endocrinología. La Habana, Cuba.
VIIIEspecialista de II Grado en Bioquímica Clínica. Investigador Titular. Profesor Consultante. Instituto Nacional de Endocrinología. La Habana, Cuba.
IXLicenciada en Bioquímica. Instituto Nacional de Endocrinología. La Habana, Cuba.
XEspecialista de II Grado en Organización y Administración de Salud Pública. Máster en Salud Pública. Profesora Auxiliar. Instituto Nacional de Endocrinología. La Habana, Cuba.
XIEspecialista de I Grado en Bioquímica Clínica. Investigador Agregado. Instituto Nacional de Endocrinología. La Habana, Cuba.
XIIDoctor en Ciencias Médicas. Instituto de Química Clínica y Medicina de Laboratorio. Universidad Técnica "Carl Gustav Carus". Dresden, Alemania.
RESUMEN
Introducción: la diabetes mellitus tipo 2 es una enfermedad heterogénea y multifactorial, que está determinada por factores genéticos y no genéticos. El sustrato 1 del receptor de la insulina (IRS-1) cumple una función fundamental en la transmisión de la señal insulínica, por tanto sus variantes génicas constituyen blancos importantes en el estudio de la susceptibilidad genética a esta enfermedad en las diferentes poblaciones.
Objetivo: explorar el papel de las variantes polimórficas Gly972Arg y Ala513Pro del gen IRS-1 en la susceptibilidad genética de la diabetes mellitus tipo 2 en un grupo de la población cubana.
Métodos: se determinó la frecuencia de los polimorfismos Gly972Arg y Ala513Pro del IRS-1 en 499 ciudadanos cubanos, con un índice de masa corporal entre 22-30, con edades comprendidas entre los 40 y 70 años: de ellos 272 (54,5 %) diabéticos y 227 (45,5 %) no diabéticos.
Resultados: la frecuencia del alelo Pro513 fue baja (1,2 %) y similar para ambos grupos (1,1 % vs. 1,3 % para el grupo de diabéticos y el grupo control, respectivamente). La frecuencia del polimorfismo Gly972Arg fue de 16,2%, superior a la reportada para la mayoría de las poblaciones estudiadas. No se encontraron diferencias significativas en la frecuencia del alelo Arg972 entre el grupo de diabéticos y el grupo control (15,4 % vs. 17,3 %), ni cambios en los niveles de glucemia e insulinemia asociados a la presencia del alelo polimórfico Arg972.
Conclusiones: en este grupo de sujetos de la población cubana, las variantes polimórficas Ala513Pro y Gly972Arg del gen IRS-1 no participan en la etiología de la diabetes mellitus tipo 2.
Palabras clave: Diabetes mellitus, susceptibilidad genética, IRS-1.
ABSTRACT
Introduction: the type 2 diabetes mellitus is a heterogeneous and multifactor disease determined by genetic and no-genetic factors. The substrate 1 of insulin receptor (IRS-1) has a fundamental function in transmission of insulin signal, thus its genic variants are significant targets in study of genetic susceptibility to this disease in different populations.
Objective: to explore the role of the Gly972Arg and Ala513PRo of IRS-1 gen polymorphous variants in the genetic susceptibility of type 2 diabetes mellitus in Cuban population.
Methods: the frequency of above mentioned polymorphous variants in 499 Cuban citizens with a 22-30 body mass index aged between 40 to 70 including 272 diabetics (54,5 %) and 227 non-diabetic (45,5 %).
Results: frequency of Pro513 allele was low (1,2 %) and similar en both groups (1,1 % versus 1,3 % for diabetic group and the control one, respectively). Frequency of Gly972Arg polymorphism was of 16,2 %, higher than that reported for most of study populations. There were not significant differences in frequency of Arg972 allele between the diabetic group and the control one (15,4 % versus 17,3 %). Also, there were not changes in glycemia and insulinemia levels associated to presence of polymorphous allele.
Conclusions: in present group of Cuban population the above mentioned polymorphous variants are not involved in etiology of type 2 diabetes mellitus.
Key words: Diabetes mellitus, genetic susceptibility, IRS-1.
INTRODUCCIÓN
La base genética de la diabetes mellitus tipo 2 (DM 2) está determinada por el aporte discreto de varios genes que interactúan entre sí y con los factores ambientales presentes en el transcurso de la vida, desde el período gestacional hasta la adultez.1-4 En la DM 2 los 2 defectos fisiopatológicos fundamentales son el deterioro de la acción de la insulina y la incapacidad de la célula beta para compensar este incremento en la demanda de insulina. Por esta razón, la búsqueda de factores genéticos relacionados con la enfermedad se enfoca hacia las variantes génicas de las moléculas involucradas en la señalización de la insulina y en la función de las células beta.
El IRS-1 constituye un elemento clave en la cascada de señalización de la insulina,5 lo que ha motivado el estudio del aporte de sus variantes génicas a la susceptibilidad genética de la DM 2. El IRS-1 es fosforilado por la quinasa del receptor de la insulina, posteriormente se une a la fosfatidil inositol 3 quinasa, lo cual provoca la activación de la vía que controla el transporte de glucosa estimulado por la insulina. El posible papel del gen del IRS-1 en la DM 2 ha sido estudiado en modelos animales experimentales y en humanos.
Existen reportes de que en ratones la destrucción del gen IRS-1 provoca hiperplasia de la célula beta y resistencia a la insulina, principalmente en el músculo.6,7 Los islotes aislados de ratones, carentes del gen del IRS-1, tienen un defecto en la síntesis y secreción de la insulina, lo cual sugiere la participación del IRS-1 en la función secretora de los islotes.8-10
Se han descrito mutaciones del IRS-1 en un 10-20 % de los pacientes con DM 2 en distintas poblaciones.11 El polimorfismo Gly972Arg del IRS-1 es una variante común de este gen. Se ha reportado que en las células secretoras de insulina, que sobre expresan la variante Gly972Arg del IRS-1, existe una disminución de la secreción de insulina estimulada por la glucosa y las sulfonilureas.12 Existen reportes de que la variante Arg972 empeora la señalización de la insulina.13 En algunos sujetos con tolerancia a la glucosa normal, el polimorfismo Gly972Arg se ha asociado a una disminución de la secreción de insulina por las células beta en respuesta a la glucosa, sin disminución de la sensibilidad a la insulina.14
Algunos estudios han mostrado una elevación de los niveles de glicemia e insulina en adultos con DM 2 que portan la variante Arg972 del IRS-1,13,15,16 mientras que en adultos obesos la forma heterocigótica de esta variante ha sido asociada al desarrollo de resistencia a la insulina,17 de manera que se ha planteado que el polimorfismo Gly972Arg representa una variante génica con repercusión funcional en 2 elementos fisiopatológicos involucrados en el desarrollo de la DM 2: la resistencia a la insulina y la disfunción de la célula beta.14
Se ha reportado un aumento significativo en la frecuencia de este alelo Arg972 en mujeres con diabetes gestacional18 y en pacientes con DM 2 en diferentes poblaciones.13,15,16,19-21 Algunos estudios sugieren que esta variante polimórfica se relaciona con un incremento en el riesgo de padecer DM 2;12,22 sin embargo, los resultados de otros estudios no han podido corroborar estas asociaciones.23-25 De esta manera el papel del polimorfismo Gly972Arg del gen IRS-1 en la fisiopatogenia de la DM 2 sigue siendo discutido, así como su posible interacción con variantes alélicas de otros genes que confieren protección para la diabetes.
El polimorfismo Ala513Pro del gen IRS-1 está producido por una mutación, y se encuentra en un sitio cercano a 2 residuos de tirosina (Tyr 982, Tyr 612) con potencialidades de fosforilación.26 El IRS-1 interviene en la cascada de señalización de la insulina una vez que es fosforilado por la quinasa del receptor, por lo que cualquier variación o interferencia en el proceso de fosforilación podría afectar la funcionalidad de esta molécula. Esto ha motivado el estudio de la posible implicación de este alelo polimórfico del IRS-1 en el desarrollo de algunos trastornos metabólicos dependientes de la acción de la insulina, como son: la diabetes, la alteración de la tolerancia a la glucosa y de la resistencia a la insulina, en los cuales puede existir un deterioro de la acción de esta hormona. De manera general la frecuencia de este alelo polimórfico Pro513 no es alta y muestra variaciones entre poblaciones. Algunos estudios realizados en grupos de sujetos taiwaneses, japoneses y de indios pimas sugieren que el alelo Pro513 resulta muy raro en estas poblaciones.26,27 Sin embargo, para otras de origen caucasiano se ha reportado un aumento de casi 3 veces en la prevalencia del alelo polimórfico Pro513 en pacientes con DM 2 con respecto a los sujetos no diabéticos,16,20 lo cual convierte a este polimorfismo del gen IRS-1 en una variante de cierto interés en los estudios diseñados para el esclarecimiento de la genética de la DM 2.
Teniendo en cuenta estos antecedentes se explorará el papel de los polimorfismos Ala513Pro y Gly972Arg del gen IRS-1 en la susceptibilidad genética para la DM 2, en un grupo de la población cubana.
MÉTODOS
Para la realización del estudio se reclutaron 499 personas nacidas en Cuba, con edades comprendidas entre 40 y 70 años, con IMC ³ 22 y < 30, provenientes de la consulta externa del Instituto Nacional de Endocrinología (INEN) y de áreas de salud de la provincia La Habana, especialmente remitidos para este estudio. Se conformaron 2 grupos: uno de pacientes diabéticos GD (n= 272), y otro de sujetos no diabéticos GC (n= 227).
A todos los participantes en el estudio se les realizó una entrevista en la que se recogió: antecedentes familiares de diabetes, sexo, edad, tensión arterial, el peso y la talla, tratamientos con medicamentos y la presencia de otras enfermedades, como son: enfermedad arterial periférica oclusiva, enfermedad vasculocerebral, cardiopatía isquémica o infarto agudo del miocardio. El IMC se calculó según la fórmula: peso (kg)/talla (m)2 (kg/m2).
A todos los participantes en el estudio se les tomó una muestra de sangre en ayunas para la determinación de glucemia, colesterol total, triglicéridos totales e insulinemia (excepto a los pacientes tratados con insulina). A las personas supuestamente no diabéticas se les realizó, además, una prueba de tolerancia a la glucosa (PTG) de 2 h, con una sobrecarga de 75 g de glucosa anhidra. Según los resultados de la PTG y siguiendo los criterios de la OMS vigentes al inicio del estudio,28 los sujetos que tuvieron una tolerancia a la glucosa alterada (glucemia en ayunas < 7,0 mmol/L y a las 2 h ³ 7,8 y < 11,1 mmol/L) se excluyeron del estudio, y los que tuvieron valores de glucemia con criterio diagnóstico de DM 2 (glucemia en ayunas ³ 7,0 mmol/L, y/o a las 2 h ³ 11,1 mmol/L) se incorporaron al grupo de pacientes diabéticos.
La determinación de glucemia se realizó utilizando el método de la glucosa-oxidasa,29 los niveles de colesterol se determinaron por el método enzimático colesterol oxidasa-peroxidasa,30 y los triglicéridos por un método colorimétrico-enzimático.31 La cuantificación de insulina se realizó por radioinmunoanálisis (RIA), utilizando un juego de reactivos producido en el INEN.32
Para la determinación de los genotipos de los polimorfismos Ala513Pro y Gly972Arg se extrajo ADN genómico de cada uno de los participantes en el estudio a partir de leucocitos de sangre periférica.33 La determinación de los genotipos del polimorfismo Ala513Pro se realizó según lo descrito anteriormente por Hitman GA y otros.19 Se amplificó un fragmento de ADN, de 268 pares de bases (pb), que contiene el sitio polimórfico, utilizando la técnica de polimerización en cadena (PCR). Posteriormente este fragmento de ADN se sometió a digestión con la enzima de restricción Dra III, y el resultado se visualizó mediante electroforesis en gel de agarosa. Se obtuvo un patrón de restricción de una banda de 268 pb para el genotipo de tipo salvaje (Ala/Ala), 2 bandas de 168 pb y 100 pb para el genotipo homocigótico del alelo mutado (Pro/Pro) y de 3 bandas de 268 pb, 168 pb y 100 pb para la variante heterocigótica de este polimorfismo (Ala/Pro).
De forma similar, para la determinación de los genotipos del polimorfismo Gly972Arg, se amplificó un fragmento de ADN, de 220 pb, que contiene el sitio polimórfico, utilizando la técnica de polimerización en cadena PCR.19 Posteriormente el producto de PCR se digirió con la enzima de restricción New England Biolabs, Beverly, MA (Bst N1). A continuación la electroforesis en gel de agarosa permitió visualizar un patrón de restricción de 3 bandas de 23 pb, 81 pb y 159 pb para la variante homocigótica del alelo de tipo salvaje (Gly/Gly), de 4 bandas de 23 pb, 81 pb, 108 pb y 51 pb para la variante homocigótica del alelo mutado (Arg/Arg), y de 5 bandas de 23 pb, 81 pb, 159 pb, 108 pb y 51 pb, para la variante heterocigótica (Gly/Arg).
Para la comparación de las frecuencias de estos polimorfismos en ambos grupos se utilizó la prueba estadística de chi cuadrado, considerando como nivel de significación p< 0,05, y para la cuantificación de las asociaciones se utilizó la razón de productos cruzados (OR). Con el fin de explorar la posible asociación entre los valores basales de insulinemia y glucemia, y la dosis del alelo Arg 972, se utilizó un análisis de varianza.
RESULTADOS
En la muestra escogida para el estudio (GD: 272 pacientes diabéticos, GC: 227 sujetos no diabéticos) hubo predominio del sexo femenino (GD: 172 mujeres y 55 hombres, GC: 180 mujeres y 92 hombres [p< 0,05]). La edad promedio, en años, fue de 55,51 para el grupo de sujetos no diabéticos y de 59,35 para el de los diabéticos (p< 0,05). No se encontraron diferencias significativas entre los grupos en cuanto al IMC (26,18 para el grupo de diabéticos y 26,04 para el grupo control). En el grupo de sujetos no diabéticos, el 48 % (n=109) refirió tener algún familiar de primer grado con diabetes.
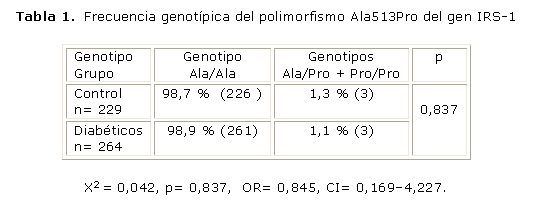
En la población estudiada la distribución genotípica del polimorfismo Ala513Pro en el IRS-1, no tuvo desviaciones significativas del equilibrio de Hardy Weinberg (test de X2, p> 0,05) con una frecuencia de 99,4 % para el alelo Ala y de 0,6 % para el alelo Pro. El alelo Pro513 (genotipos Ala/Pro y Pro/Pro) estuvo presente en el 1,2 % de la muestra general estudiada. Se muestra la comparación de las frecuencias del alelo polimórfico Pro513 en el grupo de sujetos no diabéticos y en el grupo de diabéticos. Para la comparación se utilizó la prueba estadística de chi cuadrado, considerando un nivel de significación de p< 0,05. Este alelo se encontró en el 1,1 % y el 1,3 % de los sujetos no diabéticos y diabéticos respectivamente (tabla 1).
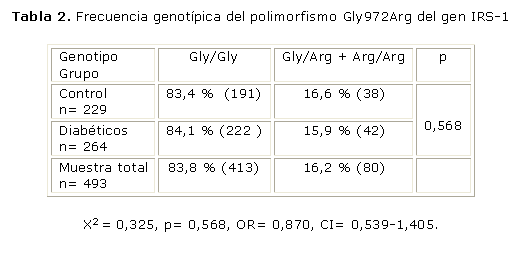
En el grupo estudiado la distribución genotípica del polimorfismo Gly972Arg en el IRS-1, está en equilibrio de Hardy Weinberg (prueba X2, p> 0,05) con una frecuencia de 92 % para el alelo Gly y de 8 % para el alelo Arg. El alelo Arg972 (genotipos Gly/Arg y Arg/Arg) estuvo presente en el 16,2 % de los sujetos estudiados. Este alelo se encontró en el 16,6 % de los sujetos del grupo control y en el 15,9 % de los pacientes diabéticos respectivamente (X2= 0,325, p= 0,568, OR= 0,870, CI= 0,539-1,405). El genotipo homocigótico para el alelo polimórfico Arg972 fue hallado únicamente en un sujeto del grupo control. Considerando lo anterior evaluamos solamente el modelo dominante, para lo cual agrupamos a los sujetos portadores del alelo polimórfico Arg972, tanto en la variante homocigótica (Arg/Arg) como heterocigótica (Gly/Arg) en una única categoría. Se muestra la comparación de las frecuencias del alelo polimórfico Arg972 en el grupo de sujetos no diabéticos y en el grupo de diabéticos. Para la comparación se utilizó la prueba estadística de chi cuadrado, considerando un nivel de significación de p< 0,05 (tabla 2).
Cuando se estratificó la población estudiada, según IMC en sujetos con normopeso (IMC< 25) y con sobrepeso (IMC ³ 25 y < 30), se encontró que en el estrato con normopeso el alelo Arg972 estuvo presente en el 21,6 % y en el 10,3 % de los sujetos del grupo control y de los pacientes diabéticos respectivamente (X2= 4,117, p= 0,062, OR= 0,419, CI= 0,178-0,987). Dentro de los sujetos con sobrepeso, el alelo Arg972 tuvo una frecuencia del 14,58 % en los controles y del 17,8 % en los diabéticos (X2= 0,616, p= 0,449, OR= 1,276, CI= 0,694-2,345). Teniendo en cuenta que se ha reportado una fuerte asociación entre el polimorfismo Gly972Arg y la DM 2 en sujetos delgados (IMC inferior a 23,1) de la población mexicana,34 exploramos esta asociación en los 72 sujetos que tenían el IMC por debajo de 23 (IMC ³ 22 y < 23). Encontramos que en este estrato la frecuencia del alelo Arg972 fue significativamente mayor en los controles que en los diabéticos (33,3 % vs. 8,3 %) (X2= 6,821, p= 0,009, OR= 0,182, CI= 0,046-0,716). Se muestra la comparación de las frecuencias del alelo polimórfico Arg972 en el grupo control y en el grupo de diabéticos con normopeso y con sobrepeso y con IMC mayor o igual a 22 y menor de 23. Para la comparación se utilizó la prueba estadística de chi cuadrado, considerando un nivel de significación de p< 0,05 (tabla 3).
Para explorar la posible asociación entre los valores basales de insulinemia y glucemia (como indicadores de la tolerancia a la glucosa y la secreción de insulina) y la presencia del alelo Arg972, se compararon los valores promedio de glucemia e insulinemia en los sujetos portadores o no del alelo polimórfico Arg972, en la muestra general estudiada, en los grupos según el estado de la tolerancia a la glucosa (controles y diabéticos) y en estratos según el IMC (normopesos y sobrepesos), utilizando un análisis de varianza. No se encontró ninguna asociación significativa (no se muestran los datos).
Con el fin de estudiar la interacción entre la historia familiar de diabetes y la presencia del alelo Arg972, se estratificó la población en estudio en 2 grupos, atendiendo a la presencia o no de familiares de primer grado diabéticos (padres, hijos y hermanos). No se encontraron diferencias en las frecuencias del alelo polimórfico entre el grupo de sujetos con antecedentes de diabetes y el de sujetos sin historia familiar de diabetes cuando analizamos la muestra total (16,3 % [n= 380] vs. 15,9 % [n= 113] respectivamente) (X2= 0,010, p= 0,922, OR= 0,972, CI 0,548-1,723), ni cuando realizamos al análisis dentro del grupo control (18,4 % [n= 21] vs. 16,1 % [n=18] respectivamente) (X2= 0,218, p= 0,640, OR= 0,848, CI= 0,425-1,694).
DISCUSIÓN
Los estudios de genes candidatos constituyen una de las estrategias para tratar el esclarecimiento de las bases genéticas de la diabetes. Permiten estudiar variantes polimórficas de genes involucrados en la patogenia de la diabetes, genes que expresan proteínas con funciones conocidas en los procesos bioquímicos relacionados con el desarrollo de la enfermedad.
El IRS-1 constituye un gen candidato en el establecimiento de las bases genéticas de la DM 2, teniendo en cuenta su importante función en el mecanismo de acción de la insulina. Sus variantes génicas podrían incidir potencialmente en el desarrollo de la resistencia a la insulina y en la patogénesis de la diabetes. En este trabajo exploramos la asociación de 2 polimorfismos del gen IRS-1 (Ala513Pro, Gly972Arg) con la DM 2, en un grupo de la población cubana que incluyó pacientes diabéticos y controles no diabéticos.
El polimorfismo Ala513Pro del gen IRS-1 resultó muy poco frecuente en los sujetos estudiados (1,2 %), en coincidencia con lo reportado para algunos grupos étnicos en los que este alelo no resulta común.19,26 A diferencia de otros estudios, en los que se ha encontrado un incremento en la frecuencia del alelo Pro513 asociado a la DM 2,16,20,35 en el nuestro, las frecuencias de la variante alélica Pro513 fueron similares para los pacientes diabéticos y los sujetos no diabéticos (1,3 % vs. 1,1 % respectivamente), por lo que, al menos en este grupo de nuestra población, el polimorfismo Ala513Pro no constituye un elemento a considerar para explicar las causas genéticas de la DM 2.
El polimorfismo Gly972Arg tuvo una frecuencia mayor (16,2 %) a la reportada para otras poblaciones.13,14,36 Sin embargo, la similitud en las prevalencias del alelo Arg972 en los sujetos no diabéticos (16,6 %) y diabéticos (15,9 %) (tabla 2) y la falta de asociación entre dicho alelo con los niveles circulantes de glucosa e insulina, sugieren que el aporte de este polimorfismo a la base genética de la DM 2, en el grupo estudiado, no es apreciable.
La asociación entre el polimorfismo Gly972Arg del IRS-1 y la DM 2 ha sido explorado para distintas poblaciones. El papel de este polimorfismo en la patogenia de la DM 2 muestra gran variabilidad entre las diferentes etnias. Para algunas de ellas el alelo Arg972 se asocia a la elevación de los niveles de glucemia,13,15,16 en otras a alteración de la tolerancia a la glucosa34 y en algunas a la DM 2.12,13,15,16,18-21,34 Un metanálisis publicado en el 2003,22 que incluyó 27 estudios independientes, realizados con distintas poblaciones (mayoritariamente de origen caucasiano), mostró un incremento en el riesgo de padecer DM 2 en los sujetos portadores del alelo Arg972. Sin embargo, estudios posteriores, en los que se incluyó un número grande de casos y controles, no lograron corroborar estas asociaciones,24,25 por lo cual el papel de esta variante polimórfica en la patogénesis de la DM 2 sigue siendo un aspecto controversial.
De manera general, y como es característico en las enfermedades multifactoriales, la magnitud de las asociaciones encontradas entre este polimorfismo y la DM 2, en los diferentes estudios, no es de gran intensidad (OR entre 1,15-1,5), lo cual sugiere que el efecto de esta variante polimórfica en la patogenia de la DM 2 es moderado y puede ser modulado con facilidad por la interacción con otros factores de riesgo o protección para la diabetes, tanto genéticos como ambientales característicos de cada población. Es necesario, además, tener en cuenta que la DM 2 es una enfermedad heterogénea, que agrupa diversos fenotipos, de forma tal que en los estudios que se realizan para definir sus bases genéticas participan pacientes con diferentes características fenotípicas, con más o menos susceptibilidad genética, expresadas, por ejemplo, en la edad de inicio de la enfermedad y en la intensidad de los síntomas. Esta diversidad de fenotipos agrupados en la DM 2, conjuntamente con las variaciones de la arquitectura genética de la DM 2 entre poblaciones y grupos étnicos, dificultan la valoración del impacto de cada polimorfismo en la fisiopatogenia de la enfermedad. No se puede descartar, tampoco, la posibilidad de que el polimorfismo Gly972Arg del IRS-1 no sea funcional, pero que se encuentre en desequilibrio de ligamiento, con algún polimorfismo realmente funcional.
Considerando que se ha reportado una interacción significativa entre la variante Arg972 y la obesidad,17 se exploró en nuestra muestra de estudio la prevalencia del polimorfismo Gly972Arg con la DM 2 en sujetos con diferentes niveles de IMC. Se halló un aumento en la frecuencia del alelo polimórfico en los sujetos no diabéticos con normopeso, que adquirió significación estadística en el grupo de sujetos no diabéticos con IMC menor de 23 (tabla 3). De forma contraria a lo esperado, para los sujetos más delgados (IMC< 23) participantes en el estudio, la variante polimórfica Arg972 resultó un alelo de protección, más que de susceptibilidad para la diabetes, lo cual no concuerda con lo hallado en la población mexicana, en la que se constató un aumento en el riesgo de padecer DM 2 en sujetos delgados (IMC< 23,1) portadores de este alelo.34 En la ancestralidad genética de la población mexicana el componente amerindio tiene una gran fuerza, mientras que la población cubana es esencialmente el resultado de la mezcla entre españoles, africanos, y en menor grado, tribus amerindias que habitaron la isla.37 Las diferencias en las proporciones de ancestralidad entre ambas poblaciones posiblemente expliquen las variaciones en el aporte del alelo polimórfico a la DM 2.
Por otro lado, en un estudio con sujetos japoneses, se encontró un aumento de la frecuencia de la variante polimórfica Arg972 en pacientes obesos con alteraciones de la tolerancia a la glucosa,38 no así en los diabéticos, lo cual muestra una asociación entre el alelo y un fenotipo particular, menos grave, de intolerancia a los carbohidratos en presencia de obesidad. Las diferencias que se reportan en cuanto a la relación del alelo polimórfico Arg972 con la DM 2 y los cambios en el patrón que sigue esta relación en interacción con la obesidad, reafirman la idea de que los componentes genéticos determinantes de la DM 2 varían entre las diferentes poblaciones.
El diseño del estudio tiene como limitante la alta frecuencia de sujetos con familiares de primer grado diabéticos en el grupo control (48 %). Este aspecto pudiera interferir en el análisis del aporte del polimorfismo Gly972Arg a la DM 2. No obstante, el hecho de que dentro del grupo de sujetos no diabéticos, las frecuencias del alelo polimórfico fueran similares en presencia o no de familiares de primer grado diabéticos, sugiere que la interacción de esta variante alélica con factores genéticos y/o ambientales determinantes de una historia familiar de DM 2, no incrementa su aporte a la etiología de la enfermedad.
Aunque este estudio solo pretendió explorar el papel de las variantes polimórficas Gly972Arg y Ala513Pro del gen IRS-1 en la susceptibilidad genética de la DM 2 en un grupo de nuestra población, debemos considerar que, por su tamaño, el grupo estudiado no es representativo de la población cubana, lo cual limita el valor de los estimados de frecuencias de los alelos a esta muestra, y por tanto, el alcance de los resultados, que muestran que en este grupo de la población cubana, las variantes polimórficas Ala513Pro y Gly972Arg del gen IRS-1 no tienen una participación importante en la etiología de la DM 2.
REFERENCIAS BIBLIOGRÁFICAS
1. Gloyn AL, Mc Carthy MI. The genetics of type 2 diabetes. Best Pract Res Clin Endocrinol Metab. 2001;15:293-308.
2. Kahn CR, Vincent D, Doria A. genetics of non insulin dependent (type II) Diabetes Mellitus. Acta Rev Med. 1996;47:509-33.
3. Mc Carthy MI. Progress in defining the molecular basis of type 2 diabetes mellitus through susceptibility gene identification. Human molecular genetics. 2004;13:R33-R41.
4. O' Rahilly S, Barroso I, Wanham NJ. Genetic factors in type 2 diabetes: the end of the beginning. Science. 2005;307:370-3.
5. White MF. The insulin signalling system and the IRS proteins. Diabetologia. 1997;40:S2-S17.
6. Araki E, López MA, Patti ME, Bruning JC, Haag IB, Johnson RS, et al. Alternative pathway of insulin signalling in mice with targeted disruption of the IRS-1 gene. Nature. 1994;372:186-90.
7. Tamemoto H, Kadowaki T, Tobe K. Insulin resistance and growth retardation in mice lacking insulin receptor substrate 1. Nature. 1994;372:182-6.
8. Aspinwall CA, Lakey JR, Kennedy RT. Insulin stimulated insulin secretion in single pancreatic beta cells. J Biol Chem. 1999;274:6360-5.
9. Kulkami RN, Bruning JC, Winnay JN, Postic C, Magnuson MA et al. Tissue specific knockout of the insulin receptor in pancreatic beta cells creates an insulin secretory defect similar to that in type 2 diabetes. Cell. 1999;96:329-39.
10. Kubota N, Tobe K, Terauchi Y. Disruption of the insulin receptor substrate 2 causes type 2 diabetes because of liver insulin resistance and lack of compensatory beta cell hyperplasia. Diabetes. 2000;49:1880-9.
11. Virkamaki A, Ueki K, Kahn CR. Protein-protein interaction in insulin signalling and the molecular mechanisms of insulin resistance. J Clinical Invest. 1999;103:931-43.
12. Porzio O, Federici M, Hribal ML. The Gly972Arg amino acid polymorphism in IRS 1 impairs insulin secretion in pancreatic beta cells. J Clinical Invest. 1999;104:357-64.
13. Almind K, Inone G, Pedersen O, Kahn CR. A common amino acid polymorphism in insulin receptor substrate-1 causes impaired insulin signalling. J Clin Invest. 1996;11:2569-75.
14. Stumvoll M, Fritsche A, Volk A. The Gly972Arg polymorphism in the insulin receptor substrate-1 gene contributes to variation in insulin secretion in normal glucose tolerant humans. Diabetes. 2001;50:882-5.
15. Hager J, Zonali H, Velho G, Froguel P. Insulin receptor substrate (IRS-1) gene polymorphism in French NIDDIM families. Lancet. 1993;342:1430-2.
16. Laakso M, Malkki M, Kekalainen P, Kuusisto J, Deeb SS. Insulin receptor substrate-1 variants in non-insulin dependent diabetes. J Clin Invest. 1994;94:1141-6.
17. Clausen JO, Hansen T, Bjorbaek C. Insulin resistance: interactions between obesity and a common variant of insulin receptor substrate-1. Lancet. 1995;346:397-402.
18. Fallucca F, Dalfrà MG, Sciullo E, Masin M, Buongiorno AM, Napoli A, Fedele D, Lapolla A. Polymorphisms of insulin receptor substrate 1 and beta3-adrenergic receptor genes in gestational diabetes and normal pregnancy. Metabolism. 2006 Nov;55(11):1451-6.
19. Hitman GA, Hawrani K, Mc Carthy MI. Insulin receptor substrate-1 gene mutation in NIDDM: implications for the study of polygenic disease. Diabetologia. 1995;38:481-6.
20. Imai Y, Fusco A, Suzuki Y, Lesniak MA. Variant sequences of insulin receptor substrate-1 in patients with non-insulin dependent Diabetes mellitus. J Clin Endocrinol Metab. 1994;79:1655-8.
21. Celi FS, Tanner K, Raben N. Two novel missense mutations in the insulin receptor substrate-1 gene Mexican-Americans with NIDDM. Diabetes. 1995;44:42-5.
22. Jellema A, Zeegers MPA, Feskens EJM, Dagnelie PC, Mensink RP. Gly972Arg variant in the insulin receptor substrate-1 gene and association with Type 2 diabetes: a meta-analysis of 27 studies. Diabetologia. 2003;46:990-5.
23. Ito K, Katsuki A, Furuta M, Fujii M, Tsuchihashi K, Hori Y, et al. Insulin Sensitivity is not Affected by Mutation of Codon 972 of the Human IRS-1 Gene. Horm Res. 1999;52:230-4.
24. Florez JC, Sjogrem M, Burtt N, Orho-Melander M, Schayer S, Sun M, et al. Association testing in 9,000 people fails to confirm the association of the insulin receptor substrate-1 G972R polymorphism with type 2 diabetes. Diabetes. 2004;53:3313-8.
25. Zeggini E, Parkinson J, Halford S, Owen KR, Frayling TM, Walker M, et al. Association studies of insulin receptor substrate 1 gene (IRS-1) variants in type 2 diabetes samples enriched for family history and early age of onset. Diabetes. 2004;53:3319-22.
26. Ta-Chi-L, Jui-Mei Y, Kum-Bing G, Tsung-Cheng K, Dong-Chi K, Shu-Fen L, et al. Abnormal glucose tolerance and insulin resistance in polycystic ovary syndrome amongst the Taiwanese population-not correlated with insulin receptor sustrate-1 Gly972Arg/Ala513Pro polymorphism. BMC Medical Genetics. 2006;7:36-40.
27. Celi FS, Silver K, Walston J, Knowler WC, Bogardus C, Shuldiner AR. Lack of IRS-1 codon 513 and 972 polymorphisms in Pima Indians. J Clin Endocrinol Metab. 1995;80:2827-9.
28. World Health Organization. Definition, Diagnosis and Classification of Diabetes Mellitus and its Complications. Part 1: Diagnosis and Classification of Diabetes Mellitus. Department of Non-communicable Disease Surveillance. Geneva; 1999. WHO/NCD/NCS/99.2.
29. Barham D, Trinder P. Glucose GOD-PAP. Analyst. 1972;97:142-5.
30. Schettler G, Nussel E. Cholesterol CHOP-PAP. Arb Med Loz Med Prat Med. 1975;10:25.
31. Schettler G, Nussel E. Triglycerides liquicolor GOP-PAP. Arb Med Loz Med Prat Med. 1975;10:25.
32. Arranz MC, González RM, Robaina R. Producción de anticuerpos anti insulina en conejos para uso como anticuerpos precipitantes en el RIA de insulina. Rev Cubana Invest Biomed. 1987;6:89-94.
33. Sambrook A, Fritsch EF, Maniatis T. Chapter: analysis and cloning of eukaryotic genomic DNA. En: Molecular Cloning a Laboratory Manual. 2th ed. USA: Cold Spring Harbor Laboratory Press; 1989. p. 9,16-9.
34. Burguette-García AI, Cruz-López M, Madrid-Marina V, López-Ridaura R, Hernández-Ávila M, Cortina B, et al. Association of Gly972Arg polymorphism of IRS1 gene with type 2 diabetes mellitus in lean participants of national health survey in Mexico: candidate gene study. Metabolism Clinical and Experimental. 2010;59:38-45.
35. Almind K, Bjorbaek C, Vestergaard H, Hansen T, Echwald S, Pedersen O. Aminoacid polymorphisms of insulin receptor substrate-1 in non-insulin-dependent diabetes mellitus. Lancet. 1993;342:828-32.
36. Lei H-H, Coresh J, Shuldiner AR, Boerwinkle E, Brancati FL. Variants of the insulin receptor substrate-1 and fatty acid binding protein 2 genes and the risk of the type 2 diabetes, obesity, and hyperinsulinemia in Africans Americans. Diabetes. 1999;48:1868-72.
37. Guanche J. Componentes étnicos nación cubana. Havana: Fundación Fernando Ortíz; 1997. p. 1255-60.
38. Yamada K, Yuan X, Ishiyama S, Shoji S, Kohno S, Koyama K-I, et al. Codon 972 polymorphism of the insulin receptor substrate-1 gene in impaired glucose tolerance and late-onset diabetes. Diabetes Care. 1998;21:753-6.
Recibido: 27 de diciembre de 2010.
Aprobado: 14 de marzo de 2011.
Luis Miguel Pérez. Instituto Nacional de Endocrinología. Calzada de Zapata esquina D, El Vedado, municipio Plaza. La Habana, Cuba. Correo electrónico: lmperezp@infomed.sld.cu