Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Endocrinología
versión On-line ISSN 1561-2953
Rev Cubana Endocrinol vol.24 no.2 Ciudad de la Habana mayo-ago. 2013
ARTÍCULO ORIGINAL
Alteraciones morfológicas de espermatozoides humanos por microscopía electrónica de barrido
Morphological alterations of human spermatozoa detected by scanning electron microscopy
MSc. Lic. Bertha Victoria Rodríguez Pendás,I Lic. Carlos Alfredo Toledo Sánchez,II Dr. Manuel Gómez Alzugaray,I Dr. Felipe Santana Pérez,I Dra. Emma Domínguez AlonsoI
IInstituto Nacional de Endocrinología. La Habana, Cuba.
IICentro de Estudios Avanzados de Cuba. La Habana, Cuba.
RESUMEN
Introducción: las alteraciones morfológicas en los espermatozoides humanos con frecuencia son responsables de la infertilidad masculina. En determinados casos, muchas anormalidades no se observan en los estudios de morfología realizados en los espermogramas de rutina por microscopía óptica convencional, por lo que es necesario recurrir a técnicas alternativas que permitan visualizar con mejor precisión los detalles morfológicos.
Objetivo: identificar anormalidades morfológicas mediante microscopía electrónica de barrido, en espermatozoides de hombres que consultan por infertilidad, los cuales fueron reportados como morfológicamente normales por microscopia óptica.
Métodos: se utilizaron 140 muestras de semen de hombres con edades entre 20 y 45 años, procedentes de las consultas de infertilidad del Instituto Nacional de Endocrinología. Se realizó el espermograma a las muestras colectadas por masturbación, según criterio de OMS, y se seleccionaron espermatozoides de las muestras con 30 % o más de morfología normal determinadas por microscopía óptica, para el estudio morfológico por microscopía electrónica de barrido.
Resultados: de las 140 muestras utilizadas en el estudio, 119 resultaron morfológicamente normales por microscopía óptica. De estas últimas, se encontraron alteraciones morfológicas por microscopía electrónica de barrido en 79 (66,4 %), en relación con 40 (33,6 %) que no mostraron. Las alteraciones espermáticas que predominaron fueron las correspondientes a colas pequeñas y enrolladas, pieza media doblada, cabezas grandes, amorfas y elongadas, con algunos cambios en la estructura acrosomal, así como espermatozoides con cabeza de punta. Las alteraciones de cola aparecen tanto aisladas como mixtas en 47 (59,4 %) de las 79 muestras.
Conclusiones: mediante la microscopía electrónica de barrido fue posible identificar anormalidades morfológicas en espermatozoides de hombres que consultan por infertilidad, los cuales fueron reportados como morfológicamente normales por microscopia óptica.
Palabras clave: espermatozoides, morfología espermática, infertilidad masculina, microscopía electrónica de barrido.
ABSTRACT
Introduction: morphological alterations of human spermatozoa are a common cause of infertility. Many abnormalities in certain cases are not observed in the morphological studies conducted in the routine spermograms based on the conventional optic microscopy; therefore, it is necessary to resort to alternative techniques that visualize morphological details with more precision.
Objective: to identify morphological spermatozoa abnormalities through scanning electron microscopy in patients who were treated in the infertility service and whose spermatozoa had been morphologically reported as normal in the optic microscopy exam.
Methods: one hundred forty semen samples taken from men aged 20 to 40 years, who were treated at the infertility service of the National Institute of Endocrinology. According to WHO criteria, the collected samples after masturbation were subjected to spermograms and those spermatozoa from the samples with 30 % or over of their morphology being normal, according to the optic microscopy results, were selected for the scanning electron microscopy study.
Results: of the 140 study samples, 119 were found morphologically normal in the optical miscroscopy. Out of the latter, 79 (66.4 %) were found to have morphological alterations in the scanning electron microscopy results, and 40 (33.6 %) were not. Predominant spermatic alterations were short and coiled tails, folded middle piece, big amorphous and elongated heads with some changes in their acrosomal structure as well as pointy-head spermatozoa. Both mixed and isolated tail alterations appeared in 47 (59.4 %) of the 79 samples.
Conclusions: through the scanning electron microscopy, it was possible to identify morphological anomalies in the spermatozoa from men who went to the infertility service. These spermatozoa had been reported as morphologically normal in the optical microscopy exam.
Key words: spermatozoa, spermatic morphology, male infertility, scanning electron microscopy.
INTRODUCCIÓN
La morfología espermática es una de las principales variables implicadas en la capacidad fertilizadora de espermatozoides humanos, y es considerada como índice predictor de la fertilidad masculina.1 La relación entre infertilidad masculina y la proporción de formas anormales en el eyaculado, es objeto de estudio de muchos investigadores,2 pues el porcentaje de espermatozoides morfológicamente normales es una de las variables que mejor se relaciona con la fertilidad masculina.
El criterio de espermatozoides morfológicamente normales se encuentra en constante revisión, teniendo en cuenta las alteraciones que desde el punto de vista de calidad espermática se han obtenido de estudios clínicos realizados en determinadas poblaciones.3 A pesar de esto, muchas instituciones, incluyendo la nuestra, continúan utilizando el valor de 30 % o más de formas normales, como morfología normal, en relación con la variable de morfología espermática determinada por los métodos convencionales de estudio de calidad seminal,4 considerando que desde el punto de vista morfológico son espermatozoides capaces de fertilizar.
La microscopía es una técnica esencial para los embriólogos en los laboratorios de reproducción,5 sin embargo, en la determinación de la morfología espermática por los métodos de rutina, utilizando microscopía óptica (MO), muchas anormalidades morfológicas no se observan, de aquí la necesidad de utilizar métodos alternativos para estudios más profundos de morfología espermática, que puedan aportar al diagnóstico y pronóstico reproductivo en la andrología clínica.6
En este trabajo nos propusimos identificar anormalidades morfológicas, en espermatozoides de hombres que consultan por infertilidad, por microscopía electrónica de barrido (MEB), los cuales, fueron previamente reportados como morfológicamente normales por MO.
MÉTODOS
En este estudio se utilizaron 140 muestras de semen, de un número igual de hombres con edades entre 20 y 45 años, procedentes de la consulta de infertilidad del Instituto Nacional de Endocrinología de La Habana, en el período comprendido entre marzo de 2009 y enero de 2010.
Las muestras de semen colectadas por masturbación, luego de la licuefacción, fueron examinadas de acuerdo con el criterio de la OMS4 para determinar las variables del espermograma. Una vez determinada la morfología espermática por MO, se seleccionaron espermatozoides de aquellas muestras que cumplían con el criterio de 30 % o más de formas normales.
De las 140 muestras del estudio, se encontraron 119 con espermatozoides con 30 % o más de morfología normal, las cuales fueron sometidas a MEB. Estas fueron diluídas (1:1) con solución salina, lavadas por centrifugación a 1 000 g x 15 minutos, y sometidas a un proceso de fijación, con una solución de fosfato-glutaraldehído al 2,5 % durante 15 minutos. Después de centrifugar 10 minutos a 500 x g, el aglomerado de espermatozoides se lavó 2 veces con solución salina, y posteriormente una gota de la muestra, fijada y deshidratada, se depositó sobre una cinta adhesiva, para su posterior recubrimiento con oro-paladio (45 nm).7 La observación se realizó en un MEB (Tescan, Vega 5130 SB). Las condiciones de trabajo fueron 10 kv de voltaje de aceleración, con 7 mm de distancia de trabajo. Se analizaron 2 láminas por muestra. Todos los datos fueron procesados por SSPS, y se tuvieron en cuenta todos los aspectos éticos y la confidencialidad de los resultados.
RESULTADOS
De las 119 muestras de semen analizadas por MEB, se encontraron anormalidades morfológicas en 79 (66,4 %), con relación a 40 (33,6 %) que no mostraron. De las 79 muestras con anormalidades por MEB, 55 (69,6 %) presentaron anormalidades mixtas y 24 (30,3 %) anormalidades aisladas.
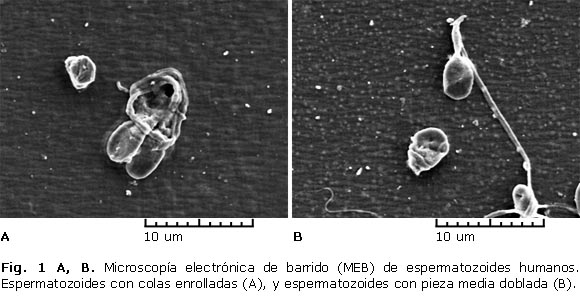
Las alteraciones espermáticas que predominaron fueron a nivel de cola: colas pequeñas y enrolladas (Fig. 1. A), a nivel de pieza media: pieza media doblada (Fig. 1. B), y a nivel de cabeza: cabezas grandes, amorfas y elongadas con algunos cambios en la estructura acrosomal (Fig. 2. A), además de espermatozoides con cabeza de punta (Fig. 2. B). Un total de 47 muestras (59,4 %) presentaron anormalidades morfológicas a nivel de la cola, tanto aisladas como mixtas.
DISCUSIÓN
La morfología espermática es considerada por algunos clínicos, como la variable del estudio seminal que mejor puede predecir la capacidad de fertilización.8 En el análisis de la morfología espermática por métodos de rutina no se revelan muchas alteraciones morfológicas de cabeza, pieza media y cola, por lo que se necesitan métodos alternativos para examinar estos defectos.9
En nuestro estudio utilizamos la MEB para identificar anormalidades morfológicas no encontradas por MO. No fue objetivo del trabajo comparar ambos métodos, pues no disponemos de un valor de corte, con una proporción de espermatozoides determinada, para considerar una muestra morfológicamente normal por MEB. Solo se trató de corroborar, que con este último método, se pueden precisar un mayor número de anormalidades, que por el método convencional no se encontraron, pues 79, de los 119 pacientes reportados como morfológicamente normales (por MO), presentaron anomalías por MEB.
Aunque no se relacionan en el trabajo los resultados de MEB con las variables del espermograma, el hecho de encontrar 47 muestras (59,4 %) de 79, con alteraciones de cola, y partir de una población de pacientes que consultan por infertilidad, con afectación de las variables de calidad del semen como es la movilidad espermática, se puede inferir que estas anormalidades de cola pudieran estar afectando la movilidad de los espermatozoides y comprometer la capacidad reproductiva de estos pacientes. Este planteamiento se apoya en resultados obtenidos recientemente por otros autores, que al relacionar motilidad y morfología espermática, sugieren que la causa probable de alteración de la motilidad progresiva, es por defectos en la pieza principal de la cola, y, probablemente, un exceso de citoplasma residual.10
Otros trabajos, como el de Munuce y otros relacionan la morfología normal del espermatozoide y su cinética de desplazamiento, apoyando la hipótesis de que los espermatozoides morfológicamente mejores, serían aquellos que presenten mejores características de movimiento medido de forma objetiva.11 Por otra parte, los espermatozoides con alteraciones morfológicas e inmóviles pudieran generar especies reactivas del oxígeno, que están asociadas a daños al ADN, en el genoma nuclear y mitocondrial,12 lo cual se relaciona con una disminución de la capacidad de fertilización de los espermatozoides involucrados.
Las anormalidades de la cabeza del espermatozoide, especialmente las cabezas amorfas encontradas en nuestros pacientes, también se reportan por algunos autores y se vinculan a la fragmentación del ADN.13 Además, en relación con el impacto de estas anormalidades en la infertilidad, Kably y otros manifiestan que la probabilidad de lograr embarazo es superior en pacientes con menor número de espermatozoides con alteraciones morfológicas de cabeza, porque además son un factor pronóstico, no solo de embarazo, sino también de la evolución de este en pacientes con infertilidad de causa no conocida.14
En nuestra práctica diaria, que realizamos técnicas de reproducción asistida de baja complejidad y no disponemos de tecnología avanzada, ni técnicas para determinar función espermática, el análisis de la morfología del espermatozoide es de vital importancia, pues la presencia de alteraciones morfológicas puede afectar los resultados de los métodos de recuperación espermática (swim up), los cuales no solo seleccionan espermatozoides con buena movilidad, sino también aquellos con morfología adecuada. Al respecto Lampiao y otros manifiestan en su estudio, que si las anormalidades morfológicas son muy severas en número y frecuencia, los espermatozoides recuperados tendrán un mal pronóstico de fertilización.15
Es cierto que la MEB es una técnica compleja, de alto costo y consumo de tiempo, con muy baja disponibilidad en la mayoría de las instituciones,16 por lo cual no se incluye en el análisis de rutina del semen, y se reserva para casos seleccionados, como es la prevalencia de defectos de cola de origen genético,17 pero su uso en la evaluación del factor masculino contribuye a esclarecer posibles causas de infertilidad, pues aporta mayor calidad en los detalles de las células espermáticas analizadas (esto último se pudo comprobar en nuestro trabajo).
Si se considera que un número importante de los pacientes analizados en este estudio presentaron alteraciones por MEB no precisadas por MO, que pueden comprometer su fertilidad, se sugiere considerar esta variable con más profundidad, cuando en los momentos actuales los criterios de normalidad para la morfología espermática son cada vez más estrictos18 y de difícil aplicación en la generalidad de las instituciones, que no disponen de tecnologías de reproducción asistida de alta complejidad, sin descartar la posible influencia negativa que implican estas anomalías a la hora de conseguir una gestación.19
Investigaciones recientes demuestran que en dependencia de la naturaleza de las anormalidades involucradas, el resultado de los procedimientos de reproducción asistida puede variar, y se introduce el concepto de patología espermática para caracterizar las deficiencias estructurales y funcionales de espermatozoides anormales,20,21 de lo que se desprende la necesidad de evaluar las características morfológicas de espermatozoides, no solo por MO, sino también a nivel ultraestructural22 para clarificar la relación entre morfología espermática y función espermática.23,24
Se sugiere considerar en trabajos futuros la utilización de un número mayor de sujetos, y detallar en cada uno el número y tipo de anormalidad encontrada dentro de cada nivel del espermatozoide, lo cual permitiría examinar la relación entre el por ciento de espermatozoides, clasificados dentro de cada tipo de alteración morfológica. Sería recomendable, hacer comparaciones entre el análisis morfológico de espermatozoides de hombres fértiles e infértiles, desde el punto de vista de calidad espermática, utilizando ambos métodos (MEB y MO), para poder clarificar la relación entre morfología espermática y fertilidad, lo cual no fue posible con este estudio. Además, profundizar en la utilización de esta técnica, que aunque engorrosa en proceder, puede refinar el diagnóstico de espermatozoides defectuosos y servir como herramienta de pronóstico reproductivo,25,26 pues su valoración puede ser útil en el diagnóstico de la infertilidad masculina, y explicar algunos fallos en los procedimientos de reproducción asistida.
La utilización de la MEB en nuestro estudio es un primer acercamiento de trabajo utilizando una técnica alternativa, que permitió identificar anormalidades morfológicas en espermatozoides de hombres que consultan por infertilidad, los cuales fueron previamente reportados como morfológicamente normales por MO.
REFERENCIAS BIBLIOGRÁFICAS
1. Eliasson R. Semen analysis with regard to sperm number, sperm morphology and functional aspects. Asian J Androl. 2010;12:26-32.
2. Yu J, Xu Y. Ultrastructural defects of acrosome in infertile men. Arch Androl. 2004;50:405-9.
3. Auger J. Assessing human sperm morphology: top models, underdogs or biometrics? Asian J Androl. 2010;12:36-46.
4. WHO. World Health Organization Laboratory. Manual for the Examination and Processing of Human Semen. Geneva: World Health Organization; 1989.
5. Shivhare S, Ladas I, Kashir J, Jones C, Griffiths T, Turner K, Coward K. Light Microscopy in Clinical Embriology: lighting the way for Infertility Treatment. Microsc and annals. 2011;109:9-13.
6. Malgorzata K, Depa-Martynow M, Butowska W, Filipiak K, Pawelczyk L, Jedrzejczak P. Human spermatozoa ultrastructure assessment in the infertility treatment by assisted reproduction technique. Arch Androl. 2007;53:297-302.
7. Gómez M, Girelda J, Fernández P, Romero A. Estudio de las alteraciones morfológicas de espermatozoides humanos con microscopía electrónica de barrido (SEM). Rev Iberoam Fértil Reprod Hum. 2005;22:59-66.
8. Skowronek M, Alciaturi J, Casanova G, Capurro A, Montes J, Sapiro R. Value of quantitative ultramorphological sperm analysis in infertile men. Reprod Biol. 2010;10:25-39.
9. Chelhod M, Lobo A, Flores E, Gómez A, Rojas L, Marina L. Anormalidades de la morfología espermática por microscopía óptica y microscopía electrónica de barrido en un grupo de estudiantes de la universidad de Oriente, núcleo de Sucre. Acta Microscópica. 2008;17(Supp. A).
10. Flores E, Lobo A, Chelhod M, Rojas L, Salazar L, Albarado L. Motilidad y morfología espermática, en estudiantes de la Universidad de Oriente. Rev Obstet Ginecol Venez. 2012;72:52-7.
11. Munuce M, Cardona M, Berta C. Existe asociación entre la morfología normal del espermatozoide y su cinética de desplazamiento? Actas urológicas españolas. 2006;30:591-7.
12. Cruz I, Colmenares M, Berrueta L, Gómez R, Montes H, Salmen S, et al. Evaluation of the quality of the human spermatozoon: comparison between spermatic DNA integrity and semen variables. Invest Clin. 2010;51:87-99.
13. Daris B, Goropevsek A, Hojnik N, Vlaisavljeviæ V. Sperm morphological abnormalities as indicators of DNA fragmentation and fertilization in ICSI. Arch Gynecol Obstet. 2010;281:363-7.
14. Kably A, Carballo E, Estévez S. Impacto de las anormalidades de la cabeza del espermatozoide como factor pronóstico en la infertilidad de causa no determinada. Ginecol Obstet Mex. 2008;76:151-5.
15. Lampiao F, Plessis S. Comparing the multi-ZSC one-step standardized swim-up method to the double-wash swim-up method regard to the effects of sperm separation on morphology, head morphometry and acrosome reaction inducibility. Fertil Steril. 2006;86:739-41.
16. Jurado S, Sarmiento P, Stornelli A. La microscopía electrónica como herramienta en la evaluación del semen canino. Analecta veterinaria. 2008;28:7-14.
17. Baccetti B, Capitani S, Collo del G, Cairano G, Gambera L, Moretti E, et al. Genetic sperm defects and consanguinity. Hum Reprod. 2001;16;1365-71.
18. Menkveld R. Clinical significance of the low normal sperm morphology value as proposed in the fifth edition of the WHO Laboratory Manual for the Examination and Processing of Human Semen. Asian J Androl. 2010;12:47-58.
19. Berger D, Abdelhafez F, Russell H, Goldfarb J, Desai N. Severe teratozoospermia and its influence on pronuclear morphology, embryonic cleavage and compaction. Reprod Biol Endocrinol. 2011;22:9-37.
20. Chemes H, Rawe V. Sperm pathology, a step beyond descriptive morphology. Origin, characterization and fertility potential of abnormal sperm phenotypes in infertile men. Hum Reprod Upd. 2003;9:405-28.
21. Chemes H, Rawe V. The making of abnormal spermatozoa: cellular and molecular mechanisms underlying pathological spermiogenesis. Cell Tissue Res. 2010;341:349-57.
22. Cabral M, Pires I, Figueredo H, Oliveira E, Sousa M, Ferras L. Ultrastructure of a case of asthenozoospermia. Rev Int Androl. 2012;10:156-9.
23. Aitken R. Sperm function test and fertility. Intern J Androl. 2006;29:69-75.
24. Skoworonek F, Casanova G, Alciaturi J, Capurro A, Cantu L, Montes J, Sapiro R. DNA sperm damage correlates with nuclear ultrastructural sperm defects teratozoospermic men. Androl. 2011;19:1439-44.
25. Joshi N, Cruz I, Osuna J. Highlights on ultrastructural pathology of human sperm. Methods Mol Biol. 2011;736:259-84.
26. Morbeck D, Leonard P, Weaver A, Shimek K, Bouwsma E, Coddington C. Sperm morphology: classification drift overtime and clinical implications. Fertil Steril. 2011;96:1350-4.
27. Chemes H. Ultrastructural analysis of testicular tissue and sperm by transmission and scanning electron microscopy. Methods Mol Biol. 2013;927:321-48.
Recibido: 4 de diciembre de 2012.
Aprobado: 18 de febrero de 2013.
Bertha Victoria Rodríguez Pendás. Instituto Nacional de Endocrinología. Calle Zapata y D, Vedado, municipio Plaza de la Revolución. La Habana, Cuba. Correo electrónico: berthapendas@infomed.sld.cu