Meu SciELO
Serviços Personalizados
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Cubana de Endocrinología
versão On-line ISSN 1561-2953
Rev Cubana Endocrinol vol.25 no.2 Ciudad de la Habana maio.-ago. 2014
ARTÍCULO ORIGINAL
Control glucémico y daño oxidativo a biomoléculas en diabéticos tipo 2
Glycemic control and oxidative damage to biomolecules observed in type 2 diabetic people
Dra. Ela María Céspedes Miranda,I Lic. Gretel Riverón Forment,II Lic. Celia Alonso Rodríguez,III Dra. Elsa Cabrera Pérez-SanzIII
IFacultad de Ciencias Médicas "Gral. Calixto García". Universidad de Ciencias Médicas de La Habana. La Habana, Cuba.
IICentro Nacional de Genética Médica. La Habana, Cuba.
IIIHospital Clinicoquirúrgico "Hermanos Ameijeiras". La Habana, Cuba.
RESUMEN
Introducción: el pobre control glucémico y los trastornos lipídicos son factores de riesgo para las complicaciones vasculares en la diabetes mellitus. Estos cambios se asocian con el estrés oxidativo.
Objetivo: analizar el perfil lipídico, el daño oxidativo a biomoléculas y el control glucémico en el diabético tipo 2.
Métodos: estudio descriptivo y transversal con 94 pacientes diabéticos tipo 2. Se determinaron los niveles de glucosa en sangre, hemoglobina glicada, creatinina, perfil lipídico, productos reactivos al ácido tiobarbitúrico y de grupos carbonilo como indicadores de peroxidación de los lípidos y de oxidación de proteínas, respectivamente. Se estratificaron los datos según el sexo, tiempo de evolución de la enfermedad y el control glucémico (glucosa < 6,2 mmol/L vs. glucosa ³ 6,2 mmol/L; hemoglobina glicada < 7 % vs. hemoglobina glicada ³ 7 %).
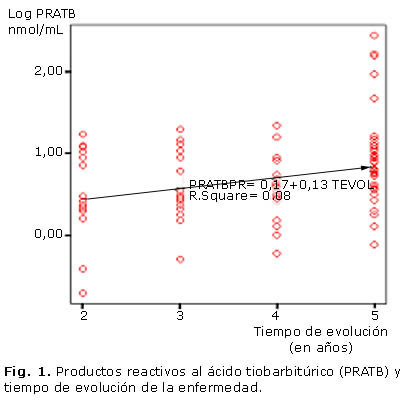
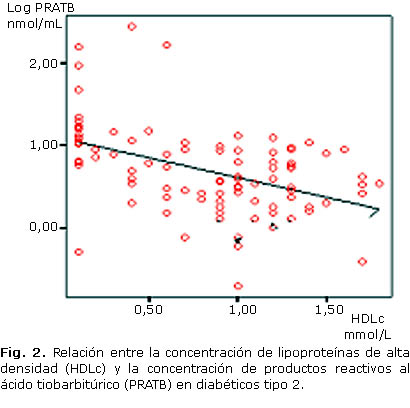
Resultados: la concentración de triglicéridos se incrementó en los diabéticos con pobre control glucémico (hemoglobina glicada ³ 7). Los productos reactivos al ácido tiobarbitúrico y de grupos carbonilo no difieren según sexo y control glucémico. Los niveles de grupos carbonilo fueron más altos en los diabéticos en relación con los valores de referencia. Se verificó una asociación positiva entre los productos reactivos al ácido tiobarbitúrico, con el tiempo de evolución de la enfermedad (r= 0,271; p= 0,008) y negativa con lipoproteínas de alta densidad (r= -0,449; p= 0,000). Los productos reactivos al ácido tiobarbitúrico fueron mayores en diabéticos con 5 años de evolución de la enfermedad.
Conclusiones: se verifica el fenotipo dislipidémico en los pacientes diabéticos, y el daño oxidativo a los lípidos es consecuente con el tiempo de evolución de la enfermedad, independientemente del sexo y del control glucémico.
Palabras clave: control glucémico, daño oxidativo, diabetes mellitus tipo 2.
ABSTRACT
Introduction: poor glycemic control and lipid disorders are risk factors for vascular complications caused by diabetes mellitus. These changes are associated to oxidative stress.
Objective: to analyze the lipid profile, the oxidative damage to biomolecules and the glycemic control in type 2 diabetic patients.
Methods: descriptive and cross-sectional study conducted in ninety four type 2 diabetic patients. The levels of blood glucose, glycated hemoglobin, creatinine, lipid profile, tiobarbituric acid reactive substances, and of carboxyl groups as indicators of lipid peroxidation and of protein oxidation were all estimated. Data were stratified by sex, time of disease progression and glycemic control (glucose < 6.2 mmol/L vs. glucose ³ 6.2 mmol/L; glycated hemoglobin < 7 % vs. glycated hemoglobin ³ 7 %).
Results: the triglyceride concentration increased in diabetics with poor glycemic control (glycated hemoglobin ³ 7 %). The tiobarbituric acid reactive substances and of carboxyl groups did not differ depending on sex and glycemic control. The levels of carboxyl groups were higher in diabetics compared to the reference values. It was confirmed that there is positive association between the tiobarbituric acid reactive substances and the time of disease progression (r= 0.271; p= 0.008) and negative association with high density lipoproteins (r= -0.449; p= 0.000). The amount of tiobarbituric acid reactive substances was higher in diabetics with 5 years of disease progression.
Conclusions: the dyslipidemic phenotype was proved in diabetic patients and the oxidative damage to lipids results from the time of disease progression, regardless of sex and glycemic control.
Keywords: glycemic control, oxidative damage, type 2 diabetes mellitus.
INTRODUCCIÓN
Las tasas de morbilidad y mortalidad de enfermedades cardiovasculares en Cuba han ido creciendo paulatinamente, en la misma medida en que la esperanza de vida se incrementa. En el contexto de estas enfermedades, la diabetes mellitus (DM) es un factor de riesgo cardiovascular, y se encuentra entre las 10 primeras causas de mortalidad en la población cubana.1
Los estudios epidemiológicos en relación con la DM en Cuba evidencian que la prevalencia es alta en la población adulta.1 Este incremento en la prevalencia es preocupante, por la enfermedad en sí y por las complicaciones crónicas microvasculares y macrovasculares que se presentan en estos pacientes. Las personas con DM tienen mayor probabilidad de desarrollar complicaciones cardiovasculares, que las que no presentan la enfermedad.2
Se proponen como factores de riesgo para esas complicaciones, el pobre control glucémico, la microalbuminuria, las dislipidemias y la hipertensión arterial, condiciones que favorecen el incremento de especies reactivas oxidantes.3-6
La hiperglucemia y las especies reactivas oxidantes, confluyen en el establecimiento de un estado metabólico que se identifica como estrés oxidativo (EO), que se expresa por una relación anormal entre especies reactivas de alto potencial oxidante y los sistemas antioxidantes, a favor de las primeras, con alteraciones o no en la relación estructura y función de los diferentes niveles de organización biológica, en la expresión génica y en vías específicas de señalización de la célula.5,7,8
En condiciones de EO se favorece la oxidación de lípidos y proteínas, se incrementa la vía del poliol, la formación de productos terminales de glicación avanzada y la actividad de la proteína quinasa C, vías que modulan las funciones de las células de la pared vascular, la resistencia a la insulina y la disfunción endotelial.2,5 Estos mecanismos están involucrados en la aterosclerosis y la enfermedad cardiovascular; sin embargo, inhibidores de estas vías no se implementan en la práctica clínica.
Se sugiere que el control glucémico riguroso reporta beneficios para la disminución del riesgo cardiovascular, aunque en los estudios ADVANCE (Action in Diabetes and Vascular Disease: Preterax and Diamicron Modified Release Controlled Evaluation) y VADT (Veteran Administration Diabetes Trial), no se demuestra asociación de la hemoglobina glicada con dicho riesgo en diabéticos tipo 2.9,10
El impacto clínico del control glucémico, la duración de la enfermedad y el EO en las complicaciones del paciente diabético tipo 2, aún es controversial, por lo que se realizó un análisis del comportamiento del perfil lipídico y el daño oxidativo a biomoléculas según el sexo, la duración de la enfermedad y el control glucémico en personas con DM 2.
MÉTODOS
Se realizó un estudio descriptivo y transversal con 94 pacientes diabéticos tipo 2. El ensayo se realizó con lo 94 pacientes diabéticos tipo 2 citados, procedentes del Servicio de Endocrinología del Hospital Clinicoquirúrgico "Hermanos Ameijeiras", en el periodo 2008-2010, con edades comprendidas entre los 50 y 70 años, que tenían entre 2 y 5 años de evolución de la enfermedad, no obesos, sin hábitos tóxicos, enfermedades autoinmunes, u otra complicación con expresión clínica de la enfermedad, y que no ingirieron suplementos antioxidantes en los 2 meses previos al estudio. El diagnóstico de DM se definió según los reportes de la Sociedad Americana de Diabetes.11 Se trabajó según las normas éticas establecidas en la convención de Helsinki y el Comité de Ética de la institución aprobó el estudio.
Se obtuvieron 10 mL de sangre de la vena cubital de las personas en ayunas de 12 horas, y el suero se conservó a -20 °C hasta el momento de su procesamiento. La concentración de glucosa en sangre, el colesterol total, la lipoproteína de alta densidad (HDLc), los triglicéridos y la creatinina, se cuantificaron según los procedimientos normativos operacionales del centro de investigaciones;12 la lipoproteína de baja densidad (LDLc) se calculó mediante la fórmula de Friedwald. La hemoglobina glicada (HbA1c) se determinó mediante inmunoturbidimetría.13 Los productos reactivos al ácido tiobarbitúrico (PRATB) como indicador de la peroxidación lipídica se cuantificaron según Yagi,14 y los grupos carbonilo como indicador de oxidación de proteínas (POX), según el método de Reznick.15
El análisis de los resultados se realizó mediante el paquete estadístico SPSS 15.0 para Windows. Se aplicó la prueba de normalidad de Kolmogorov Smirnov. Al rechazarse la hipótesis de una distribución gaussiana para la mayoría de las variables, se estimó la diferencia entre los grupos mediante estadística no paramétrica, que incluyó análisis de varianza de Kruskal-Wallis, y prueba de correlación de Spearman, con el fin de verificar diferencias entre grupos, y establecer asociaciones entre las variables. Se realizó la transformación de variables sin distribución normal, y se aplicó análisis de varianza y un modelo de regresión lineal para estimar el efecto de una variable sobre otra. Las diferencias se consideraron significativas cuando p< 0,05.
RESULTADOS
En la tabla 1 se presentan los resultados según el sexo, correspondientes a la población diabética. En el estudio la concentración de colesterol sanguíneo, de triglicéridos, HDLc, LDLc, PRATB y POX no difieren entre mujeres y hombres diabéticos; sin embargo, las HDLc son menores en ambos (riesgo vascular moderado), mientras que POX se encuentra por encima de los valores considerados de referencia (0,50-1,00 nmol/mg de proteínas).12
Los PRATB se asocian positivamente con el tiempo de evolución de la enfermedad (r= 0,271; p= 0,008) y el mayor incremento se produce después del cuarto año (figura 1). En los pacientes con 5 años de duración de la enfermedad, PRATB es mayor (p= 0,024) (tabla 2).
Se verifica, además, una asociación negativa entre PRATB y HDLc (r= -0,449, p= 0,000) en los pacientes diabéticos, asociación que se mantiene cuando la glucosa ³ 6,2 mmol/L y la hemoglobina glicada ³ 7 % (figura 2).
En la tabla 3 se observan los resultados correspondientes a las variables estudiadas atendiendo a la concentración de glucosa en ayunas. PRATB y POX no difieren significativamente entre los grupos.
En la tabla 4 se representan los resultados correspondientes a los indicadores estudiados según glucemia y hemoglobina glicada. Tanto en condiciones de normoglucemia como en hiperglucemia, la concentración de triglicéridos es significativamente diferente cuando la hemoglobina glicada es mayor que 7 (HbA1c ³ 7). Aunque no se observan diferencias significativas entre los grupos, la concentración de PRATB y POX tiende a ser mayor en los diabéticos con pobre control glucémico.
DISCUSIÓN
La concentración del colesterol y de los triglicéridos séricos se encuentra dentro de los valores de referencia, tanto en las mujeres como en los hombres,12 sin embargo, se identifica una mayor concentración de triglicéridos en los diabéticos con pobre control glucémico en relación con los que presentan buen control (tabla 4). Estas condiciones reafirman un riesgo vascular alto en pacientes diabéticos tipo 2 no controlados, riesgo que se puede relacionar con el papel de los ácidos grasos en la lipotoxicidad.16,17
Los estudios que demuestran la relación del colesterol total, los triglicéridos y la DM son numerosos.18-20 Manohar y otros reportan mayor concentración de triglicéridos en un grupo de 52 diabéticos en relación con personas saludables.20
Los efectos de la hiperglucemia y de las modificaciones en los lípidos son multiplicativos. Se induce la producción de anión superóxido y otras especies reactivas, y se produce un desbalance oxidativo que compromete el funcionamiento vascular y favorece la aparición de las complicaciones que se presentan en los diabéticos.21 La identificación de este desbalance oxidativo se puede realizar a través de la detección de productos finales de la peroxidación lipídica y de grupos carbonilo, como indicadores de la oxidación de lípidos y proteínas, entre otros.22
En la figura 1 se evidencia un incremento en PRATB con la duración de la enfermedad. Este indicador de la peroxidación lipídica es mayor en los diabéticos con 5 años de evolución, independientemente del control glucémico (tabla 2). Se reconoce que la hiperglucemia incrementa la producción de radicales libres, y se asocia con un incremento en la formación de productos finales de la peroxidación lipídica. Sin embargo, la evidencia del daño oxidativo a los lípidos depende de los diferentes productos que se forman, y de la respuesta de los sistemas antioxidantes.
Resultados similares se encontraron en el grupo de Nakhjavani y otros, en un estudio con 120 pacientes diabéticos. Estos autores demostraron una mayor concentración de malonildialdehido en pacientes diabéticos con 10 años de evolución de la enfermedad, sin asociación con el control glucémico.22 En relación con este último, no se verifican cambios significativos en el daño a biomoléculas en los diabéticos con pobre control y buen control, independientemente de la duración de la enfermedad. Este resultado puede estar en correspondencia con la propia evolución de la enfermedad, así como a la actividad de los mecanismos antioxidantes.
En relación con la asociación de la peroxidación lipídica y el control de la enfermedad, también los resultados son diversos. Algunos autores han reportado una asociación positiva entre malonildialdehido y el control glucémico;20,23 en cambio, Benítez y otros no encontraron asociación entre dichas variables.24
Algunos autores atribuyen a la hiperglucemia aguda, y no a la crónica, los mayores cambios en el EO. Sampson y otros estudiaron isoprostanos 8-epi-F2a, producido por peroxidación del ácido araquidónico, y capacidad antioxidante en el plasma de 21 pacientes con DM 2 después de una sobrecarga de glucosa, y concluyeron que la hiperglucemia aguda se asocia al daño por radicales libres en la DM 2.25 En el estudio de Gopaul, con 39 pacientes, se reporta que el incremento en la paroxidación lipídica en diabéticos tipo 2 no se relaciona con la hiperglucemia o la hiperlipidemia.26
En el estudio de Likidlilid, los niveles de malonildialdehido, un producto de la peroxidación lipídica, fueron significativamente más elevados en diabéticos controlados y no controlados.27 Resultado similar fue reportado por Bhutia y otros en un estudio con 60 pacientes diabéticos con complicaciones microvasculares y macrovasculares, y por el grupo de Soliman, en estudios con diabéticos tipo 2 sin complicaciones.28,29
Además de las modificaciones oxidativas a las biomoléculas, se reportan modificaciones en la biodisponibilidad y funcionabilidad de antioxidantes. La concentración de HDLc está disminuida en relación con los niveles de referencia, característico de las modificaciones del perfil lipídico en la DM.30 La asociación negativa de esta lipoproteína con los niveles de PRATB puede estar en correspondencia con la respuesta al daño, ya sea, por oxidación de los ácidos grasos presentes en esta lipoproteína, o por la menor actividad de enzimas antioxidantes asociadas a esta.31 La menor concentración de HDLc en los diabéticos tipo 2 puede significar una mayor sensibilidad al daño oxidativo en los diabéticos, sin relación con el control glucémico.
En algunos estudios no se ha encontrado asociación entre la peroxidación lipídica y los sistemas antioxidantes, lo que pudiese estar en relación con la participación de otros factores, relacionados o no con el metabolismo oxidativo, dada la complejidad de los mecanismos regulatorios que intervienen en la dinámica oxidativa, el funcionamiento del endotelio y del sistema cardiovascular.32-34
En conclusión, se verifica el fenotipo dislipidémico en los pacientes diabéticos y el daño oxidativo a los lípidos es consecuente con el tiempo de evolución de la enfermedad, independientemente del sexo y del control glucémico.
REFERENCIAS BIBLIOGRÁFICAS
1. Cuba. Ministerio de Salud Pública. Anuario Estadístico de Salud 2012. Dirección Nacional de Registros Médicos y Estadísticas de Salud. La Habana; 2013.
2. Deshpande AD, Harris-Hayes M, Schootman M. Epidemiology of diabetes and diabetes-related complications. Phys Ther. 2008;88:1254-64.
3. Brownlee M. The pathobiology of diabetic complications: a unifying mechanism. Diabetes. 2005;54:1615-25.
4. Sarwar N, Gao P, Seshasai SR, Gobin R, Kaptoge S, Di AE, et al. Diabetes mellitus, fasting blood glucose concentration, and risk of vascular disease: a collaborative meta-analysis of 102 prospective studies. Lancet. 2010;375:2215-22.
5. Giacco F, Brownlee M. Oxidative stress and diabetic complications. Circ Res. 2010;107(9):1058-70.
6. Ford ES, Li C, Sniderman A. Temporal changes in concentrations of lipids and apolipoprotein B among adults with diagnosed and undiagnosed diabetes, prediabetes, and normoglycemia: findings from the National Health and Nutrition Examination Survey 1988-1991 to 2005-2008. Cardiovasc Diabetol. 2013;12:26-39.
7. Santos CXC, Anilkumar N, Zhang M, Brewer AC, Shah AM. Redox signaling in cardiac myocytes. Free Radic Biol Med. 2011;50:777-93.
8. Jaganjac M, Tirosh O, Cohen G, Sasson S, Zarkovic N. Reactive aldehydes-second messengers of free radicals in diabetes mellitus. Free Radic Res. 2013;47(Suppl 1):39-48.
9. ADVANCE Collaborative Group, Patel A, MacMahon S, Chalmers J, Neal B, Billot L, et al. Intensive blood glucose control and vascular outcomes in patients with type 2 diabetes. N Engl J Med. 2008;358:2560-72.
10. Duckworth W, Abraira C, Moritz T. Intensive glucose control and complications in American veterans with type 2 diabetes. N Engl J Med. 2009;360(2):129-39.
11. Peters AL, Schriger DL. The new diagnostic criteria for diabetes: the impact on management of diabetes and macrovascular risk factors. Am J Med. 1998;105:15S-9.
12. Cuba. Ministerio de Salud Pública. Centro de Investigaciones Biomédicas. Procedimientos Normativos Operacionales. La Habana; 2000.
13. Reinahuer H, Home PD, Kanagasabapathy AS, Heuck C. OMS. Diagnóstico y monitorización de la Diabetes Mellitus desde el laboratorio. Madrid: Editorial Momento Médico Iberoamericano; 2005. p. 40-50.
14. Yagi K. Lipid peroxides and human diseases. Chem Phys Lipids. 1987;45:337-51.
15. Reznick AZ, Packer L. Oxidative damage to proteins: Spectrophotometric method for the carbonyl assay. Methods in Enzymology. 1994;233:357-63.
16. Sone H, Tanaka S, Tanaka S, Iimuro S, Oida K, Yamasaki Y, et al. Serum level of triglycerides is a potent risk factor comparable to LDL cholesterol for coronary heart disease in Japanese patients with type 2 diabetes: subanalysis of the Japan Diabetes Complications Study (JDCS). J Clin Endocrinol Metab. 2011;96(11):3448-56.
17. Davì G, Falco A, Patrono C. Lipid Peroxidation in Diabetes Mellitus. Antioxid Redox Signal. 2005;7(1-2):256-68.
18. Kannel WB. Lipids, diabetes, and coronary heart disease: insights from the Framingham Study. Am Heart J. 1985;110(5):1100-7.
19. Pop D, Dâdârlat A, Zdrenghea M, Zdrenghea DT, Sitar-Tâut AV. Evolution of cardiovascular risk factors and ischemic heart disease in an elderly urban Romanian population over the course of 1 year. Clin Interv Aging. 2013;8:1497-503.
20. Manohar SM, Vaikasuvu SR, Deepthi K, Sachan A, Narasimha SR. An association of hyperglycemia with plasma malondialdehyde and atherogenic lipid risk factors in newly diagnosed Type 2 diabetic patients. J Res Med Sci. 2013;18(2):89-93.
21. De Carvalho V, Guedes P, Gonçalves L, De Cássia R. The role of hyperglycemia in the induction of oxidative stress and inflammatory process. Nutr Hosp. 2012;27(5):1391-8.
22. Nakhjavani M, Esteghamati A, Nowroozi S, Asgarani F, Rashidi A, Khalilzadeh O. Type 2 diabetes mellitus duration: an independent predictor of serum malondialdehyde levels. Singapore Med J. 2010;51(7):582-5.
23. Nourooz-Zadeh J, Rahimi A, Tajaddini-Sarmadi J. Relationships between plasma measures of oxidative stress and metabolic control in NIDDM. Diabetologia. 1997;40:647-53.
24. Benítez S, Pérez A, Sánchez-Quesada JL. Electronegative low-density lipoprotein subfraction from type 2 diabetic subjects is proatherogenic and unrelated to glycemic control. Diabetes Metab Res Rev. 2007;23:26-34.
25. Sampson MJ, Gopaul N, Davies IR, Hughes DA, Carrier MJ. Plasma F2 Isoprostanes. Direct evidence of increased free radical damage during acute hyperglycemia in type 2 diabetes. Diabetes Care. 2002;25:537-41.
26. Gopaul NK, Anggard EE, Mallet AI, Betteridge DJ, Wolff SP, Nourooz-Zadeh J. Plasma 8-epi-PGF2a levels are elevated in individuals with non-insulin dependent diabetes mellitus. FEBS Lett. 1995;368:225-9.
27. Likidlilid A, Patchanans N, Peerapatdit T, Sriratanasathavorn C. Lipid peroxidation and antioxidant enzyme activities in erythrocytes of type 2 diabetic patients. J Med Assoc Thai. 2010;93:682-93.
28. Bhutia Y, Ghosh A, Sherpa ML, Pal R, Mohanta PK. Serum malondialdehyde level: surrogate stress marker in the Sikkimese diabetics. J Nat Sci Biol Med. 2011;2(1):107-12.
29. Soliman GZ. Blood lipid peroxidation, superoxide dismutase, malondialdehyde, glutathione levels in Egyptian type 2 diabetic patients. Singapore Med J. 2008;49:129-36.
30. Shradha B, Sisodia SS. Diabetes, dyslipidemia, antioxidant and status of oxidative stress. Internat J Res Ayurv Pharm. 2010;1(1):33-42.
31. Shao B, Heinecke JW. HDL, lipid peroxidation, and atherosclerosis. J Lipid Res. 2009;50:599-601.
32. Maahs DM, Snell-Bergeon JK. Current knowledge and future directions on cardiovascular disease in diabetes. Diabetes Tech Therap. 2012;14(Suppl 1):75-6.
33. Yang H, Jin X, Kei Lam CW, Yan SK. Oxidative stress and diabetes mellitus. Clin Chem Lab Med. 2011;49(11):1773-82.
34. Kumawat M, Pahwa MB, Gahlaut VS, Singh N. Status of antioxidant enzymes and lipid peroxidation in type 2 diabetes mellitus with microvascular complications. Open Endocrinol J. 2009;3:12-5.
Recibido: 22 de octubre de 2013.
Aprobado: 25 de marzo de 2014.