Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Endocrinología
versión On-line ISSN 1561-2953
Rev Cubana Endocrinol vol.25 no.3 Ciudad de la Habana sep.-dic. 2014
DIAGNÓSTICO
Actualización en el diagnóstico por imágenes de los tumores adrenales
Update on imaging diagnosis of adrenal tumors
Dra. Olga Cecilia Martínez Colete
Hospital clinicoquirúrgico “Hermanos Ameijeiras”. La Habana, Cuba.
RESUMEN
Cada vez es más frecuente el diagnóstico por imágenes de los tumores adrenales. La caracterización y diferenciación de los adenomas benignos y las lesiones malignas es muy importante, sobre todo, en el paciente con enfermedad maligna o funcionante. La tomografía axial computarizada, la resonancia magnética nuclear, y la tomografía con emisión de positrones acoplada a tomografía axial computarizada, permiten, con gran precisión, caracterizar y diferenciar, de forma no invasiva, las masas adrenales. En esta revisión se explican los principios fisiológicos en que se basan estas técnicas, sus ventajas y sus limitaciones. Se describen las principales características de imagen de los tumores suprarrenales más frecuentes, y se propone un algoritmo para el uso de estos medios diagnósticos.
Palabras clave: adrenal, tumor adrenal, tomografía axial computarizada, resonancia magnética nuclear, tomografía con emisión de positrones acoplada a tomografía axial computarizada.
ABSTRACT
Imaging diagnosis of adrenal tumors is increasingly frequent. Characterization and differentiation of benign adenomas and malignant injures is very important, mainly in the patient with malignant or functioning disease. Computed tomography, magnetic resonance imaging and positron emission tomography/computed tomography allowed greater precision in characterizing and differentiating the adrenal masses in a non-invasive way. This review explained the physiological principles supporting these techniques, its advantages and restrictions. The main characteristics of the most frequent adrenal tumor images were described, in addition to submitting an algorithm for the use of these diagnostic means.
Keywords: adrenal, adrenal tumor, computed tomography, magnetic resonance imaging, positron emission tomography/computed tomography.
INTRODUCCIÓN
Cada vez es más frecuente el diagnóstico de los tumores adrenales por técnicas modernas de imagen. El reto más importante para la práctica médica es lograr diferenciar las lesiones benignas de las malignas con la mayor precisión. Las actuales técnicas de imagen logran altos estándares de calidad para estos propósitos, no solo desde el punto de vista anatómico, sino que estas explotan elementos fisiológicos presentes en las masas suprarrenales, de manera que permiten una alta precisión en la determinación de su estado funcional. 1
La forma clínica de presentación de los tumores adrenales más frecuente es el incidentaloma suprarrenal, y dentro de ellos, los adenomas benignos predominan en más del 70 %.2 Es por ello que para evaluar imagenológicamente una lesión de esta glándula, se debe preferir una prueba que los detecte con alta eficacia, es decir, que tenga una razonable sensibilidad, y sobre todo, una alta especificidad para la detección del adenoma y para diferenciarlo de las lesiones malignas. Estos requisitos los cumplen las pruebas de imagen que se obtienen por tomografía axial computarizada (TAC), resonancia magnética nuclear (RMN) y la tomografía con emisión de positrones (PET/CT). 3
Estas técnicas de imagen son sensibles al contenido de lípidos de las masas adrenales, y aprovechan para su desempeño, además del contenido graso intracelular, la diferencia de perfusión entre las lesiones benignas y malignas, así como la actividad metabólica tumoral. 3,4
I. TAC
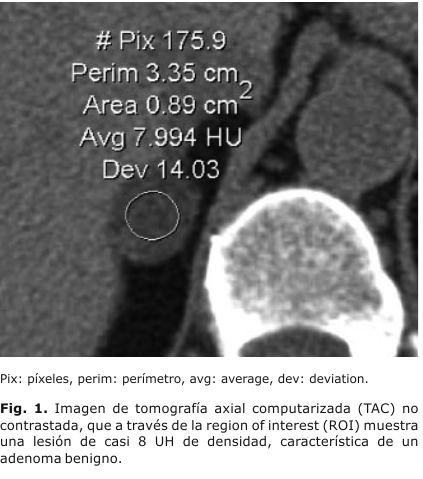
Este es el medio diagnóstico de mayor disponibilidad en todo el mundo, con más años de uso, y que ha demostrado un gran valor en el diagnóstico de los tumores. Para el estudio de las glándulas suprarrenales, debe utilizarse un equipo helicoidal o multicorte, que disponga, además, entre sus herramientas de software, las de la region of interest-región de interés (ROI), para analizar a través de ella el valor de atenuación o densidad, expresado en unidades Hounsfield (UH), en las vistas simples y contrastadas. El imagenólogo, a través de esta herramienta, traza el área del tumor que va a analizar, observa que seleccione un área mayor de 2/3 de la superficie del tumor, evita los bordes de la lesión (para que no haya superposición de órganos vecinos), y las zonas calcificadas o necrosadas que también pueden distorsionar el verdadero valor de atenuación.3,4 El programa informático calcula la densidad promedio, la desviación estándar y el número de píxeles, el perímetro y el área de la zona seleccionada (figura 1).
1. Imágenes sensibles a los lípidos: estudios no contrastados
Los adenomas benignos, en el 70 % de los casos, tienen un alto contenido lipídico, lo que les confiere la característica de atenuar la señal, es decir, que tienen un valor de atenuación, o densidad, expresado en UH, inferior al de las lesiones malignas.5 Lee, en 1991,6 utilizó este parámetro para diferenciar los adenomas benignos de las lesiones no adenomatosas, mientras que Korobkin, en 1996, demostró que la diferencia se debía a la carga lipídica diferente entre ambos tipos de lesiones.7 Existe consenso en señalar que un valor igual o inferior a 10 UH permite diagnosticar el adenoma suprarrenal con una sensibilidad de 96-100 %, y una especificidad entre 50-100 %.3,4,7 El 30 % de los adenomas suprarrenales tiene un contenido lipídico pobre (adenomas atípicos). En esto casos, esta técnica no es efectiva para detectarlos, por lo que se requieren otras de más precisión.8-10
2. Imágenes por perfusión: estudios dinámicos contrastados y determinación de los por cientos de lavado
Los adenomas benignos tienen una circulación sanguínea homogénea y uniforme, por lo que perfunden el contraste radiológico yodado de forma rápida, lo que les distingue, sobre todo, de las lesiones malignas. Basado en este principio, se realizan los estudios dinámicos contrastados, administrando el contraste radiológico yodado por vía intravenosa. Se obtiene y se determina la densidad de las lesiones en las imágenes de la vista arterial o precoz (al minuto), y en una vista tardía, que generalmente se obtiene entre 10-15 minutos después de la administración del contraste. Los adenomas, ya sean ricos o pobres en contenido de lípidos, captan el contraste rápidamente, o sea, tienen un elevado realce, y lo liberan de forma rápida también, por lo que en las vistas tardías conservan poco contraste.3 La pérdida de contraste o lavado no es más que la disminución en por ciento del realce inicial, al minuto de la administración del contraste, y del realce final, en las vistas tardías, a los 10-15 minutos. Se calcula el por ciento de lavado absoluto (%LA), y el por ciento de lavado relativo (%LR), según las fórmulas del cuadro 1.
Se ha establecido para el %LA un punto de corte de 60 % o más para los adenomas benignos, con una sensibilidad de 82-97 %, y una especificidad de 83-92 %. Para el %LR, el punto de corte se ha establecido en 40 % o más, con sensibilidad similar y una especificidad que se incrementa de 92-100 %. 3,5,10,11 Esta prueba obvia la limitación de la densidad en vista no contrastada de los adenomas atípicos (figura 2) (%LA: 79 %, %LR: 53 %).
3. Caracterización anatómica y morfológica
La TAC es un instrumento muy útil para la evaluación del tamaño, las características morfológicas y anatómicas de los tumores adrenales.
Tamaño: se ha establecido que los tumores adrenales menores de 3 cm, si son homogéneos, deben ser considerados como adenomas benignos. Los tumores mayores de 6 cm tienen un riesgo de malignidad de un 85 %, mientras que los valores intermedios representan un 70 % de riesgo. La evaluación del crecimiento del tumor en el tiempo es un parámetro que se evalúa en todos los protocolos, pues se consideran tumores con potencial elevado de malignidad aquellos que crecen 0,5 cm o más, en 6 meses. El imagenólogo reportará el diámetro mayor que encuentre con las herramientas de medición que ofrecen los paquetes informáticos incorporados a los equipos.3,9
Características morfológicas: la TAC permite visualizar, con gran nitidez, los contornos, la textura y la presencia de necrosis, hemorragias y calcificaciones dentro de la lesión. En una lesión suprarrenal, se consideran signos indirectos de malignidad la heterogeneidad, los contornos irregulares, la presencia de calcificaciones centrales y necrosis, pero con baja especificidad. Se ha visto que los adenomas grandes y los feocromocitomas pueden presentar estas características. Por otro lado, con frecuencia se ha observado que las metástasis suprarrenales son pequeñas, homogéneas y pueden interpretarse como adenomas, de ahí la baja especificidad de estos parámetros para la detección de los adenomas benignos.3,12
II. RMN
La RMN tiene la misma utilidad que la TAC en el estudio de los tumores adrenales, pero es una técnica más costosa, por lo que se utiliza como técnica de segunda línea.3,13 Solo se le ha señalado alguna superioridad en la detección de adenomas atípicos, sobre todo, aquellos que tienen una densidad superior a 30 UH. Al igual que la TAC, estas técnicas son sensibles al contenido lipídico de los tumores adrenales, pero a diferencia de analizar el valor de atenuación, se aplica el principio del contraste químico, conociendo que los protones de la grasa y del agua resuenan a frecuencias diferentes.3,14
Los basamentos físicos que sustentan la obtención y procesamiento de las imágenes en la RMN son complejos y exceden la intención de esta actualización. Cabe señalar que los resonadores que se deben utilizar deben ser de alto campo (más de 3 Tesla), para que se puedan aplicar las técnicas necesarias que permiten una mejor visualización y procesamiento de las imágenes.15-17 Las ventajas de este método incluyen una alta resolución por contraste y ausencia de radiación ionizante y contraste yodado. Como desventajas, presenta un elevado costo, poca disponibilidad y un tiempo de duración muy prolongado. Las secuencias sugeridas son: rapid acquisition with relaxation enhancement (T2 RARE) coronal y axial, T2 axial con saturación grasa, T1 gradiente “en fase” y “fuera de fase” axial y coronal; e imágenes ponderadas en T1 con saturación grasa pre y poscontraste, con gadolinio en 4 fases volumetric interpolated breath-hold examination (VIBE). La técnica del contraste químico es la que se usa actualmente en la mayoría de los centros, y consiste en que se toman 2 secuencias en T1: la primera, en la que los protones del agua y la grasa están “en fase” de resonancia según el eco aplicado; y una segunda secuencia, en la que estos protones están “fuera de fase”.18 La disminución de la intensidad de la señal en la secuencia “fuera de fase” de 20 % o más con respecto a la secuencia “en fase”, indica la presencia de un adenoma, con una sensibilidad de 84-100 % y una especificidad del 92-100 %.3,16,18 En las secuencias T2, los adenomas, por su contenido lipídico elevado, se observan isointensos, mientras que las lesiones malignas son hiperintensas, al contener más agua.
III. PET, PET/CT
Esta novedosa técnica combina el uso de radioisótopos, su rastreo, y la combinación de estudios tomográficos para la localización y fijación anatómica de las zonas captantes de radiofármacos. Nos referiremos a ella como PET, PET/CT, pues así se conoce en el lenguaje médico de manera universal.12 La PET utiliza un metabolito marcado de la glucosa, la 18fluorino-fluorodeoxiglucosa ( 18F-FDG), y se basa en la actividad metabólica de los tumores suprarrenales, pues las células malignas de los tumores tienen gran avidez por la glucosa, por lo que captan y acumulan más cantidad de este metabolito que las lesiones benignas.19 El análisis cuantitativo de la captación de 18F-FDG se realiza por programas prediseñados de medición de valores de captación estandarizados, mientras que el análisis cualitativo se realiza mediante evaluación visual, usando como referencia la captación del tejido hepático.3,19,20
La incorporación de la TAC (PET/CT) permite una aproximación anatómica y funcional de las lesiones. Así, se determinan las zonas captantes y se localizan y analizan mediante la TAC, ya sea simple o contrastada, con la determinación de los valores de atenuación y los por cientos de lavado. La sensibilidad de PET/CT se estima entre 98-100 %, y la especificidad es de 92-94 %. Las limitaciones de este estudio radican, en primer lugar, en que las lesiones malignas con grandes zonas de necrosis y hemorragia captan muy poco radiofármaco con el consecuente resultado falso negativo;3,19,20 y en segundo lugar, el estudio no es muy fiable en lesiones menores de 1 cm.3,18 Un meta-análisis reciente analizó y comparó la utilidad de esta técnica con la de TAC y RMN para el diagnóstico de las enfermedades tumorales malignas suprarrenales, y demostró una evidente superioridad en ese aspecto.21
La incorporación de otros metabolitos trazadores permite también la caracterización de tumores funcionantes, como los feocromocitomas, los aldosteronomas y los tumores productores de cortisol.19,22,23 Es una técnica muy promisoria, pero que no está incorporada como prueba rutinaria ni de primera línea por ser muy costosa, y de manera general, se reserva para cuando los estudios de TAC y RMN no son concluyentes, o cuando se buscan activamente lesiones metastásicas muy pequeñas.9
IV. PRINCIPALES CARACTERÍSTICAS IMAGENOLÓGICAS DE ALGUNOS TUMORES ADRENALES
A continuación se expone un resumen de las principales características de los tumores suprarrenales más frecuentes en los diferentes medios diagnósticos analizados (cuadro 2).
Los adenomas corticales generalmente son pequeños, redondeados y homogéneos, aunque estas características morfológicas no son exclusivas de ellos. Generalmente tienen una densidad inferior a 10 UH, %LA superiores a 60 % y %LR mayores que 40 %. En ocasiones, los adenomas atípicos necesitan definirse imagenológicamente a través de la RMN.4,9,11
El feocromocitoma tiene características imagenológicas muy variables. Ha sido denominado como “el camaleón”, debido a que se puede presentar en imágenes con la apariencia de un carcinoma adrenal, de un adenoma atípico, de una metástasis, o incluso, de un quiste, por lo que el estudio hormonal, y los estudios con MIBG en gammagramas o en PET/CT son necesarios para precisar su diagnóstico.24-26
Los carcinomas adrenales son poco frecuentes, y por lo general, son de crecimiento rápido y mal pronóstico evolutivo. Son tumores grandes, irregulares y heterogéneos. Con frecuencia presentan extensas zonas de necrosis y gruesas calcificaciones centrales, y muestran infiltración e invasión de los tejidos vecinos. Tienen unos valores elevados de densidad y bajos % de lavado. Se observan hiperintensos en las imágenes en T2 de RMN, sin pérdida significativa de la intensidad de señales con la técnica de contraste químico en las secuencias T1.4,19,27
Las metástasis adrenales de tumores malignos pueden ser difíciles de diagnosticar, aún teniendo el antecedente de que existe una enfermedad maligna previa. En no pocos casos, si se trata de una lesión única, suelen ser pequeñas, regulares y homogéneas. Por lo general, la TAC contrastada informa por cientos elevados de lavado, aunque estos parámetros no siempre son concluyentes. En estas situaciones, la RMN es muy útil. La PET/CT es una herramienta de gran valor, sobre todo, cuando se trata de lesiones muy pequeñas, las que marcarán captación de FDG.13,14,19,28
Existen tumores adrenales raros, y poco frecuentes, de los que brevemente se exponen sus características imagenológicas más sobresalientes: 3,11
- Mielolipomas: tumores de contenido graso, con una imagen en TAC simple inconfundible, pues la densidad es muy baja, como la de la grasa, inferior a 0 UH, habitualmente menor de -50 UH.
- Quistes: de tamaño variable, son redondeados, homogéneos y de baja densidad, entre 10 y -10 UH, que no se realzan en las TAC contrastadas, pues no captan contraste.
CONSIDERACIONES FINALES
Las recomendaciones de uso de los medios diagnósticos de imagen, según las asociaciones europeas y norteamericanas más importantes son: 9,29
1. Iniciar el estudio con TAC no contrastada.
2. Recomendar el valor de 10 UH o menos en TAC no contrastada para diagnosticar el adenoma suprarrenal.
3. Recomendar el uso de la TAC contrastada en lesiones con más de 10 UH.
4. EL PET/CT solo se recomienda si los estudios de TAC y RMN no son suficientes para aclarar el tipo de lesión, especialmente si se trata de una metástasis (figura 3).
REFERENCIAS BIBLIOGRÁFICAS
1. Boland G W. Adrenal imaging: why, when, what, and how? Part 1. Why and when to image? Am J Roentgenol. 2010;195:W377-W81.
2. Aron D, Terzolo M, Cawood TJ. Adrenal incidentalomas. Best Pract Res Clin Endocrinol Metab. 2012;26(1):69-82.
3. Boland GW, Blake MA, Hahn PF, Mayo-Smith WW. Incidental adrenal lesions: principles, techniques, and algorithms for imaging characterization. Radiology. 2008;249(3):757-65.
4. Boland GW. Adrenal imaging: why, when, what, and how? Part 2: What technique? Am J Roentgenol. 2011;196:W1-W5.
5. Johnson PT, Horton KM, Fishman EK. Adrenal imaging with multidetector CT: evidence-based protocol optimization and interpretative practice. Radiographics. 2009;29:1319-31.
6. Lee MJ, Hahn PF, Papanicolau l. Benign and malignant adrenal masses: CT distinction with attenuation coefficients, size, and observer analysis. Radiology. 1991;179:415-8.
7. Korobkin M, Brodeur FJ, Yutzy GG, Francis JR, Quint LE, Dunnick NR, et al. Differentiation of adrenal adenomas from nonadenomas using CT attenuation values. Am J Roentgenol. 1996;166:531-6.
8. Aron D, Terzolo M, Cawood TJ. Adrenal incidentalomas. Best Pract Res Clin Endocrinol Metab. 2012;26(1):69-82.
9. Terzolo M, Stigliano A, Chiodini I, Loli P, Furlani L, Arnaldi G, et al. AME Position Statement on adrenal incidentaloma. European Journal of Endocrinology. 2011;164:851-70.
10. Johnson PT, Horton KM, Fishman EK. Adrenal mass imaging with multidetector CT: pathologic conditions, pearls, and pitfalls. Radiographics. 2009;29(5):1333-51.
11. Taffel M, Haji-Momenian S, Nikolaidis P, Miller FH. Adrenal imaging: a comprehensive review. Radiol Clin North Am. 2012;50(2):219-43.
12. McDermott S, O'Connor OJ, Cronin CG, Blake MA. Radiological evaluation of adrenal incidentalomas: current methods and future prospects. Best Pract Res Clin Endocrinol Metab. 2012;26(1):21-33.
13. Goenka AH, Shah SN, Remer EM, Berber E. Adrenal imaging: a primer for oncosurgeons. J Surg Oncol. 2012;106(5):543-8.
14. Halefoglu AM, Altun I, Disli C, Ulusay SM, Ozel BD, Basak M. A prospective study on the utility of diffusion-weighted and quantitative chemical-shift magnetic resonance imaging in the distinction of adrenal adenomas and metastases. J Comput Assist Tomogr. 2012 Jul;36(4):367-74
15. Siegelman ES. Adrenal MRI: techniques and clinical applications J Magn Reson Imaging. 2012 Aug;36(2):272-85.
16. Song J, Zhang C, Liu Q, Yu T, Jiang X, Xia Q, et al. Utility of chemical shift and diffusion-weighted imaging in characterization of hyperattenuating adrenal lesions at 3.0 T. Eur J Radiol. 2012;81(9):2137-43.
17. Nakamura S, Namimoto T, Morita K, Utsunomiya D, Oda S, Nakaura T, et al. Characterization of adrenal lesions using chemical shift MRI: comparison between 1.5 Tesla and two echo time pair selection at 3.0 Tesla MRI. J Magn Reson Imaging. 2012;35(1):95-102.
18. O’Brien A, Oyanedel R, Huete A, Cruz F, Menías Ch. Masas suprarrenales: evaluación por tomografía computada y resonancia magnética. Revista Chilena de Radiología. 2009;15(1):31-8.
19. Xu B, Gao J, Cui L, Wang H, Guan Z, Yao S, et al. Characterization of adrenal metastatic cancer using FDG PET/CT. Neoplasma. 2012;59(1):92-9.
20. Wong KK, Arabi M, Zerizer I, Al-Nahhas A, Rubello D, Gross MD. Role of positron emission tomography/computed tomography in adrenal and neuroendocrine tumors: fluorodeoxyglucose and nonfluorodeoxyglucose tracers. Nucl Med Commun. 2011;32(9):764-81.
21. Boland GW, Dwamena BA, Jagtiani Sangwaiya M, Goehler AG, Blake MA, Hahn PF, et al. Characterization of adrenal masses by using FDG PET: a systematic review and meta-analysis of diagnostic test performance. Radiology. 2011;259(1):117-26.
22. Alencar GA, Fragoso MC, Yamaga LY, Lerario AM, Mendonca BB. (18)F-FDG-PET/CT imaging of ACTH-independent macronodular adrenocortical hyperplasia (AIMAH) demonstrating increased (18)F-FDG uptake. J Clin Endocrinol Metab. 2011;96(11):3300-1.
23. Burton TJ, Mackenzie IS, Balan K, Koo B, Bird N, Soloviev DV, et al. Evaluation of the sensitivity and specificity of (11)C-metomidate positron emission tomography (PET)-CT for lateralizing aldosterone secretion by Conn's adenomas. J Clin Endocrinol Metab. 2012;97(1):100-9.
24. Yoon JK, Remer EM, Herts BR. Incidental pheochromocytoma mimicking adrenal adenoma because of rapid contrast enhancement loss. AM J Roentgenol. 2006;187:1309-11.
25. Blake MA, Kalra MK, Maher MM, Sahani DV, Sweeny AT, Mueller PR, et al. Pheochromocytoma: an imaging chameleon. Radiographics. 2004;24:87-99.
26. Chen CC, Carrasquillo JA. Molecular imaging of adrenal neoplasms. J Surg Oncol. 2012;106(5):532-42.
27. Bharwani N, Rockall AG, Sahdev A, Gueorguiev M, Drake W, Grossman AB, et al. Adrenocortical carcinoma: the range of appearance on CT and MRI. Am J Roentgenol. 2011;196:W706-14.
28. Deandreis D, Leboulleux S, Caramella C, Schlumberger M, Baudin E. FDG PET in the management of patients with adrenal masses and adrenocortical carcinoma. Horm Cancer. 2011;2(6):354-62.
29. Zeiger MA, Thompson GB, Duh QY, Hamrahian AH, Angelos P, Elaraj D, et al. Adrenal Incidentaloma Guidelines. Endocr Pract. 2009;15(1):3-20.
Recibido: 11 de enero de 2014.
Aprobado: 7 de junio de 2014.
Olga Cecilia Martínez Colete. Hospital Clinicoquirúrgico “Hermanos Ameijeiras”. San Lázaro # 701, municipio Centro Habana. La Habana, Cuba. Correo electrónico: olga.martinez@infomed.sld.cu