Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Endocrinología
versión On-line ISSN 1561-2953
Rev Cubana Endocrinol vol.26 no.2 Ciudad de la Habana mayo.-ago. 2015
REVISIÓN BIBLIOGRÁFICA
Mecanismos inmunológicos e infertilidad femenina
Immune mechanisms and female infertility
Dr. Emigdio José León Toirac,I Dra. Elaine Bárbara Hernández Díaz,II Dra. Ileana Cubas Dueñas, I Lic. Janet Rodríguez Acosta,I Dr.C. Eduardo Cabrera-RodeI
IInstituto Nacional de Endocrinología (INEN). La Habana, Cuba.
IIHospital Ginecoobstétrico “Eusebio Hernández”. La Habana, Cuba.
RESUMEN
Introducción: la infertilidad es un problema de salud mundial en aumento. Sus factores causales relacionados con el sexo femenino son mayoritarios. Recientemente se ha planteado una fuerte asociación entre los trastornos de la fertilidad y las alteraciones funcionales del sistema inmune, que contribuyen al origen y mantenimiento de la infertilidad.
Objetivo: identificar en la literatura científica actualizada la contribución de los mecanismos inmunológicos en el desarrollo de la infertilidad femenina.
Desarrollo: los mismos componentes inmunitarios que garantizan el éxito de la reproducción, pueden generar un entorno inflamatorio perpetuado, ante un estímulo antigénico, que produce lesión tisular. La inflamación desregulada repercute en reacciones autoinmunes contra las estructuras del aparato reproductor, y afectan su funcionalidad. La presencia de autoanticuerpos y citocinas proinflamatorias, como marcadores biológicos de estos fenómenos, ha sido reportada en entidades como la endometriosis y el síndrome de ovario poliquístico.
Conclusiones: aunque se ha señalado que el sistema inmune desempeña un importante rol en el desarrollo de la reproducción femenina normal y patológica, el conocimiento obtenido en esta área sigue siendo exiguo. La subestimación de los factores inmunitarios en el escenario clínico muchas veces omite posibles alternativas diagnósticas y terapéuticas, que pudieran contribuir a incrementar la calidad del enfoque asistencial a las mujeres infértiles. La complejidad de los sistemas inmune y endocrino, y el corto alcance de las herramientas diagnósticas disponibles, son factores que contribuyen a esta insuficiencia.
Palabras clave: infertilidad femenina, infertilidad de causa inexplicable, autoinmunidad, inflamación.
ABSTRACT
Introduction: infertility is a growing worldwide health problem whose causal factors are mostly associated to the female sex. A close relationship has recently been suggested between fertility disorders and functional alterations of the immune system contributing to and maintaining infertility.
Objective: review updated scientific literature about the subject to identify the role of immune mechanisms in the development of female infertility.
Development: the very immune components ensuring the success of reproduction may create a perpetuated inflammatory environment in the presence of an antigenic stimulus, resulting in the development of a tissular lesion. Dysregulated inflammation triggers autoimmune reactions against reproductive structures, affecting their operation. The presence of autoantibodies and proinflammatory cytokines as biological markers of these phenomena has been reported for conditions such as endometriosis and polycystic ovary syndrome.
Conclusions: the immune system is known to play an important role in both normal and pathological female reproduction. However, information about the subject continues to be scant. Underestimation of the immune factors present in the clinical environment often blocks the way for diagnostic and therapeutic alternatives which could otherwise improve the quality of the care of infertile women. The complexity of the immune and endocrine systems, as well as the limited reach of the available diagnostic tools, are factors contributing to such insufficiency.
Key words: female infertility, unexplained infertility, autoimmunity, inflammation.
INTRODUCCIÓN
El reconocimiento de la infertilidad como un problema de salud mundial aumenta cada día.1-3 Aun cuando es notable el desarrollo científico tecnológico alcanzado en el campo de la biología de la reproducción, el número de parejas que buscan asesoría médica y tratamiento por infertilidad aumenta considerablemente.3,4
La percepción actual de que la infertilidad es una dificultad en aumento no carece de bases; incluso, el riesgo se acrecienta, pues cada vez es mayor el número de parejas que eligen demorar la procreación hasta tener más edad, y se convierten en estadísticamente menos fértiles. A pesar de lo antes referido, este trastorno de la reproducción puede presentarse en cualquier momento, enmarcado en el periodo de edad fértil del hombre o la mujer.5 La prevalencia mundial de infertilidad se estima entre 3,5 a 16,7 % en países desarrollados, y entre 6,9 a 9,3 % en naciones menos desarrolladas.3,6 Según estudios realizados en Cuba, la prevalencia de esta entidad clínica oscila entre 12 a 14 %.6-8
La infertilidad se define como la incapacidad de lograr el embarazo luego de un año de relaciones sexuales frecuentes, sin protección, en parejas en edad reproductiva.8 En sí misma, habitualmente no significa una amenaza para la salud física, pero puede tener un serio impacto en la salud mental personal y familiar.6 La mayoría de las parejas suponen que serán capaces de engendrar hijos cuando se lo propongan, y la frustración y/o disgusto que produce la falta de concepción durante meses o años, provoca serios problemas psicosexuales en los individuos.9,10
Las causas documentadas de infertilidad incluyen factores pélvicos o tubarios que interfieren con el transporte del óvulo, anovulación, anomalías del aparato reproductor masculino, y penetración anormal de espermatozoides en el moco cervical.1-3 De manera general, las causas relacionadas con el sexo femenino son mayoritarias.6-8
A pesar de los más recientes avances obtenidos en el diagnóstico y seguimiento de la infertilidad, entre 10 y 20 % de los casos no puede identificarse ninguna etiología.3,6 Estas incógnitas en el estudio de la infertilidad representan un reto para las Ciencias Médicas, por lo que no se considera patrimonio exclusivo de la Ginecoobstetricia, sino que requiere evaluaciones diversas por otros especialistas entrenados.5,6,9
En fecha reciente se ha planteado una fuerte asociación entre los trastornos de fertilidad y alteraciones funcionales del sistema inmune, las cuales contribuyen al origen y mantenimiento de la infertilidad.1,5,11 El interés en el conocimiento de la inmunología de la reproducción surge, en primer lugar, por la necesidad de la identificación de una causa tratable de infertilidad idiopática; y en segundo lugar, por la ventaja que representaría el desarrollo de un método anticonceptivo sumamente específico mediante la vacunación de individuos contra el embarazo.5,11
Por tales razones, el siguiente trabajo se propuso identificar en la literatura científica actualizada la contribución de los mecanismos inmunológicos en el desarrollo de la infertilidad femenina. El dominio de los elementos científicos obtenidos en esta pesquisa permitirá su aplicación práctica a los profesionales de la salud, al adquirir una perspectiva integral de esta entidad clínica, de gran repercusión en la perpetuación de la especie humana.
DESARROLLO
Se realizó una revisión bibliográfica, mediante consulta digital de las revistas especializadas, actualizadas y de libre acceso disponibles en el sitio web PubMed de la Biblioteca Médica Nacional de EUA e Institutos Nacionales de Salud (US National Library of Medicine National Institutes of Health). Para la localización de las publicaciones fueron empleadas varias asociaciones de palabras clave, que contuvieron fundamentalmente los términos inmunidad e infertilidad femenina (immunity and feminine infertility). Las citas digitales más recientes y que mostraban el trabajo de manera íntegra, fueron sometidas a un análisis que permitió obtener la información que se presenta a continuación.
Históricamente a la mujer se le asignan binomios inseparables, tales como, que mujer es igual a madre, o que mujer es igual a familia, los que conforman el eje de la subjetividad femenina. El género femenino socializado en el modelaje de la pasividad, la ternura, el afecto, la complacencia, la maternidad y la valoración del ser mujer a partir de las tareas del maternaje, supone un estilo de vida de un número de mujeres que daña su autoestima, y provoca depresión cuando el rol de mujer igual a madre no se puede lograr.10
Con frecuencia se emplean como sinónimos los términos esterilidad e infertilidad, aunque, en sentido estricto, no tienen el mismo significado, ya que infertilidad significa incapacidad para tener hijos, pero con posibilidad de embarazo, que por una u otra razón no llega a término. 8 Por lo tanto, una mujer infértil será aquella que queda embarazada, pero no llega a tener hijos, mientras que la estéril no consigue el embarazo. El concepto de infertilidad también puede asociarse al referido como pérdida del embarazo, en que la mujer es capaz de concebir, pero no logra un nacimiento vivo.1,12 Existe la infertilidad primaria, que se aplica a la mujer que nunca concibió, a pesar de la cohabitación y exposición al embarazo por un período de 1 año; y la infertilidad secundaria, referida a la mujer que concibió con anterioridad, pero no logra embarazo con posterioridad, a pesar de la cohabitación y la exposición al embarazo por un período de 1 año; si la mujer amamantó a su hijo anteriormente, se debe calcular la exposición al embarazo desde el fin del período de la amenorrea de la lactancia.8,12
Para que una gestación pueda desarrollarse exitosamente, la mujer requiere de un tracto reproductor competente a nivel estructural y funcional, lo cual se garantiza fundamentalmente por medio de un balance de señales autocrinas, paracrinas y endocrinas.13-16 En este sentido, las gónadas femeninas u ovarios, juegan un rol protagónico. Dentro de la diversidad de poblaciones celulares de este órgano, existen estirpes reconocidas por su alta capacidad de producción hormonal, que son sensibles a la regulación del eje hipotalámico-hipofisiario, y constituyen un circuito de retroalimentación que rige los ciclos reproductivos de la mujer.11,17
La confirmación de la existencia del eje neuro-inmuno-endocrino ha dotado a las células del sistema inmune de una participación en esta dinámica de regulación reproductiva. La evidencia experimental señala una comunicación tridireccional a través de mediadores solubles inmunológicos, hormonales y neuromoduladores. Al respecto se ha descrito un incremento en la producción de la respuesta inmune humoral sistémica, mediada por inmunoglobulinas de clase M (IgM) y G (IgG), como producto de la acción de los esteroides gonadales femeninos.17,18
Los niveles de estrógeno y progesterona influyen, además, en la remodelación del epitelio de la mucosa vaginal. Estas hormonas también incrementan la presencia de leucocitos polimorfonucleares neutrófilos a ese nivel, y potencian la expresión de moléculas de histocompatibilidad de tipo I (MHC-I), y de receptores de reconocimiento de patrones moleculares asociados a patógenos. De esta forma, el tenor hormonal garantiza un potente nivel de inmunidad local en esa zona no estéril del tracto genital.19,20 La complejidad de esta relación de acción y control a múltiples niveles del aparato reproductor femenino, ha sido tratada por algunos equipos de investigación, 17,19,21 pero continúan emergiendo nuevas incógnitas. Muchos mecanismos de regulación neuroinmunoendocrina, así como la influencia de otros factores exógenos, medicamentosos o disruptores endocrinos, permanecen sin ser precisados.19
Retomando el carácter funcional del aparato genital femenino, se ha descrito que la mucosa que recubre estas vías es una barrera anatómica e inmunitaria de importancia clínica en las defensas del hospedero contra la propagación de infecciones transmitidas sexualmente. Esta mucosa se constituye de tejidos reactivos desde el punto de vista inmunitario, los cuales producen respuestas locales contra antígenos extraños, de modo similar a otras superficies inmunitariamente activas, como las vías respiratorias y gastrointestinal.15,16,22
En cuanto a la composición de efectores inmunológicos de estas mucosas se ha demostrado la presencia en ellas de células plasmáticas que contienen IgA en la lámina propia de las trompas uterinas, endometrio, endocérvix y vagina. Además, se han descrito distribuciones singulares de células de Langerhans, linfocitos T CD4 (del inglés, cluster of differentiation 4) positivos y CD8 positivos, en trompas y cuello uterinos, así como a nivel de la vulva.21,22
Por otra parte, la microbiota vaginal, conformada por microorganismos comensales no patógenos, es otro de los mecanismos de inmunidad innata de gran significación en el tracto genital inferior, debido a su estrecho contacto con el medio externo. El ácido láctico y peróxido de hidrógeno producido por estos agentes inocuos, inhibe el crecimiento de organismos patógenos en esta ubicación anatómica.20,23 También se ha destacado en la literatura científica la presencia de macrófagos residentes, como principal componente del compartimento ovárico intersticial. Este hallazgo ha reforzado el enfoque del fenómeno de la ovulación como una reacción de tipo inflamatoria, en la cual se genera gran cantidad de citocinas como la interleucina 1b (IL-1b), y se produce un elevado flujo de entrada de leucocitos alrededor del ovario en esta etapa.21
No solamente se ha verificado la producción de citocinas moduladoras y antivirales por los leucocitos y células epiteliales, sino que también ha sido reportada la expresión temporal de un perfil de péptidos con función antimicrobiana y quimioatrayente, reconocidos como defensinas humanas, y la autofagia de organelos defectuosos y microorganismos intracelulares. Estos mecanismos inmunológicos, en general, contribuyen a la homeostasis estructural y funcional del aparato ginecológico.16,20,24 La disfuncionalidad de este sistema biológico sobreviene cuando se pierde este equilibrio, al que también aportan las anomalías estructurales (como ausencia o duplicación de segmentos del tracto), los factores ambientales (como infecciones y efectos por disruptores endocrinos), los trastornos hormonales, y los defectos genéticos e idiopáticos.13,14
Desde el punto de vista patológico, la disminución o ausencia de la función ovárica (hipogonadismo), debido a trastornos intrínsecos del ovario (primario), o secundaria a disrupción del eje hipotalámico-hipofisiario (secundario), es una de las principales causas de infertilidad.13 El número creciente de pacientes con insuficiencia ovárica primaria (IOP) y con síndrome de ovario poliquístico (SOP) así lo confirman.25,26 Se plantea que la etiología de ambas entidades es multifactorial, y obedece a la interacción de factores genéticos y ambientales; fundamentalmente, cuando se ha descrito mayor incidencia de IOP en mujeres portadoras de una mutación predisponente al síndrome de frágil X.13,25
Las anomalías en el tracto reproductivo superior, de manera especial en las trompas uterinas, se refieren generalmente a alteraciones estructurales. Estas se presentan con mayor frecuencia en mujeres tratadas con dietilestilbestrol, fumadoras y portadoras de entidades infecciosas.13 Las disfunciones uterinas se manifiestan como dolor, infertilidad y sangrado uterino irregular. Uno de estos trastornos es la endometriosis, reconocida como la presencia de tejido de tipo endometrial fuera de la cavidad uterina. Estudios observacionales sobre el tema,27-29 han señalado que de 30 a 50 % de mujeres con endometriosis presenta infertilidad de difícil tratamiento.25,26
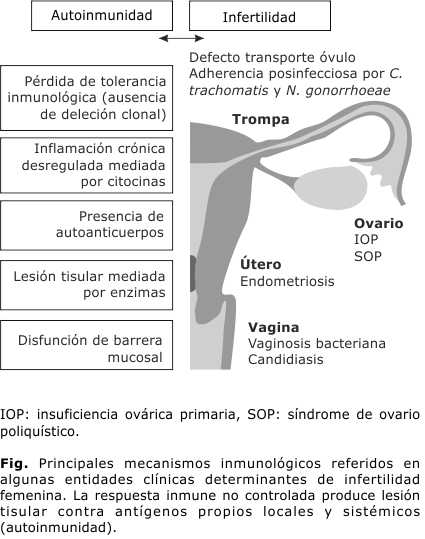
Los eventos clínicos hasta aquí descritos parecieran mantenerse al margen del alcance de los efectores del sistema inmune. En oposición al planteamiento anterior, puede decirse que la contribución de los mecanismos inmunológicos a la patogenia de los trastornos de la reproducción es amplia.30 Los mismos componentes inmunitarios que garantizan el éxito de la reproducción, pueden generar un entorno inflamatorio perpetuado, ante un estímulo antigénico, que produce lesión tisular. Por solo citar un ejemplo, la implantación fetal normal, considerada por muchos como un alotrasplante, exige una reprogramación del sistema inmune materno para generar tolerancia temporal, y evitar el rechazo del feto, que contiene antígenos de origen paterno. La pérdida de esta tolerancia inmunológica provoca entonces reacciones autoinmunes caracterizadas por inflamación desregulada, que involucra a los efectores de la inmunidad innata y adquirida, presentes en el tracto genital femenino31 (Fig.).
Datos obtenidos de trabajos de experimentación animal,18,30-33 refieren que la pérdida de tolerancia inmunológica en el aparato reproductor de la mujer, está determinada por la influencia de los estrógenos. Estas hormonas influyen directamente sobre el principal proceso de eliminación fisiológica de los linfocitos autorreactivos que emergen en los órganos linfoides primarios y secundarios, la deleción clonal. También se ha sugerido la participación de los linfocitos T cooperadores secretores de IL-17, como base de la inflamación descontrolada en algunas endocrinopatías. Sin embargo, su actuación en los trastornos reproductivos no ha sido esclarecida del todo.
La destrucción tisular resultante de la inflamación crónica es mediada por proteasas y elastasas, cuyos antagonistas, la SLP1 (del inglés secretory leukocyte proteinase inhibitor) y la elafina (ESI, del inglés elastase-specific inhibitor), dejan de ejercer su función reguladora. Estos antagonistas, a su vez, son potentes péptidos antimicrobianos naturales. El desbalance proteico de este ambiente inflamatorio perpetuado genera predisposición a infecciones.22,23,34 En los últimos años se ha dado mayor importancia a las infecciones como causa de infertilidad, quizás porque las infecciones de transmisión sexual se hayan incrementado a nivel mundial de forma alarmante. Las infecciones producidas por Chlamydia trachomatis y Neisseria gonorrhoeae, son causa frecuente de infertilidad de origen tubario.16,21
Las perturbaciones en la microbiota vaginal también contribuyen a la persistencia de infecciones patogénicas, como la vaginosis bacteriana y la candidiasis. Este factor, de conjunto con la pérdida de la integridad de la barrera mucosal, facilita la penetración de patógenos y coadyuva en el desarrollo de inflamación local.20 Un acercamiento al contexto clínico muestra que el síndrome de fallo autoinmune reproductivo fue planteado originalmente en mujeres con endometriosis, infertilidad y autoanticuerpos aumentados. Posteriormente, fue observado en otros tipos de trastornos de la reproducción como IOP y SOP, así como en la infertilidad de causa inexplicable, y probablemente esté implicado en la fisiopatología de la preeclampsia y abortos espontáneos.31-34
Dentro de las entidades clínicas causantes de hipogonadismo hipergonadotrópico figura la IOP, en la cual tiene lugar una fuerte reacción autoinmune contra el tejido ovárico. Esta respuesta se hace manifiesta en los estadios finales de la enfermedad, de manera que, al establecer el diagnóstico serológico de autoanticuerpos antiováricos (AOA, del inglés anti-ovarian antibodies), la reserva folicular ovárica ya está agotada. A pesar de la alta prevalencia de estos anticuerpos, se han observado otros marcadores de autorreactividad a nivel de otros órganos.32,34
La anovulación normogonadotrópica representa el 50 % de mujeres con infertilidad de causa endocrina, e incluye fundamentalmente pacientes con SOP. En esta entidad también se ha reportado elevada prevalencia de AOA y de otros autoanticuerpos no específicos de órgano, que marcan otras enfermedades autoinmunes, fundamentalmente tiroideas.5,25,31 También se ha descrito la presencia de un ambiente de inflamación crónica de bajo grado como vínculo existente entre esta entidad, y el síndrome metabólico y la obesidad. Esta inflamación está integrada por moléculas marcadoras de inflamación como proteína C reactiva, citocinas proinflamatorias (IL-1, IL-6, IL-18, TNF, del inglés tumor necrosis factor).26,31
El decremento en la fertilidad puede atribuirse a factores tubáricos ocasionados por defectos en la transportación del óvulo y/o adherencia anexial. Dentro de las entidades que ocasionan estas anomalías en las trompas, pueden citarse las infecciones, las cirugías pélvicas y la endometriosis. En todos estos casos, el grado de afectación tubaria dependerá del grado de lesión tisular alcanzado, una vez que se active la respuesta inflamatoria autoinmune. Se ha observado recientemente que en el caso de las infecciones, ocurre una superproducción de proteínas de choque térmico. Estas proteínas poseen homología estructural con secuencias aminoacídicas microbianas, lo cual genera una reactividad cruzada y las convierte en blanco de la respuesta autorreactiva tras la eliminación del patógeno.13,32
En el caso de la endometriosis se ha planteado que los efectores del sistema inmune participan en el desarrollo de su patogenia. Incluso, ha llegado a reconocerse la endometriosis como una enfermedad autoinmune, debido a la manifiesta activación policlonal de linfocitos B y a los elevados títulos de autoanticuerpos presentes en el 40 a 60 % de los casos. En investigaciones5,11,29 que han testado estas inmunoglobulinas contra paneles de antígenos, se ha observado una diversa representación de AOA, antinucleares (ANA, del inglés anti-nuclear antibodies), antimúsculo liso (ASMA, del inglés anti-smooth muscle antibodies) y antifosfolípidos (APA, del inglés anti-phospholipid antibodies).
Por otro lado, el término infertilidad de causa inexplicable, aplicado a mujeres cuyas investigaciones estándares ováricas y tubarias son normales pero no logran el embarazo, se ha revitalizado en fecha reciente al esbozarse un posible origen inmunológico en esta. La desregulación de las respuestas inmunitarias observadas y la presencia de autoanticuerpos, pudieran ser candidatos putativos para la etiología de esta variante clínica. Este descontrol molecular se atribuye al fallo de la diferenciación de linfocitos T en células T reguladoras en el contexto uterino, lo cual es crucial para el desarrollo exitoso de la gestación, por medio del mantenimiento de un ambiente tolerogénico frente a la diversidad de antígenos que se generan en esta etapa. En estos casos no solo se han encontrado los autoanticuerpos antes mencionados, sino que también aparecen anticuerpos antiesperma, y lo que resulta más llamativo, antitiroideos.30,31
Con respecto a la importancia diagnóstica y la diversidad de autoanticuerpos que se generan en estas entidades, muchos autores se pronuncian a favor de la contribución de estas moléculas como expresión de la orquestación general de una respuesta inflamatoria autoinmune, restando importancia a la especificidad de estas inmunoglobulinas.5,25,30-32
Se ha constatado que algunos de los AOA actúan contra la subunidad β de la hormona folículo estimulante, e interfieren en el reconocimiento y la unión de la hormona a su receptor, generando disfunciones ovulatorias. Se presume que los ANA pueden interferir en las primeras fases de la implantación del embrión, y que los ASMA podrían alterar las funciones de las trompas uterinas; así como, los APA podrían estar involucrados en determinar alteraciones vasculares uterinas que afectan la implantación. Aun con estas evidencias, no existe uniformidad de consenso sobre el impacto de estos autoanticuerpos en la patogénesis de la infertilidad.31
Según se verificó en esta revisión de artículos científicos, estos resultados provienen, en su gran mayoría, de modelos animales. Escasos sondeos se han realizado en humanos, en los cuales se determina fundamentalmente el componente humoral y sistémico de la respuesta, quedando solapado lo correspondiente al componente celular y local autorreactivo, por las dificultades técnicas y materiales que conlleva implementar este tipo de estudio.
La caracterización molecular y de la histopatología clínica de la ooforitis autoinmune se ha esbozado, a pesar de la complejidad de este tratamiento. En esta reacción se ha observado un denso infiltrado de linfocitos T activados que expresan en su superficie moléculas de histocompatibilidad (del inglés major histocompatibility complex) de clase II (MHC-II), del tipo HLA-DR (del inglés human leukocyte antigen) y marcadores de diferenciación CD-40. Este infiltrado celular se ubica en zonas del ovario donde la teca está en contacto íntimo con el epitelio folicular.11,30 Características similares se han reportado en enfermedades endocrinas de origen autoinmune a nivel de hipófisis y tiroides.25,31
Otro hallazgo que refuerza el carácter autoinmune de esta entidad nosológica se manifiesta en la presencia del antígeno específico de ovocito MATER (del inglés, maternal antigen that embryos require), originalmente identificado en ratones.30 Esta proteína también es un posible autoantígeno característico del síndrome poliglandular autoinmune tipo 1, pero solo cuando se presenta con autoinmunidad paratiroidea.31
Si bien desde el punto de vista molecular la relevancia del sistema inmune para la infertilidad está siendo reconocida de manera creciente por muchos investigadores, con frecuencia no se considera adecuadamente en el ámbito clínico, resultando, por tanto, subestimada.31,34 En una experiencia regional de caracterización clínico-epidemiológica realizada en Cuba, se observó un predominio discreto del grupo de mujeres comprendidas entre los 25 a 29 años de edad, y que la edad promedio en todo el grupo era de 30,6 ± 5,4 años; hubo predominio, además, de la infertilidad secundaria (64,4 %) y del componente femenino implicado en la infertilidad al estudiar la pareja.1,2,6 La infección vaginal y las causas uterinas entre las féminas constituyeron mayoría, aunque en el 6,8 % de los casos la causa fue inexplicable. El estudio de exudados vaginales y endocervicales, desde el punto de vista de microbiológico, ha arrojado positividad a Chlamydia trachomatis, Ureaplasma urealyticum, Mycoplasma hominis, vaginosis bacteriana, Candida spp. y a asociaciones de estos microorganismos.7,35 Estas investigaciones cubanas no han podido llegar a conclusiones definitivas sobre el impacto de estos elementos sobre la fertilidad. En ninguno de los casos revisados se mostraron resultados de variables inmunológicas, lo que induce a pensar que no fueron tomadas en cuenta para la valoración clínica especializada de estas pacientes. Se considera que este es uno de los factores que producen interferencia en los estudios y caracterización realizados al respecto. Entre otros pueden mencionarse la dificultad para aislar los patógenos responsables de infección, la presencia de procesos inflamatorios subclínicos, y el uso frecuente de terapéutica de manera inadecuada sin haber completado el perfil diagnóstico.
Es evidente que la inflamación residual y las infecciones pueden tener consecuencias devastadoras para la fertilidad de la mujer. Muchas alternativas terapéuticas se han esbozado con mediano éxito para la erradicación del patógeno y del ambiente inflamatorio que se genera de manera secundaria. La variabilidad obtenida en la respuesta inmune, tras estos ensayos terapéuticos, solo puede explicarse por las variaciones genéticas individuales, que complejizan la búsqueda de soluciones terapéuticas grupales, como candidatos vacunales, cuya eficacia sigue siendo controversial.24,34,36
Otro reto anatómico que enfrenta el diseño de terapias inmunológicas contra gérmenes patógenos, es el escaso tejido linfoide asociado a mucosa del tracto genital femenino, si se compara con otras mucosas, como la respiratoria y gastrointestinal; además, la producción de inmunoglobulina secretora es a expensas de IgG, y no de IgA como en las mucosas antes mencionadas.35 No obstante, algunos autores11,13,35 plantean una robusta respuesta de anticuerpos cuando se vacuna durante la fase folicular del ciclo menstrual, y un buen nivel de protección empleando la terapia pasiva con anticuerpos administrados por vía sistémica, pero que se difunden exitosamente en el aparato ginecológico.
En cuanto al acápite de la inflamación, la inducción de tolerancia a autoantígenos administrando péptidos foliculares por vía oral, ha logrado una supresión exitosa de enfermedades ováricas autoinmunes. La timectomía neonatal, así como la expresión transgénica de antígenos MATER en el timo y en órganos linfoides secundarios, constituyen otras alternativas terapéuticas en ensayo. Hasta el presente, estos procederes solo han sido verificados en modelos animales.31
La terapia convencional dirigida a humanos, contempla la inseminación intrauterina (para pasar por alto los anticuerpos presentes en el moco cervical), el empleo de corticosteroide, la fertilización in vitro y la transferencia intrafalopiana de gametos, las cuales se han calificado como exitosas. En estos tratamientos pueden presentarse complicaciones poco frecuentes, pero graves e impredecibles. Además de su bajo grado de especificidad, ninguna ha demostrado ser eficaz en estudios aleatorios y bien controlados.37
De manera general, al revisar la literatura científica especializada, se observa que los hallazgos referentes al tema son controversiales y no concluyentes. Fomentar la incorporación del conocimiento de la contribución de los mecanismos inmunológicos a los trastornos del aparato reproductor femenino, especialmente los que rigen la fertilidad, permitirá el diseño de estrategias de intervención que permitan un mejor tratamiento asistencial de estas mujeres.
CONCLUSIONES
El cúmulo de evidencias expuesto en la literatura científica apunta a que el sistema inmune desempeña un importante rol en el desarrollo de la reproducción femenina, tanto normal como patológica. No obstante, el conocimiento obtenido en esta área sigue siendo exiguo. La complejidad de los sistemas inmune y endocrino, y el corto alcance de las herramientas diagnósticas disponibles, son factores que contribuyen a esta insuficiencia.
La subestimación de los factores inmunitarios en el escenario clínico muchas veces omite posibles alternativas diagnósticas y terapéuticas, que pudieran contribuir a incrementar la calidad del enfoque asistencial a las mujeres infértiles.
La convocatoria a especialistas en Ginecoobstetricia, Endocrinología e Inmunología para revisar lo referente a los mecanismos inmunológicos de la reproducción y su participación en la infertilidad, es de extrema urgencia. La necesidad de una mirada multidisciplinaria a los trastornos de la reproducción ha sido un reclamo de los últimos años, y hoy, continúa siéndolo.
REFERENCIAS BIBLIOGRÁFICAS
1. Torres Y, Verdecia EE, Cedeño Y, Pérez Y, Santana M. Comportamiento clínico epidemiológico de las enfermedades tiroideas en mujeres con trastornos de la fertilidad. Correo Científico Médico de Holguín. 2011;15(4):4.
2. Urgellés SA, Reyes E, Figueroa M, Palazón A. Infertilidad en pacientes mayores de 35 años. Rev Cubana Obstet Ginecol. 2012 Dic;38(4):530-7.
3. Boivin J, Bunting L, Collins JA, Nygren KG. International estimates of infertility prevalence and treatment-seeking: potential need and demand for infertility medical care. Oxford J Medicine Human Reproduction. 2007;22(6):1506.
4. Díaz Z, García D. La perspectiva de género y la relación médico-paciente para el problema de la infertilidad. Rev Cubana Salud Pública [serie en Internet]. 2011 Mar [citado 8 de agosto de 2014];37(1). Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0864-34662011000100009&lng=es&nrm=iso&tlng=es
5. Carp HJ, Selmi C, Shoenfeld Y. The autoimmune bases of infertility and pregnancy loss. J Autoimmun. 2012;38:J266-J274.
6. Fernández H, Valle T, Fernández I, Ramírez N. Caracterización de la infertilidad en el municipio Pinar del Río. Rev Ciencias Médicas. 2013 sep-oct;17(5):64-73.
7. Hernández A, Padrón RS, Seuc A. Caracterización de la mujer infértil: resultados de un estudio estandarizado. Rev Cubana Endocrinol. 1999;10(1):16-24.
8. Oliva JA. Problemas de la Reproducción: Infertilidad. En: Temas de Obstetricia y Ginecología. La Habana: Editorial Ciencias Médicas; 2007. p. 1-32.
9. Jurado RA, Moreno-Rosset C, Río CJ, Espada AA. Principales trastornos psicológicos asociados a la infertilidad. Papeles del Psicólogo. 2008;29(2):167-75.
10. González I. La infertilidad, el maternaje frustrado. Rev Cubana Med Gen Integr. 2002;18:47-52.
11. Mande PV, Thomas S, Khan S, Jadhav S, Khole VV. Immunization with ovarian autoantigens leads to reduced fertility in mice following follicular dysfunction. Reproduction. 2012;143:309-23.
12. Veranes M. Evaluación de la pareja infértil. En: Ginecología y Obstetricia. Cap. 35. La Habana: Editorial Ciencias Médicas; 2004. p. 357-73.
13. Roy A, Matzuk MM. Reproductive tract function and dysfunction in women. Nature Reviews Endocrinology. 2011 September;7:517-25.
14. Yamamoto HS, Xu Q, Fichorova RN. Homeostatic properties of Lactobacillus jensenii engineered as a live vaginal anti-HIV microbicide. BMC Microbiol. 2013 Jan 8;13:4.
15. Anderson DJ, Marathe J, Pudney J. The structure of the human vaginal stratum corneum and its role in immune defense. Am J Reprod Immunol. 2014;71:618-23.
16. Nguyen PV, Kafka JK, Ferreira VH, Roth K, Kaushic C. Innate and adaptive immune responses in male and female reproductive tracts in homeostasis and following HIV infection. Cell Mol Immunol. 2014 Sep;11(5):410-27.
17. Libert C, Dejager L, Pinheiro I. The X chromosome in immune functions: when a chromosome makes the difference. Nature Reviews Immunology. 2010;10:594-604.
18. Sakiani S, Olsen NJ, Kovacs WJ. Gonadal steroids and humoral immunity. Nat Rev Endocrinol. 2013;9:56-62.
19. Dunbar B, Patel M, Fahey J, Wira C. Endocrine control of mucosal immunity in the female reproductive tract: impact of environmental disruptors. Mol Cell Endocrinol. 2012 May 6;354(1-2):85-93.
20. Gregorczyk KP, Krzyżowska M. Innate immunity to infection in the lower female genital tract. Postepy Hig Med Dosw. 2013 May 10;67:388-401.
21. Wira CR, Fahey JV, Rodriguez-Garcia M, Shen Z, Patel MV. Regulation of mucosal immunity in the female reproductive tract: the role of sex hormones in immune protection against sexually transmitted pathogens. Am J Reprod Immunol. 2014;72(2):236-58.
22. Wira CR, Fahey JV, Sentman CL, Pioli PA, Shen L. Innate and adaptive immunity in female genital tract: Cellular responses and interactions. Immunol Rev. 2005;206:306-35.
23. Amjadi F, Salehi E, Mehdizadeh M, Aflatoonian R. Role of the innate immunity in female reproductive tract. Adv Biomed Res. 2014;3:1.
24. Jayaram A, Orfanelli T, Doulaveris G, Linhares IM, Ledger WJ, Witkin SS. Autophagy and female genital tract infections: new insights and research directions. BJOG. 2014 Jun;121(7):801-8.
25. Unuane D, Tournaye H, Velkeniers B, Poppe K. Endocrine disorders & female infertility. Best Pract Res Clin Endocrinol Metab. 2011;25:861-73.
26. Ojeda-Ojeda M, Murri M, Insenser M, Escobar-Morrealee HF. Mediators of low-grade chronic inflammation in polycystic ovary syndrome (PCOS). Curr Pharm Des. 2013;19:5775-91.
27. Johnson NP, Hummelshoj L. World Endometriosis Society Montpellier Consortium. Consensus on current management of endometriosis. Hum Reprod. 2013;28:1552-68.
28. Capobianco A, Rovere-Querini P. Endometriosis, a disease of the macrophage. Front Immunol. 2013;4:1-13.
29. Vercellini P, Viganò P, Somigliana E, Fedele L. Endometriosis: pathogenesis and treatment. Nat Rev Endocrinol. 2014;10:261-75.
30. Pires E. Multiplicity of molecular and cellular targets in human ovarian autoimmunity: an update. J Assist Reprod Genet. 2010;27:519-24.
31. Sen A, Kushnir VA, Barad DH, Gleicher N. Endocrine autoimmune diseases and female infertility. Nat Rev Endocrinol. 2014 January;10:37-50.
32. Haller-Kikkatalo K, Salumets A, Uibo R. Review on Autoimmune Reactions in Female Infertility: Antibodies to Follicle Stimulating Hormone. Clin Dev Immunol. 2012;2012:762541.
33. Bedoya SK, Lam B, Lau K, Larkin J 3rd. Th17 cells in immunity and autoimmunity. Clin Dev Immunol. 2013;2013:986789.
34. Horne AW, Stock SJ, King AE. Innate immunity and disorders of the female reproductive tract. Reproduction. 2008;135:739-49.
35. Ortiz C, Hechavarría C, Ley M, Álvarez G, Hernández Y. Estudio de Chlamydia trachomatis, Ureaplasma urealyticum y Mycoplasma hominis en pacientes infértiles y abortadoras habituales. Rev Cubana Obstet Ginecol [serie en Internet]. 2010 Dic [citado 13 de agosto de 2014];36(4). Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0138-600X2010000400011&lng=es&nrm=iso&tlng=es
36. Naz RK. Female genital tract immunity: distinct immunological challenges for vaccine development. J Reprod Immunol. 2012 Jan;93(1):1-8.
37. Monach J. Developments in infertility counselling and its accreditation. Hum Fertil (Camb). 2013 Mar;16(1):68-72.
Recibido: 11 de noviembre de 2014.
Aprobado: 16 de febrero de 2015.
Emigdio José León Toirac. Instituto Nacional de Endocrinología (INEN). Calle Zapata y D, Vedado, municipio Plaza de la Revolución. La Habana, Cuba. Correo electrónico: emigdio.leon@infomed.sld.cu