Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Endocrinología
versión On-line ISSN 1561-2953
Rev Cubana Endocrinol vol.26 no.3 Ciudad de la Habana dic. 2015
Rev Cubana Endocrinol. 2015;26(3)
ARTÍCULO ORIGINAL
Adiposidad, resistencia a la insulina, tensión arterial y geometría ventricular en niños y adolescentes
Adiposity, insulin resistance, blood pressure and ventricular geometry of children and adolescents
MSc. Silvia María Marín Juliá,I Dra. Johana Soledad Argoti Naranjo,II Dr.C. Julio Oscar Cabrera RegoIII
IInstituto Nacional de Endocrinología (INEN). La Habana, Cuba.
IIHospital “Oskar Jandl”. Galápagos. San Cristóbal, Ecuador.
IIIHospital Universitario “Comandante Manuel Fajardo”. La Habana, Cuba.
RESUMEN
Introducción: la elevada prevalencia de la obesidad en la niñez se asocia con el desarrollo prematuro de factores de riesgo cardiovasculares, como la dislipidemia, la hipertensión arterial y la resistencia a la insulina.
Objetivo: identificar si existe asociación entre variables antropométricas de adiposidad y las bioquímicas, con los valores de la tensión arterial y la masa del ventrículo izquierdo en niños y adolescentes.
Métodos: se realizó un estudio de corte transversal, observacional, que incluyó 96 pacientes, con edades entre 9 y 16 años, atendidos en la consulta de Endocrinología Pediátrica del Instituto Nacional de Endocrinología, desde noviembre de 2012 hasta abril de 2013 (mediante un método no probabilístico por conveniencia). Se incluyeron variables demográficas, clínicas, antropométricas, bioquímicas y ecocardiográficas.
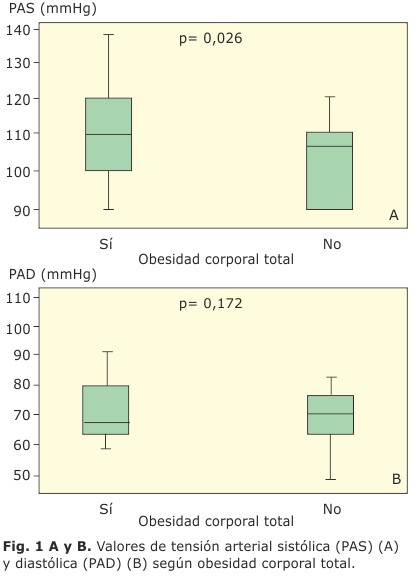
Resultados: las cifras de tensión arterial sistólica fueron significativamente mayores en aquellos con obesidad corporal total (110 ± 11 vs. 105 ± 11 mmHg, p= 0,026) y obesidad abdominal (111 ± 11 vs. 105 ± 12 mmHg, p= 0,013), en comparación con los que tenían índice de masa corporal por debajo del 97 percentil. La obesidad corporal total se relacionó con mayores cifras de triglicéridos y ácido úrico, la obesidad abdominal con antecedentes familiares de hipertensión arterial, y en ambas se constató una relación significativa con los antecedentes familiares de diabetes y los valores de modelo homeostático de Mathews-Resistencia a la insulina. La masa del ventrículo izquierdo fue significativamente mayor en aquellos con obesidad corporal total (118 ± 39 vs. 96 ± 35 g/m2, p= 0,008) y obesidad abdominal (123 ± 39 vs. 97 ± 34 g/m2, p= 0,001). El modelo homeostático de Mathews-Resistencia a la insulina mostró una correlación positiva y significativa con la masa del ventrículo izquierdo (r= 0,496, p< 0,001).
Conclusiones: la búsqueda activa mediante examen ecocardiográfico permite identificar cambios estructurales en el corazón y el lecho vascular de niños y adolescentes con obesidad y resistencia a la insulina.
Palabras clave: niños y adolescentes, obesidad corporal total, obesidad abdominal, dislipidemia, hipertensión arterial, resistencia a la insulina, masa del ventrículo izquierdo.
ABSTRACT
Introduction: high prevalence of obesity in childhood is associated to premature development of cardiovascular risk factors such as dyslipidemia, blood hypertension and insulin resistance.
Objective: to identify whether there is association between anthropometric variables of adiposity and biochemical variables with the blood pressure and the left ventricle mass values in children and adolescents.
Methods: a cross-sectional observational study conducted in 96 patients who were 9 to 16 years of age and had been seen at pediatric endocrinology service of the National Institute of Endocrinology from November 2012 to April 2013; a non-probabilistic method at convenience was used. Demographic, clinical, anthropometric, biochemical and echocardiographic variables were included.
Results: systolic blood pressure values were significantly higher in those with total body obesity (110 ± 11 vs. 105 ± 11 mmHg, p= 0.026) and those with abdominal obesity (111 ± 11 vs. 105±12 mmHg, p= 0.013) than in those who had body mass index under 97 percentile. Total body obesity was related to high triglyceride and uric acid values, the abdominal obesity to family history of blood hypertension, and both types of obesity were significantly associated with the family history of diabetes and the Mathews homeostatic model- insulin resistance values. The left ventricle mass was remarkably greater in those with total body obesity (118 ± 39 vs. 96 ± 35 g/m2, p= 0.008) and with abdominal obesity (123 ± 39 vs. 97 ± 34 g/m2, p= 0.001). Mathews homeostatic model-insulin resistance showed significant positive correlation with the left ventricle mass (r= 0.496; p< 0.001).
Conclusions: active search through an echocardiographic test allows identifying structural changes in the heart and in the vascular floor of children and adolescents with obesity and insulin resistance.
Keywords: children and adolescents, total body obesity, abdominal obesity, dyslipidemia, blood hypertension, insulin resistance, left ventricle mass.
INTRODUCCIÓN
La obesidad es causa importante de morbilidad y mortalidad en adultos, y su incremento es dramático en la población infantil a nivel mundial.1 La elevada prevalencia de obesidad en la niñez se asocia con el desarrollo prematuro de factores de riesgo cardiovascular (FRCV), como la dislipidemia (DLP), la hipertensión arterial (HTA) y la resistencia a la insulina (RI).2
La HTA, en las primeras etapas de la vida, puede asociarse tempranamente a la hipertrofia ventricular izquierda (HVI), y a largo plazo aumentar las posibilidades de ocurrir eventos cardiovasculares (CV) graves.3,4
La circunferencia de la cintura (CCin) se establece como un método seguro para determinar adiposidad central en niños y adolescentes e importante predictor del riesgo de enfermedad coronaria.5-7
La HVI es la evidencia clínica más prominente de la afectación que causa la HTA en el sistema CV de niños y adolescentes. Con la ecocardiografía y la posibilidad de medir la masa del ventrículo izquierdo (VI), se ha podido demostrar la presencia de HVI en niños y adolescentes con elevación persistente de la TA, y en aquellos con ligera elevación de la TA no tratados.8-11
En Cuba, la búsqueda de asociación de la geometría ventricular con diversos parámetros antropométricos es escasa. La investigación que propone el presente estudio, buscando la posible asociación entre parámetros antropométricos de adiposidad, algunas variables bioquímicas asociadas, las cifras de TA y masa del VI, puede facilitar la elaboración de estrategias de salud cada vez más eficaces, encaminadas al diagnóstico y control precoz de factores de riesgo, y al propio tiempo disminuir las complicaciones aterogénicas, CV y metabólicas derivadas de su expresión.
MÉTODOS
Se realizó un estudio de corte transversal, observacional, con niños y adolescentes que asistieron a la consulta de Endocrinología del Departamento de Endocrinología Pediátrica del INEN, desde noviembre de 2012 hasta abril de 2013, con edades entre 9 y 16 años, con el objetivo de identificar si existe asociación entre variables antropométricas de adiposidad y algunas variables bioquímicas, con los valores de la TA y la masa del VI. Se excluyeron aquellos con antecedentes personales (APP) de diabetes mellitus (DM), insuficiencia renal crónica u obesidad secundaria. Se seleccionaron 96 niños, a través de un método no probabilístico por conveniencia. Se requirió previamente la adecuada información del estudio y la autorización de los padres.
Se incluyeron variables demográficas (edad y sexo); clínicas (antecedentes patológicos familiares [APF] de HTA, DM y cardiopatía isquémica [CI]; tensión arterial sistólica [TAS] y tensión arterial diastólica [TAD]); antropométricas (índice de masa corporal [IMC] y CCin); bioquímicas (glucemia e insulinemia de ayunas, colesterol total [CT], triglicéridos [TG], ácido úrico [AU]; del modelo homeostático de Mathews (HOMA-IR); y ecocardiográficas (masa del VI), las cuales se vaciaron en un modelo de recolección de datos.
Los APF se recogieron durante el primer contacto con los padres de los niños y adolescentes incluidos en el estudio. La TAS y TAD se determinaron con un esfigmomanómetro aneroide, después de 5 min de descanso con el sujeto sentado, se colocó el brazalete en el brazo derecho a la altura del corazón, con la parte inflable sobre la arteria braquial; dos tomas de TA a cada paciente, 10 min entre tomas, y se promediaron ambos valores. Para clasificar la TA se utilizaron las tablas de percentiles de TAS y TAD en mmHg, según edad, sexo y talla para niños y adolescentes, establecidas como patrón de referencia por el Fourth Report on the Diagnosis, Evaluation and Treatment of High Blood Pressure in Children and Adolescents (EE.UU.), que son las que aparecen en la Guía Cubana para la Prevención, Diagnóstico y Tratamiento de la Hipertensión Arterial del 2008.12
El IMC se calculó según fórmula de Quetelel, considerando obesidad corporal total (OCT) por encima del 97 percentil.13 La CCin, a partir del perímetro marcado a nivel del punto medio entre el último arco costal y la cresta ilíaca anterosuperior, definió la obesidad abdominal (OAb) por encima del 97 percentil, para edad y sexo, según tablas cubanas.14
En todos los participantes la extracción (10 mL) se realizó por punción en la vena cubital, y se depositó la sangre en un tubo con ácido etilendiaminotetraacético (EDTA), otro con heparina y otro con gel seco para suero. La glucemia fue procesada en un equipo Eppendorf mediante método enzimático colorimétrico; y el colesterol, triglicéridos y AU en un equipo Hitachi 7170 A.
La insulina se determinó por método de radio inmunoensayo.15 El índice de RI empleado fue el HOMA-IR, calculado a partir de los valores iniciales de glucosa e insulina sanguíneos, siguiendo el modelo homeostático HOMA.16 Se consideró RI a partir de valores de HOMA-IR (HOMA-IR ≥ 75 percentil17 iguales o superiores para diferentes grupos de edad: 1,67 para niños entre 5,1 y 10 años, 2,53 para niños entre 10,1 y 15 años, y 2,52 para niños entre 15,1 y 19 años).18
La ecocardiografía se realizó en un equipo provisto de imagen armónica, por un observador con nivel III de experiencia de la Sociedad Americana de Ecocardiografía, que no conocía los datos del paciente. La masa del VI se calculó a partir de medir las áreas epicárdica y endocárdica del VI en la vista eje corto para-esternal a nivel medio ventricular, la medida del área del VI por el método del elipsoide truncado,19 y el equipo informó automáticamente la masa del VI en gramos.
Las variables cualitativas se expresaron en números absolutos y porcentaje; y las cuantitativas, en media y desviación estándar. Para establecer diferencias entre las variables cualitativas, se aplicó la prueba de chi cuadrado, y para las variables cuantitativas el test ANOVA. Se incluyó además el cálculo del Odds Ratio con un intervalo de confianza del 95 %. El coeficiente de correlación de Pearson determinó la correlación entre el HOMA-IR y la masa del VI. Se asumió asociación significativa entre las variables si p< 0,05. Los datos del estudio fueron vaciados en hojas de cálculo de Microsoft Excel 2007. Para el análisis estadístico se aplicó el programa SPSS versión 16.0.
RESULTADOS
Se incluyeron 96 niños y adolescentes, edad media 11,7 ± 2,8 años; 58 (60,4 %) eran del sexo masculino, 66 (68,8 %) tenían OCT y 54 (56,3 %) OAb, sin diferencias según el sexo. La TAS fue significativamente mayor en aquellos con OCT (110 ± 11 vs. 105 ± 11 mmHg, p= 0,026) y OAb (111 ± 11 vs. 105 ± 12 mmHg, p= 0,013) (Fig. 1A y 2A). La TAD no mostró diferencias significativas para la OCT (110 ± 11 vs. 105 ± 11 mmHg, p= 0,026), ni para la OAb (72 ± 8 vs. 70 ± 8 mmHg, p= 0,153) (Fig. 1B y 2B).
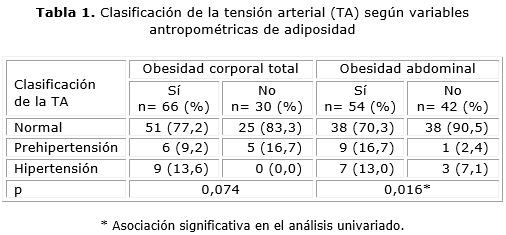
Según valor de TA (normotensos, prehipertensos e hipertensos), se encontró 11,5 % de pacientes con prehipertensión y 9,4 % hipertensos para la edad, sexo y talla; un por ciento mayor, no significativo, de hipertensos en la OCT (13,6 vs. 0,0 %, p= 0,074). El por ciento de prehipertensos (16,7 vs. 2,4 %) e hipertensos (13 vs. 7,1 %) fue significativamente mayor en OAb (p= 0,016) (tabla 1).
El APF de DM fue significativamente mayor en los niños y adolescentes con OCT, y con OAb; de la misma forma se comportó el APF de HTA en los obesos. Los valores de insulinemia en ayunas, TG y AU, aunque normales, fueron por ese orden, significativamente mayores en los obesos. Para el valor de HOMA-IR, ambos grupos mostraron una elevación significativa. El resto de las variables bioquímicas no mostraron diferencias estadísticamente significativas, aunque vale señalar que el valor de insulinemia se duplicó en aquellos con OAb (tabla 2).
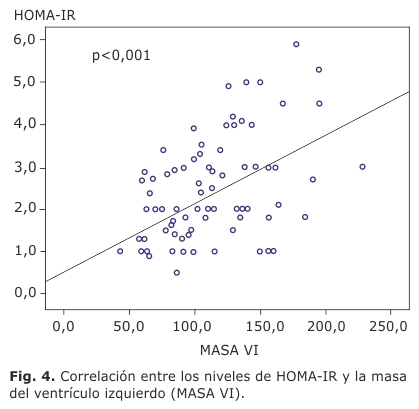
Se encontraron diferencias significativas en los valores de la masa del VI en el grupo de niños y adolescentes con OCT (118 ± 39 vs. 96 ± 35, p= 0,008) y OAb (123 ± 39 vs. 97 ± 34 g, p= 0,001) (Fig. 3A y B). Se encontró correlación positiva y significativa entre los niveles de HOMA-IR y la masa del VI (r= 0,496, p< 0,001) (Fig. 4).
DISCUSIÓN
La obesidad y la HTA son dos de los principales factores de riesgo que conducen al incremento en la incidencia de enfermedad cardiovascular (ECV). Se invocan varios mecanismos en su patogenia que relacionan las cifras de TA con la grasa visceral, la RI y la hiperinsulinemia compensadora, además de la afectación que puede provocar la obesidad en la función renal, al incrementar la reabsorción de sodio y agua con aumento del volumen intravascular, activación del sistema renina-angiotensina, aumento de la producción de catecolaminas con activación del sistema nervioso simpático, favorecer la hipertrofia del músculo liso, ya sea por estimulación directa o por la acción del factor de crecimiento insulínico (IGF-1), y afectar el funcionamiento de algunas bombas iónicas transmembranas (bomba sodio-potasio, bomba sodio ATPasa, bomba calcio ATPasa).20 Algunos trabajos realizados por Lurbe, Marcovecchio y otros, en los que se utiliza la monitorización ambulatoria de la TA, documentan la asociación entre la obesidad y la elevación de la TA en niños, y en todos ellos se observan mayores cifras de TA en pacientes con sobrepeso/obesidad cuando se comparan con niños normopeso.21 En el presente estudio, la OCT y la OAb se asociaron con valores significativamente mayores de TAS, mientras que el porcentaje de prehipertensos e hipertensos fue significativamente mayor en aquellos con OAb.
Basado en estos resultados, se deduce que el IMC y la CCin deben convertirse en objetivos terapéuticos a través de los cuales modificar las cifras de TA, pues se ha demostrado que la HTA, en esta etapa de la vida, sigue un patrón de arrastre, que continúa hasta la tercera o cuarta década, lo que resulta en un indicador de riesgo de HTA en el adulto.22 Por otro lado, la presencia de 9,4 % de HTA en la investigación fue superior a las identificadas por el Centro Nacional de Estadísticas de Norteamérica, al analizar datos en tres períodos de la Encuesta Nacional de Nutrición y Salud de los EE. UU. (1988-1994, 1999-2002 y 2003-2006), en los que se estudiaron 15 000 adolescentes con 2,6 % de HTA en varones y 3,4 % para las hembras,23 similar al 2 % encontrado para Cuba.24 Estos resultados pudieron estar relacionados con el tamaño de la muestra y la limitación en el grupo de edades en estudio. No obstante, la prevalencia informada no dista mucho del rango encontrado por diversos autores.25-29
Para la prehipertensión, se identifica 24,91 %, que se corresponde con lo publicado por McNiece y otros,29 en un tamizaje a 6 790 educandos de varios colegios norteamericanos (11-17 años), que detectaron 15,7 %, y lograron estimar una prevalencia de prehipertensión “oculta” de hasta el 25,5 %. Otros autores coinciden en que para el próximo decenio esta estadística, que fluctúa alrededor del 15 al 20 %, podría aumentar significativamente.30
En este estudio, el antecedente familiar de DM fue significativamente superior en el grupo de niños y adolescentes con OCT y abdominal. Este resultado evidencia la importancia de realizar mayor énfasis en la búsqueda de trastornos del metabolismo de los carbohidratos y estrategias preventivas en niños con familiares de primer grado con DM. En una investigación reciente realizada en Cuba, que incluyó 46 niños y adolescentes obesos, el 78 % presentó RI, que no estuvo relacionada con el grado de obesidad ni con el pliegue tricipital de grasa, pero sí con la historia familiar de DM 2.31
El perfil lipídico en niños con obesidad se presenta habitualmente con elevación de TG y disminución de lipoproteínas de alta densidad del colesterol (HDL-c). Los niveles de lipoproteínas de baja densidad del colesterol (LDL-c) suelen ser normales, pero las partículas son más pequeñas, densas y con mayor poder aterogénico.32 Se conoce que la RI aumenta la síntesis hepática de LDL-c, y a la vez, disminuye la acción de la lipasa lipoproteica en los tejidos periféricos, aumentando la degradación de HDL-c; como consecuencia aumentan los TG, con una permanencia mayor en el plasma, lo que permite un intercambio de TG (bajo la influencia de la proteína transportadora de esteres del colesterol) entre estas partículas, la LDL-c y HDL-c con la lipasa hepática, y una disminución de los niveles de HDL-c y el incremento de la proporción de partículas pequeñas densas de LDL-c, e hipertrigliceridemia posprandial.33
Los adipocitos, como órgano endocrino, secretan una variedad de moléculas activas (adipocitocinas) como la leptina, la adiponectina, la resistina, el factor de necrosis tumoral alfa e interleukina 6, que contribuyen a la RI periférica.34 De hecho, la obesidad es la causa más frecuente de RI en niños y adolescentes, y por tanto, precursora de la DM 2. Los reportes de prevalencia de RI en niños obesos determinada por el HOMA-IR son muy amplios.35-37 En este estudio encontramos valores significativamente mayores de TG en el grupo de niños con OCT, además de un incremento significativo en los valores de insulinemia, HOMA-IR y AU.
Arnaíz y otros38 encontraron resultados similares a esta investigación para el laboratorio, con diferencias significativas en todos los componentes del perfil lipídico: los obesos presentaron concentraciones mayores de CT (p< 0,003), LDL-c (p< 0,005) y TG (p< 0,005) mg/dL, y menor HDL-c (p< 0,007) mg/dL. No hubo diferencia en la glucemia de ayunas entre ambos grupos.
Estudios realizados por Genovesi, Cuesta, Ng y otros, reportaron la relación existente entre la CCin y la hipertrigliceridemia, considerada el principal trastorno lipídico de la obesidad.5-7 Probablemente, la alteración más temprana asociada a la obesidad central tiene que ver con el metabolismo de los carbohidratos. Esta alteración es progresiva, va desde la aparición de hiperinsulinismo asociado o no a RI, hasta la DM 2, pasando por las fases de glucemia en ayunas alterada e intolerancia a hidratos de carbono.39 No obstante, si bien los valores de glucemia en ayunas fueron mayores en los niños obesos, no se encontraron diferencias significativas en este estudio.
Las alteraciones cardiacas en la obesidad incluyen adaptación estructural con HVI, dilatación ventricular y auricular, y anomalías funcionales, además de disfunción diastólica, demostradas tempranamente en niños y adolescentes obesos.40,41 En esta investigación, se encontró un incremento significativo de la masa del VI en aquellos niños con OCT y abdominal. Similares resultados encontraron Ozdemir y otros.42
Di Bonitoa y otros43 encontraron en 111 adolescentes una correlación positiva y significativa de la CCin y el IMC, con la masa del VI. En el análisis multivariado, la razón CCin/talla fue la única variable que se asoció significativamente con la masa del VI. Otros estudios han encontrado resultados similares.44-46
Por el contrario, en 140 niños y adolescentes con HTA esencial estudiados en el Hospital “William Soler”, la obesidad no mostró una relación significativa con la presencia de HVI.47 En el presente estudio también se demostró una correlación positiva y significativa entre los niveles de HOMA-IR y la masa del VI.
Varios mecanismos pueden explicar el efecto inductor de la RI sobre la masa del VI, como por ejemplo la acción mitogénica directa de la insulina en la célula miocárdica mediante la vía de la proteinquinasa asociada a mitógenos, y la activación del sistema nervioso simpático y el sistema renina angiotensina, particularmente la angiotensina II, cuya acción sobre los receptores AT1 puede producir proliferación celular miocárdica, y en la capa glomerular de la corteza suprarrenal estimular la síntesis y secreción de aldosterona, producir reabsorción de agua y sodio, expansión del volumen extracelular, y por último, HVI.48
Otros estudios refieren la relación entre la RI y la masa del VI, tanto en obesos como en hipertensos, con resultados diversos.49-51 Algunos, han encontrado una relación entre ambos,52,53 mientras que otros no han obtenido estos resultados después del ajuste con el resto de las covariables.54 Estos resultados sugieren que la OCT, la OAb y la RI se relacionan con el incremento de la TA y con cambios en la geometría ventricular desde etapas tempranas de la vida, por lo que, el subgrupo de niños y adolescentes con obesidad debe recibir especial atención en la búsqueda activa y rutinaria de HTA e incremento de la masa del VI, que identificarían un grupo de pacientes con mayor riesgo de desarrollar complicaciones cardiometabólicas durante la vida adulta y, por tanto, necesitados de recibir acciones preventivas más intensas.
Se concluye que la búsqueda activa mediante examen ecocardiográfico permite identificar cambios estructurales en corazón y lecho vascular de niños y adolescentes con obesidad y RI. Los APF de DM e HTA se relacionan con la aparición de obesidad en niños y adolescentes. Los valores de insulinemia, TG y AU son más elevados en niños y adolescentes obesos.
REFERENCIAS BIBLIOGRÁFICAS
1. Singh GK, Kogan MD, Van Dyck PC. Changes in state-specific childhood obesity and overweight prevalence in the United States from 2003 to 2007. Arch Pediatr Adolesc Med. 2010;164:598-607.
2. Aggoun Y. Obesity, metabolic syndrome and cardiovascular disease. Pediatr Res. 2007;61:653.
3. Ramírez M, Moreno-Martínez FL, Torres D, Nieto CG, Osorio CM, Guevara A, et al. Detección de hipertrofia ventricular izquierda en adolescentes con hipertensión arterial esencial. Hipertensión. 2006;23:277-83.
4. Torró I, Lurbe E. Beneficios de la medida de la masa ventricular en adolescentes con hipertensión arterial. Hipertensión. 2006;23:275-6.
5. Genovesi S, Antolini L, Giussani M, Brambilla P, Barbieri V, Galbiati S, et al. Hypertension, Prehypertension, and Transient Elevated Blood Pressure in Children: Association With Weight Excess and Waist Circumference. Epidemiol. 2010;23:756-61.
6. Cuestas E, Achával A, Garcés N, Larraya C. Waist circumference, dyslipidemia and hypertension in prepubertal children. An Pediatr (Barc). 2007;67:44-50.
7. Ng VW, Kong AP, Choi KC, Ozaki R, Wong GW, So WY, et al. BMI and Waist Circumference in Predicting Cardiovascular Risk Factor Clustering in Chinese Adolescents. Obesity. 2007;15:494-503.
8. Belsha CW, Wells TG, McNiece KL, Seib PM, Plummer JK, Berry PL. Influence of diurnal blood pressure variations on target organ abnormalities in adolescents with mild essential hypertension. Am J Hypertens. 1998;11:410-7.
9. Sorof JM, Alexandrov AV, Cardwell G, Portman RJ. Carotid artery intimal-medial thickness and left ventricular hypertrophy in children with elevated blood pressure. Pediatrics. 2003;111:61-6.
10. Hanevold C, Waller J, Daniels S, Portman R, Sorof J. The effects of obesity, gender, and ethnic group on left ventricular hypertrophy and geometry in hypertensive children: A collaborative study of the International Pediatric Hypertension Association. Pediatrics. 2004;113:328-33.
11. Daniels SR, Loggie JM, Khoury P, Kimball TR. Left ventricular geometry and severe left ventricular hypertrophy in children and adolescents with essential hypertension. Circulation. 1998;97:1907-11.
12. National High Blood Pressure Education Program Working Group on High Blood Pressure in Children and Adolescents. The fourth report on the diagnosis, evaluation and treatment of high blood pressure in children and adolescents. Pediatrics. 2004;114:555-76.
13. Esquivel M. Valores cubanos de índice de masa corporal en niños de 0 a 19 años. Rev Cubana Pediatr. 1991;63:180-90.
14. Esquivel M, Rubén M, González C, Rodríguez L, Tamayo V. Curvas de crecimiento de la cintura en niños y adolescentes habaneros. Rev Cubana Pediatr. 2011;83:44-55.
15. Arranz C, González RM. Utilización de un método rápido para la separación de la hormona libre y unida en el radioinmuno ensayo de insulina. Rev Cubana Invest Biomed. 1988;7:150-6.
16. Mathews DR, Hosker JP, Rudenki AS, Nailor BA, Treacher DF, Turner RC. Homeostasis model assessment: Insulin resistance and Beta Cell Function from fasting plasma glucose and insulin concentration in man. Diabetologia. 1985;28:412-9.
17. Tapia L, López JP, Jurado A. Prevalencia del síndrome metabólico y sus componentes en niños y adolescentes con obesidad. An Pediatr. 2007;67:352-61.
18. Cabrera E, Marichal S, Parlá J, Arrans C, González R, Pérez C, et al. Frecuencia y características del síndrome metabólico y de la resistencia a la insulina en familiares de primer grado de personas con diabetes mellitus tipo 1. Endocrinol Nutr. 2010;57(7):311-21.
19. Schiller NB, Shah PM, Crawford M. Recommendations for quantitation of the left ventricle by two-dimensional echocardiography. American Society of Echocardiography Committee on Standards, Subcommittee on quantitation of two-dimensional echocardiograms. J Am Soc Echocardiogr. 1989;2:358-67.
20. Hall JE. The kidney, hypertension and obesity. Hypertension. 2003;41:625-33.
21. Urbina E, Alpert B, Flynn J, Hayman L, Harshfield GA, Jacobson M, et al. Ambulatory blood pressure monitoring in children and adolescents: recommendations for standard assessment. A Scientific Statement from the American Heart Association Atherosclerosis, Hypertension, and Obesity in Youth Committee of the Council on Cardiovascular Disease in the Young and the Council for High Blood Pressure Research. Hypertension. 2008;52:433-51.
22. Halfon N, Verhoef PA, Kuo AA. Childhood antecedents to adult cardiovascular disease. Pediatr Rev. 2012;33:51-60.
23. Roger VL, GO AS, Lloyd-Jones DM, Adams RJ, Berry JD, Brown TM, et al. Heart Disease and Stroke Statistics 2011 Update: A Report from the American Heart Association. Circulation. 2011;123:e18-e209.
24. Pérez D, Dueñas A, Alfonzo J, Vázquez A, Navarro D, Del Pozo A, et al. Guía cubana para la prevención, diagnóstico, y tratamiento de la hipertensión arterial. Comisión Nacional Técnica Asesora del Programa de Hipertensión Arterial. La Habana: Editorial Ciencias Médicas; 2008. p. 64.
25. Álvarez JL, Ondina E, Díaz J, Ferrer M. Exceso de peso corporal e hipertensión arterial en adolescentes de secundaria básica. Rev Cubana Med Gen Integr [serie en Internet]. 2010 Mar [citado 29 de septiembre de 2012];26(1). Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0864-21252010000100004&lng=es&nrm=iso&tlng=es
26. Suárez L, Rodríguez A, Tamayo JL, Rodríguez RP. Prevalencia de hipertensión arterial en adolescentes de 15 a 17 años. MEDISAN [serie en Internet]. 2009 [citado 3 de marzo de 2010];13(6). Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1029-30192009000600007&lng=es&nrm=iso&tlng=es
27. Kollias A, Antonodimitrakis P, Grammatikos E, Chatziantonakis N, Grammatikos EE, Stergiou GS. Trends in hypertension in Greek adolescentes. J Hum Hypertens. 2009;23:385-90.
28. Hansen ML, Gunn PW, Kaelber DC. Underdiagnosis of hypertension in children and adolescents. JAMA. 2007;298:874-9.
29. Mc Niece KL, Poffenbarger TS, Turner JL, Franco KD, Sorof JM, Portman RJ. Prevalence of hypertension and pre-hypertension among adolescents. J Pediatr. 2007;150:640-4.
30. Singh RB, Fedacko J, Pella D, Macejova Z, Ghosh S, de Amit K, et al. Prevalence and risk factors for prehypertension and hypertension in five Indian cities. Acta Cardiol. 2011;66:29-37.
31. González P, Cabrera E, Oti MA. Resistencia a la insulina e historia familiar de diabetes en niños y adolescentes obesos con acantosis nigricans y sin ella. Rev Cubana Endocrinol. 2011;22:210-24.
32. Guijarro de Armas MG, Monereo S, Merino M, Iglesias P, Vega B. Prevalencia de síndrome metabólico en una población de niños y adolescentes con obesidad. Endocrinol Nutr. 2012;59:155-9.
33. Calderín RO, Prieto M, Cabrera E. Síndrome de insulinorresistencia en niños y adolescentes. Rev Cubana Endocrinol [serie en Internet]. 2007 [citado 14 de abril de 2013];18(2). Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1561-29532007000200007&lng=es&nrm=iso&tlng=es
34. Simón E, Barrios AS. Leptina y obesidad. ANA. 2007;25:1-17.
35. Caceres M, Teran CG, Rodriguez S, Medina M. Prevalence of insulin resistance and its association with metabolic syndrome criteria among Bolivian children and adolescents with obesity. BMC Pediatrics. 2008;8:31.
36. Martínez JJ, Guadalupe G, León NM. Prevalencia de resistencia a la insulina y síndrome metabólico en niños obesos que acuden a la Clínica de Obesidad del Hospital Pediátrico de Sinaloa. Pediatr Mex. 2010;12:18-22.
37. Lee JM, Okumura MJ, Davis MM, Herman WH, Gurney JG. Prevalence and determinants of insulin resistance among US adolescents: a population-based study. Diabetes Care. 2006;29:2427-32.
38. Arnaíz P, Acevedo M, Barja S, Berríos X, Guzmán B, Bambs C, et al. Arterioesclerosis subclínica, factores de riesgo cardiovascular clásicos y emergentes en niños obesos chilenos. Rev Chil Pediatr. 2007;78(2):135-42.
39. Hannon TS, Rao G, Arslanian SA. Childhood obesity and type 2 diabetes mellitus. Pediatrics. 2005;116:473-80.
40. Chinali M, de Simone G, Roman MJ, Lee ET, Best LG, Howard BV, et al. Impact of obesity on cardiac geometry and function in a population of adolescents: the Strong Heart Study. J Am Coll Cardiol. 2006;47:2267-73.
41. Van Putte-Katier N, Rooman RP, Haas L, Verhulst SL, Desager KN, Ramet J, et al. Early cardiac abnormalities in obese children: importance of obesity per se versus associated cardiovascular risk factors. Pediatr Res. 2008;64:205-9.
42. Ozdemir O, Hizli S, Abaci A, Agladioglu K, Aksoy S. Echocardiographic Measurement of Epicardial Adipose Tissue in Obese Children. Pediatr Cardiol. 2010;31:853-60.
43. Di Bonitoa P, Capaldob B, Forziatoc C, Sanguignoc E, Di Fraiac T, Scillad C, et al. Central adiposity and left ventricular mass in obese children. Nutr Metab Cardiovasc Dis. 2008;18:613-7.
44. Baszun-Stepaniuk E, Urban M, Głowińska B. Left ventricular mass and function in hypertensive and obese children and adolescents with family history of cardiovascular diseases. Pol Merkur Lekarski. 2004;16:420-4.
45. Friberg P, Allansdotter-Johnsson A, Ambring A, Ahl R, Arheden H, Framme J, et al. Increased left ventricular mass in obese adolescents. Eur Heart J. 2004;25:987-92.
46. Pacileo G, Castaldi B, Di Salvo G, Limongelli G, Rea A, D’Andrea A, et al. Assessment of left-ventricular mass and remodeling in obese adolescents: M-mode, 2D or 3D echocardiography? J Cardiovasc Med. 2013;14:144-9.
47. Llapur JR, González R, Betancourt A, Rubio DY. Hipertrofia ventricular izquierda y factores de riesgo cardiovascular en niños y adolescentes hipertensos. Rev Cubana Pediatr [serie en Internet]. 2009 Jun [citado 13 de abril de 2013];81(2). Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0034-75312009000200004&lng=es&nrm=iso&tlng=es
48. Lima MM, Nuccio JC, Villalobos M, Torres C, Balladares N. Sistema renina angiotensina y riesgo cardiometabólico. Rev Venez Endocrinol Metab. 2010;8:3-10.
49. Ilercil A, Devereux RB, Roman MJ, Paranicas M, O'Grady MJ, Lee ET, et al. Associations of insulin levels with left ventricular structure and function in American Indians: the strong heart study. Diabetes. 2002;51:1543-7.
50. Atabek ME, Pirgon O, Kivrak AS. Evidence for association between insulin resistance and premature carotid atherosclerosis in childhood obesity. Pediatr Res. 2007;61:345-9.
51. Atabek ME, Pirgon O, Kurtoglu S. Assessment of abnormal glucose homeostasis and insulin resistance in Turkish obese children and adolescents. Diabetes Obes Metab. 2007;9:304-10.
52. Chinali M, de Simone G, Roman MJ, Lee ET, Best LG, Howard BV, et al. Impact of obesity on cardiac geometry and function in a population of adolescents: the Strong Heart study. J Am Coll Cardiol. 2006;47:2267-73.
53. Chinali M, de Simone G, Roman MJ, Best LG, Lee ET, Russell M, et al. Cardiac markers of pre-clinical disease in adolescents with the metabolic syndrome: the strong heart study. J Am Coll Cardiol. 2008;52:932-8.
54. Malmqvist K, Ohman KP, Lind L, Nyström F, Kahan T. Relationships between left ventricular mass and the rennin-angiotensin system, catecholamines, insulin and leptin. J Intern Med. 2002;252:430-9.
Recibido: 7 de febrero de 2015.
Aprobado: 1º de junio de 2015.
Silvia María Marín Juliá. Instituto Nacional de Endocrinología (INEN). Calle Zapata y D, Vedado, municipio Plaza de la Revolución. La Habana, Cuba. Correo electrónico: simaju@infomed.sld.cu