Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Endocrinología
versión On-line ISSN 1561-2953
Rev Cubana Endocrinol vol.27 no.1 Ciudad de la Habana ene.-abr. 2016
Rev Cubana Endocrinol. 2016;27(1)
ARTÍCULO ORIGINAL
Colonización por Candida spp. en sujetos diabéticos y no diabéticos
Colonization by Candida spp. in diabetic and non-diabetic individuals in the north of Colombia
Paola Suárez Álvarez,I Indira Llanos González,I Rina Montoya Ojeda,I Martha Puello Hoyos,I Gregorio Young Castro,I Niradiz Reyes RamosII
IGrupo de Micología. Facultad de Medicina. Universidad de Cartagena. Cartagena, Colombia.
IIGrupo de Genética y Biología Molecular. Facultad de Medicina. Universidad de Cartagena. Cartagena, Colombia.
RESUMEN
Introducción: el género Candida puede encontrarse colonizando el cuerpo humano, pero también puede provocar infecciones de carácter oportunista. La diabetes es considerada comúnmente un factor de riesgo para la infecciones candidósicas, dadas sus características asociadas a inmunosupresión, hiperglucemia, problemas de microvascularización, entre otros. Usualmente, para que se inicie un proceso infeccioso, es necesaria la colonización; por tanto, es importante conocer su frecuencia de portación en grupos con factores de riesgo asociados.
Objetivo: determinar los porcentajes de colonización por Candida spp. en la cavidad oral y la zona interdigital del pie en pacientes diabéticos y no diabéticos.
Métodos: el estudio, de carácter descriptivo, se realizó en un grupo de 85 pacientes del norte de Colombia: 46 diabéticos y 39 no diabéticos. La identificación de los aislamientos se realizó por pruebas fenotípicas, que incluyeron CHROMagar, microscopía, prueba de tubo germinal, prueba de clamidosporas y zimograma.
Resultados: en los pacientes diabéticos se encontró una frecuencia de colonización por Candida spp. en la cavidad oral de 23,9 %, y en el pie, de 56,52 %; mientras que, para los sujetos no diabéticos, la frecuencia de colonización en la cavidad oral fue del 33,3 % y en el pie del 43,58 %. Adicionalmente, en el grupo de diabéticos se encontró que la frecuencia de colonización por la especie Candida albicans en la cavidad oral fue de 45,5 %, mientras que en el pie fue del 11,5 %.
Conclusiones: los resultados obtenidos sugieren que las condiciones locales del ambiente de donde se aísla Candida spp. pueden influir en los niveles de portación y la variedad de especies, lo que podría ser más determinante que la condición de base.
Palabras clave: Candida; diabetes; microbiota.
ABSTRACT
Introduction: Candida genus may colonize the human body but also may cause opportunistic infections. Diabetes is frequently considered a risk factor for Candida infections, given its characteristics associated to immunosuppresion, hyperglycemia, microvascularization problems and others. Generally, colonization is necessary for the starting of an infectious process; therefore, it is important to know its frequency of carriage in groups with associated risk factors.
Objective: to determine the percentages of Candida spp. colonization in the oral cavity and the inter-toe area in diabetic and nondiabetic patients.
Methods: the descriptive study was carried out in a group of 85 patients from the north of Colombia, that is, 46 diabetics and 39 non diabetics. The isolates were identified through phenotypical tests including CHROMagar, microscopy, germ tube test, Chlamydospore test and zymogram.
Results: it was found in diabetic patients that the frequency of colonization by Candida spp. in the oral cavity was 23.9 % and in the foot was 56.52 % whereas in non-diabetic patients, the frequency of colonization in the oral cavity was 33.3 % and in the foot was 43.58 %. Additionally, it was found in the group of diabetic subjects that the frequency of colonization by Candida albicans was 45.5 % in the oral cavity whereas that of the foot was 11.5 %.
Conclusions: the achieved results indicate that the local environmental conditions where the Candida spp. is isolated may have an impact on the levels of carriage and the variety of species, which could be more determining than the underlying condition.
Keywords: Candida; diabetes; microbiota.
INTRODUCCIÓN
El género Candida incluye un grupo de levaduras que hacen parte de la microbiota normal humana del tracto digestivo, piel y vagina, dentro del cual varias especies emergen como patógenos oportunistas involucrados en infecciones superficiales y sistémicas, que comprenden candidiasis orofaríngea, ocular, cutánea, genital, esofágica, gastrointestinal, mucocutánea crónica y diseminada, especialmente en pacientes con inmunosupresión asociada a trasplante de órganos, quimioterapia, síndrome de inmunodeficiencia adquirida o edad avanzada, así como en pacientes diabéticos, o que reciben terapia antibiótica de amplio espectro.1-4 Las infecciones por Candida spp. no solo son prevalentes, sino que también causan una considerable mortalidad y morbilidad.5-8 Aproximadamente el 95 % de todas las infecciones candidósicas son producidas por cuatro especies: C. albicans, C. glabrata, C. parapsilosis y C. tropicalis.4,9-12
En general, las infecciones superficiales y sistémicas producidas por Candida spp. involucran múltiples factores de riesgo,13-15 que pueden ser locales o sistémicos, entre los cuales, la diabetes es uno de los más frecuentes.16-18 La susceptibilidad a infecciones es una de las complicaciones que pueden presentarse en los pacientes diabéticos.19-21 Las de tipo infeccioso comprenden infecciones de cabeza y cuello, tracto respiratorio inferior, vías biliares, urinarias, tejidos blandos, cutáneas y de membranas mucosas y estructuras óseas, particularmente del pie.22-26 En el proceso de patogénesis de candidemia en pacientes con diabetes mellitus se reconocen tres componentes importantes: primero; la colonización fúngica; segundo, la penetración o alteración de las barreras anatómicas; y tercero, las deficiencias en el sistema inmune, que pueden llevar a la diseminación y proliferación de Candida spp. en los tejidos profundos y órganos.16,27,28
Al ser la colonización por Candida spp. uno de los primeros pasos en el proceso de patogénesis, el objetivo de este estudio fue establecer la frecuencia de colonización y la variación de especies, en la cavidad oral y la zona interdigital del pie, en pacientes diabéticos y no diabéticos.
MÉTODOS
El estudio, de carácter descriptivo, se realizó en un grupo de 85 pacientes con diagnóstico previo de diabetes y pacientes no diabéticos, durante los meses de agosto y septiembre de 2013, que hacían parte de un programa de promoción de salud del municipio de Túrbaco, departamento de Bolívar, norte de Colombia.29,30 A los participantes se les explicaron debidamente los objetivos y beneficios del proyecto, y se les solicitó su consentimiento informado. Los datos personales y clínicos de todos los participantes se tomaron de las respectivas historias clínicas, o por pregunta directa, y se consignaron en el cuestionario diseñado para este fin.
De esta manera, la hemoglobina glicosilada (HbA1c) se utilizó como parámetro para determinar el control glucémico de los participantes diabéticos, y la glicemia en ayunas para los no diabéticos.31 Con el fin de evaluar el porcentaje de colonización o portación de Candida spp., solo se tomaron muestras a pacientes sin lesiones en los sitios anatómicos de estudio. Las muestras de la cavidad oral de pacientes diabéticos y no diabéticos, se tomaron mediante enjuague bucal durante 30 s con buffer fosfato-salino 0,01 M, pH 7,2 y se recolectaron en recipientes estériles.32
Las muestras de escamas de pie se tomaron mediante frotis de la zona interdigital, que se conservó para su transporte en el buffer fosfato-salino. Las muestras se sembraron en agar sabouraud-cloranfenicol, y las colonias se resembraron para su diferenciación en CHROMagar Candida.33,34 Las especies se identificaron de acuerdo con los colores producidos por las colonias en CHROMagar Candida, atendiendo a las indicaciones del fabricante.33,35,36 Para la realización de las pruebas, los aislamientos se resembraron en agar sabouraud.
Se realizaron pruebas fenotípicas adicionales, como tinción de Gram, la prueba del tubo germinal, producción de clamidosporas y zimograma.33,37 La prueba de tubo germinal se realizó con 500 µL de suero humano, al que se adicionó una asada del aislado en estudio con 24 h de crecimiento, se mezcló y se incubó por 2-3 h a 37 °C. La prueba resulta positiva para C. albicans y C. dubliniensis.33,38 La prueba de producción de clamidosporas se efectuó en agar leche de acuerdo con lo descrito por Pineda y otros.37 El agar leche se sirvió sobre portaobjetos ubicados en cámaras húmedas, y una vez solidificado, se procedió a sembrar por medio de una estría con un asa en punta, haciendo incisión del medio, y luego se cubrieron con los cubreobjetos. Las cajas se incubaron a 28 °C por 48 horas.
La observación microscópica se hizo directamente con el portaobjetos con una intensidad de luz apropiada para la visualización de las estructuras a 400X. La prueba se consideró positiva para C. albicans y C. dubliniensis.37 Para la prueba de zimograma, el medio utilizado se preparó con 5,5 g de extracto de levadura, 7,5 g de peptona y 40 mg de púrpura de bromocresol por litro; y los azúcares glucosa, maltosa, sacarosa, galactosa, lactosa y trehalosa, a una concentración del 6 %. Para la prueba, los aislados completaron 24 h de crecimiento. El inóculo se preparó con solución salina estéril, y se ajustó a 1 de la escala de McFarland. A cada tubo de medio se agregó 1 mL de uno de los azúcares a evaluar y 100 µL del inóculo, hasta completar los seis azúcares por cada aislado en estudio. Se incubaron por 48 h a 37 °C, y se tomó como positivo ante el viraje del medio a amarillo y/o la producción de gas.39 Las especies que no fueron plenamente identificadas, se reportaron como Candida no albicans.33 El análisis estadístico de los datos se realizó con el programa SPSS de IBM, versión 19 para Windows 8.40
RESULTADOS
El estudio se realizó con 85 pacientes pertenecientes a un grupo de promoción de salud del municipio de Túrbaco, que comprendía sujetos con un rango de edad entre 39 y 87 años, la media correspondió a 66,35 ± 11,54, con una mediana de 47 y tres modas de 47, 75 y 76 años de edad. El 76,5 % de la población era de sexo femenino, y el 23,5 % de sexo masculino. El grupo de estudio incluyó 46 pacientes diabéticos y 39 pacientes no diabéticos. La media de edad en pacientes diabéticos era de 63,65 ± 12,07, con un 89,1 % de individuos del sexo femenino. Para los pacientes diabéticos, la HbA1c se encontró entre 5,2 y 12,2, con una media de 7,71 ± 2,034. De este grupo de pacientes, solo 23 (54 %) presentaban control adecuado de su glicemia, de acuerdo con los valores de su HbA1c, que se encontraban por debajo de 7. En los pacientes no diabéticos, la media de la edad era de 69,53 ± 10,15, con 61,5 % de sujetos de sexo femenino.
La frecuencia de colonización por Candida spp. en el total de la población —tanto diabéticos como no diabéticos— fue de 28,2 % y de 50,6 %, en la cavidad oral y el pie, respectivamente. De las muestras de la cavidad oral se obtuvo crecimiento en 11 pacientes diabéticos y en 13 pacientes no diabéticos, para un total de 24 aislamientos en la cavidad oral, con predominio de Candida albicans. El porcentaje de colonización en la cavidad oral por Candida spp. en pacientes diabéticos fue de 23,9 %, y fue la especie más frecuentemente aislada (45,5 %), seguida por Candida glabrata (18,8 %) y otras especies en igual porcentaje (9,1 %), como Candida tropicalis, Candida krusei, Candida dubliniensis y Candida stellatoidea. Los aislamientos de C. albicans correspondieron a 60,8 % de todos los aislamientos en diabéticos y no diabéticos, pero se observó que para los pacientes diabéticos hubo un menor número de aislamientos en los que C. albicans correspondía a 45,5 %, mientras que para los no diabéticos, en los que la frecuencia total fue de 33,3 %, para C. albicans se halló un 69,2 % y de otras especies de Candida 7,79 % (tablas 1 y 2).
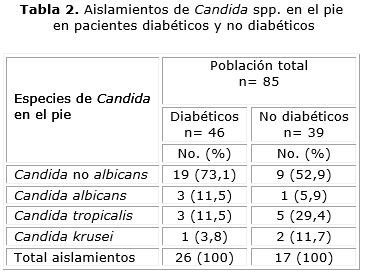
En las muestras de zona interdigital del pie se obtuvo crecimiento en 26 pacientes diabéticos y 17 pacientes no diabéticos, para un total de 43 aislamientos, con predominio de Candida no albicans, lo que corresponde a 56,5 % de colonización en pie para pacientes diabéticos y 43,6 % de colonización en el pie para no diabéticos.
En zona interdigital del pie, la colonización por C. albicans y C. tropicalis se observó en pacientes diabéticos, en 11,5 % para ambas especies. En las muestras estudiadas solo se pudo identificar una cepa de C. krusei. En el grupo de no diabéticos, C. tropicalis se halló en 24,9 % y C. krusei en 11,7 %. A diferencia de lo observado en la cavidad oral, los datos muestran un mayor número de aislamientos en el pie para pacientes diabéticos, que corresponden a 70,3 % del total de aislamientos (37 cepas de boca y pie) obtenidos en diabéticos.
DISCUSIÓN
La tasa de colonización por Candida spp. puede variar ampliamente de una población a otra, dependiendo de su edad, enfermedad de base, sitio anatómico de aislamiento, o inclusive, del método utilizado.3,30,41-43 En el presente estudio se halló un porcentaje de colonización en la población total de estudio entre 28,2 y 50,6 %, pero que dependía del sitio anatómico del aislamiento. Duque y otros44 encontraron una frecuencia de portación de 48 % de Candida spp. en la cavidad oral de diabéticos, en un estudio realizado en 200 pacientes. En otro estudio, realizado por Thaweboon y otros,42 en pacientes sometidos a radioterapia, todos resultaron portadores de Candida spp.; en pacientes infectados con VIH en una población de Turquía, la colonización oral fue del 82,8 %.45 Estas diferencias podrían estar relacionadas con factores de riesgo sistémicos (antibióticos, corticosteroides, radioterapia, cáncer y VIH), o con factores locales (prótesis dentales, maceración, etc.), que pueden variar las condiciones del ambiente, y favorecer, en algunos casos, la colonización por Candida.2,43
La especie más frecuentemente aislada, en la cavidad oral, tanto en pacientes diabéticos como no diabéticos, fue Candida albicans, en 45,5 a 69,2 % respectivamente. La frecuencia de esta especie para Duque y otros44 fue de 95,4 % y para las especies noalbicans (Candida guillermondii y Candida parapsilosis) en 2,3 %. En nuestro estudio, si bien hubo una menor colonización por C. albicans, se halló una mayor variedad de especies no albicans. Premkumar y otros,43 en Chennai (India), encontraron en un estudio realizado con 80 pacientes diabéticos y no diabéticos, que la colonización en la cavidad oral por C. albicans fue del 33 y 45 % respectivamente. Además, reportaron que las especies no albicans fueron más prevalentes en los pacientes diabéticos, que en los no diabéticos. Estos resultados coinciden con nuestros hallazgos, al encontrarse un mayor porcentaje de C. albicans en los pacientes diabéticos.
Prácticamente no se hallan datos de colonización en el pie, pero en úlceras de pie diabético también se encuentra variación en los porcentajes de aislamiento, que pueden ir del 5 al 21 %.46 Por último, podría considerarse que factores locales asociados al nicho de Candida, quizás influyan en las frecuencias de portación de la levadura y en la variación de especies que colonizan el sitio anatómico de estudio. La menor colonización en la cavidad oral podría estar relacionada con otros factores locales diferentes, relacionados con el uso de prótesis dentales, una higiene inadecuada, o que muchos pacientes, a pesar de ser edéntulos completos, no usaban la prótesis.
De igual forma, se presentaría una situación similar en el pie, pues se observó un predominio de especies no albicans y un mayor porcentaje de colonización con respecto a la cavidad oral, por lo que quizás, antes que la condición de base o el factor de riesgo, serían muy determinantes las condiciones locales del ambiente de donde se aísle Candida spp.
La colonización por el género Candida en pacientes diabéticos es diferente dependiendo del sitio de aislamiento, tanto en frecuencia, como en variación de especies. El mayor porcentaje de colonización se destaca en la zona interdigital de pie. Al observarse similitud en la frecuencia de colonización entre diabéticos y no diabéticos, es probable que la colonización por Candida esté más influida por factores locales como la maceración, la humedad y el calor, que por factores de riesgo sistémicos.
Agradecimientos
A la señora María de la Vega, por su valiosa asistencia técnica; y a la Vicerrectoría de Investigaciones de la Universidad de Cartagena, por la financiación del presente proyecto, de acuerdo con Resolución No. 1 279 del 20 de abril de 2012.
REFERENCIAS BIBLIOGRÁFICAS
1. Nobile CJ, Johnson AD. Candida albicans Biofilms and Human Disease. Annu Rev Microbiol. 2015;69:71-9.
2. Lopez-Martinez R. Candidosis, a new challenge. Clin Dermatol. 2010;28(2):178-84.
3. Merenstein D, Hu H, Wang C, Hamilton P, Blackmon M, Chen H, et al. Colonization by Candida species of the oral and vaginal mucosa in HIV-infected and noninfected women. AIDS Res Hum Retroviruses. 2013;29(1):30-4.
4. Pfaller MA, Andes DR, Diekema DJ, Horn DL, Reboli AC, Rotstein C, et al. Epidemiology and outcomes of invasive candidiasis due to non-albicans species of Candida in 2,496 patients: data from the Prospective Antifungal Therapy (PATH) registry 2004-2008. PLoS One. 2014;9(7):e101510.
5. Almirante B, Rodriguez D, Park B, Ayats J, Gimenez M, Saballs P, et al. Epidemiology and predictors of mortality in cases of Candida bloodstream infection: Results from population-based surveillance, Barcelona, Spain, from 2002 to 2003. J Clin Microbiol. 2005;43(4):1829-35.
6. Sendid B, Cotteau A, Francois N, D'Haveloose A, Standaert A, Camus D. Candiaemia and antifungal therapy in a French University Hospital: rough trends over a decade and possible links. BMC Infect Dis. 2006;6(80):1-9.
7. Bedini A, Venturelli C, Mussini C, Guaraldi G, Codeluppi M, Borghi V, et al. Epidemiology of candidaemia and antifungal susceptibility patterns in an Italian tertiary-care hospital. Clin Microbiol Infect. 2006;12(1):75-80.
8. Leon C, Ostrosky-Zeichner L, Schuster M. What's new in the clinical and diagnostic management of invasive candidiasis in critically ill patients. Intensive Care Med. 2014;40(6):808-19.
9. Caggiano G, Coretti C, Bartolomeo N, Lovero G, De Giglio O, Montagna MT. Candida Bloodstream Infections in Italy: Changing Epidemiology during 16 Years of Surveillance. Biomed Res Int. 2015;2015:256580.
10. Taj-Aldeen SJ, Kolecka A, Boesten R, Alolaqi A, Almaslamani M, Chandra P, et al. Epidemiology of candidemia in Qatar, the Middle East: performance of MALDI-TOF MS for the identification of Candida species, species distribution, outcome, and susceptibility pattern. Infection. 2014;42(2):393-404.
11. Trubiano JA, Leung VK, Worth LJ, Teh BW, Thursky KA, Slavin MA. Candida glabrata fungaemia at an Australian cancer centre: epidemiology, risk factors and therapy. Leuk Lymphoma. 2015:56(1):3442-4.
12. Yang ZT, Wu L, Liu XY, Zhou M, Li J, Wu JY, et al. Epidemiology, species distribution and outcome of nosocomial Candida spp. bloodstream infection in Shanghai. BMC Infect Dis. 2014;14:241.
13. Yapar N. Epidemiology and risk factors for invasive candidiasis. Ther Clin Risk Manag. 2014;10:95-105.
14. Pu S, Niu S, Zhang C, Xu X, Qin M, Huang S, et al. Epidemiology, antifungal susceptibilities, and risk factors for invasive candidiasis from 2011 to 2013 in a teaching hospital in southwest China. J Microbiol Immunol Infect [serie en Internet]. 2015 [citado 5 de mayo de 2015]. Disponible en: http://dx.doi.org/10.1016/j.jmii.2015.01.005
15. Wang L, Tong Z, Wang Z, Xu L, Wu Y, Liu Y, et al. Single-center retrospective study of the incidence of, and risk factors for, non-C. albicans invasive candidiasis in hospitalized patients in China. Med Mycol. 2014;52(2):115-22.
16. Soysa NS, Samaranayake LP, Ellepola NB. Diabetes mellitus as a contributory factor in oral candidosis. Diabet Med. 2005;23:455-9.
17. Al Mubarak S, Robert AA, Baskaradoss JK, Al-Zoman K, Al Sohail A, Alsuwyed A, et al. The prevalence of oral Candida infections in periodontitis patients with type 2 diabetes mellitus. J Infect Public Health. 2013;6(4):296-301.
18. Bassyouni RH, Wegdan AA, Abdelmoneim A, Said W, Abo Elnaga F. Phospholipase and Aspartyl Proteinase Activities of Candida Species Causing Vulvovaginal Candidiasis in Patients with Type 2 Diabetes Mellitus. J Microbiol Biotechnol. 2015;25(10):1734-41.
19. Peleg AY, Weerarathna T, McCarthy JS, Davis TM. Common infections in diabetes: pathogenesis, management and relationship to glycaemic control. Diabetes Metab Res Rev. 2007;23(1):3-13.
20. Nikolic DM. Effects of Candida on insulin secretion of human adult pancreatic islets and possible onset of diabetes. Br J Biomed Sci. 2014;71(2):73-8.
21. Wilke T, Boettger B, Berg B, Groth A, Mueller S, Botteman M, et al. Epidemiology of urinary tract infections in type 2 diabetes mellitus patients: An analysis based on a large sample of 456,586 German T2DM patients. Journal of Diabetes and its Complications. 2015 Nov-Dec;29(8):1015-23.
22. Lipsky BA, Aragon-Sanchez J, Diggle M, Embil J, Kono S, Lavery L, et al. IWGDF guidance on the diagnosis and management of foot infections in persons with diabetes. Diabetes Metab Res Rev [serie en Internet]. 2015 [citado 10 de mayo de 2015]. Disponible en: http://onlinelibrary.wiley.com/doi/10.1002/dmrr.2699/pdf
23. Atreja A, Kalra S. Infections in diabetes. J Pak Med Assoc. 2015;65(9):1028-30.
24. Bomberg H, Kubulus C, List F, Albert N, Schmitt K, Graber S, et al. Diabetes: a risk factor for catheter-associated infections. Reg Anesth Pain Med. 2015;40(1):16-21.
25. Nitzan O, Elias M, Chazan B, Saliba W. Urinary tract infections in patients with type 2 diabetes mellitus: review of prevalence, diagnosis, and management. Diabetes Metab Syndr Obes. 2015;8:129-36.
26. O'Toole P, Maltenfort MG, Chen AF, Parvizi J. Projected Increase in Periprosthetic Joint Infections Secondary to Rise in Diabetes and Obesity. J Arthroplasty [serie en Internet]. 2015 [citado 2 de junio de 2015]. Disponible en: http://dx.doi.org/10.1016/j.arth.2015.07.034
27. Bader MS, Lai SM, Kumar V, Hinthorn D. Candidemia in patients with diabetes mellitus: epidemiology and predictors of mortality. Scand J Infect Dis. 2004;36(11-12):860-4.
28. Martinez RF, Jaimes-Aveldanez A, Hernandez-Perez F, Arenas R, Miguel GF. Oral Candida spp. carriers: its prevalence in patients with type 2 diabetes mellitus. An Bras Dermatol. 2013;88(2):222-5.
29. Alayón A, Alvear C. Prevalencia de desórdenes del metabolismo de los glúcidos y perfil del diabético en Cartagena de Indias (Colombia), 2005. Salud Uninorte. 2006;22(1):20-8.
30. Al-Attas SA, Amro SO. Candidal colonization, strain diversity, and antifungal susceptibility among adult diabetic patients. Ann Saudi Med. 2010;30(2):101-8.
31. WHO. Definition and diagnosis of diabetes mellitus and intermediate hyperglycaemia [homepage en Internet]. Diabetes Programme. WHO; 2006 [citado 8 de noviembre 2012]. Disponible en: http://www.who.int/diabetes/publications/diagnosis_diabetes2006/en
32. Byadarahally Raju S, Rajappa S. Isolation and identification of Candida from the oral cavity. ISRN Dent. 2011;2011:487921.
33. Alvarez MI, Suarez BL, Caicedo LD. Isolation of Candida dubliniensis for the First Time in Cali, Colombia, and its Identification with Phenotyping Methods. Mycopathologia. 2009;167(1):19-24.
34. Foster KW, Ghannoum MA, Elewski BE. Epidemiologic surveillance of cutaneous fungal infection in the United States from 1999 to 2002. J Am Acad Dermatol. 2004;50(5):748-52.
35. Hospenthal DR, Beckius ML, Floyd KL, Horvath LL, Murray CK. Presumptive identification of Candida species other than C. albicans, C. krusei, and C. tropicalis with the chromogenic medium CHROMagar Candida. Ann Clin Microbiol Antimicrob. 2006;5:1.
36. Odds FC, Bernaerts R. CHROMagar Candida, a new differential isolation medium for presumptive identification of clinically important Candida species. J Clin Microbiol. 1994;32(8):1923-9.
37. Pineda G, Scollo K, Santiso G, Lehmann E, Arechavala A. Isolation of Candida dubliniensis in different clinical samples. Analysis of phenotypical methods to differentiate it from Candida albicans. Rev Argent Microbiol. 2008;40(4):211-7.
38. Duarte A, Márquez A, Araujo C, Pérez C. Modalidades del tubo germinal. Rev Soc Ven Microbiol. 2009;29(1):66-8.
39. Pincus DH, Orenga S, Chatellier S. Yeast identification-past, present, and future methods. Med Mycol. 2007;45(2):97-121.
40. Wadile RG, Bhate VM. Study of clinical spectrum and risk factors of neonatal candidemia. Indian J Pathol Microbiol. 2015;58(4):472-4.
41. Mullaoglu S, Turktas H, Kokturk N, Tuncer C, Kalkanci A, Kustimur S. Esophageal candidiasis and Candida colonization in asthma patients on inhaled steroids. Allergy Asthma Proc. 2007;28(5):544-9.
42. Thaweboon S, Thaweboon B, Srithavaj T, Choonharuangdej S. Oral colonization of Candida species in patients receiving radiotherapy in the head and neck area. Quintessence Int. 2008;39(2):e52-7.
43. Premkumar J, Ramani P, Chandrasekar T, Natesan A, Premkumar P. Detection of species diversity in oral candida colonization and anti-fungal susceptibility among non-oral habit adult diabetic patients. Journal of Natural Science, Biology, and Medicine. 2014;5(1):148-54.
44. Duque C, Correa E, Rendón J, Bedoya J, Hernández O. Frecuencia de portadores de Candida spp. en cavidad oral de pacientes diabéticos de Medellín. NOVA Publicación Científica en Ciencias Biomédicas. 2012;10(17):34-7.
45. Erkose G, Erturan Z. Oral Candida colonization of human immunodeficiency virus infected subjects in Turkey and its relation with viral load and CD4+ T-lymphocyte count. Mycoses. 2007;50(6):485-90.
46. Milnaric-Missoni E, Kalenic S, Vukelic M, De Syo D, Belicza M, Vazic-Babic V. Candida infections of diabetic foot ulcers. Diabetologia Croatica. 2005;34(1):29-35.
Recibido: 11 de junio de 2015.
Aprobado: 10 de noviembre de 2015.