Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Endocrinología
versión On-line ISSN 1561-2953
Rev Cubana Endocrinol vol.27 no.1 Ciudad de la Habana ene.-abr. 2016
Rev Cubana Endocrinol. 2016;27(1)
REVISIÓN BIBLIOGRÁFICA
El órgano adiposo, un arcoiris de regulación metabólica y endocrina
Adipose organ, a metabolic and endocrine regulating rainbow
Julio César Sánchez, César Ramón Romero, Laura Victoria Muñoz, Ricardo Alonso Rivera
Grupo de Fisiología Celular y Aplicada. Facultad Ciencias de la Salud. Universidad Tecnológica de Pereira. Risaralda, Colombia.
RESUMEN
Introducción: el adipocito es una célula multifuncional e interviene en la homeostasis sistémica a través de la producción de adipocinas. Con la presente revisión se pretende revisar el estado actual del conocimiento respecto al tejido adiposo, y proponer la consolidación del concepto de órgano adiposo.
Desarrollo: el tejido adiposo está constituido por diferentes tipos de adipocitos, no solamente el blanco y pardo, sino también el beige, el rosa y la célula estrellada hepática; todos ellos, además, se integran funcionalmente con células no grasas. Este hecho permite la evolución hacia el concepto de órgano adiposo, con funciones metabólicas, endocrinas y regulatorias, tanto a nivel sistémico como local en algunos órganos, como es el caso del adipocito rosa en la glándula mamaria lactante, y de la célula estrellada en el hígado. Estas funciones se ejercen a través de la producción de una gran diversidad de adipocinas, con efectos autocrinos y paracrinos complejos. La transdiferenciación entre diferentes tipos de adipocitos permite entender la importancia de la integración de las funciones en el órgano adiposo. La alteración de la homeostasis de estas células y el desequilibrio en la producción de adipocinas que ocurre como resultado de la obesidad, genera una debacle metabólica que conduce al síndrome metabólico.
Conclusiones: el concepto de órgano adiposo permite comprender integralmente la función de los adipocitos en el contexto de la regulación sistémica. La investigación sobre los diferentes tipos de adipocitos —y sobre el funcionamiento del órgano adiposo en conjunto— conducirá a un mejor entendimiento de estos procesos, tanto a nivel fisiológico, como patológico.
Palabras clave: órgano adiposo; adipositos; adipocinas.
ABSTRACT
Introduction: adipocyte is a multifunctional cell that intervenes in the systemic homeostasis through the production of adipokines. The present review intended to revise the present situation of the knowledge on the adipose tissue and to make proposals for the consolidation of the concept of adipose organ.
Development: the adipose tissue is made up of different types of adipocytes, not only the white and the brown but also the beige, the pink and the hepatic stellate cell. All of them are functionally integrated with non-fatty cells. This fact allows the evolution into the concept of adipose organ, with metabolic, endocrine and regulatory functions both at the systemic and local levels in some organs, as it happens in the rose adipocyte in the lactating mammary gland and in the hepatic stellate cells. These functions are performed through the production of a wide diversity of adipokines, with complex autocrine and paracrine effects. The transdifferentiation of several types of adipocytes allows understanding the importance of integrating these functions into the adipose organ. The alteration of homeostasis in these cells and the imbalanced production of adipokines that takes place as a result of obesity, generate metabolic chaos leading to metabolic syndrome.
Conclusions: the concept of the adipose organ allows understanding in a comprehensive way the function of adipocytes in the systemic regulation. This research on the different types of adipocytes - and on the functioning of the adipose organ as a whole - will lead to a better understanding of these processes at both the physiological and pathological level.
Keywords: adipose organ; adipocytes; adipokines.
INTRODUCCIÓN
Hasta los años 80s el tejido adiposo (TA) era considerado tan solo un reservorio de energía, pero esta perspectiva ha venido cambiando, en la medida en que la evidencia ha demostrado el importante papel que estas células cumplen en el metabolismo general y en la regulación de la función de diversos ejes endocrinos.1
Posterior a la identificación de la leptina, el adipocito es reconocido como una célula multifuncional,1 productora de sustancias bioactivas denominadas adipocinas. Las adipocinas intervienen en las funciones de otros órganos y tejidos, regulan la secreción de hormonas y participan en procesos tan complejos como la regulación térmica, la homeostasis de carbohidratos y lípidos y, por ende, la regulación metabólica general.2 Su relevancia es aún mayor si se considera que estas células son protagonistas en el complejo proceso de la obesidad y el síndrome metabólico (SM).3
La presente revisión tiene como objetivo presentar una visión actualizada de la fisiología de los adipocitos y del concepto de órgano adiposo, dada la significancia de este tejido en el proceso fisiopatológico de diversas enfermedades de alto impacto.
La búsqueda de la información se realizó mediante consulta de recursos bibliográficos, como las bases de datos ScienceDirect, Scielo, Medline y Pubmed, utilizando diferentes combinaciones de los descriptores siguientes en inglés: adiposetissue, adipocytes, brownadipocytes, whiteadipocytes, beige adipocytes, pinkadipocytes, stellatecells, itocells, adipokines, leptin, resistin, adiponectin. Se revisaron todos los artículos que pudieron ser recuperados completos, publicados entre 1980 y 2015, y se seleccionaron aquellos considerados relevantes.
DESARROLLO
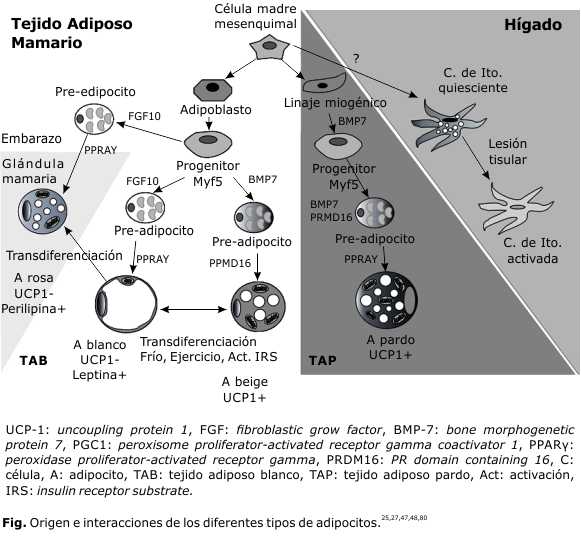
El TA tiene origen y desarrollo mesodérmico.4 Existen dos: blanco (TAB) o pardo (TAP), de acuerdo con el tipo de adipocito predominante; el tercer tipo, son los beige (ABg) o brite (término que mezcla las palabras inglesas brown y white, dado que se consideran células que comparten ciertas características con ambos), encontrados en el TAB en cantidades menores.
Los adipocitos rosa (AR) y las células estrelladas hepáticas (CEH), son tipos especiales que hacen parte de un tejido, en el cual no predominan como tipo celular (glándula mamaria e hígado respectivamente) (Fig.).
Además de los adipocitos, también se encuentran coexistiendo con ellos sus células precursoras, los preadipocitos, en distintos grados de diferenciación. Adicionalmente, tanto en TAB como en TAP, se encuentran en cantidades importantes diferentes tipos de células no grasas, tales como, células sanguíneas, células endoteliales, pericitos, fibroblastos, macrófagos y otras células del sistema inmune, integradas funcionalmente con los adipositos.5
En humanos, el TAB se encuentra distribuido a nivel visceral en diferentes depósitos grasos (mediastínico, omental, mesentérico, perigonadal, perirrenal y retroperitoneal), y a nivel subcutáneo en forma generalizada. El TAP, en cambio, se encuentra en regiones anatómicas particulares (peritiroidea, interescapular, supraclavicular y alrededor de algunos órganos, como los riñones y las glándulas suprarenales). Existen diferencias funcionales notables entre los diferentes tipos de adipocitos, aunque el origen celular pueda ser compartido o exista interconversión entre algunos de los subtipos (Fig.).
Adipocito blanco (AB)
El AB maduro se caracteriza por tener forma esférica, diámetros muy variables, y una única y voluminosa vacuola grasa que constituye más del 90 % de su volumen total (uniloculares).3 Su origen es mesodérmico. Posee una gran plasticidad estructural, pues el volumen de su vacuola grasa puede incrementarse o disminuir, dependiendo del estado funcional.6 Es el principal efector de los procesos de lipogénesis y lipólisis, regulados por diversos agentes hormonales y bajo la influencia de otros órganos y sistemas.7
El AB es también es el más importante productor de leptina, hormona reguladora de la producción de otras adipocinas en forma autocrina. A través de la leptina los ABs intervienen en la regulación de todos los ejes hormonales del organismo y en una multiplicidad de funciones, que van desde la regulación del apetito, hasta la regulación de la respuesta inmune. En la obesidad hay una sobreproducción de esta hormona por parte de un TAB hipertrófico, que ocasiona la debacle metabólica característica de esta enfermedad, y que lleva al SM, un grave problema de salud pública.8,9 La leptina producida por los ABs estimula la síntesis de resistina, cuya principal fuente son los macrófagos del TAB,10 e inhibe la de adiponectina en forma autocrina, y así empeora el desequilibrio metabólico en el SM.
Además, la proliferación de ABs se relaciona con la disminución de APs,11 fuente de adiponectina. La leptina promueve la producción de otros factores proinflamatorios, tales como, la misma resistina, el factor de necrosis tumoral alfa (FNTα) y la interleucina 6 (IL-6),12 factores inductores del estado de inflamación crónica sistémica que se encuentra en la obesidad. Los ABs también son productores de varias moléculas relacionadas con la cascada del complemento, como la acylationstimulatingproteína (ASP), incrementada en sujetos obesos, y promotora del almacenamiento de triglicéridos por medio de la estimulación del transporte de glucosa, la inhibición de la lipólisis y el aumento de la reesterificación de ácidos grasos.13 La adipsina, también conocida como factor D, otra proteína relacionada con el complemento, también es producida por los ABs; en humanos aumenta su expresión en la obesidad, mientras que en el ayuno, la caquexia y la lipodistrofia, disminuyen sus concentraciones.14
La visfatina, otra de las adipocinas producidas por los ABs, se incrementa en pacientes con SM,15 y ha sido postulada como un marcador de aterogénesis;16 sin embargo, en pacientes con obesidad de larga data e hiperleptinemia, sus niveles se encuentran disminuidos.17 Esta adipocina puede tener efectos hipoglucemiantes ejercidos por medio del mismo receptor de la insulina, pero uniéndose a este en un sitio diferente;18 también posee efectos vasodilatadores mediados por la vía del óxido nítrico,19 genera agregación leucocitaria, y tiene efectos angiogénicos y proinflamatorios directos, y por ende, puede generar disfunción endotelial.20 Los ABs periviscerales producen también la omentina, la cual incrementa la sensibilidad a la insulina,21 inhibe la producción de FNTα y posee efectos antiinflamatorios y cardioprotectores;22 su producción se disminuye en pacientes con SM y diabetes mellitus tipo 2 (DM 2).23,24
Adipocito pardo (AP)
En contraste con el AB, el AP posee varias vacuolas pequeñas de lípidos (multilocular), y tiene cantidades mayores de mitocondrias y de gránulos de glucógeno.25 Se caracterizan también por expresar las proteínas uncoupledprotein 1 (UCP-1), no expresadas por los AB.26 En humanos estas células son más abundantes en fetos y recién nacidos, y su cantidad disminuye gradualmente hacia la adultez, dependiendo de la exposición al frío y el ejercicio.27 Su principal función es la termogénesis, proceso de elevada eficiencia pues genera unos 300 vatios por kilogramo (w/kg), en contraste con otros tejidos que producen tan solo 1 w/kg.28 Su origen es también mesodérmico, pero independiente del AB,29 pues se origina en células Myogenic Factor 5+ (Myf5+).30 Hasta hace poco tiempo se asumía que la presencia de AP solo era significativa en fetos y recién nacidos, pero diversos estudios han demostrado su presencia en adultos;31 sin embargo, su papel en la homeostasis térmica tiende a disminuir a medida que aumenta la edad y el índice de masa corporal (IMC), o se desarrollan enfermedades como DM o SM.32 El papel de este tejido como regulador de la termogénesis se debe a la presencia de gran cantidad de mitocondrias y en su membrana interna, de las proteínas UCP-1,33 transportadores que permiten la translocación de protones hacia la matriz mitocondrial, aumentando la actividad de la cadena respiratoria, y por ende, la producción de energía, parte de la cual es disipada en forma de calor.34
Otras proteínas producidas por el AP, también involucradas en el proceso de termogénesis, son la deiodinasa tipo II (D2) de la tetrayodotironina (T4), reguladora de la tasa metabólica basal e inducible por la exposición al frío,35 y la proteína 1α activadora del receptor activado por el proliferador de peroxisomas (PGC1-α), cuya síntesis también es inducida por bajas temperaturas, y es fundamental para promover la expresión dereceptores activados por proliferadores de peroxisomas γ yα (PPARγ y α),36 y el dominio que contiene la proteína 16(PRDM16), proteína que promueve la diferenciación hacia APs.30,37
El AP produce adiponectina, hormona que aumenta la sensibilidad a la insulina en músculos, hígado y otros órganos, además de favorecer la oxidación de ácidos grasos.38 No obstante, la adiponectina puede reducir la producción de UCP-1 en APs, y disminuir así su potencial termogénico.39 Los APs también producen factor de crecimiento fibroblástico (FGF, fibroblastgrowth factor), particularmente los subtipos 16, 19 y 21.40 El FGF19 es un activador de la tasa metabólica y sensibilizador para la insulina. En ratones transgénicos, FGF19+ se favorece el crecimiento de TAP;41 el FGF16 es promotor mitogénico del TAP en las primeras etapas embrionarias,42 y el FGF21 activa varios genes relacionados con la termogénesis en roedores, que se asocian con activación de los receptores β adrenérgicos y el incremento en la producción de UCP-1 en el mismo tejido a través de un efecto autocrino.43,44 El FGF21, por su parte, activa la termogénesis y la lipólisis directamente, y aumenta la producción de adiponectina en APs humanos.45
Adipocito beige (ABg)
Este tipo de adipocito se desarrolla en lo que comúnmente se conoce como el proceso de “pardeamiento” (browning) o reclutamiento de APs en el TAB, a partir de ABs(transdiferenciación), por exposición a temperaturas bajas, o estimulación de receptores β3 adrenérgicos.46 Los ABgs también presentan vacuolas lipídicas múltiples, pero en menor cantidad que los APs (pauciloculares); estas células también son capaces de expresar UCP-1.47 Se desarrollan en el TAB, principalmente en la región inguinal.26
Los ABgs son también de origen mesodérmico, y presentan características comunes con los APs. No obstante, se ha demostrado que poseen orígenes distintos, ya que los ABgs son derivados de células Myogenic Factor 5- (Myf-5-) y comparten un ancestro común con los ABs;48 no obstante, representan un linaje diferente a estos.49 El término “brite” ha sido acuñado para denominar estos adipocitos que parecen proceder de los ABs, pero que adquieren características similares a los APs.47 La inducción de esta transdiferenciación representa una estrategia terapéutica potencial para el tratamiento de la obesidad,50 dado que los ABg o “brite” son también termogénicos y productores de adiponectina.51 Adicionalmente los ABgs producen FGF21,52 factor optimizador del consumo de oxígeno y favorecedor de la termogénesis. La leptina del AB, hallada también en cantidades menores en los ABgs, inhibe la transdiferenciación del AB al ABg. Los ABgs también son productores de quimerina, la cual también es inducida por el frío en ratones y favorece la termogénesis.53
Adipocito rosa (AR)
El AR es una célula secretora de leche, y fue denominado de esta forma en referencia a su existencia exclusiva en glándulas mamarias lactantes de los mamíferos hembras, y a la coloración rosada de estos órganos con tinciones comunes.54 Cumplen con la definición de adipocitos porque pueden almacenar grandes cantidades de grasa, son productores de adipocinas y están sometidos a regulación funcional por estas. Existe evidencia que sugiere que se originan por transdiferenciación de los ABs.55
En condiciones fisiológicas basales, el TAB ocupa 90 % del volumen de las mamas; durante el embarazo y la lactancia, los cambios hormonales promueven la expresión de PPARγ,56 e inducen un incremento del parénquima glandular, incluyendo a los AR, en reemplazo del TAB. Los AR son considerados un reservorio graso que sirve de sustrato a la producción de leche;54,57 y al terminar la lactancia, se reinicia el proceso de formación de nuevo TAB y la glándula mamaria vuelve a su estado basal.55
Los AR son productores de leptina,58 hormona promotora de la proliferación del epitelio mamario, y preventiva de la obesidad en las crías.59 También expresan la proteína S100b, que promueve la maduración del sistema nervioso central del neonato, es vasodilatadora y tiene efectos proinflamatorios.60
La perilipina B, una fosfoproteína que regula la lipólisis en las vacuolas grasas, se expresa abundantemente en los AR.61 En pacientes con obesidad actúa impidiendo la lipólisis inducida por TNFα, y sus niveles bajos se relacionan con la presencia de otras proteínas como la lipoproteín lipasa;62 adicionalmente se transmite de la madre al neonato, por la leche materna, para cumplir la misma función, por lo que adquiere un papel importante en la hidrólisis de los lípidos lácteos.63
Célula estrellada hepática (CEH-¿adipocito azul?)
La CEH, también conocida como célula de Ito, lipocito hepático o célula perisinusoidal, tiene un origen embriológico controversial, pero es más probable que su origen sea mesodérmico.64 Uno de los aspectos más relevantes de las CEH es su capacidad para expresar un fenotipo dual. El primer fenotipo es el quiescente, estado fisiológico de estas células, en el que poseen múltiples vesículas (multilocular) llenas de vitamina A y organelas pequeñas; constituyen entre 5 y 8 % de todas las células hepáticas. Se encuentran localizados en el espacio de Disse, subyacentes a las células endoteliales; poseen un citoplasma alargado y prolongaciones que interactúan con endotelio, células nerviosas, y hepatocitos. Estas células también liberan mediadores extracelulares, y poseen funciones bien definidas en la regulación de la homeostasis de la matriz extracelular.65
El segundo fenotipo es el llamado de activación, y se constituye en una célula altamente fibrogénica, como consecuencia de una estimulación paracrina a partir de células de Kupffer, hepatocitos y plaquetas, por una alteración metabólica o inflamatoria.66 Inicialmente su citoarquitectura se transforma, pierde las vesículas grasas y se incrementa la producción de desmina, proteína ácida fibrilar glial y algunas adipocinas; a medida que la lesión avanza hacia la cronicidad, su estructura se transforma a miofibrilar, con una alta producción de factor de crecimiento transformante β (TGFβ), FNTα e IL-1α, y adquisición de capacidad contráctil y actividad proinflamatoria.65
Todo lo anterior finalmente genera una alteración estructural y funcional del hígado, que desemboca en fibrosis hepática, fenómeno que es común a una serie de procesos inflamatorios secundarios a consumo de alcohol, obesidad extrema o infecciones hepáticas. En el desarrollo de este proceso se da la intervención de diferentes adipocinas, que establecen una comunicación cruzada entre los hepatocitos, las CEHs y los macrófagos, alterando la homeostasis de lípidos y generando resistencia a la insulina, así como una respuesta inmunológica aberrante, y finalmente fibrogénesis.67 Este fenómeno está comúnmente asociado a la obesidad y la hiperleptinemia, pues la leptina se encarga de promover la activación de la CEH, al inhibir la acción protectora para el desarrollo de fibrosis de la proteína ligadora de elementos reguladores de esterol 1c (SREBP-1c). En roedores, la catenina β, reguladora de la diferenciación de los adipocitos, inhibe la síntesis de leptina en CEHs y potencia la acción protectora de SREBP-1c.68 Adicionalmente, la leptina producida por la CEH activada altera la regulación de los niveles de glucosa del hepatocito.69
Otra adipocina con efectos desde y hacia este tejido es la resistina, cuyos niveles séricos se encuentran elevados en la fase temprana de la esteatosis hepática no alcohólica (EHNA), inicialmente en la CEH y luego a nivel sistémico. Sus niveles de expresión se correlacionan con el grado de esteatosis e inflamación hepáticas.70 Posee acción proinflamatoria a nivel hepático, al estimular directamente la activación del factor nuclear kappa β y las IL-1 y 5,71 y además una acción profibrótica, pues favorece la activación de la CEH.72
La adiponectina también es expresada por las CEH en estado quiescente.73 Esta adipocina posee actividades antifibróticas, pues disminuye los niveles de marcadores como la α actina de músculo liso (α-SMA), el factor de crecimiento transformante 1β (TGF-β1) y el inhibidor tisular de metaloproteinasa 1 (TIMP1), todos ellos marcadores de la fibrogénesis hepática;74 la adiponectina también inhibe la migración de las CEH, propiedad que está en relación con su actividad fibrogénica,75 y antagoniza los efectos profibróticos de la leptina en el hígado, originados en la CEH.76
La quemerina, otra adipocina que se incrementa en pacientes obesos, es también expresada por las CEH, pero en mucha menor cantidad que en los hepatocitos.77 EL FNTα, en sí mismo, también ha sido implicado en el desarrollo de EHNA. En modelos murinos el incremento de la producción de esta citosina, por parte de la CEH, promueve la fibrosis hepática, al incrementar los niveles de expresión de colágeno α1, α-SMA y TGF-β1.78 Adicionalmente, hay evidencia del incremento de la producción de visfatina en la CEH activada, efecto estimulante de la expresión de α-SMA y factor de crecimiento de tejido conectivo, así como de la producción de colágeno tipos 1 y 3.79
Las respuestas de las CEHs a diferentes adipocinas, y su potencial actividad proinflamatoria y reguladora del metabolismo, permiten integrarlas al órgano adiposo como un componente adicional, regulador de la función hepática, que responde ante estímulos sistémicos. De acuerdo con la tendencia a denominar los adipocitos con un color relacionado con su función y/o estructura, a la CEH se le podría asignar el azul, dada la coloración de la autofluorescencia, emitida por las gotas lipídicas cuando estas células son estimuladas a 328 nm.64
En la obesidad, un estado que cursa con hiperleptinemia, hiperresistinemia y adiponectinemia, se puede producir esteatosis, y posteriormente fibrosis hepática, como consecuencia de la regulación alterada ejercida por estas adipocina sobre las CEHs, no solo por los efectos de las hormonas producidas desde los ABs o APs, sino también por las producidas localmente.
CONCLUSIONES
El concepto de TA ha ido evolucionando hacia el de órgano adiposo, en la medida en que se han identificado diferentes tipos de adipocitos que se regulan mutuamente, y que, en algunos casos, pueden transdiferenciarse entre sí, dependiendo de diversos factores. Estas células, además, intervienen en la homeostasis metabólica sistémica y, en algunos tejidos, como la glándula mamaria y el hígado, logran un grado de especialización particular para la regulación de funciones específicas.
Esta concepción de órgano adiposo permite entender la importancia de los adipocitos en un contexto integral, y puede ayudar a comprender mejor los procesos fisiopatológicos en los cuales estas células son protagonistas, en particular, la obesidad y el SM.
La investigación en torno a la fisiología de los diferentes tipos de adipocitos, las adipocinas y los procesos regulatorios que permiten una función integrada de los diferentes componentes del órgano adiposo, permite una mejor comprensión de estos procesos fisiológicos y patológicos, y abre mucho más el panorama alrededor de estas células.
REFERENCIAS BIBLIOGRÁFICAS
1. Reyes J. Características biológicas del tejido adiposo: el adipocito como célula endocrina. Rev Méd Clín Condes. 2012;23(2):136-44.
4. Zuttion MSSR, Wenceslau CV, Lemos PA, Takimura C, Kerkis I. Células Madre de Tejido Adiposo y la Importancia de la Estandarización de un Modelo Animal para Experimentos Preclínicos. Revista Brasilera de Cardiología Invasiva. 2013;21(3):1-7.
6. Spiegelman BM, Enerback S. The adipocyte: a multifunctional cell. Cell Metab. 2006;4(6):425-7.
23. de Souza Batista CM, Yang RZ, Lee MJ, Glynn NM, Yu DZ, Pray J, et al. Omentin plasma levels and gene expression are decreased in obesity. Diabetes. 2007;56(6):1655-61.
24. Matsuo K, Shibata R, Ohashi K, Kambara T, Uemura Y, Hiramatsu-Ito M, et al. Omentin functions to attenuate cardiac hypertrophic response. J Mol Cell Cardiol. 2014;79C:195-202.
27. Esteve Ràfols M. Tejido adiposo: heterogeneidad celular y diversidad funcional. Endocrinología y Nutrición. 2014;61(2):100-12.
35. Martinez de Mena R, Scanlan TS, Obregon MJ. The T3 receptor beta1 isoform regulates UCP1 and D2 deiodinase in rat brown adipocytes. Endocrinology. 2010;151(10):5074-83.
43. Hondares E, Iglesias R, Giralt A, Gonzalez FJ, Giralt M, Mampel T, et al. Thermogenic activation induces FGF21 expression and release in brown adipose tissue. The Journal of Biological Chemistry. 2011;286(15):12983-90.
55. Morroni M, Giordano A, Zingaretti MC, Boiani R, De Matteis R, Kahn BB, et al. Reversible transdifferentiation of secretory epithelial cells into adipocytes in the mammary gland. Proc Natl Acad Sci USA. 2004;101(48):16801-6.
59. Palou A, Sanchez J, Pico C. Nutrient-gene interactions in early life programming: leptin in breast milk prevents obesity later on in life. Adv Exp Med Biol. 2009;646:95-104.
60. Gonçalves CA, Leite MC, Guerra MC. Adipocytes as an important source of serum S100B and possible roles of this protein in adipose tissue. Cardiovascular Psychiatry and Neurology. 2010;(2010):790431.
68. Zhai X, Yan K, Fan J, Niu M, Zhou Q, Zhou Y, et al. The beta-catenin pathway contributes to the effects of leptin on SREBP-1c expression in rat hepatic stellate cells and liver fibrosis. Br J Pharmacol. 2013;169(1):197-212.
79. Liang NL, Men R, Zhu Y, Yuan C, Wei Y, Liu X, et al. Visfatin: An adipokine activator of rat hepatic stellate cells. Molecular Medicine Reports. 2015;11(2):1073-8.
80. Cinti S. White, brown, and pink adipocytes: the extraordinary plasticity of the adipose organ. Eur J Endocrinol. 2014;170(5):R159-71.
Recibido: 12 de mayo de 2015.
Aprobado: 10 de noviembre de 2015.