Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Endocrinología
versión On-line ISSN 1561-2953
Rev Cubana Endocrinol vol.27 no.3 Ciudad de la Habana sep.-dic. 2016
ARTÍCULO ORIGINAL
Valor pronóstico de la hiperglucemia en hospitalizados por enfermedad cerebrovascular
Prognostic value of hyperglycemia in hospitalized patients suffering cerebrovascular diseases
Manuel Emiliano Licea Puig,I Julio César Cala CardonaII
ICentro de Atención al Diabético del Instituto Nacional de Endocrinología (INEN). La Habana, Cuba.
IIInstituto Nacional de Endocrinología (INEN). La Habana, Cuba.
RESUMEN
Antecedentes: la hiperglucemia en el paciente crítico se asocia a un mal pronóstico.
Objetivo: determinar la relación existente, entre la hiperglucemia y el pronóstico, de hospitalizados por enfermedad cerebrovascular con y sin diabetes tipo 2.
Métodos: estudio descriptivo, correlacional, de corte transversal. Se revisaron 570 historias clínicas de hospitalizados consecutivamente (años 2010-2012), por enfermedad cerebrovascular, en el Hospital Universitario "Comandante Manuel Fajardo", en La Habana. Se dividieron en 3 grupos: 1) sin antecedentes de diabetes tipo 2 con hiperglucemia en la primera glucemia en ayunas; 2) con diagnóstico conocido de diabetes tipo 2 previo; y 3) sin diabetes tipo 2 normoglucémicos. Las variables estudiadas fueron: clínicas, primera glucemia en ayunas, promedio de las glucemias durante la hospitalización, tratamiento antihiperglucémico de insulinoterapia (indicación y modalidad [convencional o dosis múltiples]), evolución de la diabetes y sus complicaciones, y se correlacionaron con el tipo de enfermedad cerebrovascular y el pronóstico.
Resultados: la enfermedad isquémica predominó significativamente sobre la hemorrágica en todos los grupos: 1) 77,2 %; 2) 91,6 %; y 3) 91,8 %. Se asoció a edades > 70 años (p= 0,002), al sexo femenino (p= 0,042) y al promedio de las glucemias durante la hospitalización (p= 0,000). El punto de corte de la primera glucemia en ayunas y el promedio de las glucemias durante la hospitalización fue para las complicaciones neurológicas de 7,3 mmol/L, para las extraneurológicas de 6,9 % y para la mortalidad de 7 mmol/L.
Conclusiones: la primera glucemia en ayunas y el promedio de las glucemias durante la hospitalización son indicadores de mal pronóstico en personas con enfermedad cerebrovascular.
Palabras clave: diabetes mellitus tipo 2; enfermedad cerebrovascular; pronóstico; primera glucemia en ayunas; hiperglucemia; insulinoterapia.
ABSTRACT
Background: presence of hyperglycemia in a critical patient is a sign of bad prognosis.
Objective: to determine the relationship between hyperglycemia and prognosis in hospitalized patients suffering cerebrobascular diseases with/without type 2 diabetes mellitus.
Methods: Cross-sectional, descriptive and correlational study which analyzed 570 clinical histories of hospitalized patients suffering cerebrovascular disease in the 2010-2012 period in "Comandante Manuel Fajardo" university hospital located in Havana. They were divided into 3 groups: 1) no history of type 2 diabetes mellitus with hyperglycemia seen in the first glycemia test on fasting 2) previous diagnosis of type 2 diabetes mellitus and 3) normoglycecimia without type 2 diabetes. The studied variables were clinical ones, first glycemia on fasting, glycemia average during the hospital stay, anti-hyperglycemia treatment based on insulin therapy (indications and modalities [conventional or multiple doses]), progression of diabetes and its complications; and they were correlated with type of cerebrovascular disease and prognosis.
Results: ischemic disease significantly predominated over the hemorrhagic disease in all the groups 1) 77.2 %, 2) 91.6 % and 3) 91.8 %. It was associated to ages over 70 years (p= 0.002), being female (p= 0.042) and glycemia average values during hospitalization (p= 0.000). The cutoff point of the first glycemia on fasting and the glycemia average values during hospitalization was 7.3 mmol/L for neurological complications, 6.9% for extra-neurological ones and 7 mmol/L for mortality.
Conclusions: first glycemia on fasting and the glycemia average values during hospitalization are bad prognosis indicators in patients with a cerebrovascular disease.
Keywords: type 2 diabetes mellitus; cerebrovascular disease; prognosis; first glycemia on fasting; hyperglycemia; insulin therapy.
INTRODUCCIÓN
La diabetes mellitus (DM) constituye un factor de riesgo (FR) independiente de enfermedad cerebrovascular (ECV), y se asocia a hipertensión arterial (HTA), dislipidemia y obesidad.1-3 El riesgo relativo (RR) de ictus isquémico en personas con DM oscila entre 1,8 y 6, y en el ictus hemorrágico (IH) la asociación es controversial.4,5
El Northern Manhattan Study (NOMAS) valoró la glucemia en ayunas en 3 298 ictus, y de los 572 que reportaban historia de DM, 338 (59 %) tenían glucemia en ayunas elevada.5,6 En las personas con ECV, la hiperglucemia es considerada un indicador de mal pronóstico, independientemente de tener o no DM. Lang y otros7 realizaron un estudio transversal y descriptivo en 265 pacientes ingresados por ECV, y comprobaron DM conocida en el 15,85 %, y la primera glucemia en ayunas (PGA) elevada se asoció a un mal pronóstico. Se ha relacionado el antecedente de DM con un peor pronóstico y riesgo aumentado de recurrencia tras el ictus,8 y se ha informado9 que los valores glucemia al ingreso (GI) hospitalario > 7,8 mmol/L se asocian a una mayor mortalidad.
Nos proponemos determinar la relación existente, entre la hiperglucemia y el pronóstico en personas hospitalizadas con ECV, con y sin DM 2.
MÉTODOS
Se realizó un estudio descriptivo, correlacional, de corte transversal basado en la información obtenida de la revisión de 570 historias clínicas (HC) de hospitalizados consecutivamente con el diagnóstico de ECV en el Hospital Universitario "Comandante Manuel Fajardo", en La Habana (1ro de enero de 2010 a 31 de diciembre de 2011). Se incluyeron sujetos con ECV (con y sin DM 2),10 y se excluyeron aquellas HC que no contaran con la información necesaria, o con errores de codificación. Los grupos de estudio fueron: 1) sin antecedentes conocidos de DM 2 con hiperglucemia en la PGA; 2) con diagnóstico conocido de DM 2 previo al ingreso hospitalario; y 3) sin DM 2, normoglucémicos.
Las variables estudiadas son: edad, sexo, hábito de fumar, antecedentes patológicos personales (ECV, DM, HTA y cardiopatía isquémica), presión arterial sistólica (PAS) y diastólica (PAD) y su control, presión de pulso (PP), PGA, promedio de las glucemias durante la hospitalización (PGDH), tipo de ECV (isquémico y hemorrágico), complicaciones neurológicas y extraneurológicas, evolución (egresado vivo o fallecido), estadía hospitalaria, causa directa de muerte, insulinoterapia durante la hospitalización (momento de indicación [primeras 24 h, 48 h y ≥ 72 h] y modalidad [convencional o intensiva]), así como la utilización de compuestos orales antidiabético (COA). En aquellos con DM 2 se precisó tiempo de evolución y presencia de complicaciones agudas, y en los hiperglucémico sin antecedentes de DM 2, se precisó el tratamiento antihiperglucemiante utilizado.
La glucemia se determinó por el método de la glucosa-oxidasa.11 Para el diagnóstico y tipo de ECV se adoptó la clasificación siguiente:11,12 A) isquemia cerebral: focal, a) accidente isquémico transitório [AIT], y b) infarto cerebral estabelecido); y B) hemorragia cerebral. La PGA y PGDH se estratificaron en: < 7 mmol/L, entre 7 y 11,1 mmol/L y > 11,1 mmol/L, y se relacionó con el pronóstico. Se consideró fumador cuando fumaban ≥ 1 cigarrillo diariamente, y exfumadores quienes abandonaron el hábito ≥ 6 meses antes de su inclusión. Se aceptó como portador de HTA, toda persona que refirió serlo y/o consumía medicamentos hipotensores, aunque las cifras de la presión arterial fueran normales en el momento del ingreso o durante la estadía hospitalaria. Para los criterios y clasificación de los valores de presión arterial se utilizaron los propuestos en el VII Report of Joint National Committee.12,13 La de PP se calculó de la forma siguiente: PAS-PAD (valores > 50 mmHg factor de riesgo vascular).
Para el análisis estadístico se utilizó el programa SPSS versión 12.0. Se realizó un análisis univariable, en el que se determinó la frecuencia y el porcentaje de cada variable categórica y la media aritmética, junto con la desviación estándar (DE) de las variables cuantitativas. En todos los casos se comprobó la distribución de la variable frente a los modelos teóricos, y se contrastó la hipótesis de homogeneidad de variancias. Se consideraron significativas las diferencias encontradas con una probabilidad de error ≤ 5 % (p≤ 0,05). Para el hallazgo de los valores p y comprobar la asociación entre variables categóricas, se utilizó la prueba de chi2, y la asociación entre variables cuantitativas; y el desarrollo de eventos fatales (muerte) o no fatales (egresado vivo), se objetivó mediante la prueba de la t de Student o el análisis de la varianza, según el número de categorías de la variable en estudio.
Se obtuvieron las medias aritméticas y los DE de las variables cuantitativas (edad, PAS, PAD, PP, estadía hospitalaria, evolución de la DM), así como el promedio de los valores de PGDH, PGA y la distribuciones de frecuencia de las variables cualitativas (sexo, hábito de fumar, HTA, antecedentes personales [ECV, DM, HTA, y cardiopatía isquémica]), tratamiento de la DM, complicaciones agudas de la DM (hipoglucemia, cetoacidosis, coma hiperosmolar, acidosis láctica), complicaciones de la ECV (neurológicas y extraneurológicas) y la causa de muerte. Se realizaron tabulaciones cruzadas de las variables cualitativas con la presencia -o no- de hiperglucemia, y la utilización -o no- de tratamiento intensivo con insulina, utilizando la prueba de chi2 para determinar la significación estadística de la posible asociación. Los valores promedio de las variables cuantitativas entre los 3 grupos se compararon mediante análisis de varianza de una vía; y entre los que presentando hiperglucemia reciben tratamiento intensivo con insulina, y los que no lo reciben, mediante la el test de Student para muestras independientes. Los grupos se asociaron con la con la edad, tiempo de evolución de la DM, PAS, PAD; y la PP (PAS-PAD) se evaluaron mediante el coeficiente de correlación de Pearson. Se establecieron los valores de corte de la PGA y el promedio de los valores del PGDH. Se aplicó análisis de regresión logística en variables de riesgo asociadas (edad, sexo y promedio de la PGA y del PGDH).
Por tratarse de una investigación en la que solo se utilizarán los datos existentes en las HC, con un interés puramente científico y con estricta confidencialidad, no se violó ningún principio ético. Este proyecto fue discutido y aprobado por la Comisión de Ética de la Investigación de nuestra institución.
RESULTADOS
De la totalidad de la muestra 158 (27,7 %) pertenecían al grupo 1, 155 (27,1 %) al grupo 2, y 257 (45,0 %) al grupo 3. Los eventos isquémicos en los hombres se observaron en el grupo 1 en el 73,8 %, en el 2 en el 93,1 % y en el 3 en el 93,4 %; y en las mujeres, en el grupo 1, en el 79,4 %, en el 2 en el 90,7 %, y en el 3 en el 90,4 %. Los eventos hemorrágicos en los hombres fueron: en el grupo 1 en el 26,2, en el 2 de 6,09, y en el 3 el 11,7 %. En las mujeres, en el grupo 1, fue del 26,6, en el 2 de 9,3 y en el 3 en 9,6 %; con una diferencia estadísticamente significativa (isquémicos versus hemorrágicos) para los hombres (p= 0,000) y para las mujeres (p= 0,021).
La edad para el grupo 1 fue de 75,35±13,52, para el 2 de 75,55±9,53 y para el 3 de 71,78±14,56 años, con una diferencia significativa de p= 0,004. Los valores de PAS fueron para el grupo 1 de 147,75±32,13, para el 2 de 142,70±31,27 y para el 3 de 141,43±30,17 mmHg, sin diferencias significativas entre grupos (p= 0,12). Los valores de la PAD fueron para el grupo 1 de 85,79±15,35, para el 2 de 82,66±15,18 y para el 3 de 83,43±15,65 mmHg, sin diferencias significativas (p= 0,16). La PP fue para el grupo 1 de 62,08±22,99, para el 2 de 62,43±22,55 y para el 3 de 58,0±21,56 mmHg, sin diferencias significativas (p= 0,176). El tiempo de evolución de la DM fue de 15,10±9,67 años.
Fue más frecuente la ECV en aquellos con ≥ 60 años en los tres grupos. El grupo 2 se asoció significativamente con edades de 70-79 años, con una diferencia estadísticamente significativa de p= 0,000.
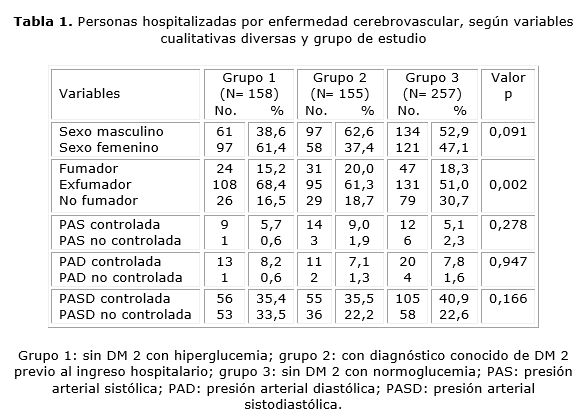
Predominó el sexo femenino sobre el masculino en el grupo 1 (61,4 versus 38,8 %); en el 2, 62 versus 37,4 %; y en el 3, 52,9 versus 47,1 %, sin diferencias estadísticamente significativas (p= 0,091). Los exfumadores y los no fumadores predominaron significativamente en los tres grupos (p= 0,002). En el grupo 1 la PAS estuvo controlada en el 5,7, y no controlada en el 0,6 %; en el 2, estuvo controlada en el 9 y no controlada en el 1,9 %; y en el 3 controlada en el 5,1, y no controlada en el 2 %, sin diferencias significativas (p= 0,278). La PAD en el grupo 1 estuvo controlada en el 8,2 y no controlada en el 0,6 %; en el 2, estuvo controlada en 7,1 y no controlada en el 1,3 %; y en el 3 estuvo controlada en el 7,8, y no controlada en el 1,6 %, sin diferencias significativas (p= 0,947). La presión arterial sistodiastólica (PASD), en el grupo 1 estuvo controlada en el 35,4, y no controlada en el 33,5 %; en el 2, estuvo controlada en el 35,5 y no controlada en el 23,2 %; y en el 3 estuvo controlada en el 40,9 y no controlada en el 22,6 %, sin diferencias significativas al comparar los tres grupos (p= 0,166) (tabla 1).
El antecedente de HTA estuvo presente en el grupo 1 en el 91,1, en el 2 en el 83,9, y en el 3 en el 89,5 %, sin diferencias significativas entre los grupos (p= 0,102). El antecedente de cardiopatía isquémica en el grupo 1 fue de 30, en el 2 en el 26,8 y en el 3 en el 27,4 %, sin diferencias significativas entre grupos (p= 0,518). El antecedente de ECV se confirmó en el 29,1 del grupo 1, en el 23,2 en el 2 y en el 19,5 % en el 3, sin diferencias significativas entre grupos (p= 0,077). El tiempo de evolución de la DM 2 (grupo 2) fue de 0-4 años en el 9, de 5-9 en el 17,4, de 10-14 en el 27,8, de 15-19 en el 14,2 y ≥ 20 años en el 31,6 %. Predominó el tratamiento con insulina (35,5 %), seguido de dieta solamente (30,3 %), y ninguno (23,2 %). La monoterapia oral se empleó en el 7,8 y la combinada el 3,1 %. El tratamiento convencional con insulina solo se indicó en el grupo 2 (36,1 %), y en ninguno intensivo. Se indicó a las 24 h en el 32,2, a las 48 en el 2,6 y a las ≥ 72 en el 1,3 %. En 63,9 % no se utilizó insulina. Solo un caso presentó hipoglucemia no grave.
Cuando la PGA fue < 7 mmol/L la hipertensión endocraneana se presentó en el 3,5 %, entre 7-11,1 mmol/L se observó en el 22,2, y cuando fue >11,1 mmol/L, se constató en 13,3 %, con una diferencia estadísticamente significativa de p= 0,000. Cuando la PGA fue < 7 mmol/L se confirmó bronconeumonía en el 17,5 %, entre 7-11 mmol/L en el 30,4 y cuando fue > 11,1 mmol/L en el 36,7 %, con una diferencia estadísticamente significativa de p= 0,001. La sepsis urinaria se observó en el 6,9 % cuando la PGA fue < 7 mmol/L, entre 7-11 mmol/L en el 5,9 %, y en aquellos con > 11,1 mmol/L en el 3,3 %, sin diferencias significativas (p= 0,711) (tabla 2).
Cuando la PGDH fue < 7 %, la hipertensión endocraneana se presentó en el 4 %, cuando fue de 7-11,1 mmol/L en el 19,9, y cuando fue > 11,1 mmol/L en el 15,6 %, con una diferencia significativa de p= 0,000. La bronconeumonía se constató en el 16,7 % cuando el PGDH fue < 7 mmol/L, cuando fue de 7-11,1 mmol/L en el 31,6 y cuando fue >11,1 mmol/L fue de 40,6 %, con una diferencia significativa de p= 0,000 (tabla 3).
La estadía hospitalaria (días) fue en el grupo 1: < 7 en el 55,1, de 7-13 en el 29,7, de 14-20 en el 10,8, de 21-27 en el 3,2, y ≥ 28 días de 1,3 %; en el 2: < 7 en el 51,6, de 7-13 en el 34,8, de 14-20 en el 10,8, de 21-27 en el 2,6, y ≥ 28 días en el 0,6 %; y en el 3: < 7 en el 57,6, de 7-13 en el 31,9, de 14-20 en el 8,6, de 21-27 en el 2,5 y ≥ 28 días en el 0 %.
Las causas directas de muertes mostraron que las ECV fueron la causa en el grupo 1 en el 8,2 %, en el 2 en el 10,3 y en el 3 en el 7 %. La bronconeumonía lo fue en el 11,4 % en el grupo 1, en el 5,8 en el 2 y en el 1,9 % en el 3. Por su parte, la hipertensión endocraneana fue la causa de muerte en el 14,6 % en el grupo 1, en el 10,3 en el 2 y en el 2,7 % en el 3.
Egresó vivo el 54,4 % del grupo 1, el 65,8 en el 2, y el 82,9 % en el 3, con una diferencia significativa de p= 0,000. En el grupo 1 falleció el 45,6 %, en el 2 el 34,2 y en el 3 el 17,1 %, con una diferencia estadísticamente significativa de p= 0,000.
Atendiendo a la PGA, egresaron vivos en el grupo 1 el 13,1 % cuando el valor < 7 mmol/L, el 22,2 cuando estuvo entre 7-11,1 mmol/L y el 10 % cuando fue > 11,1 mmol/L. Fallecieron cuando los valores fueron < 7 mmol/L el 4,2 %, cuando estuvieron entre 7-11 mmol/L el 36,3 y cuando fue > 11,1 mmol/L el 20 %. En el grupo 2 egresaron vivos el 13,8 % cuando el valor promedio de la PGA fue < 7 mmol/L, el 25,9, cuando estuvo entre 7-11,1 mmol/L, y el 36,7 % cuando fue > 11,1 mmol/L. Fallecieron cuando los valores fueron < 7 mmol/L el 5,4 %, cuando estuvieron entre 7-11,1 mmol/L el 15,6 y el 33,3 % cuando fue > 11,1 mmol/L. En el grupo 3 egresaron vivos el 52,6 % cuando la glucemia fue de < 7 mmol/L, y no existieron pacientes con glucemias entre 7-11,1 mmol/L y >11,1 mmol/L. Fallecieron cuando los valores de glucemia fueron < 7 mmol/L el 10,9 %.
Atendiendo al PGDH egresaron vivos en el grupo 1: el 14,4 % con valores < 7 mmol/L, el 19,1 cuando estuvo entre 7-11,1 mmol/L y el 6,3 % cuando fue > 11,1 mmol/L. Fallecieron cuando los valores fueron < 7 mmol/L el 4,5 %, cuando estuvieron entre 7-11 mmol/L el 19,1 y cuando fue > 11,1 mmol/L el 6,3 %. En el grupo 2 egresaron vivos el 13,2 % cuando el valor promedio fue < 7 mmol/L, el 25,9, cuando estuvo entre 7-11,1 mmol/L y cuando fue > 11,1 mmol/L fue del 25 %. Fallecieron cuando los valores fueron < 7 mmol/L el 4 %, cuando estuvieron entre 7-11,1 mmol/L el 14,7 y el 53,1 % cuando fue > 11,1 mmol/L. En el grupo 3 egresaron vivos el 53 % cuando la glucemia fue de < 7 mmol/L, y no existieron pacientes con glucemias entre 7-11,1 mmol/L y > 11,1 mmol/L. Fallecieron cuando los valores de glucemia fueron < 7 mmol/L el 10,9 %.
Las causas de muerte en los tres grupos según el valor de la PGA, mostró que la hipertensión endocraneana fue la causa directa de muerte en el 12,32 % cuando el promedio fue < 7 mmol/L, en el 42,46 cuando fue de 7-11,1 mmol/L, y cuando fueron > 11,1 mmol/L fue de 37,5 %, con una diferencia estadísticamente significativa de p= 0,00 (tabla 4).
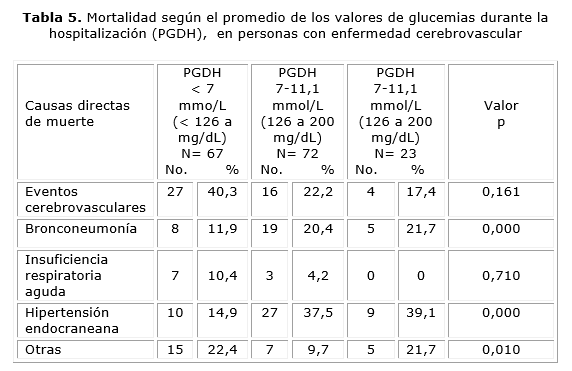
Las causas de muerte en los tres grupos, según el PGDH, mostraron que la bronconeumonía fue la causa en el 11,9 % en aquellos con < 7 mmol/L, en el 26,4 cuando fue de 7-11,1 mmol/L, y en el 21,7 % cuando fueron > 11,1 mmol/L, con una diferencia estadísticamente significativa de p= 0,000. La hipertensión endocraneana fue la causa en el 14,9 % en aquellos con < 7 mmol/L, en el 37,5 cuando fue de 7-11,1 mmol/L y en el 39,1 % cuando los valores fueron > 11,1 mmol/L, con una diferencia significativa de p= 0,000 (tabla 5).
El punto de corte de los valores de la PGA y el PGDH fue para las complicaciones neurológicas (7,3 mmol/L), para las extraneurológicas 6,9 %, y para la mortalidad de 7 mmol/L. El análisis de regresión logística confirmó cómo fueron variables de riesgo asociadas la edad (p= 0,002), el sexo femenino (p= 0,042) y el promedio de la glucemia durante la hospitalización (p= 0,000).
DISCUSIÓN
La ECV es más frecuente en edades avanzadas (85 % isquémicos versus 15 % hemorrágicos).13,14 En este estudio prevalecieron los eventos isquémicos, posiblemente relacionados con el predominio de personas con > 70 años de edad. Los eventos hemorrágicos fueron más frecuentes en el sexo femenino, lo que coincide con otros autores.14,15
En la DM 2 la incidencia de ictus es de 2 a 6 veces superior a la de la población general, el riesgo relativo (RR) aumenta con la edad (40-60 años), y el 9,1 % de las recurrencias son atribuidas a la DM.15,16 Otros factores de riesgo (FR) de ECV son: el tabaquismo, los antecedentes personales y familiares de ECV, la HTA, la cardiopatía isquémica, la dislipidemia y la obesidad.16,17 El RR de ictus isquémico en la DM oscila entre 1,8 y 6,8, y la asociación con el hemorrágico es controversial.18 Estudios de seguimiento, han confirmado que la DM aumentó el RR de ictus en 2,2.19 Otros informan, una incidencia de ictus isquémico dos veces mayor en sujetos con DM,20 y que esta se considera predictora de estadía hospitalaria prolongada, discapacidad y determinante de muerte.
En Cuba, la incidencia de ECV entre la tercera y cuarta décadas de la vida, es de 3 por cada 10 000 habitantes, y entre la octava y novena décadas, aumenta a 300 por cada 10 000 habitantes.20,21 El predominio del sexo femenino, es relevante en las personas con ECV (1,2 a 2,4 veces).22,23 Estudios en poblaciones afronorteamericanos y blancas, muestra que, en aquellos con 55-64 años, la tasa es mayor en los negros.24 Nosotros no incluimos en este estudio la variable raza, por ser la población cubana muy heterogénea y mestiza.
El hábito de fumar es un FR para la ECV, mayor en las mujeres.25 En este trabajo no confirmamos esta asociación (predominaron exfumadores y no fumadores). Otros FR de ECV (sedentarismo, dislipidemia, dieta y consumo de alcohol) no fueron evaluados en este estudio, por falta de la información en las HC.
El riesgo de desarrollar ECV se duplica por cada incremento de 10 mmHg de la PAD y disminuye un 40-50 % con descensos de 5 o 6 mmHg.26 La PAS >180 mmHg en las primeras 6 h de un evento isquémico, es un predictor independiente de mal pronóstico funcional al egreso, y a los 3 meses al alta.27
En este estudio, se confirmaron valores de PAS elevados, sin diferencias significativas entre grupos, ni con la presencia de hiperglucemia. La PP fue ≥ 50 mmHg en la mayoría, y particularmente en los hiperglucémicos. Un tiempo de evolución de la DM > 10 años se observa en la mayoría de los afectados de ECV,28 lo que se constató en este trabajo.
Se ha informado que la estadía hospitalaria en sujetos con ECV, fue de 4 a 7 días en los egresados vivos, y de 4 a 14 días en los fallecidos,29 lo que coincide con los resultados de este trabajo.
El NOMAS6 incluyó 572 sujetos con DM, luego del seguimiento de 6,5 años, aquellos con PGA > 7 mmol/L, tuvieron mayor riesgo de ECV y de otros eventos vasculares, y cuando fue < 7 mmol/L no tuvieron incremento en el riesgo ni de otros eventos vasculares.
En los que sufren un ictus, entre el 43 y el 68 % tienen hiperglucemia.30,31 Un estudio prospectivo y multicéntrico informa que el 27 % presentó glucemias > 8 mmol/L. La mayoría de los que sufren un ictus tienen una regulación anormal de la glucosa.32 Se ha informado un aumento de la glucemia en las primeras 8 h (50 % de las personas sin DM y del 100 % con DM), seguido de un decremento entre las 14 y 16 h, y un segundo pico (fase tardía) entre las 48 y 88 h en aquellos con DM. La hiperglucemia en la fase aguda del ictus en sujetos sin DM el RR de muerte se triplica.33 El presente estudio confirmó la PGA elevada en personas sin antecedentes de DM, lo que evidencia su alta frecuencia y valor pronóstico, independientemente de la edad, la gravedad y el subtipo de evento; en particular, en aquellos con DM.
Se confieren a la hiperglucemia en el curso de la ECV34 valor pronóstico a corto y largo plazo. Aún se debate, en qué rango se debe mantener la glucemia y cuándo indicar insulina (convencional o intensiva).34-36 Algunos plantean que con glucemia < 10 mmol/L el tratamiento intensivo no ofrece beneficios,37 y que la reducción intensiva de la glucemia en ingresados en Unidades de Cuidados Intensivos (UCI), aumenta la mortalidad, al compararlos con el tratamiento convencional hasta lograr cifras diana de 8,3 mmol/L.38 Con la modalidad intensiva se incremente el riesgo de hipoglucemia. A pesar de lo señalado, la insulina reduce el daño en la isquemia focal,39 modula la inflamación mediante la inhibición de las citocinas y la producción de radicales libres, lo que mejora la función endotelial.
En este estudio solo un bajo porcentaje de pacientes recibió tratamiento con insulina. Pensamos que el manejo antihiperglucemiante fue inadecuado en general, y en particular, el uso de insulina y la modalidad empleada. Además, no está justificado el tratamiento con dieta solamente, ni con drogas orales en las personas hospitalizadas por ECV con hiperglucemia, independientemente de que tengan DM o no.
En el presente estudio se confirmó solo el antecedente de DM 2 en aquellos con diagnóstico previo de DM 2 al ingreso, lo que hace pensar que en el grupo sin estos antecedentes con hiperglucemia, la causa probablemente fuera por el estrés. Otros antecedentes no fueron relevantes, a excepción de la HTA presente en los tres grupos. Las complicaciones neurológicas o sistémicas, se describen entre el 85-95 %;40 daño neurológico y sistémico, la estadía hospitalaria, los costos y la calidad de vida al dejar secuelas invalidantes, e influir en la mortalidad a corto y largo plazo.
En este estudio se confirmó que las cifras > 7 mmol/L de la PGA y del PGDEH se asociaron significativamente a la presencia de hipertensión endocraneana y bronconeumonía. Estos resultados, le confieren a la hiperglucemia valor como marcador de mal pronóstico.
La mortalidad en la ECV depende de varios factores (edad y la condición de salud previa),41 y es de 14-24 %, más frecuente en los primeros 30 días, independientemente del sexo, con una alta tasa de recurrencia, y mayor en el ictus aterotrombótico de origen extracraneal (8,8 %).42 La mortalidad hospitalaria es de alrededor de 15-20 % para eventos isquémicos y de 40 % para los hemorrágicos.43
Se ha confirmado que por cada 1 % de aumento en los niveles de HbA1c, aumenta en 1,37 veces el riesgo de morir por ictus, y como las principales causas directas de muerte las ECV, la bronconeumonía y la hipertensión endocraneana, que predominaron en aquellos con hiperglucemia.
Este trabajo muestra que la mayoría de los sujetos con normoglucemia egresaron vivos, hubo mayor cantidad de fallecidos en aquellos con hiperglucemia (PGA > 7 mmol/L y del PGDH entre 7-11,1 mmol/L), y confirma su valor pronóstico.34,40 La mortalidad en los hiperglucémicos fue < 50 % de los casos.
Se concluye que la hiperglucemia (con o sin DM 2) es frecuente en sujetos con ECV, y que la PGA y el PGDH se asocian a un mal pronóstico; pero no influyen en la estadía hospitalaria. El pequeño número de personas tratadas con insulina convencional no permite establecer una relación con el pronóstico. La hipertensión endocraneana y la bronconeumonía constituyen las principales causa de muerte en los sujetos con hiperglucemia, y en los normoglucémicos las ECV. Fueron más frecuentes los eventos isquémicos, independientemente de la presencia o no de hiperglucemia. La mayor edad (> 70 años), los valores elevados de la PAS, PAD, PP y el sexo femenino, son FR asociados a la ECV, independientemente de la presencia de hiperglucemia o no. Como limitación del estudio se señala que la información fue obtenida de los datos de la historia clínica.
Conflicto de intereses
Los autores declaran no tener conflicto de intereses en la realización del estudio.
REFERENCIAS BIBLIOGRÁFICAS
1. Zevir J. Patología vascular cerebral isquémica. En: Golman L, Schaffer A, Armitage A, Arozen N, Rustgi L. Cecil Goldman Tratado de Medicina Interna. 24ed Vol. 2. Madrid: Editorial Elsevier Saunder; 2013. p. 2314-24.
2. Saposnik G, Del Brutto OH. Stroke in South America: a systematic review of incidence, prevalence, and stroke subtypes. Stroke. 2003;34:2103-7.
3. Cuba. Misap. Anuario Estadístico de Salud-2012. Dirección Nacional de Registros Médicos y Estadísticas de Salud. La Habana; 2013.
4. Nerving B, Kissela B. The global burden of stroke and need for a continuum of care. Neurology. 2013;80(suppl.2):S5-S12.
5. American Diabetes Association. Standards of Medical Care in Diabetes 2009. Diabetes Care. 2009;32(suppl 1):S13-S61.
6. Boden-Albala B, Cammack S, Wang C, Rundek T, Elkind M. Diabetes, fasting glucose levels, and risk of ischemic stroke and vascular events. Finding from the Northern Manhattan Study (NOMAS). Diabetes Care. 2008;31:1132-7.
7. Lang J, Licea ME, Borges R, Revilla R, Reina A. La diabetes mellitus y su relación con la enfermedad cerebrovascular: estudio de 265 casos. Rev Cubana Endocrinol. 1992;3:122-32.
8. Méndez M, Dubois C, Sinnaeve P, Piessens J, Desmet W. La hiperglucemia de ingreso se asocia a mayor mortalidad en personas con IAM y supra desnivel del ST sometidos a angioplastia primaria. Rev Chilena Cardiol. 2006;25:253-8.
9. Sánchez Ch. Accidentes cerebrales vasculares. En: Farrera/Rosman. Medicina Interna. XIIed Vol. 2. Madrid: Editorial Elsevier; 2012. p. 1334-47.
10. American Diabetes Association. Standards of Medical Care in Diabetes-2013. Classification and diagnosis. Diabetes Care. 2013;36(suppl 1):S11.
11. Trider P. Determination of glucose in blood using glucose-oxidase with alternative oxygen acceptor. Ann Clin Biochem. 1969;6:24-7.
12. Romero B, Aguilera JM, Castela A. Enfermedad cerebrovascular. Doyma. 2007;9(72):4581-8.
13. The Seventh Report of the Joint National Committee on Prevention, Detection and Treatment of High Blood Pressure. Hypertension. 2003;42:1206-25.
14. Sánchez LJ, Rodríguez RI, Díaz DM. Ataque transitorio de isquemia, el heraldo del ictus. Rev Cubana Plantas Medicinales. 2012;31:108-22.
15. Blanco M, Rodríguez-Yanes M. Ataque isquémico transitorio y riesgo de trombosis cerebral en pacientes con diabetes: prevención y tratamiento. Av Diabetol. 2010;26:403-7.
16. Eckel RH, Kahn R, Robertson RM, Rizza RA. Preventing cardiovascular disease and diabetes: a call to action from the American Diabetes Association and the American Heart Association. Circulation. 2006;113:2943-6.
17. Fernández L, Díaz N, Guevara IM. Estudio de factores de riesgo de la enfermedad cerebrovascular en el Policlínico Docente "Doctor Carlos J. Finlay". Rev Cubana Med Gen Integr [serie en Internet]. 2004 Feb [citado 19 de octubre de 2013];20(1). Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0864-21252004000100005&lng=es&nrm=iso&tlng=es
18. Kissela BM, Lhoury J, Kleindorfer D, Woo D, Schneider A, Alwell K, et al. Epidemiology of Ischemic Stroke in Patients With Diabetes. The Greater Cincinnati/Northern Kentucky Stroke Study. Diabetes Care. 2005;28:355-9.
19. Folsom AR, Rasmussen ML, Chambless LE, Howard G, Cooper LS, Schmidt MI, et al; For The Atherosclerosis Risk In Communities (ARIC) Study Investigators. Prospective Associations of Fasting Insulin, Body Fat Distribution and Diabetes with Risk of Ischemic Stroke. Diabetes Care. 1999;22:1077-83.
20. Rodríguez BL, D'Agostino R, Abbott RD, Kagan A, Burchfiel CM, Yano K, et al. Risk of hospitalized stroke in men enrolled in the Honolulu Heart Program and the Framingham Study: a comparison of incidence and risk factor effects. Stroke. 2002;33:230-6.
21. Rodríguez JM, Polanco F, Olivera LO, Pérez JL, Fabelo CJ, Rodríguez I. Comportamiento de la enfermedad cerebrovascular en un período de dos años. Rev Cubana Med Milit [serie en Internet]. 2006 Dic [citado 19 de octubre de 2013];35(4). Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0138-65572006000400003&lng=es&nrm=iso&tlng=es
22. Blacher J, Evans A, Arveiler D, Amouyel P, Ferrier's J, Bingham A, et al. Residual cardiovascular risk in treated hypertension and hyperlipidemia: the PRIME Study. J Human Hypertens. 2010;24:19-26.
23. Weng WC, Huang WY, Su FC, Chien YY, Wu CL, Lee TH, et al. Less favorable neurological recovery after acute stroke in patients with hypercholesterolemia. Clin Neurol Neurosurg. 2013:S0303-8467(13):00041-00043.
24. Morrish NJ, Wang SL, Stevens LK, Fuller JH, Keen H. Mortality and causes of death in the WHO Multinational Study of Vascular Disease in Diabetes. Diabetologia. 2001;44(suppl. 2):S14-21.
25. Paul SL, Thrift AG, Donnan GA. Smoking as a crucial independent determinant of stroke. Tob Induc Dis. 2004;2:67-80.
26. Rodero L, González R. Accidente cerebrovascular. Concepto. Clasificación. Valoración sindrómica. Epidemiología. Impacto socioeconómico. Medicine-Programa de formación Médica Continuada Acreditada. 2003;8:4903-10.
27. Dorjgochoo T, Shu XO, Zhang X, Li H, Yang G, Gao L, et al. Relation of blood pressure components and categories and all-cause, stroke and coronary heart disease mortality in urban Chinese women: A population-based prospective study. J Hypertens. 2009;27:468-75.
28. Valdés E, Bencosme N. Las complicaciones macrovasculares y su relación con algunas variables clínicas y bioquímicas en diabéticos tipo 2. Rev Cubana Endocrinol. 2010;21:256-68.
29. Aruza A, Ruiz A. Enfermedad vascular cerebral. Rev Fac Medina UNAM. 2012;55:11-21.
30. Fernández O, Buergo MA, López M. Hiperglicemia post-ictus. Rev Cubana Neurol Neurocir. 2012;2:144-9.
31. Poppe AY, Majumdar SR, Jeerakathil T, Ghali W, Buchan AM, Hill MD. On Behalf of the Canadian Alteplase for Stroke Effectiveness Study (CASES) Investigators. Admission Hyperglycaemia Predict a Worse Outcome in Stroke Patients Treated with Intravenous Thrombolysis. Diabetes Care. 2009;32:617-22.
32. Matz K, Karesztes K, Tatschi C, Nowotny M, Dachenhausen A, Brainin M. Disorders of glucose metabolism in acute stroke patients: An under recognized problem. Diabetes Care. 2006;29:792-7.
33. Masharan U, German MS. Hormonas pancreáticas y diabetes mellitus. En: Gardner DG, Shoback CK. Greenspan Endocrinología básica y clínica. 9ed Ed. Madrid: McGrew Hill Lange; 2012. p. 574-655.
34. Broderick J, Connolly S, Feldmann E, Hanley D, Kase C, Krieger D, et al. Guidelines for the management of spontaneous intracerebral hemorrhage in adults: 2007 update: a Guideline from the American Heart Association/American Stroke Association Stroke Council, High Blood Pressure Research Council, and the Quality of Care and Outcomes in Research Interdisciplinary Working Group. Stroke. 2007;38:2001-23.
35. The European Stroke Initiative Writing Committee and the Writing Committee for the EUSI Executive Committee. Recommendations for the management of intracranial hemorrhage. Part I: spontaneous intracerebral hemorrhage. Cerebrovasc Dis. 2006;22:294-316.
36. Van den Berghe G, Wouters P, Weekers F, Verwaest C, Bruyninckx F, Schetz M, et al. Intensive insulin therapy in critically patients. N Eng J Med. 2001;345:1359-67.
37. Pérez A. Objetivos de control glucémico en los pacientes críticos. Reflexiones acerca del estudio NICE-SUGAR. Av Diabetol. 2009;25:347-9.
38. The NICE-SUGAR Study Investigators. Intensive versus conventional glucose control in critically ill patients. N Engl J Med. 2009;360:1283-97.
39. Adviye E, Weiguo L, Mostafa ME, Askiel B, Fagan SC. Hyperglycemia, diabetes and stroke: Focus on the cerebrovasculature. Vasc Pharmacol. 2009;51:44-9.
40. Sweileh WM, Sawalha AF, Al-Aqad SM, Zyoud SH, Al-Jabi SW. Predictor of in-hospital mortality after acute stroke: impact of gender. Int J Clin Exp Med. 2008;1:41-7.
41. Félix FJ, Consuegra L, Ramírez JM, Lozano L, Escudero V, Fernández-Bergés D . Ischemic stroke mortality tendency (2000-2009) and prognostic factors. ICTUS Study-Extremadura (Spain). Rev Clin Esp. 2013;213:177-85.
42. Tejada J, Redondo L. Epidemiología de la enfermedad vascular cerebral en los pacientes con diabetes. Av Diabetol. 2010;26:377-402.
43. Caballero López A. Enfermedad Cerebrovascular en Tratado de Terapia Intensiva. 2da ed. La Habana: Editorial Ciencias Médicas; 2008. p. 1030-51.
Recibido: 28 de enero de 2016.
Aprobado: 27 de abril de 2016.
Manuel Licea Puig. Centro de Atención al Diabético (CAD) del Instituto Nacional de Endocrinología (INEN). Calle 17, esquina a D, Vedado, municipio Plaza de la Revolución. La Habana, Cuba. Correo electrónico: licea@infomed.sld.cu