Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Endocrinología
versión On-line ISSN 1561-2953
Rev Cubana Endocrinol vol.28 no.3 Ciudad de la Habana set.-dic. 2017
ARTÍCULO ORIGINAL
Incidencia de la diabetes mellitus en Cuba, según tipo, en menores de 18 años de edad
Incidence of diabetes mellitus in Cuba in children under 18 years by type
Yuri Arnold Domínguez,I Obdulio González Hernández,I Norma Martínez Vázquez,II Berta Isabel Formental Hidalgo,III María de Lourdes Arnold Alfonso,IV Teresa Margarita González Calero,I Ana Ibis Conesa GonzálezI
IInstituto Nacional de Endocrinología (INEN). La Habana, Cuba.
IIFacultad de Ciencias Médicas "Comandante Manuel Fajardo". La Habana, Cuba.
IIIFacultad de Ciencias Médicas "General Calixto García". La Habana, Cuba.
IVHospital Docente Clinicoquirúrgico "Faustino Pérez Hernández". Matanzas, Cuba.
RESUMEN
Introducción: la diabetes mellitus tipo 2 en niños y adolescentes está alcanzando proporciones alarmantes. Desde la década de los 90, se asiste a la aparición, cada vez más frecuente, de este fenómeno, el cual parece ser una consecuencia del preocupante aumento de la obesidad en la población, proceso que va acompañado también de insulinorresistencia.
Objetivo: describir el comportamiento del incremento de la incidencia de la diabetes mellitus tipo 2 con respecto a la tipo 1, en individuos hasta 18 años de edad, Cuba, 2013-2015.
Métodos: se realizó un estudio observacional descriptivo. La población de estudio fue la diagnosticada como diabética de 1 a 18 años, tipo 1 y tipo 2. Los datos estadísticos se tomaron del Registro Nacional de Dispensarización de Diabetes Mellitus correspondiente a los años 2013, 2014 y 2015.
Resultados: el comportamiento global de la Razón de Tasas de Incidencia, en los años estudiados, fue fluctuante en la diabetes mellitus tipo 2; mientras que, en la diabetes mellitus tipo 1, se elevó en el periodo 2013-2014 y durante el 2014-2015 existió un notable descenso. La Razón de Tasas de Incidencia (diabetes mellitus tipo 2/diabetes mellitus tipo 1) es mayor que 1, solo en el grupo de edad de 15 a 18 años, correspondientes a los años 2013 y 2014. A medida que incrementa la edad, se eleva esta Razón de Tasas de Incidencia.
Conclusiones: la incidencia de diabetes mellitus tipo 2 en los grupos de edades estudiados, se incrementa a medida que incrementa la edad, mientras que la incidencia de la DM 1 disminuye con el incremento de esta.
Palabras clave: diabetes mellitus tipo 1/epidemiología; diabetes mellitus tipo 2/epidemiología; diabetes mellitus de inicio en la madurez; obesidad infantil.
ABSTRACT
Introduction: type 2 diabetes mellitus in children and adolescents is reaching alarming proportions. Since the 1990s, we are witnessing the increasingly frequent appearance of this phenomenon, which seems to be a consequence of the worrying increase in obesity in the population, a process that is also accompanied by insulin resistance.
Objective: to describe the behavior of the increase in the incidence of type 2 diabetes mellitus with respect to type 1 in individuals up to 18 years old in Cuba from 2013 to 2015.
Methods: a descriptive observational study was carried out. The study population was the one diagnosed as diabetic from 1 to 18 years old, type 1 and type 2. The statistical data were taken from the National Registry of Classification of Diabetes Mellitus corresponding to the years 2013, 2014 and 2015.
Results: the overall behavior of the Incidence´s Rate Ratio in the years studied was fluctuating in type 2 diabetes mellitus; while in type 1 diabetes mellitus, it increased in the period 2013-2014, and during 2014-2015 there was a notable decrease. The Incidence´s Rate Ratio (diabetes mellitus type 2/diabetes mellitus type 1) is higher than 1 only in the age group of 15 to 18 years, corresponding to the years 2013 and 2014. As the age increases, it raises this Incidence´s Rate Ratio.
Conclusions: the incidence of type 2 diabetes mellitus in the age groups studied increases as age increases, while the incidence of type 1 decreases with the increase of age.
Keywords: type 1 diabetes mellitus/epidemiology; type 2 diabetes mellitus/epidemiology; diabetes mellitus with onset in maturity; childhood obesity.
INTRODUCCIÓN
La diabetes mellitus (DM) se ha convertido en uno de los más graves problemas sanitarios. Sus proporciones son ya epidémicas en la mayor parte del mundo. Se estima que en 2015 existieron 415 millones de personas entre 19 y 79 años (con una prevalencia global de un 8,8 %) afectadas en el mundo, y esta cifra aumentará en los próximos años, hasta alcanzar 642 millones en el año 2040, si se cumplen las últimas predicciones.
En países de altos ingresos económicos la DM tipo 2 (DM 2), ha sido estimada en 87-91 %, la DM tipo 1 (DM 1) en 7-12 %, mientras que el 1-3 % restante fue por otros tipos de diabetes. La proporción de ambas no ha sido estudiada con grandes detalles en países de bajos y medianos ingresos económicos.
En prácticamente todas las sociedades desarrolladas la DM es una de las principales causas de ceguera, amputaciones y enfermedad renal terminal.
Según la Federación Internacional de Diabetes, aproximadamente 5 millones de personas entre 19 y 79 años fallecieron con DM durante el 2015. La DM representó el 14,5 % del total de causas de muerte en ese grupo de edad. La mortalidad prematura por debajo de los 60 años de edad por esta enfermedad a nivel mundial en el grupo de edad estudiado, fue de un 46,6 %, y por último es necesario destacar que el mayor número de fallecimientos ocurrieron en países con altas prevalencias como China, India y la Federación Rusa.1,2
La DM 2 es una enfermedad de etiología heterogénea y multifactorial, en la que están implicados factores genéticos y ambientales, como la obesidad, la ingesta de grasas y la vida sedentaria.3
Existe acuerdo común en que la DM 2 puede desarrollarse solo en personas que acarrean una predisposición genética para la enfermedad. Con base en observaciones epidemiológicas, cerca de la mitad de las personas desarrollarán DM 2 durante su vida, y cerca del 30-35 % tendrán intolerancia a la glucosa.4,5 En personas genéticamente predispuestas a la enfermedad, la probabilidad de desarrollo de DM 2 es muy alta una vez que se exponen a estilos de vida no saludables.6
Desde la década de los 90 se asiste a la aparición, cada vez más frecuente, de DM 2 en adolescentes y personas muy jóvenes.7-9 Este fenómeno parece ser debido en gran medida al aumento de la prevalencia de la obesidad en este subgrupo poblacional, proceso que va acompañado también de insulinorresistencia (IR).10
Se invocan otros factores de riesgo (FR) en la génesis de la DM 2 en la niñez, que están relacionados con el ambiente intrauterino, a través del peso al nacer y la hiperglucemia materna.11,12
El riesgo de padecer de DM 2 es mayor entre aquellos con un peso al nacer menor a 2 500 g o mayor a 4 000. Por otro lado, los hijos de mujeres que desarrollan DM durante la gestación, tienen más riesgo de ser obesos en la infancia y de desarrollar DM en su segunda década de vida. Para algunos investigadores, estos hallazgos sustentarían una hipótesis patogénica común para la DM 1 y 2, conocida como "hipótesis del acelerador", que coloca al aumento de peso en el punto clave para que se inicie la IR, la glucotoxicidad, la apoptosis de células β, y finalmente, la aparición de DM.13
Por lo general, la DM 2 aparece en la edad madura, pasados los 45 años de edad, a diferencia de la DM 1.8,9 En algunos países, la DM tipo 1-A o autoinmune (DM 1-A), constituía previamente el 99 % de las formas diagnosticadas en la población infantil; según datos de una investigación realizada en el año 2000, la incidencia de DM 2 en EUA se ha ido incrementado de 8 a 45 %, y en determinadas etnias fue de un 94 %.14
Aunque la DM 1-A sigue siendo predominante en este grupo poblacional, el diagnóstico diferencial entre DM 1 y DM 2 se complica debido al solapamiento entre las características clínicas de ambas; en un estudio realizado en población pediátrica en Chicago, EUA,15 se comprobó que hasta el 25 % de los casos inicialmente diagnosticados como DM 1 eran DM 2. La DM 1-A se presenta característicamente en sujetos sin sobrepeso, con síntomas cardinales, y en el 30-40 % de los casos se manifiesta con cetoacidosis; sin embargo, la mayor prevalencia de obesidad en la población general hace que esta también sea más frecuente en los pacientes con DM 1, y llegan a presentarla hasta el 24 % de los casos al diagnóstico.16
Este tipo de DM se nombra "DM doble", que sugiere que elementos de la DM 1 y de la DM 2 coexistan en la misma persona: personas con DM 1 que tienen insensibilidad a la insulina y que suele ir asociada a la obesidad; personas con DM 2, con anticuerpos que atacan las células β pancreáticas. Para complicar aún más el panorama, está el hecho de que hay personas con DM 1 con antecedentes patológicos familiares de DM 2 y viceversa. Esto significa que un número considerable de personas podrían correr un riesgo genético de desarrollar ambos tipos de DM.17
La DM 2 tiene un pico en las tasas de incidencia (TI) en la niñez y adolescencia, entre los 12 y los 16 años, que coincide con estadios medios o finales de la pubertad, pueden tener cetosis, e incluso, cetoacidosis, pérdida de peso leve y en el 90 % de los casos se observa acantosis nigricans, que indica hiperinsulinismo de larga evolución.18,19 El aumento de la incidencia de la DM 2 en jóvenes se ha confirmado tanto en países desarrollados, como en vías de desarrollo.20
Existen datos disponibles sobre el incremento de la incidencia de DM 2 en la población pediátrica de países desarrollados como Australia, Canadá y Japón, mientras que escasean los datos provenientes de países en vía de desarrollo. En Japón21 se ha encontrado, en este subgrupo poblacional, que la prevalencia se duplicó, pasando de 0,08 por cada 1 000 habitantes en los años 1975-1980, a 0,14 por cada 1 000 habitantes entre 1991 y 1995. En EUA las cifras varían considerablemente según las etnias estudiadas: la máxima prevalencia la tienen los indios pima, con el 22,3 % entre 10 y 14 años y 50,9 % entre los 15 y 19 años,22,23 seguidos de afroamericanos e hispanos, en los que se ha encontrado mayor IR que en los caucásicos.24,25
Durante los años 1996 y 1998, en EUA se realizó un estudio con un diseño epidemiológico más complejo que los anteriores, con vistas a estudiar dicho fenómeno.26 El estudio tenía como meta observar la evolución de pacientes que se les realizó el diagnóstico de DM 2 a edades tempranas y tardías de la vida, y se estableció como punto de corte para la comparación, los 45 años. Los resultados fueron los siguientes: el 80 % de los diagnosticados a edades comprendidas entre 18 y 44 años llegaron a iniciar un tratamiento con insulina con respecto al otro grupo, aunque en ambos casos el tiempo transcurrido desde el diagnóstico hasta el momento en que se hizo necesaria la insulina fue similar. Respecto a las complicaciones presentes en el primer grupo, con más frecuencia, se encontró la presencia de microalbuminuria en la orina (riesgo relativo [RR]= 1,2, 95 %, intervalo de confianza [IC]:1,1-1,4) y complicaciones macrovasculares; estas últimas tuvieron un RR dos veces más alto con respecto al otro grupo, además se constató que el riesgo de infarto del miocardio fue 14 veces mayor en los diabéticos, en quienes el diagnóstico se estableció a edad más temprana que en el grupo control (RR= 14,0, 95 %, IC: 6,2-31,4). Con posterioridad se realizó el Ensayo SEARCH de USA,27 el cual identificó a un número de niños con "DM doble", y fue diseñado para determinar la incidencia y prevalencia de DM en USA, y demostró que una proporción relativamente grande de los jóvenes a quienes se les había diagnosticado DM seguían produciendo insulina y presentaban anticuerpos que atacan a las células β del páncreas.
En el continente europeo, los estudios al respecto son muy escasos. Se destaca uno de 520 escolares obesos, caucásicos, residentes en Alemania, en el que se observaron alteraciones del metabolismo de la glucosa en 6,7 % de los estudiados, de los que solo el 1,5 % tenían DM.28
América Latina (AL) tiene un comportamiento similar al mundo respecto a la situación planteada. Las encuestas de FR poblacionales, en la región, incluyendo el Caribe, indicaron que en 2002, entre el 7 y 12 % de los niños menores de 5 años de edad exhibían sobrepeso o eran obesos; en México y Chile, las encuestas nacionales de factores de riesgo (ENFR) de 2004, indicaron que el 15 % de los adolescentes eran obesos.
Aún en la región no se cuenta con un registro oficial de la incidencia de niños y adolescentes con DM 2, así que la necesidad de incursionar en la temática es importante y prioritaria. La obesidad en estas poblaciones latinoamericanas va en aumento, se circunscriben a este el proceso de globalización, la era de la tecnología, que ha traído consigo cambios en sus modos y estilos de vida (consumo de comida rápida y llevar una vida sedentaria, a lo que se suma el componente genético).29
Según fuentes oficiales, en Cuba, del 2 al 3 % del total de personas con DM 2 le corresponde a la población infantil.30
Al igual que sucede con la DM 1, muchos niños con DM 2 corren el riesgo de desarrollar complicaciones al inicio de la edad adulta, lo cual emplazaría una carga notable sobre la familia y la sociedad. Con el aumento de los niveles de obesidad y la falta de actividad física entre los niños y adolescentes de muchos países, la DM 2 en la infancia tiene el potencial de convertirse en un problema de salud pública mundial que generará graves resultados sanitarios, por lo que urge recabar más información acerca de este aspecto de la epidemia de DM.31
El objetivo del siguiente trabajo es describir el comportamiento del incremento de la incidencia de la DM 2 con respecto a la tipo 1, en individuos hasta 18 años de edad, Cuba, 2013-2015.
MÉTODOS
Se realizó un estudio observacional descriptivo. La población de estudio fue la diagnosticada como diabética de 1 a 18 años, tipo 1 y tipo 2. Los criterios diagnósticos de definición de paciente diabético,32-34 usados por el Registro Nacional de Dispensarización de Diabetes Mellitus (RND-DM) fueron clínicos y de laboratorio clínico, según los establecidos por la Asociación Latinoamericana de Diabetes en el año 2000:
- Cuando existen síntomas de DM y una glucemia casual medida en plasma venoso que sea igual o mayor a 11,1 mmol/L (200 mg/dL). Casual se define como cualquier hora del día, sin relación con el tiempo transcurrido desde la última comida. Los síntomas clásicos de diabetes incluyen poliuria, polidipsia, polifagia y pérdida inexplicable de peso.
- Cuando a pesar de que no existen síntomas de DM y se tenga una glucemia casual medida en plasma venoso que sea igual o mayor a 11,1 mmol/L (200 mg/dL), exista una glucemia en ayunas medidas en plasma venoso que sea igual o mayor a 7 mmol/L (126 mg/dL).
- Cuando existen 2 glucemias en ayunas medidas en plasma venoso que sean igual o mayor a 7 mmol/L (126 mg/dL). En ayunas se define como un período sin ingesta calórica de por lo menos 8 a 12 horas antes de la primera comida de la mañana.
- Cuando existe una glucemia medida en plasma venoso que sea igual o mayor a 11,1 mmol/L (200 mg/dL) 2 horas después de una carga de glucosa durante una prueba de tolerancia oral a la glucosa.
- Cuando existe una hemoglobina glucosilada ≥ 6,5 %.
Los datos estadísticos de los 3 años estudiados se tomaron del RND-DM correspondiente a los años 2013, 2014 y 2015. Los subregistros estadísticos revisados, según variables sociodemográficas, fueron los siguientes: según edad, grupos de edades, edad y sexo, tasas de dispensarización, y según edad y sexo. Cada uno de los mencionados estaban compuestos por información correspondiente a ambos tipos de DM. Se utilizaron las tasas ajustadas para la edad según población cubana tipo censal de 1981. Como métodos para estudiar la comparación de TI (cada 1 000 habitantes) entre los 3 años, por grupos de edades, tipo de DM, sexo, se utilizó el porcentaje de cambio relativo (PCR), el cual se calcula de la forma siguiente: PCR= (TI primer año-TI segundo año/TI primer año, entre el año 2014 con respecto al 2013, y entre el año 2015 con respecto al 2014); además, se utilizó la Amplitud Relativa (AR), que consiste en la razón entre la tasa mayor y la menor de los 3 años estudiados. Esta expresa la dispersión del valor de las tasas entre años, que será mayor cuando la AR exceda la unidad. Por último, se realizó la Razón de Tasas de Incidencia (RTI) en los 3 años estudiados, entre sexos (femenino [F]/masculino [M]) y entre la DM 2 con respecto a la DM 1 (RTI [DM 2/DM 1]), y ambas fueron analizadas según grupos de edades y global. Solo se pudieron utilizar los datos de morbilidad correspondientes a los años estudiados según tipos de DM, dado que el RND-DM, por tipo de DM, se inició en 2013, lo que representó una limitación del estudio. Se tomó en consideración la bibliografía y la experiencia del investigador en el análisis de la información.
Los datos obtenidos se representaron en tablas para su mejor comprensión. Para la realización del estudio siguiente, se solicitó la autorización a la Dirección Nacional de Estadísticas (DNE) del Ministerio de Salud Pública (Minsap) de Cuba, y se le notificó por escrito que este fue aprobado por el Comité Científico y de Ética de la Investigación, respectivamente, del INEN de Cuba.
Limitaciones del estudio: va a depender de la calidad del registro de dispensarización, que se sustenta de la capacidad que tiene el médico facultativo en notificar esta entidad en los modelos estadísticos correspondientes.
RESULTADOS
Durante los años 2013 y 2014 se mostraron los datos siguientes: los grupos de edades de 5 a 9 y de 10 a 14 años, en la población en general, fueron los que presentaron un mayor PCR de la TI (50 y 75 %, respectivamente) (tabla 1); además, se muestra que se han notificado casos en todos los grupos de edades representados. Es apreciable también, que a medida se incrementa la edad, se incrementa el riesgo de padecer de DM 2.
Las mayores dispersiones de las TI ocurrieron en los grupos de 5-9 años de la población masculina, seguido del grupo de edad de 15 a 18 años de edad, correspondiente a las mujeres.
En la tabla 2 se evidencia que TI de 0-18 años de edad, de personas con DM 1, tendió a disminuir desde 2013 a 2015 en la población en general y ambos sexos, excepto entre los años 2013 y 2014 en el sexo femenino, que se mantuvo igual. El análisis por grupos de edad, entre los años 2013 y 2014, aportó que los grupos etarios que correspondieron a las edades de 0 a 4 años, tuvieron los PCR más altos.
La AR entre los años estudios se comportó de la forma siguiente: las mayores dispersión de las TI ocurrieron en el grupo de edad de 10-14 años de la población masculina, y en el de 1-4 años correspondiente al sexo femenino.
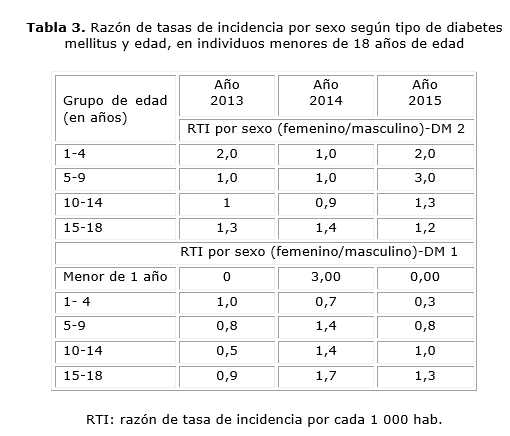
El 91,6 % de los valores de la RTI (F/M) de la DM 2 por grupos de edades en los 3 años, fue ≥ 1 (la unidad). El grupo de edad de 5 a 9 años en 2015, fue 3 veces mayor en las niñas con respecto al sexo opuesto; le siguió el grupo de 1-4 años, con una razón de 2:1 (tabla 3).
El comportamiento global de la RTI, en los años estudiados, fue fluctuante en la DM 2; mientras que en la DM 1 esta se elevó en el periodo 2013-2014, y durante el 2014- 2015 existió un notable descenso.
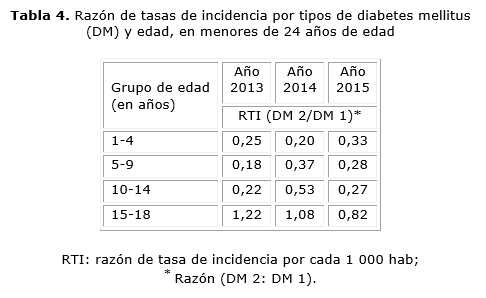
En la tabla 4 se observó que la RTI (DM 2/DM 1) es mayor que 1 solo en el grupo etario de 15 a 18 años, correspondientes a los años 2013 y 2014. A medida que incrementa la edad, se eleva la RTI (DM 2/DM 1). La mayor RTI (DM 2/DM 1) obtenida, le correspondió al grupo de 15 a 18 años, del año 2013.
DISCUSIÓN
En los últimos años se ha incrementado el número de estudios que describen la epidemiología de la DM. Los estudios poblacionales evidencian que la DM constituye un importante problema de salud pública, relacionado fundamentalmente por el elevado riesgo de enfermedad cardiovascular que proporciona esta entidad.35
Según plantean Mbanya y Hospedales, se encara actualmente una franca epidemia de DM. Entre las causas posibles se incluyen: el envejecimiento poblacional, su inicio en edades más jóvenes y una disminución de la mortalidad por otras causas, pero, estos factores, explican solamente del 20-25 % del incremento 36 observado en la prevalencia; la explicación más probable para este suceso, es el incremento en la incidencia de la enfermedad. Actualmente son pocos los argumentos sólidos para apoyar esta visión, pero al parecer es posible que un aumento en la prevalencia de factores FR, como la dieta no saludable, la obesidad y la inactividad física, más notablemente, sea una causa mayor.
Adicionalmente, las investigadoras D'adamo y Caprio, 37 en un reciente artículo, refieren que, coincidente con la epidemia mundial creciente de obesidad en la infancia,36,38 la DM 2 y la prediabetes están llegando a ser frecuente en niños obesos y adolescentes. Hasta hace 10 años la DM 2 se cuantificaba para menos del 3 % de todos los casos de inicio en adolescentes;36,37 en cambio, actualmente el 45 % de los casos son atribuibles a la DM 2 en algunas regiones del mundo. Esta tendencia en la incidencia no ha sido un fenómeno exclusivo de otras regiones del mundo, que involucra con mayor peso, a los países desarrollados y en vías de desarrollo.35 Cuba no se excluye tampoco de esta situación, aunque no con la magnitud de gravedad referida anteriormente.
Los reportes bajos de las TI de DM 2 en edades de 0-18 años en Cuba, observadas en nuestro estudio con respecto a cifras de prevalencias en ese mismo grupo de edad y en otras poblaciones, pudiesen estar dados por la implementación de programas de intervención multifactoriales de reducción de estilos de vidas insanos que se realizan anualmente en escenarios escolares, como la incentivación de la práctica continua del ejercicio físico y de alimentación saludable.
Es necesario destacar la labor que realizan los departamentos de enfermedades no transmisibles (ENT) provinciales, coordinados por la instancia central en el Minsap en el diagnóstico de esta enfermedad a nivel poblacional, a través de instrumentos validados de pesquisa activa, con especial énfasis en la atención primaria de salud.35
Prueba de ello son los datos obtenidos por la III ENFR para ENT de Cuba,39,40 donde del grupo de niños y adolescentes (solo se exploró el de 15 a 24 años), el 7,4 % IC: 4,5-10,2 de los pertenecientes a ese grupo, contaban con un valor de glucemia alterada en ayunas.
La incidencia de la DM 1 en la infancia se ha incrementado globalmente en los últimos 50 años en todas las poblaciones, tanto en los de baja como alta incidencia.41,42
Existe una amplia variación de la incidencia de DM 1 en la edad pediátrica entre los diferentes países, así como entre y dentro de los distintos grupos étnicos, lo que indica la importancia de los factores ambientales en su etiología, y prueba de ello son los datos siguientes: la incidencia global ajustada de DM 1 anual en la infancia varía desde 0,01 por cada 1 000 habitantes en China y Venezuela, 0,37 en Cerdeña, Italia, y se reportó la TI más alta en Finlandia, donde llegó a afectar a 0,5 por cada 1 000 niños menores de 15 años;43 incluso, estas variaciones de las TI ocurren en poblaciones europeas cercanas genéticamente similares, y se han documentado diferencias de hasta diez veces.44,45
La TI relativamente baja de DM 1 en los países de Europa del Este, puede estar dada porque los perfiles de esta enfermedad en estos, estén en una etapa inicial en cuanto a la evolución natural de la enfermedad; en cambio, en algunas zonas de alta TI en Europa del Norte, últimamente existe una tendencia a su estabilización, después de que alcanzó en los últimos años un pico.
Por otro lado, si se representa la TI de la DM 1 frente al Índice de Desarrollo Humano (IDH) de cada país europeo, se puede observar que existe una correlación lineal entre los países con alto IDH y los de mayor TI. El IDH del Programa de las Naciones Unidas para el Desarrollo, se calcula desde 1990, y busca medir el desarrollo de un país a través de un índice compuesto, por medio de indicadores que se relacionan en la economía, la salud u otros.
Estudios anteriores sobre la incidencia de la DM 1 en la infancia en países de AL, han indicado que las tasas de todos los países de la región se encuentran catalogadas entre muy bajas e intermedias,44 sin embargo las cargas de enfermedades individuales y sociales son altas.46 De manera general, la incidencia es más baja que la reportada por España y Portugal,43 dos países europeos que contribuyeron significativamente a la composición de las poblaciones de la mayoría de los países de AL. La TI más alta de la región es la de Puerto Rico, que se considerada como alta.43,47
Algunas investigaciones sobre la incidencia de la DM 1 en AL48,49 mostraron que existe una fuerte correlación negativa entre la incidencia/prevalencia de la DM 1 y la proporción de amerindios. La baja incidencia de DM 1 en la mayoría de los países de la región, pudiese estar parcialmente explicada por una baja susceptibilidad genética para padecer de DM en los amerindios, por una baja exposición a FR no identificados, o por un alto nivel de exposición a factores protectores en este grupo poblacional. Los resultados indican además que los halotipos de amerindios ancestrales y de nativos americanos originarios, confieren protección contra la DM 1. Es importante recalcar que los habitantes amerindios originarios fueron eliminados en la conquista de América, y por lo tanto, su proporción actual en la población general de AL es casi ausente.48,50 Otros autores añaden tres factores más que inciden en el descenso de la TI de DM 1, como: la ineficiente atención de salud brindada a los amerindios, que su gran mayoría pertenecen a un estrato socioeconómico bajo; segundo, que dada la baja cobertura médica en muchos países de la región, la DM 1 puede no diagnosticarse en pacientes jóvenes y finalmente ocurrir el fallecimiento sin siquiera saberse el diagnóstico posmorten;50 y por último, se plantea que en AL, generalmente se incrementa la TI, proporcionalmente con el tamaño de la población caucasoide en un país determinado, razón que puede explicar las TI altas en Puerto Rico.51
Al estratificar el comportamiento de la incidencia de la DM 1 solo en niños y adolescentes (menores de 15 años) de manera global, y por grupos de edades específicos, se muestran diferencias marcadas de las variables sociodemográficas entre diferentes regiones geográficas. La TI anual de DM 1 en este subgrupo poblacional aumenta en un 2-5 % cada año.52
Nuestro estudio aportó que durante los años 2013 y 2015, la TI del grupo de 0-14 años de DM 1 sobrepasó el límite superior de 5 % observado por Silink y otros,52 resultado plausible, dado que en estas edades actúan factores genéticos. En el 70-75 % de los casos notificados y ambientales, en estos últimos son difíciles de cuantificar su efecto, porque ambos facilitan o desencadenan el proceso que conlleva a la destrucción de las células β al comienzo de la enfermedad.53-56
Existe una explicación menos convincente para el incremento de la TI de DM 1 en niños y adolescentes en todo el mundo y su distribución. Los rápidos e importantes cambios dentro de poblaciones genéticamente estables, no se pueden explicar por el aumento de la transmisión de genes de la DM de una generación a otra, sino que parece más fácil que sugieran algunos FR ambientales que podrían haber acelerado el proceso de la enfermedad sobrecargando las células β pancreáticas (hipótesis de la sobrecarga); estos FR medioambientales parecen ser: un aumento general del índice de crecimiento de los niños, la sobrealimentación, el aumento de los niveles de grasa en el organismo, el descenso de la edad de la pubertad, algunas infecciones víricas, estrés psicológico, o un clima frío, entre otros.57
Con respecto al sexo, en los últimos años se observa que en la mayoría de las poblaciones, ambos sexos, se ven igualmente afectados. Solo en algunos países, principalmente con alta TI de la enfermedad, se ha documentado que es mayor en los niños que en las niñas.58 Nuestros resultados difieren con lo antes expuesto, ya que la TI de las niñas fueron superiores a la de los niños, y esto pudiese estar condicionado que en la población cubana existen más representantes del sexo masculino a estas edades.59
Además, es conocido, que la incidencia de la DM 1 aumenta con la edad, alcanzando su máximo con la pubertad. En nuestro caso existieron TI más altas que en el grupo de edad correspondiente a este proceso fisiológico, en el de 5 a 9 años en el caso de las niñas y en el de 10 a 14 en el caso de las niños, grupos de edades que corresponden con la pubertad.
Referente al comportamiento de la incidencia de la DM 2 en la infancia y adolescencia, de acuerdo con los resultados de nuestra búsqueda, no existen estudios epidemiológicos que traten al respecto, pero sí se encuentran resultados referentes a la incidencia de la obesidad y el sobrepeso en edades pediátricas, dado que es conocida la relación entre la obesidad y el sobrepeso, y la presencia de alteraciones del metabolismo de la glucosa. Según datos de la I y II ENFR de la población cubana, en los menores de 5 años de edad el incremento del exceso de peso (IEP) fue del 31,6 % entre los años 2002-2012. El sobrepeso predominó entre los varones, pero la prevalencia de obesidad fue independiente del sexo del niño; en los adolescentes el IEP fue un 19,0 %.60
La III ENFR exploró a adolescentes y jóvenes de 15 a 24 años; los resultados mostraron que los menores de 20 años, tuvieron menores prevalencias de incremento en la adiposidad del abdomen respecto a la población adulta, a través de la circunferencia de la cintura y del índice cintura/cadera, y fue mayor el riesgo para el sexo femenino, dado además ellas presentaron un IEP (IMC> 24,9 kg/cm2), dado por sobrepeso, obesidad y obesidad extrema de 19,7 vs. 16,4 % en los hombres, valores similares a los obtenidos en 2002; pero, de manera global, la población cubana ha mantenido una tendencia hacia la reducción del bajo peso en un término de 15 años. La distribución incrementada del tejido adiposo intrabdominal continúa en ascenso, constituye un importante factor independiente que eleva las enfermedades asociadas crónicas y no transmisibles en la población general. Las políticas de salud son prioritarias para continuar trabajando en la disminución del sobrepeso y la obesidad, así como de sus principales implicaciones negativas para la salud de los cubanos.39
Resultados de investigaciones provenientes de Brasil,61 Cuba62,63 y Perú,64 coinciden que para el desarrollo del sobrepeso y la obesidad en los niños y adolescentes, el factor genético es predominante, además obedece a las malas prácticas alimentarias, así como la poca actividad física, y mostraron también que la mayor proporción fueron féminas, dado por tener una actividad física insuficiente (AFI), con respecto a los varones.
La AFI65 se atribuye a nivel individual, a los cambios de estilos de vida. Por mencionar algunos, este subgrupo poblacional pasa horas mirando televisión, videos y tras una computadora, así lo revelaron investigadores de la Sociedad de Ciencias de la Alimentación:66 "…los niños miran la televisión más de cinco horas al día, cuando lo recomendado es menos de dos..."; además, señalaron: "…tres de cada cuatro anuncios comerciales que se difunden en los espacios de programación infantil se relacionan con productos comestibles ricos en azúcares simples y grasas…".
Son varias las determinantes en la ingesta de comida con alto contenido energético e hipercalórico y en la baja actividad física en la población. Varios autores sostienen que en la incorporación de actividad física se involucran factores internos de las de las personas, interindividuales, ambientales y contextuales,67 de ahí la importancia de plantear, adoptar y promover metodologías que tengan como propósito incidir en los individuos, vistos como sujetos de cambio en el mejoramiento de su calidad de vida.
Con respecto a la fisiopatología del síndrome metabólico del niño asociado a la obesidad, se invoca a la IR como elemento clave, y suele estar presente mucho antes que aparezcan otras anomalías. La acumulación de grasa visceral y en órganos sólidos intrabdominales, en contraste con la acumulación de grasa glúteo-femoral, es fuertemente asociada a complicaciones relacionadas con la obesidad, como la DM 2 y la enfermedad coronaria arterial, y se acompaña frecuentemente de hipertensión arterial, hipertrigliceridemia y bajos niveles de colesterol, unido a lipoproteínas de alta densidad, e inflamación y estado protrombótico. Los cambios metabólicos son reflejo o consecuencia de la RI y su interacción con la obesidad.67,68
Se concluye que, la incidencia de DM 2 en los grupos de edades estudiados se incrementa a medida que aumenta la edad, y se alcanzan cifras superiores a la de la incidencia de DM 1 a partir del grupo de edad de 15 a 18 años de edad, mientras que la incidencia de la DM 1 presenta un comportamiento inverso.
Agradecimientos
Se agradece a los funcionarios de la DNE-Minsap de Cuba por habernos permitido utilizar los datos de estadísticas continuas relacionados con DM, y en el especial al Dr.C. Eduardo Cabrera Rode, Jefe del Grupo de Grupo de Investigaciones de Diabetes Mellitus del INEN, por sus precisas sugerencias.
Conflicto de intereses
Los autores declaran no tener conflicto de intereses en la realización del estudio.
REFERENCIAS BIBLIOGRÁFICAS
1. International Diabetes Federation (IDF). Atlas IDF. The global pictures. The IDF Diabetes Atlas. 7th. ed. Brussels: IDF; 2015. p. 50-1.
2. International Diabetes Federation (IDF). Atlas IDF. The global pictures. The IDF Diabetes Atlas. 7th. ed. Brussels: IDF; 2015. p. 56-7.
3. Weiss R, Dziura J, Burgert TS, Tamborlane WV, Taksali SE, Yeckel CW, et al. Obesity and the metabolic syndrome in children and adolescents. N Engl J Med. 2004;350:2362-74.
4. The DECODA Study Group. Age-and sex-specific prevalence of diabetes and impaired glucose regulation in 11 Asian cohorts. Diabetes Care. 2003;26:1770-80.
5. The DECODE Study Group. Age-and Sex-Specific, Prevalences of Diabetes and Impaired Glucose Regulation in 13 European Cohorts. Diabetes Care. 2003;26:61-9.
6. Turner RC, Cull CA, Frighi V. Glycemic control with diet, sulfonylurea, metformin, or insulin in patients with type 2 diabetes mellitus. Progressive requirement for multiple therapies (UKPDS 49). JAMA. 1999;281:2005-12.
7. Rosenbloom AL, Joe JR, Young RS, Winter WE. Emerging Epidemic of Type II Diabetes in Youth. Diabetes Care. 1999;22:345-54.
8. Editorial (Sección Instantáneas). Asociación entre la edad del diagnóstico de diabetes tipo 2 y la gravedad del trastorno. Rev Panam Salud Pública [serie en Internet]. 2003 Dec [citado 28 de octubre de 2016];14(6). Disponible en: http://www.scielosp.org/scielo.php?script=sci_arttext&pid=S1020-49892003001100010&lng=es&nrm=iso&tlng=es
9. Sperling MA. Aspects of the etiology, prediction and prevention of insulin dependent diabetes mellitus in childhood. Pediatr Clin North Am. 1997;44:269-84.
10. National Task Force on the Prevention and Treatment of Obesity. Overweight, Obesity and Health Risk. Arch Intern Med. 2000;160: 898-904.
11. Alberti G, Zimmet P, Shaw J, Bloomgarden Z, Kaufman F, Silink M. Type 2 diabetes in the young: The evolving epidemic. The International Diabetes Federation Consensus Workshop. Diabetes Care. 2004;27:1798-811.
12. Freemark M. Pharmacologic approaches to the prevention of type 2 diabetes in high risk pediatric patients. J Clin Endocrinol Metab. 2003;88:3-13.
13. Wilkin TJ. The Accelerator Hypothesis: Weight Gain as the Missing Link Between Type I and Type II Diabetes. Diabetologia. 2001;44:914-22.
14. Brosnan CA, Upchurch S, Schreiner B. Type 2 diabetes in children and adolescents: An emerging disease. J Pediatr Health Care. 2001;15:187-93.
15. American Diabetes Association. Type 2 diabetes in children and adolescents. Diabetes Care. 2000;23:381-9.
16. Rosenbloom AL. Obesity, insulin resistance, β-cell autoimmunity, and the changing clinical epidemiology of childhood diabetes. Diabetes Care. 2003;26:2954-6.
17. Kaufman F. La "diabetes doble" en jóvenes y su tratamiento. Diabetes Voice. 2006;51(1):19-22.
18. Aye T, Levitsky LL. Type 2 diabetes: an epidemic disease in childhood. Curr Opin Pediatr. 2003;15:411-5.
19. Cruz M, Torres M, Aguilar-Herrera B, Pérez R, Guzmán N, Aranda M, et al. Type 2 diabetes mellitus in children-an increasing health problem in Mexico. J Pediatr Endocrinol Metab. 2004;17:183-90.
20. Pinhas O, Zeitler P. The global spread of type 2 diabetes mellitus in children and adolescents. J Pediatr. 2005;146:693-700.
21. Kobayashi K, Amemiya S, Higashida K, Ishihara T, Sawanobori E, Mochizuki M, et al. Pathogenic factors of glucose intolerance in obese Japanese adolescents with type 2 diabetes. Metabolism. 2000;49:186-91.
22. Fagot-Campagna A, Pettitt DJ, Engelgau MM, Ríos N, Giell LS, Valdez R, et al. Type 2 among North American children and adolescents: an epidemiologic review and a public health perspective. J Pediatr. 2000;136:664-72.
23. Diabetes in Children Adolescents Work Group of the National Diabetes Education Program. An update on Type 2 diabetes in youth from the National Diabetes Education Program. Pediatrics. 2004;114:259-62.
24. Lipton R, Keenan H, Onyemere KU, Freels S. Incidence and onset features of diabetes in African-american and latino children in Chicago, 1985-1994. Diabetes Metab Res Rev. 2002;18:135-42.
25. Bacha F, Saad R, Gungor N, Janosky J, Arslanian SA. Obesity, regional fat distribution, and syndrome X in obese black versus white adolescents: Race differential in diabetogenic and atherogenic risk factors. J Clin Endocrinol Metab. 2003;88:2534-40.
26. Hillier TA, Pedula KL. Complications in young adults with early-onset type 2 diabetes: losing the relative protection of youth. Diabetes Care. 2003;26:2999-3005.
27. S.E.A.R.C.H. for Diabetes in Youth Study Group, Liese AD, D'Agostino RB, Hamman RF, Kilgo PD, Lawrence JM. The burden of diabetes mellitus among US youth: prevalence estimates from the SEARCH for Diabetes in Youth Study. Pediatrics. 2006;118(4):1510-8.
28. Wabitsch M, Hauner H, Hertrampf M, Muche R, Hay B, Mayer H, et al. Type 2 diabetes mellitus and impaired glucose regulation in Caucasian children and adolescents with obesity living in Germany. Int J Obes. 2004;28:307-13.
29. Organización Panamericana de la Salud. Estrategia Mundial sobre Alimentación Saludable, Actividad Física y Salud (DPAS). Plan de Implementación en América Latina y el Caribe 2006-2007 [homepage en Internet]; Washington D.C., OPS, 2006 [citado 23 de mayo de 2015]. Disponible en: http://www.msal.gov.ar/argentina-saludable/pdf/dpas-plan-imp-alc.pdf
30. Cambizaca GD, Castañeda I, Sanabria G. Sobrepeso, obesidad y diabetes mellitus 2 en adolescentes de América Latina en 2000-2010. Rev Cubana Med Gen Integr [serie en Internet]. 2015 [citado 1º de septiembre de 2016];31(2). Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0864-21252015000200011&lng=es&nrm=iso&tlng=es
31. International Diabetes Federation (IDF). Atlas IDF. The global pictures. The IDF Diabetes Atlas. 7th. ed. Brussels: IDF; 2015. p. 12.
32. Asociación Latinoamericana de diabetes. Guías ALAD 2000 para el diagnóstico y manejo de la diabetes mellitus tipo 2 con medicina basada en evidencia. Rev Asoc Latinoam Diab. 2000;(sup 1 ed. extraordinaria).
33. Nice clinical guideline. Management of type 2 diabetes: management of blood glucose. London: National Institute for Clinical Excellence; 2008.
34. Grupo de trabajo de la Guía de práctica clínica sobre diabetes tipo 2. Guía de práctica clínica sobre diabetes tipo 2. Madrid: Plan Nacional para el SNS. Agencia de evaluación de tecnologías sanitarias del país Vasco; 2008.
35. Arnold Y, Licea M, Castelo L, Medina I. Comportamiento de indicadores epidemiológicos de morbilidad por diabetes mellitus en Cuba, 1998-2009. Revista Peruana de Epidemiología [serie en Internet]. 2012 [citado 27 de octubre de 2016];16(enero-abril). Disponible en: http://www.redalyc.org/html/2031/203124341004/
36. Mbanya JC, Hospedales J. A report from: the diabetes summit for latinamerica, Bahia Brazil June 30th-july 2nd. Pract Diab Int. 2010;27(sup):9.
37. International Diabetes Federation (IDF). Regional overview. IDF Diabetes Atlas. 4th. ed. Brussels: IDF; 2009. p. 22.
38. Macmullan J. perspectivas mundiales de la diabetes. Proteger a la generación de la comida basura: la necesidad de una intervención internacional. Diabetes in Voice. 2009;54(3):15.
39. Bonet M, Varona P. III Encuesta nacional de factores de riesgo y actividades preventivas de enfermedades no trasmisibles. Cuba 2010-2011. La Habana: Editorial Ciencias Médicas; 2015. p. 110-78.
40. Cuba (Minsap). Oficina Nacional de Estadísticas (ONE). Anuario Estadístico de Cuba, 2015. La Habana; 2016. p. 17.
41. Onkamo P, Vaananen S, Karvonen M, Tuomilehto J. Worldwide increase in incidence of type 1 diabetes: the analysis of the data on published incidence trends. Diabetologia. 1999;42:1395-403.
42. Green A, Patterson CC. Trends in the incidence of childhood-onset diabetes in Europe 1989-1998. Diabetologia. 2001;44(sup 3):3-8.
43. Karvonen M, Viik-Kajander M, Moltchanova E, Libman I, LaPorte R, Tuomilehto J. Incidence of childhood type 1 diabetes worldwide. Diabetes Mondiale (DiaMond) Project Group. Diabetes Care. 2000;23:1516-26.
44. Vilardell C. El aumento de la diabetes tipo 1 y 2 en niños y adolescentes. Madrid: Observatorio de la salud de la infancia y la adolescencia, FAROS; 2012.
45. Dabelea D. The accelerating epidemic of childhood diabetes. The Lancet. 2009;(373)9680:1999-2000.
46. Barceló A, Aedo C, Rajpathak S, Robles S. The cost of diabetes in Latin America and the Caribbean. Bull World Health Organ. 2003;81(1):19-27.
47. Barceló A, Rajpathak S. Incidence and prevalence of diabetes mellitus in the Americas. Rev Panam Salud Publica. 2001;10(5):300-8.
48. Erlich HA, Zeidler A, Chang J, Shaw S, Raffel LJ, Klitz W, et al. HLA class II alleles and susceptibility and resistance to insulin dependent diabetes mellitus in Mexican-American families. Nat Genet. 1993;3(4):358-64.
49. Shaw SJ, Vadheim CM, Rotter JI, Costin G, Beshkov Y, Zeidler A. Ancestral origin of insulin-dependent diabetes in Mexican Americans. Int J Epidemiol. 1992;21(4):725-9.
50. Rewers M, LaPorte RE, King H, Tuomilehto J, Diabetes Epidemiology Research International Group. Trends in the prevalence and incidence of diabetes: insulin-dependent diabetes mellitus in childhood. World Health Stat Q. 1990;41:179-89.
51. Karvonen M, Pitkäniemi M, Pitkäniemi J, Kohtamäki K, Tajima N, Tuomilehto J. Sex difference in the incidence of insulin-dependent diabetes mellitus: an analysis of the recent epidemiological data. Diabetes Metab Rev. 1997;13:275-91.
52. Silink M. Childhood Diabetes: A Global Perspective. Horm Res. 2002;57(sup 1):1-5.
53. Atkinson MA, MacLaren NK. The pathogenesis of insulin-dependent diabetes. N Engl J Med. 1994;331:1428-36.
54. Maahs DM, West NA, Lawrence JM, Mayer-Davis EJ. Epidemiology of Type 1 Diabetes. Endocrinol Metab Clin North Am. 2010;39(3):481-97.
55. Pérez Y, Díaz A, Navarrete J, Curbelo Y. Incidencia de diabetes mellitus tipo 1 en la provincia Mayabeque. Medimay [serie en Internet]. 2015 [citado 25 de junio de 2017];21(0). Disponible en: http://revcmhabana.sld.cu/index.php/rcmh/article/view/754
56. Dahlquist G. Can we slow the rising incidence of childhood onset autoimmune diabetes? The overload hypothesis. Diabetología. 2006;49:20-4.
57. Soltész G. La diabetes en niños: tendencias cambiantes dentro de una epidemia emergente. Diabetes Voice. 2007;52(2):34-56.
58. Cuba (Minsap). Dirección Nacional de Estadísticas y Registro Médicos. Anuario estadístico de salud, 2015. La Habana; 2016.
59. Jiménez SM, Rodríguez A, Díaz M. La obesidad en Cuba: Una mirada a su evolución en diferentes grupos poblacionales. Revista Cubana de Alimentación y Nutrición. 2013;23(2):297-308.
60. Cosson CI. Aspectos de saúde relacionados a fatores de risco para o DM 2 em adolescentes do Município de Rio Branco-Acre [tesis]. Universidade de São Paulo, Brasil; 2011.
61. Guerra CE, Vila J, Apolinaire JJ, Cabrera AC, Santana I, Almaguer P. Factores de riesgo asociados a sobrepeso y obesidad en adolescentes. Medisur. 2009;7(2):25-34.
62. Licea ME, Bustamante M, Lemane M. Diabetes tipo 2 en niños y adolescentes: aspectos clínico-epidemiológicos, patogénicos y terapéuticos. Rev Cuba Endocrinol [serie en Internet]. 2008 [citado 9 de octubre de 2012];19(1). Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1561-29532008000100007&lng=es&nrm=iso&tlng=es
63. Garcia F, Solis J, Luque E, Neyra L, Manrique H, Cancino R, et al. Prevalencia de diabetes mellitus y factores de riesgo relacionados en una población urbana. Rev Soc Peru Med Interna. 2007;20(3):90-4.
64. Lício DAC. Prevalencia de sobrepeso e obesidades em adolescentes escolares do Município de Fortaleza [tesis]. Universidade Federal do Ceará, Brasil; 2004.
65. Red Internacional de Grupos Pro Alimentación Infantil IBFAN. Los malos hábitos alimenticios provocan diabetes en los niños. Boletines de la red IBFAN América Latina y el Caribe [homepage en Internet]; IBFAN, año II, número 8, 2007 [citado 28 de abril de 2015]. Disponible en: http://www.ibfan-alc.org/boletines/medios_07/0208/0208_si.htm
66. Instituto Colombiano de Bienestar Familiar. Encuesta Nacional de la Situación Nutricional de Colombia, 2005 [homepage en Internet]; Borda Villega C, editor. Ensin. Bogotá: Panamericana Firmas e Impresos, 2005 [citado 12 de mayo de 2015]. Disponible en: http://www.icbf.gov.co/portal/page/portal/PortalICBF/NormatividadGestion/ENSIN1/ENSIN2005/LIBRO_2005.pdf
67. Pérez LM, Herrera R, Villacís D, de León M, Fernández I. Obesidad pediátrica y factores de riesgo cardiometabólicos asociados. Rev Cubana Pediatr. 2014;86(3):273-88.
68. Pérez LM, Herrera R, Chong A, Villacís D, Fernández I. Marcadores de daño vascular y renal en orina en niños y adolescentes obesos. Rev Cubana Pediatr [serie en Internet]. 2014 Jun [citado 5 de noviembre de 2013];86(2). Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0034-75312014000200005&lng=es&nrm=iso&tlng=es
Recibido: 26 de febrero de 2017.
Aprobado: 26 de junio de 2017.
Yuri Arnold Domínguez. Instituto Nacional de Endocrinología. Calle Zapata y D, Vedado, municipio Plaza de la Revolución. La Habana, Cuba. Correo electrónico: yuri.arnold@infomed.sld.cu