Introducción
La infertilidad es considerada como un trastorno de la salud reproductiva y reconocida como tal por la Organización Mundial de la Salud (OMS). Tiene percusiones no solo desde el punto de vista orgánico, sino en el status psicosocial de la pareja.1 Afecta entre 15 y 20 % de las parejas en edad reproductiva2, comportándose en nuestro país, en estudio realizado por Padrón y otros entre 14 y 16 %.3 Alrededor del 40 - 50 % de los casos, son de origen masculino.4
El manejo de la pareja con problemas de infertilidad es complejo y los tratamientos convencionales, dirigidos esencialmente a corregir la causa probable suelen ser infructuosos, lo que conlleva a utilizar técnicas de reproducción asistida (TRA).
Basado en los aportes de sus predecesores, en 1978 el grupo inglés liderado por Robert Edwards, logró exitosamente el primer nacimiento humano mediante la fertilización in vitro (FIV), en el Reino Unido.5 En nuestro continente, los primeros resultados en nacidos vivos, fueron en los Estados Unidos de América, en 1981.6 Desde entonces, las TRA en general y la FIV en particular, han tenido un crecimiento vertiginoso y se han ido extendiendo a numerosos centros, donde se desarrollan nuevos procederes que la hacen más efectiva.
En Cuba, desde 1979 se dieron los primeros pasos con la transferencia embrionaria en animales, pero no fue hasta la década del 80, que comenzaron los estudios en reproducción humana. Los pioneros fueron el Instituto Nacional de Endocrinología (INEN) y el Hospital Ginecobstétrico “Ramón González Coro”, donde se logró en 1986 el primer nacido vivo de esta técnica en Cuba y Centro América. En el Servicio de Endocrinología y Reproducción del Hospital Clínico Quirúrgico “Hermanos Ameijeiras” se iniciaron los primeros estudios para implementar la FIV y no fue hasta 1990 que se obtuvieron 3 embarazos en ese año y el nacimiento de un niño en 1992. Después de una pausa originada por factores económicos, en 1999 se reinicia el trabajo en esta especialidad, creándose un Centro de Referencia Nacional de Reproducción Asistida y convirtiendo a Cuba, en el único país de América Latina que brinda este servicio de forma gratuita a disposición de las parejas que lo necesiten.7
Nuestro centro, a pesar de las reales limitaciones económicas, hace un considerable esfuerzo y ha logrado conformar un laboratorio, con las condiciones técnicas necesarias y un equipo humano multidisciplinario capacitado, para llevar a cabo la reproducción asistida de alta tecnología en un numeroso grupo de parejas, que son remitidas del Programa Nacional de atención a la pareja infértil.
Si bien los métodos de reproducción asistida se han desarrollado de manera apreciable desde el punto de vista técnico, ello por sí solo no basta para lograr un embarazo, que es el objetivo final de las TRA. Con el desarrollo de las mismas, se han ido definiendo factores maternos y paternos, que pueden influir en el éxito del proceso.
El análisis del semen sigue siendo la prueba clínica de laboratorio más importante para la evaluación del factor masculino. El número y la concentración de los espermatozoides, su movilidad y su normalidad morfológica son factores importantes que determinan el éxito en la consecución de un embarazo.8 Aunque el análisis del semen, constituye un pilar esencial para la evaluación de la infertilidad, en algunas parejas no permite detectar la presencia de alteraciones micromorfológicas del espermatozoide.9 Se considera que aproximadamente 15 % de los varones infértiles presenta un espermograma dentro de la normalidad,10 por lo que recientes estudios indican que la fragmentación del ácido desoxiribonuclueico (ADN) espermático podría ser otro predictor de fertilidad y que un ADN intacto es necesario para la correcta transmisión del material genético a la próxima generación.11
Las alteraciones en el ADN de los espermatozoides son consideradas una causa importante de infertilidad y han despertado particular interés por el riesgo que implica la transmisión de defectos genéticos a la descendencia, en especial, cuando se utilizan TRA.12 En estos procedimientos no es posible realizar una selección espermática que permita excluir espermatozoides con daño genómico.
Diversos estudios clínicos indican que el porcentaje de espermatozoides con fragmentación del ADN, está significativamente correlacionado con la tasa de embarazo tanto in vivo como in vitro y demuestran que los varones infértiles tienen una mayor fracción de espermatozoides con roturas en el ADN,13,14 por lo que se ha intentado establecer un punto de corte por encima del cual, el pronóstico sería desfavorable. Estos ensayos permiten discriminar entre individuos fértiles e infértiles y pueden ser determinantes en el tratamiento de la pareja infértil, como por ejemplo, en la recomendación del procedimiento de reproducción asistida más adecuado.15,16
Se han desarrollado varias técnicas, objetivas y reproducibles, para detectar rupturas de hebra simple o doble en el ADN espermático. Estas incluyen métodos directos, como, los ensayos de TÚNEL (terminal deoxynucleotidyl transferase-mediatedl' - deoxyundine5' - tnphosphate nick end - labeling) y Cometa (single - cell gel electrophoresis assay) y, métodos indirectos, como el análisis de la estructura de la cromatina (SCSA).10,17,18
Fernández y otros19,20, desarrollaron una nueva técnica que permite evaluar la integridad del ADN. Se trata del ensayo de dispersión de la cromatina espermática (SCD). Mediante un tratamiento ácido se induce la descondensación del ADN y los espermatozoides con ADN intacto son visualizados (mediante microscopía de campo claro) por la formación de un halo de dispersión alrededor de la cabeza. Los espermatozoides con ADN fragmentado no forman este halo de dispersión. Esta metodología es sencilla de realizar, rápida y requiere de instrumentos de laboratorio de fácil acceso. Además, es de bajo costo y se correlaciona con técnicas existentes de mayor complejidad y costo.
El origen de las lesiones en el ADN del espermatozoide puede deberse a múltiples causas, como son, determinadas condiciones ambientales: temperatura testicular elevada, contaminación atmosférica y tabaquismo; o patológicas: criptorquidia, varicocele, procesos inflamatorios o infección del tracto genital, cáncer, episodios febriles, estrés, uso de fármacos, factores hormonales, o edad avanzada.10,21,22,23,24 El mecanismo molecular implicado en estas lesiones se encuentra en investigación. Los principales mecanismos en consideración son el empaquetamiento anormal del ADN espermático durante el proceso de espermatogenésis, la apoptosis abortiva y la presencia o acción sobre el ADN de las especies reactivas de oxígeno (ROS).25,26,27,28
La realización de esta investigación ofrece elementos teóricos importantes, ya que contribuye al entendimiento de los problemas relacionados con el éxito/ fracaso de la FIV, generando un marco conceptual, científicamente establecido, sobre la reproducción humana y las técnicas empleadas para la solución de los problemas de infertilidad. Por otra parte, tiene implicaciones clínicas, porque permite una mejor selección de las parejas tributarias de reproducción asistida de alta tecnología, lo que supondría, aumentar notablemente las tasas de éxito, reducir el número de ciclos innecesarios y conseguir finalmente, no solo una eficiencia mayor de estas técnicas, sino también un menor costo socioeconómico.
El conocimiento de los factores que influyen en las alteraciones del ADN de la cromatina espermática, es de vital importancia puesto que facilita generar estrategias terapéuticas y de prevención dirigidas a mejorar la calidad del semen paterno.
Métodos
Se realizó un estudio descriptivo transversal, en el servicio de Endocrinología del Hospital Clínico Quirúrgico “Hermanos Ameijeiras”, de conjunto con el Centro Nacional de Genética Médica “Victoria de Girón”, en el período comprendido de enero a diciembre de 2013.
El universo estuvo conformado por parejas infértiles remitidas del Programa Nacional de atención a la pareja infértil, que requirieron FIV convencional. La muestra quedó constituida por 107 parejas infértil, que cumplieron los criterios de inclusión: mujeres de edad ≤ 42 años, causa tubárica de infertilidad o reserva ovárica normal (niveles de FSH basal ≤ 10 mUI/ml), estudios hormonales previos al proceder dentro del rango de la normalidad (prolactina, insulinemia, hormona estimulante de la tiroides, estradiol basal), así como los siguientes criterios de exclusión: mujeres con presencia de fibroma uterino que comprometa la cavidad endometrial, pólipo endometrial o hidrosalpinx, no respuesta a la inducción de la ovulación -que se consideró cuando al 6to día tenían menos de tres folículos en cada ovario, con un diámetro menor de 10 mm y niveles de estradiol por debajo de 1000 pmol/L-, presencia de enfermedades de transmisión sexual, genéticas, malignas, degenerativas o caquectizantes, así como hombres con alteraciones severas del espermograma. El tamaño de la muestra se determinó por razones de factibilidad y la inclusión se realizó de forma consecutiva.
Se determinó el índice de fragmentación del ADN de la cromatina espermática (IFA) mediante el test de dispersión de la cromatina espermática (SCD): “Sperm Chromatin Dispersion”. Se define como un IFA normal cuando se encuentra en un 22 % ± 2.19,20 En nuestro estudio se estableció que el potencial fertilizante de una muestra seminal en función del índice de fragmentación del ADN de la cromatina espermática era alto cuando este era
< de 25 %, o bajo, cuando era ≥ a 25 %. Para la realización de este examen los hombres fueron citados en el laboratorio de Reproducción Asistida del hospital Hermanos Ameijeiras, en el período comprendido entre el primer mes posterior al ciclo de estimulación de la inducción de la ovulación, donde se tomó la muestra de semen que fue enviada al Centro Nacional de Genética Médica para su análisis y procesamiento.
Durante el proceso de FIV se analizaron variables como: número de óvulos aspirados y fertilizados, tasa de fertilización, calidad de las tripletas embrionarias que serían transferidas al útero, y se realizó la determinación de la Beta HCG, que en caso de ser positiva (valor ≥ a 5 mUI/ml), se evaluó por ultrasonido la presencia o no de embarazo. Además, se analizaron variables que consideramos pueden influir en el índice de fragmentación del ADN espermático: edad paterna, varicocele y otras condiciones como el consumo de alcohol, hábito de fumar y exposición a agentes físico/químicos.
El procesamiento de los datos se realizó mediante el paquete estadístico SPSS versión 15 para Windows. Se emplearon medidas de resumen para variables cualitativas (frecuencias absolutas y porcentajes); para las variables cuantitativas se calculó el promedio y la desviación estándar. Para evaluar la asociación entre la variable potencial fertilizante en relación con las variables de resultados se emplearon: tasa de fertilización, calidad embrionaria y embarazo. Se confeccionaron tablas de contingencia y se realizó un análisis univariado empleando la prueba de independencia Chi Cuadrado (X2), o test exacto de Fisher, según fuera apropiado. El análisis multivariado se basó en el modelo de regresión logística paso a paso, donde además se obtuvieron los Odds Ratio (OR) “ajustados”, controlando el resto de las variables con intervalos de confianza del 95 %. La elección de las variables explicativas consideradas para este análisis respondió a un análisis previo donde se evalúo la asociación entre todas las variables explicativas, mediante la determinación del coeficiente de contingencia. Para este análisis se tomó como variable dependiente la calidad embrionaria de forma dicotómica (buena y mala calidad) y como variables explicativas o independientes, el potencial fertilizante, la edad materna y los años de infertilidad. Se utilizó un nivel de significación de 5 % para todas las pruebas empleadas. Se estimó el (OR) o razón de productos cruzados con el propósito de cuantificar la magnitud de la asociación en aquellos casos donde esta resultó significativa en el análisis univariado.
Resultados
En las 107 parejas incluidas en la investigación, la edad materna promedio fue de 33,4 años (DE 4,25 años), mientras que la paterna fue de 38,1 años (DE 6,59 años). Los años de infertilidad tuvieron una media de 7,81 años (DE 3,6). Los hombres con antecedentes de hijos previos constituyeron el 34,6 %.
El índice de fragmentación de la cromatina espermática tuvo una media de 27,3 % (DE 8,6). El 33,6 % (36 hombres) presentaron un alto potencial fertilizante (Fig.1).
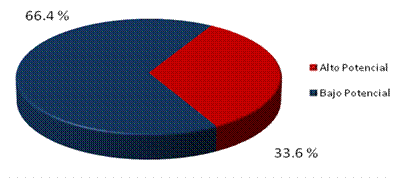
Fig. 1 - Distribución del potencial fertilizante acorde al índice de fragmentación del ADN de la cromatina espermática.
La tasa de fertilización promedio para el grupo de pacientes con bajo potencial fertilizante fue de 75,56 (DE 19,05) y de 81,82 (DE 15,87) para los que poseían un alto potencial fertilizante. A pesar de no existir diferencias significativas (P= 0.39) se observa un ligero predominio de la baja tasa de fertilización en los pacientes con bajo potencial fertilizante (Fig. 2).
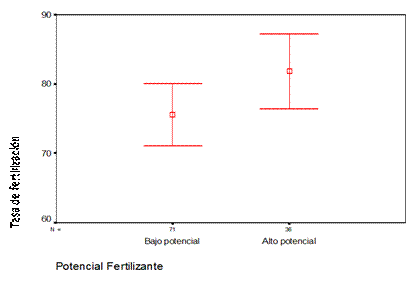
P= 0.39 (P: significativa para p ?λτ;0.05)
Fig. 2 - Comportamiento de la tasa de fertilización en los grupos con alto y bajo potencial fertilizante.
Como se muestra en la tabla 1, la buena calidad embrionaria predominó en 64 pacientes (59,1 %). La tabla refleja una asociación significativa entre el potencial fertilizante y la calidad embrionaria (P= 0.036). Nótese que un porcentaje mayor de pacientes con mala calidad (79,1 %) poseía un bajo potencial fertilizante con relación a los pacientes con buena calidad, que poseían la misma condición de potencial (57,8 %). Dicha relación se corroboró mediante la estimación de la razón de productos cruzados: (OR= 2,76 (1,05 - 7,39) IC:95 %). Lo que significa que los pacientes con bajo potencial fertilizante muestran mayor probabilidad de asociarse a una mala calidad embrionaria.
Tabla 1- Comportamiento del potencial fertilizante en relación con la calidad de los embriones a transferir
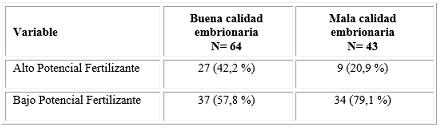
P= 0.036 (OR (95 % IC) = 2.76 (1.05-7.39)
Solo en 17 mujeres (15,9 %) se obtuvo embarazo clínico, con un comportamiento similar en los diferentes grupos en estudio, no existiendo diferencias significativas entre ellos (P= 1.00) (Tabla 2).
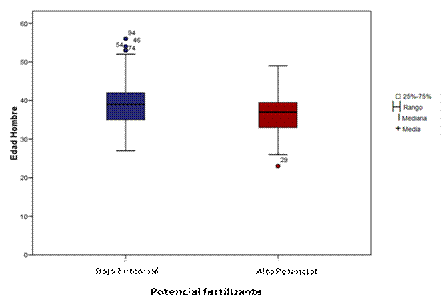
La media de la edad paterna en los pacientes con bajo potencial fue de 39,1 años (DE 6,68 años) y con alto potencial de 36,1 años (DE 6,07), lo cual fue estadísticamente significativo (P= 0.032) (Fig. 3).
En la tabla 3 se puede apreciar que el 24,30 % (26 varones) tenían antecedentes de varicocele (21 se habían operado en el momento del estudio), de los cuales 23 (32,4 %) poseían un bajo potencial fertilizante con una diferencia estadísticamente significativa (P= 0.008). Se corroboró esta asociación mediante la estimación del OR, que muestra un valor de 5,27 con IC de 1.34 - 24.09. Esto significa que la probabilidad de tener un bajo potencial fertilizante es mayor en los pacientes con antecedentes de varicocele.
Consumían alcohol en el momento de la consulta 45 pacientes (42,1 %), solo 2 (5,6 %) bebían de forma moderada y los 43 pacientes restantes lo hacían sin transgredir las normas sociales (40,2 %). En ninguno de los casos estuvo presente el alcoholismo. El hábito de fumar estuvo presente en 17,8 % de los hombres y 24 de ellos (22,4 %) estuvieron expuestos a agentes físicos o químicos ambientales. El porciento de pacientes que consumían de alcohol, poseían el hábito de fumar y estaban expuestos a agentes físicos o químicos ambientales fue ligeramente superior en los varones que mostraron bajo potencial fertilizante, aunque no se encontraron diferencias significativas (Tabla 3).
Discusión
Los parámetros obtenidos en el estudio del semen, a través de un espermograma convencional no aportan una información completa y detallada de su potencial fecundante y de la capacidad de proporcionar un embrión de buena calidad y un embarazo evolutivo.29
Está demostrado que los varones infértiles tienen una mayor fracción de espermatozoides con roturas en el ADN, por lo que, un estudio exhaustivo del factor masculino requiere determinar otros parámetros como es el índice de fragmentación del ADN espermático. Este hecho puede tener un impacto negativo en los resultados de las técnicas de reproducción asistida de alta tecnología.
Las muestras de semen que presentan altos niveles de daño en el ADN están con frecuencia relacionadas con una disminución de las tasas de fertilización o implantación después de la FIV, y pueden estar asociadas a una mala calidad embrionaria y aumento de la probabilidad de aborto.30,31)
Investigaciones relacionadas con esa temática32,33, reportan que el grado de fragmentación del ADN de la cromatina espermática oscila en valores tan bajos como 8,7 % hasta tan altos como el 65,1 %. En nuestro estudio la media fue de 27,3 % (DE 8,6).
A pesar de no existir diferencias significativas (P= 0.39) se comprobó un ligero predominio de la baja tasa de fertilización en los pacientes con bajo potencial fertilizante. Se demostró una alta incidencia de embriones de buena calidad (59,1 %), resultado que está en relación a la edad promedio de las pacientes que fue inferior a los 35 años (33,4 años [DE 4,25 años]) edad en que la mujer se encuentra en condiciones fisiológicas óptimas para la reproducción. 34,35,36
El grado fragmentación del ADN de la cromatina espermática no se relacionó con la tasa de fertilización, ni con la obtención de embarazo en nuestra investigación. Se demostró que existe asociación entre en el grupo de pacientes con embriones de buena calidad y el alto potencial fertilizante en análisis univariado. Es difícil relacionar el grado de daño del ADN espermático con los resultados de la técnica de FIV, considerando que varios factores pueden influir en que una paciente sometida a una TRA de alta tecnología y FIV, obtengan resultados en términos de embarazo.
Existen estudios37,38,39 donde se observó que el índice de fragmentación del ADN espermático y la tasa de fertilización no estaban relacionados y sin embargo, otros estudios40,41 demostraron una correlación negativa entre la fragmentación del ADN y la tasa de fertilización en FIV. Virro y otros42 y Sadeghi y otros43 determinaron la relación entre los resultados de SCSA y los resultados en la FIV. En el estudio de Virro y otros42, las tasas de fertilización no fueron estadísticamente significativas entre grupos con alto y bajo índice de fragmentación. Por su parte Sadeghi y otros43 comprobaron que la tasa de fertilización fue significativamente elevada en el grupo con fragmentación de ADN espermático inferior a 10 % (p< 0.05), por lo que la integridad de la cromatina espermática era esencial para una fertilización satisfactoria.
La influencia de la integridad subóptima de la cromatina espermática en el desarrollo embrionario es objeto de investigaciones.44 Las primeras etapas del desarrollo embrionario están sometidas al control materno y la expresión de los genes paternos comienza en el estadio de 4 - 8 células; en ese momento las alteraciones del ADN paterno se ponen de manifiesto, perjudicando el desarrollo del embrión y produciendo bloqueo embrionario, que puede explicar fallos de implantación, embarazos bioquímicos o abortos clínicos.45,46 El efecto paterno es aparente ya en el estadio embrionario de pronúcleos (efecto paterno temprano), y se ha sugerido que puede deberse a una deficiencia de factores activadores del ovocito, o a un elevado nivel de fragmentación que pueda exceder la capacidad reparadora del mismo.47,48 La implicación de la fragmentación del ADN espermático en este estadio todavía es un tema controvertido.
Investigadores han intentado establecer la correlación entre el daño de la cromatina espermática y la calidad embrionaria.32,33,49). Otros reportes indican que el daño del ADN espermático podría estar relacionado con un aumento en la muerte embrionaria prematura. 50
Tras observar un efecto negativo de una elevada fragmentación en los resultados de las TRA, se ha sugerido que el daño en el ADN del espermatozoide podría considerarse un marcador para el estudio de la implicación paterna en el desarrollo preimplantacional en humanos. Así Tesarik y otros51 demostraron que un alto nivel de fragmentación del ADN espermático normalmente no se asocia con anormalidades morfológicas en los estadios embrionarios iniciales pero afecta a la tasa de implantación (efecto paterno tardío). Estos autores proponen que un análisis de la fragmentación del ADN espermático es un buen método diagnóstico para revelar la causa paterna de los repetidos fallos de implantación en FIV con embriones de buena calidad morfológica.
Los investigadores52 con la técnica SCSA, no obtuvieron ningún embarazo tras FIV con un índice de fragmentación del ADN espermático en semen fresco superior al 27 %. De acuerdo con estos resultados Virro y otros42 observaron que un índice de fragmentación en semen fresco por encima de 30 % se correspondía con una baja tasa de formación de blastocistos y de embarazo. Sin embargo Bungum y otros53 y Payne y otros54 sí consiguieron embarazo tras FIV con un índice de fragmentación mayor de 27 %. En otro estudio Bungum y otros55, compararon las tasas de embarazo, tanto en ciclos naturales, como en ciclos con inseminación artificial (IA) y FIV durante un período de 10 años y concluyeron que un índice superior a 30 % está asociado con una muy baja probabilidad de embarazo por vía natural y por IA, pero no con la FIV. Cuando el índice estaba superior a 20 %, la posibilidad natural de embarazo estaba reducida, a pesar de poseer parámetros seminales normales.
Henkel y otros37 obtuvieron resultados similares a los anteriores usando la técnica TUNEL. En este estudio la fragmentación del ADN espermático no se correlacionó con la tasa de fertilización ni con la calidad embrionaria, los pacientes con un alto porcentaje de fragmentación (TUNEL positivo: > 36,5%) mostraban una disminución significativa de las tasas de embarazo, con respecto a los pacientes que poseían TUNEL positivo en valores inferiores. Mediante esta técnica se han llevado a cabo estudios posteriores. Benchaib y otros 56 tras llevar a cabo 54 ciclos de FIV tampoco obtuvieron ningún embarazo cuando la fragmentación era mayor de 20 %. Sin embargo, Seli y otros45) y Huang y otros57 no apreciaron una relación entre la tasa de embarazo y la tasa de fragmentación del ADN espermático.
Si bien existen desacuerdos en los resultados de los estudios realizados sobre la influencia de la fragmentación del ADN de la cromatina espermática en los resultados de las TRA de alta tecnología, una selección de espermatozoides más estricta, asegura mejores resultados durante la aplicación de estas técnicas de reproducción humana, tal es el caso de la inyección intracitoplasmática de espermatozoides morfológicamente seleccionados (IMSI).58
En la actualidad se han realizado numerosos trabajos no sólo para establecer la relación entre el daño del ADN espermático y los resultados de las TRA, sino también para identificar los factores causales del daño del ADN.
Se estiman entre 40 - 50 % los casos de infertilidad atribuibles a una causa masculina, por lo que el análisis de las características del semen es esencial en la valoración de la pareja con dificultades reproductivas.
La Organización Mundial de la Salud59 estableció parámetros básicos para el estudio de la pareja infértil, donde se analiza en el factor masculino: volumen de eyaculado, concentración de espermatozoides, movilidad, morfología viabilidad y concentración de leucocitos. Se considera que aproximadamente entre 10 y 15 % de los varones infértiles presentan parámetros dentro de rangos normales.60 En estos casos el origen de la infertilidad masculina podría deberse, entre otras causas, a defectos en la membrana del espermatozoide, factores ambientales, o genéticos y por tanto no detectables en el espermograma convencional.10,61
En nuestro trabajo se encontró relación entre la edad paterna y el grado de fragmentación del ADN espermático, lo cual concuerda con lo referido por la literatura.
El efecto de la edad paterna sobre la fertilidad constituye actualmente un tópico de interés en salud pública, debido a que las estadísticas de nacimiento demuestran que un número cada vez mayor de varones escogen ser padres a edades más avanzadas (> 40 años). La mayor edad paterna ha sido implicada en una variedad de alteraciones reproductivas y genéticas, que incluyen: disminución de la calidad seminal, aumento de la fragmentación del ADN en los espermatozoides eyaculados, disminución de la fertilidad, aumento de la frecuencia de abortos espontáneos y mayor incidencia de enfermedades genéticas.62,63
Un creciente número de trabajos reportan una asociación entre la mayor edad en el varón y el aumento de espermatozoides eyaculados que presentan daño en el ADN nuclear, lo que supone que, a mayor edad, mayor es la exposición acumulativa del hombre a factores ambientales que pueden causar alteraciones genéticas en los gametos y dañar su ADN.64,65 Los mecanismos a través de los cuales se genera este daño no están completamente establecidos. Se sugiere, como posibles factores involucrados, las alteraciones de la apoptosis testicular y la disminución de los mecanismos de defensa antioxidante.64
La asociación entre el aumento de daño genómico en los espermatozoides y la edad del varón es un factor que reviste gran importancia por el riesgo potencial de transmitir el daño genético a la descendencia.10,66 En estudio realizado por Horta y otros65 se analizó la relación entre la edad paterna y el grado de fragmentación del ADN espermático, mediante el estudio de 62 muestras seminales evaluadas a través de los ensayos de TÚNEL y de dispersión de la cromatina espermática (SCD). Los resultados demostraron un aumento significativo de este daño en varones mayores de 40 años. Wyrobeck y otros62, en un grupo bien caracterizado (no fumador) de 97 varones entre 22 y 80 años, se demostró una clara asociación entre las siguientes variables: incremento de la edad del individuo, porcentaje de fragmentación del ADN, daño a la cromatina y mutaciones genéticas. Mientras que la incidencia de aneuploidías/diploidías no se asoció con la edad del varón.
La dilatación anormal de las venas del plexo pampiniforme se define como varicocele.67 Es una condición con elevada incidencia dentro de la población infértil que afecta a 21- 41 % de los hombres con infertilidad primaria y a 75-81 % de pacientes con infertilidad secundaria.68 Varias hipótesis han sido sugeridas para explicar el mecanismo por el cual el varicocele produce infertilidad. Algunas de ellas incluyen, un incremento en la apoptosis, daño del ADN espermático, estrés oxidativo, hipoxia tisular, y de cambios degenerativos en los túbulos seminíferos.69
En nuestro estudio se encontró asociación con el daño en el ADN, lo cual ha sido reportado en otras investigaciones.70
El nivel excesivo de óxido nítrico (ON) dentro de las venas espermáticas dilatadas ha sido identificado en pacientes subfebriles con varicocele. Estos niveles de ON pudieran repercutir en la disfunción de los espermatozoides.71
Estudios relacionados con la temática han mostrado que el varicocele incrementa el daño del ADN espermático y que cuando el varicocele es operado, disminuye el estrés oxidativo seminal y mejora la fragmentación del ADN.72,73
En un estudio realizado por Allamaneni y otros74, se reportó una correlación positiva entre los niveles de ROS en semen y el grado de varicocele (fueron significativamente más elevadas en pacientes con varicocele grado 2 y 3, que en pacientes con varicocele grado 1). En reciente metaanálisis realizado por Agarwal y otros75 se compararon espermogramas de pacientes con varicocele y espermogramas normales de donantes, encontrándose niveles aumentados de estrés oxidativo, así como disminución significativa de la concentración de antioxidantes en los pacientes con varicocele.
Mostafa y otros76 reportaron que la cirugía del varicocele reduce los niveles de ROS del plasma seminal de hombres infértiles asociado con incremento en la concentración seminal de antioxidantes como las superóxido dismutasa, catalasa, glutation peroxidasa y vitamina E.
Otros factores que influyen en la fragmentación del ADN de la cromatina espermática fueron analizados en nuestra investigación: consumo de alcohol, hábito de fumar y exposición a agentes físicos y químicos, los cuales no se relacionaron con el índice de fragmentación del ADN de forma significativa. No obstante, estos se presentaron con mayor frecuencia en los varones que mostraron bajo potencial fertilizante.
La asociación entre el hábito de fumar y la disminución de la calidad seminal ha sido identificada. Sustancias perjudiciales incluidos alcaloides, nitrosaminas, nicotina, cotinina, e hidroxicotinina están presentes en los cigarros y producen radicales libres.77,78) En un estudio prospectivo Saleh y otros79 compararon a hombres infértiles fumadores con no fumadores. El hábito de fumar se asoció con un incremento significativo (aproximadamente 48 %) de la concentración de leucocitos en el semen, con un incremento de los niveles de ROS (especies reactivas del oxígeno) en un 107 % y con una disminución de 10 puntos en ROS-TAC score. Los autores concluyen que los hombres infértiles que fumaban presentaban niveles elevados de estrés oxidativo en relación con los no fumadores, posiblemente por el incremento significativo de la concentración de leucocitos en las muestras seminales de estos pacientes.
En las últimas décadas la evidencia sugiere que los efectos perjudiciales de la exposición a sustancias químicas, como disruptores endocrinos en el sistema reproductivo, tiene un efecto acumulativo.80 La contaminación ambiental es la mayor fuente de ROS y ha sido implicada en la patogénesis de la mala calidad seminal.60,61 Además, el incremento en la industrialización ha determinado un elevado depósito de metales pesados en la atmósfera. La exposición paterna a metales pesados está asociada con una disminución de la fertilidad y del embarazo.60
Niveles elevados de ROS han sido detectados en el 25 - 40 % de las muestras seminales de hombres infértiles. En el contexto de la reproducción humana, en el aparato genital masculino, la presencia de estrés oxidativo tiene lugar cuando existe un desbalance entre los niveles de producción de ROS y de los sistemas antioxidantes.77 Pequeños niveles fisiológicos de ROS son esenciales para la regulación de una función espermática normal, como la capacitación espermática, la reacción acrosómica y la interacción espermatozoide - ovocito.81
Como limitaciones de la investigación consideramos que, a pesar de que se calculó el tamaño de la muestra para lograr una adecuada ponderación, la misma fue obtenida sólo de un período de tiempo seleccionado, por lo que no representa la totalidad de las pacientes atendidas en nuestro centro. Esto estuvo condicionado al hecho de que el estudio de la fragmentación de la cromatina espermática mediante la técnica de SCD es una técnica de reciente introducción en el país.