Introducción
La diabetes mellitus tipo 1A (DM1) es una enfermedad autoinmune órgano específica causada por la respuesta autoinmune contra las células β pancreáticas.1 Las características distintivas de este tipo de diabetes son el desarrollo de autoanticuerpos circulantes contra los antígenos específicos de las células β [Insulina, decarboxilasa del ácido glutámico (GAD65), fosfatasa trans-membrana de tirosinas (IA-2 e IA-2β) y anti transportador del catión zinc (ZnT8)], la presencia de infiltrados de células inmunes dentro de los islotes pancreáticos y una disminución progresiva de la secreción de insulina que finalmente culmina en hiperglucemia e inestabilidad metabólica clínicamente significativa.2,3,4,5,6 La DM1 es manejable con la administración de insulina exógena.3 Sin embargo, la terapia con insulina no es una cura, sino una terapia de reemplazo;7,8 aunque varios años después del diagnóstico clínico, la mayoría de las personas con DM1 continúan produciendo insulina debido a que tienen células β pancreáticas residuales.3,9
El proceso autoinmune conduce al fallo lento y progresivo de la función de las células β y la destrucción de la mayoría y en ocasiones la totalidad de estas células, lo que conduce a la deficiente secreción de insulina. La enfermedad es evidente años después de haberse iniciado la pérdida de las células β, cuando la mayor parte de la función celular se ha perdido (90 %) y presumiblemente la mayor parte de la masa de estas células ha sido destruida; en estas condiciones aparece hiperglucemia franca.1,2,3,6,10) De ahí la necesidad de evaluar la reserva funcional pancreática en etapas tempranas de la enfermedad.
La medición del péptido C en respuesta al estímulo de una prueba de tolerancia a comida mixta (PTCM) proporciona una evaluación válida y confiable de la función residual de las células β en la investigación clínica. La PTCM es la medida estándar de oro aceptada para evaluar la producción de insulina endógena en pacientes con DM1. Aunque la PTCM puede proporcionar información pronóstica importante sobre la DM1, rara vez se utiliza en la práctica clínica habitual debido a la naturaleza intensiva de la prueba.11,12
Al diagnóstico, la secreción de las células β en respuesta al estímulo de una PTCM es aproximadamente la mitad de la respuesta considerada como normal.13 La disminución del péptido C estimulado es rápida en el período de pre-diagnóstico de seis meses e incluso mayor en los primeros tres meses posteriores, lo que sugiere que hay una aceleración de la pérdida de péptido C después de la exposición a elevados niveles de glucemia en el diabético.14 Una pequeña proporción de pacientes con DM1 de diagnóstico reciente incluidos en un estudio prospectivo de dos años, experimentó una mejora de la respuesta secretora a una PTCM en las visitas de seguimiento en comparación con el estado inicial. Este aumento no se mantuvo a lo largo del tiempo, pero indica que no todos los pacientes tienen una disminución constante en la función de las células β.15
Otros estudios también evidenciaron un aumento a corto plazo de la respuesta secretora de las células β. La mejoría transitoria se debe a un incremento real de la secreción de insulina mediante la restauración de la masa y/o función de las células β, o podría ser debido a la corrección de los factores precipitantes, lo cual no está bien definido.9,15,16
En la actualidad, no existen indicadores definidos que identifiquen a las personas con una pérdida lenta o más rápida de la secreción de insulina a lo largo del tiempo y los factores que pueden predecir estos cambios siguen siendo investigados de manera prospectiva. Esto se debe a una serie de factores críticos que incluyen, entre los más relevantes, la edad al inicio de la enfermedad, la respuesta inicial y estimulada del péptido C al diagnóstico, la genética, la gravedad de la descompensación metabólica al momento del diagnóstico, la presencia de resistencia a la insulina, las necesidades de insulina exógena requerida, los valores de glucemia alcanzados (HbA1c < 7 %) con terapia intensiva y que podrían influir en el resultado de la intervención terapéutica.3,10
Existen varias maneras de expresar los resultados del péptido C estimulado durante una PTCM [por ejemplo, área bajo la curva del péptido C (AUC-pc) hasta las 2 horas, incremento del AUC-pc estimulado respecto al valor basal, pico de péptido C a los 90 minutos (valor ≥ 0,20 nmol/L)], pero no hay evidencias claras que indiquen cuál es el parámetro óptimo, ni qué grado de cambio de péptido C se correlacionaría con los resultados clínicos.12,16,17 Idealmente, los estudios longitudinales que investigan esta correlación proporcionarán el mejor conocimiento que responda la pregunta.17,18,19,20,21
En el estudio DCCT (Diabetes Control and Complications Trial), la secreción de insulina endógena residual se determinó midiendo los niveles de péptido C a los 90 minutos después de la prueba de estimulación con comida mixta: un valor ≥ 0,20 nmol/L se definió como clínicamente relevante.11,12,16,18,19 La máxima respuesta post estímulo de la PTCM también ocurrió a los 90 min en el estudio TrialNet-EPCT (TrialNet Research Group and the European C-peptide Trial).12 Sin embargo, estudios previos al usar la misma prueba han demostrado que algunas personas con DM1 podrían tener una respuesta inducida retardada. La respuesta secretora de péptido C y el patrón de respuesta fue pronóstico de la progresión de la enfermedad durante los 2 años de seguimiento: la disminución de la respuesta secretora de péptido C fue significativamente menor en sujetos con retardo en el pico de producción de péptido C.12,13
Para una evaluación general de la respuesta secretora a la PTCM, el cálculo del AUC-pc es útil.5,11,22 Algunos investigadores han usado 4 horas, mientras que la mayoría prefiere la PTCM de 2 horas. La prueba de 4 horas proporciona información de toda la respuesta y podría ser útil en los pacientes con alteración de la función de las células β que no alcanzan sus valores máximos en las primeras 2 horas.23 Sin embargo, teniendo en cuenta que la duración de la prueba tiene inconvenientes para los pacientes e investigadores en un entorno clínico, por ser larga y tener riesgo potencial de que se produzcan hipo o hiperglucemia, en sujetos con una mínima función residual, probablemente sea razonable aconsejar una prueba de 2 horas.11,12,13 Un enfoque aceptado es considerar una diferencia significativa en la respuesta del AUC-pc a las dos horas posterior a la estimulación estandarizada con la PTCM entre los grupos tratados y controles.11,12
La PTCM se ha empleado con frecuencia en los estudios de intervención, para establecer los criterios de inclusión en los ensayos clínicos: péptido C en ayunas > 0,1 nmol/L o ≥ 0,2 nmol/L, péptido C aleatorio ≥ 0,2 nmol/L o concentraciones independientes iniciales de péptido C. En algunos estudios, los resultados avalan que los umbrales específicos de péptido C no son aconsejables, sin embargo, los pacientes con niveles basales altos posterior a una PTCM, se beneficiaron más de la inmunoterapia y de un mejor control glucémico que aquellos con niveles más bajos.11,12,14,20,24,25
En Cuba no se han realizado estudios donde se analice la función residual de las células β en personas con diabetes tipo 1 de diagnóstico reciente (DM1dr). Considerando la amplia variabilidad de esta reserva funcional y la utilidad de conocer la misma con fines pronósticos en los individuos afectados, nos proponemos determinar la utilidad de la PTCM con el suplemento Nutrial I en la evaluación de la función residual de las células β en individuos con diabetes tipo 1 de diagnóstico reciente. Además, pretendemos determinar la relación de la función residual con algunas de las características clínicas (edad, índice de masa corporal y unidades de insulina) y bioquímicas (hemoglobina glucosilada, glucemia, péptido C, perfil lipídico e índice triglicérido-glucosa) estudiadas.
Métodos
Se realizó un estudio descriptivo de corte transversal, utilizando los datos obtenidos del ensayo clínico: Evaluación de la seguridad y el efecto terapéutico del anticuerpo monoclonal humanizado anti-CD6 itolizumab (T1h) combinado con insulina en el tratamiento de pacientes con diabetes mellitus tipo 1, que se desarrolló en el Instituto Nacional de Endocrinología (INEN), La Habana, Cuba.
El tamaño de la muestra se estableció por conveniencia de acuerdo con el número de sujetos incluidos en el ensayo clínico al momento de este reporte preliminar. Se incluyeron en el estudio un total de 18 sujetos con DM1 de diagnóstico reciente (hasta 12 semanas después del diagnóstico) bajo tratamiento con múltiples dosis de insulina, durante al menos 4 semanas antes de la inclusión, con edades comprendidas entre 19 y 35 años; así como, 8 voluntarios sanos sin diabetes incluidos como controles en el rango similar de edades correspondiente a los casos. Los pacientes fueron reclutados consecutivamente en una consulta de investigación habilitada para este estudio en el INEN en el período comprendido entre los años 2015 y 2018.
Se excluyeron a las personas con diabetes tipo 2, otros tipos específicos de DM, desnutrición grave [índice de masa corporal (IMC) < 16 Kg/m2], antecedentes de neoplasia maligna, enfermedades del sistema hemolinfopoyético congénitas o adquiridas, infección aguda o crónica detectada clínicamente, ingestión de fármacos con efecto hiperglucemiante (beta-bloqueadores, ácido nicotínico, interferón), embarazo, puerperio y/o lactancia materna, además, personas con enfermedades crónicas asociadas que requirieron tratamiento esteroideo o inmunosupresor.
De la base de datos de la investigación se extrajo información referente a: edad, sexo, dosis de insulina (unidad/kg/día), peso, talla e índice de masa corporal,26 además, las mediciones de HbA1c, glucemia, péptido C en ayunas y durante la PTCM, así como, las concentraciones de lípidos (colesterol total, triglicéridos, lipoproteínas de alta densidad (HDL-colesterol) y la presencia de autoanticuerpos asociados a DM1 [IsleTest-ICA y antitransportador del catión zinc (ZnT8)].
El índice triglicérido-glucosa (TyG) se calculó con fórmulas establecidas de acuerdo con los estudios previos: TyG = Ln [triglicéridos (mg / ml) * glucosa en ayunas (mg / ml) / 2].27
La información obtenida se recogió en un modelo de recolección de datos confeccionado para la investigación.
En la investigación original las concentraciones (mmol/L) de glucemia en ayunas, colesterol total, triglicéridos y HDL-c se midió en los sujetos mediante un analizador automático (Elimat, Francia) por métodos enzimáticos. La HbA1c se determinó utilizando kits comerciales empleando un método enzimático (Cobas HbA1c Test, Germany-REF 06378676 190). El péptido C en ayunas y durante la PTCM con Nutrial I se determinó utilizando kits comerciales empleando un método radioinmunométrico (IRMA) (IZOTOP, RK-84CT, Hungría). Los anticuerpos asociados a diabetes tipo 1 (IsleTest-ICA y AZnt8) se determinaron utilizando kits comerciales empleando métodos de ELISA (BIOMERICA, INC. USA, REF 7010 y ELISARSR( ZnT8( Limited, UK, respectivamente).
El producto Nutrial I (Aurora, Cuba) es un polvo de composición conocida (100 g de Nutrial I que contiene 59,5 g de carbohidratos, 18,7 g de grasa y 19,2 g de proteína). En la tabla 1 se muestra la cantidad a ingerir, la cual se calcula a partir del peso del sujeto (6,75 cal / kg de peso corporal, máximo 405 kcal) y se diluye en 250 ml de agua. Debe ser consumido en no más de 5 minutos. Se obtuvieron muestras de glucemia y péptido C a los -10, 0, 30, 60, 90 y 120 minutos de la ingestión del producto, de acuerdo con la metodología establecida.11,12,16,22,23
Tabla 1- Gramos de Nutria I según peso corporal
| Peso del paciente | Gramos de Nutrial I | Peso del paciente | Gramos de Nutrial I |
|---|---|---|---|
| 40 kg | 56,0 | 51 kg | 71,9 |
| 41 kg | 57,4 | 52 kg | 72,8 |
| 42 kg | 58,8 | 53 kg | 74,2 |
| 43 kg | 60,2 | 54 kg | 75,6 |
| 44 kg | 61,6 | 55kg | 77,0 |
| 45 kg | 63,0 | 56 kg | 78,4 |
| 46 kg | 64,4 | 57 kg | 79,8 |
| 47 kg | 65,8 | 58 kg | 81,2 |
| 48 kg | 67,2 | 59 kg | 82,6 |
| 49 kg | 68,6 | >60 kg | 84,0 |
| 50 kg | 70,0 | - | - |
Nota: Las personas con un peso superior a 60 kg consumieron siempre 84 gramos de Nutrial I.
La PTCM con Nutrial I se realizó en el departamento de pruebas especiales en la mañana (entre las 7 y las 10 a.m.) después de un ayuno nocturno, sin comida ni bebida y sin fumar después de las 10 p.m. El día anterior a la prueba se les suspendió la dosis nocturna de insulina NPH y la regular (Actrapid) administrada al menos 6 h antes de la prueba.11,12,22,23 La glucemia antes de iniciar la PTCM con Nutrial I debía encontrarse en niveles inferiores a 15 mmol/L. Durante la prueba el paciente se mantuvo en reposo, acostado y sin fumar.
Se estableció como una función conservada de las células β (respondedores) un péptido C estimulado ≥ 0,2 nmol/L, según recomendaciones del DCCT.28,29,30
Se calculó el AUC total de producción de péptido C estimulado durante la PTCM según la siguiente fórmula: AUC= [área 1: tiempo 30 min-basal (0) / 2 + área 2: tiempo 60-30 min / 2 + área 3: tiempo 90-60 min / 2 + área 4: 120-90 min / 2]. AUC total= área 1+ área 2+ área 3+ área 4.
Para los cálculos estadísticos se utilizó el programa SPSS versión 21 para Windows. Se realizó un análisis descriptivo de la muestra expresando las variables en sus respectivas medidas de resumen: las cualitativas en cifras relativas y absolutas (frecuencias y porcentajes) y las cuantitativas en sus medidas de posición y dispersión (media y desviación estándar).
Se compararon los resultados de las características clínicas (edad, índice de masa corporal) y bioquímicas (HbA1c, glucemia, péptido C, AUC-pc, perfil lipídico e índice triglicérido-glucosa) entre las personas con DM1dr y los voluntarios sanos mediante la prueba de comparación de medias (la prueba U de Mann-Whitney) y la prueba exacta de Fisher para las variables cualitativas (sexo y presencia de los autoanticuerpos asociados a DM1).
Se analizó la relación del AUC del péptido C con la edad, las unidades de insulina, el IMC, la glucemia en ayunas (GA), el péptido C, la HbA1c, las variables lipídicas e índice TyG en las personas con DM1dr. Para el análisis de las asociaciones entre las variables cuantitativas se empleó la prueba de correlación de Spearman. Además, al realizar la PTCM con Nutrial I se compararon las concentraciones de, de péptido C, así como, el AUC-pc y el resto de las características clínicas y bioquímicas estudiadas en los DM1dr de acuerdo al valor de glucemias en ayunas (GA < 7mmol/L y ≥ 7 mmol/L), estas comparaciones se efectuaron mediante la prueba de comparación de medias (la prueba U de Mann-Whitney) y la prueba exacta de Fisher para las variables cualitativas (sexo).
En todos los casos se trabajó para un nivel de confianza del 95 % (IC 95 %), prefijando un error alfa de 0,05 y una región crítica o de rechazó a p = 0,05, de tal forma que cuando p < 0,05 existió significación estadística.
El estudio fue aprobado por el Comité de Ética e Investigación del Instituto de Endocrinología en La Habana, Cuba. Esta investigación no presentó riesgos para el paciente porque se trabajó con una base de datos estructurada del ensayo clínico anteriormente mencionado. Se contó con la autorización del autor principal de la investigación original para acceder a la base de datos. Los voluntarios del estudio dieron su consentimiento informado por escrito, previa información de los objetivos y propósitos del estudio. Todos los datos se mantuvieron confidenciales y la identidad del participante se mantuvo en el anonimato.
Resultados
Se estudiaron 18 individuos diabéticos tipo 1 (DM1) de diagnóstico reciente con edades comprendidas entre 19 y 35 años; la edad media fue de 23,56 ± 4,25 años; el sexo más frecuente fue el masculino [66,7 %, (12/18)] y con una elevada frecuencia de autoanticuerpos ICA y ZNT8 [61,1 %, (11/18)]. De los 8 voluntarios estudiados, la edad media fue de 26,14 ± 3,67 años y el 50 % correspondió al sexo masculino (4/8) con ausencia de autoanticuerpos asociados a DM1. Las características de la muestra se describen a continuación (Tabla 2).
Tabla 2 Características clínicas y metabólicas de sujetos con DM1 y voluntarios al inicio del estudio

DM1 dr: Diabetes tipo 1 de diagnóstico reciente; F = Femenino; M = Masculino; IMC = Índice de masa corporal;
HbA1c= Hemoglobina glucosilada; HDL-c = Lipoproteína de alta densidad; Índice TyG = Índice Triglicéridos Glucosa
En la tabla 3, se muestran las concentraciones de péptido C, así como, la disminución del área bajo la curva de péptido C en los DM1dr en comparación con los voluntarios durante la PTCM con Nutrial I.
En los individuos con DM1dr encontramos una correlación negativa entre el AUC-pc con los niveles de glucemia en ayunas (r=-0,747; p( 0,0001), HbA1c (r =-0,535; p= 0,022) y el índice TyG (r=-0,542; p= 0,020). Al contrario, encontramos una correlación positiva entre el AUC-pc y el péptido C en ayunas (r= 0,722; p= 0,001), además, con el péptido C a los 30 (r=0,911), 60 (r=0,934), 90 (r=0,952) y 120 minutos (r=0,910) (p( 0,0001) (Datos no mostrados). No encontramos correlación entre el área bajo la curva de péptido C (AUC-pc) luego de la PTCM con las características clínicas (edad, IMC y dosis de insulina usada), ni con las concentraciones de lípidos estudiadas.
Tabla 3 Concentraciones de péptido C en sujetos con DM1dr y voluntarios durante la PTCM con Nutrial I
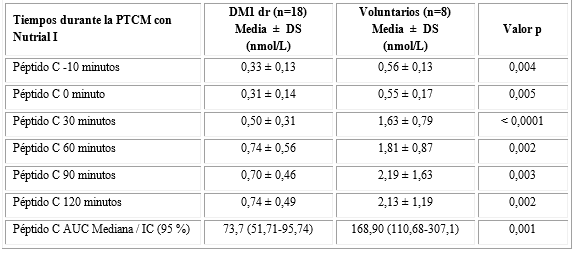
DM1 dr: Diabetes tipo 1 de diagnóstico reciente; PTCM = Prueba de tolerancia con comida mixta.
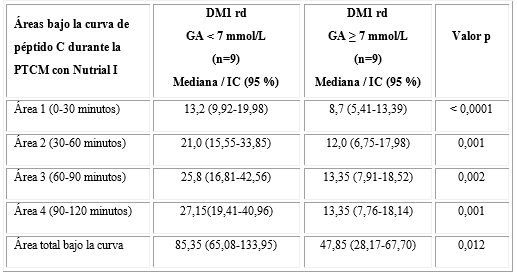
Al comparar a los DM1dr según los valores de glucemia en ayunas (GA) al comienzo de la PTCM, observamos que los pacientes con GA inferior a 7 mmol/L (n = 9) mostraron bajos niveles de HbA1c (p = 0,006) y menos unidades de insulina por kilogramo de peso (p = 0,024) en relación a los sujetos con GA ( 7 mmol/L (n = 9) (Tabla 4).
Tabla 4 Características clínicas metabólicas de los sujetos con DM1dr durante la PTCM con Nutrial I de acuerdo al nivel de glucosa en ayunas

En la tabla 5, observamos que las concentraciones de péptido C fueron superiores a partir de los 30 minutos de la PTCM en los sujetos con niveles de GA < 7 mmol/L en relación con aquellos con GA ( 7 mmol/L (p < 0,05).
Tabla 5 Concentraciones de péptido C en los sujetos con DM1dr durante la PTCM con Nutrial I de acuerdo al nivel de glucosa en ayunas

PTCM = Prueba de Tolerancia con Comida Mixta; DM1 dr: Diabetes tipo 1 de diagnóstico reciente; GA: Glucosa en ayunas
El AUC total de péptido C y las AUC-pc de los distintos intervalos durante la PTCM fueron superiores en los individuos con GA < 7 mmol/L en relación con aquellos con GA ( 7 mmol/L, como se puede apreciar en la tabla 6. El 100 % (9/9) de los sujetos con GA inferior a 7 mmol/L fueron respondedores con concentraciones de péptido C ≥ 0,2 nmol/L posterior a la estimulación con Nutrial I, mientras que en los sujetos con GA ( 7 mmol/L, el 22,2 % (2/9) fue no respondedor (< 0,2 nmol/L).
Discusión
Varios estudios han identificado niveles detectables de péptido C en aquellos diabéticos con un largo tiempo de duración de la enfermedad.9,31 Además, las inmunoterapias eficaces podrían dar como resultado la conservación de la producción de insulina residual durante períodos prolongados.6,32,33,34,35,36
Además, la razón por la cual algunas personas con DM1 paralizan la capacidad de producir insulina mientras que otras no lo hacen, se ha abordado en los últimos años. Varios investigadores confirman, que en los individuos con DM1dr, puede haber diferencias intrínsecas en las células β y que existen diabéticos que conservan la función en comparación con aquellos que no la tienen.18,29,30,31,37 Por lo tanto, es muy importante medir o cuantificar la secreción de insulina en las personas con DM1.
El estudio de la función residual post estimulación con una PTCM en sujetos con DM1 no se ha realizado en Cuba. En esta investigación pudimos apreciar diferencias en la respuesta de la función de las células β (péptido C estimulado y el AUC-pc) durante la PTCM con el suplemento Nutrial I (producción nacional) entre las personas con DM1dr y voluntarios. Estos resultados concuerdan con los encontrados en la literatura revisada1,11,13,28,30 y podrían servir de sustento para poder utilizar en Cuba la PTCM con Nutrial I en el estudio de la función residual de las células β en los sujetos con diabetes. Es importante aclarar que desde el punto de vista de sustitución de importaciones, adquirir el suplemento Nutrial I es mucho más económico (2,48 USD), que comprar el suplemento Sustacal (12 a 18 USD) empleado en la PTCM en distintos estudios internacionales.11,12,28,30
El haber encontrado una correlación negativa del AUC-pc con los niveles de glucemia en ayunas, la HbA1c y del índice TyG, nos reveló que a medida que disminuyó el AUC-pc, aumentó la glucemia, la HbA1c y disminuyó la sensibilidad a la insulina. Al contrario, a medida que aumentó el AUC-pc (función conservada de las células β) se observó valores menores de glucemia y mayores de péptido C, tanto en ayunas como en el resto de los intervalos (30, 60, 90 y 120 minutos). Similares resultados han sido encontrados por otros investigadores.12,22,25,31
En este estudio (adultos entre 19 a 35 años) no observamos relación entre la función residual de las células β (AUC-pc) con la edad, IMC y las dosis de insulina. Sin embargo, Buchanan y otros,38 en una cohorte de personas con diabetes tipo 1 de diagnóstico reciente con edades de 8 a 30 años, mostró que el péptido C estimulado más alto se asoció con una HbA1c más baja, un IMC más alto, un aumento de la edad, y una dosis más baja de insulina.
Los resultados de la correlación entre el AUC-pc y la GA durante la PTCM con Nutrial I, nos motivó al análisis de los sujetos con DM1dr de acuerdo a las concentraciones de GA. Por consiguiente, los DM1dr con una GA ≥ 7 mmol/L mostraron una función residual de las células β baja, debido a una menor AUC-pc durante la PTCM, por lo tanto, necesitaron más unidades de insulina por kilogramo de peso. En cambio, la producción de insulina residual (AUC-pc) fue mayor en los sujetos con una GA < 7 mmol/L durante la PTCM; lo antes mencionado repercute en las concentraciones de HbA1c y glucemia; así como, en necesidades menores de unidades de insulina por kilogramo de peso. Por lo tanto, se confirman los beneficios clínicos de la producción de insulina endógena.11,13,16,19,20,21,22,24,25,28,29,30
Aunque diversos estudios han caracterizado la secreción de insulina poco después del diagnóstico de la DM1,13,21,23,24,28,30) este es el primer análisis en Cuba sobre la evaluación de la función residual de las células β que aplique la PTCM con Nutrial I en sujetos con DM1dr.
Keenan y otros,9 encontraron que más del 67 % de los sujetos con DM1, de al menos 50 años de evolución de la enfermedad, tenían niveles detectables de péptido C. Estos investigadores observaron que los sujetos clasificados como "respondedores" (péptido C basal ≥ 0,2 nmol/L), el 41,9 % (13/31) mostró más del doble de la respuesta del péptido C durante la PTCM de 120 minutos, mientras que el 58,1 % (18/31) de los sujetos no respondedores (péptido C basal ( 0,2 nmol/L) no presentó un aumento significativo en los niveles de péptido C.
Sherr y otros,31 también encontraron una frecuencia de péptido C detectable en el 68 % de los sujetos con más de dos años de duración de la enfermedad; los autores sugieren que estas respuestas secretoras de insulina luego de una PTCM son comunes en individuos con mayor duración de la enfermedad y que las mismas están asociadas con parámetros clínicos mejorados en estos sujetos.
Los datos del DCCT también confirman el hecho de que casi todos los individuos con DM1 con una duración de hasta 4 años tienen péptido C estimulado medible, incluso, en algunos sujetos con un valor en ayuno indetectable y la mayoría de ellos mantiene cantidades clínicamente significativas (> 0,2 nmol/L).29)
La preservación de la función de las células β en la DM1, genera un mejor control glucémico y una menor incidencia de complicaciones agudas y crónicas como las hipoglucemias, la retinopatía y la nefropatía diabética.3,16,25,29,30,37) Es por ello que los estudios de intervención, destinados a preservar la función de las células β, generalmente han medido el péptido C en plasma después de una PTCM y de esta forma, evitar la exposición del paciente a dosis elevada de glucosa, como lo serían las pruebas de tolerancia a la glucosa oral o endovenosa.28,30,31,32,33,34,35,36,37
La PTCM es costosa y consume tiempo, por lo que podría no ser útil en la práctica clínica, más allá de una medición de péptido C en ayunas o aleatoria. Se ha observado que un valor de péptido C en ayunas (basal) tiene una alta correlación con la respuesta (AUC-pc) durante la PTCM; así como un valor de péptido C aleatorio demostró que diferenciaba a los sujetos con DM1, diabetes tipo 2 y la diabetes autoinmune latente del adulto (LADA).24,29,37,38,39,40 Resultados similares se observaron en este estudio en relación a que el incremento del AUC-pc estaba correlacionado de manera positiva con los niveles de péptido C en ayunas, en cambio ese incremento del AUC-pc con una correlación negativa de los niveles de glucemia en ayunas, lo que representa que estos sujetos tienen una función residual más conservada.
La PTCM es una prueba sensible de la función residual de células β. En la PTCM, la respuesta máxima en algunos estudios se produjo a aproximadamente a los 90 minutos. En esta investigación la máxima respuesta se produjo tanto a los 60, 90 y 120 minutos (Ver tablas 3, 5 y 6). En modelos multivariados, la duración prolongada de la diabetes y la menor edad se asociaron con una menor respuesta del péptido C durante la PTCM.14 En este estudio no encontramos asociación con la edad.
Se demostró también que el péptido C estimulado a los 90 minutos mostró el valor de correlación más alto (r= 0,952) con el AUC-pc,12 por lo que se sugiere como la medida de la secreción máxima de insulina y de la misma manera, que todo el AUC-pc son medidas más confiables que el péptido C en ayunas. Lo cual concuerda con los resultados de Besser y otros que encontraron el pico máximo de péptido C estimulado a los 90 minutos.12 Esto sugiere que un solo análisis de sangre que mida el péptido C a los 90 minutos es una alternativa a la PTCM completa.12
Sin embargo, el énfasis en los niveles estimulados de péptido C en la DM1 se debe a la demostración del DCCT, que un incremento del AUC-pc en el grupo con terapia intensiva, se asoció directamente con un mejor control glucémico, con menor riesgo de complicaciones microvasculares y menos hipoglucemias. 11,12,25,29,30
La PTCM proporciona respuestas más confiables de péptido C post estímulo; es reproducible y se tolera bien, por lo que es el método de elección para medir la función residual de las células-β en los sujetos que podrían ser incluidos en los ensayos clínicos con inmunoterapias en DM1.19,20,21,22,23,24,28,29,30,32,33,34,35,36 Otro beneficio de esta prueba podría ser su utilidad para discriminar el tipo de diabetes en los pacientes que fueron asignados de forma incorrecta a un tipo particular de diabetes, ya que la identificación de una buena reserva funcional pancreática podría descartar la DM1.37,38,39,40
Estos datos proporcionan el primer informe sobre la secreción de insulina (péptido C) durante la PTCM con Nutrial I en personas con DM1 y voluntarios. Una de las limitaciones de esta investigación es el número relativamente pequeño de sujetos estudiados. No obstante, estos resultados preliminares proporcionan evidencias sobre la utilidad de la PTCM con Nutrial I para evaluar la secreción dinámica de insulina en pacientes con DM1. Otra limitación es no haber podido realizar la comparación concurrente de la estimulación de la PTCM con Nutrial I (59,5 g de carbohidratos, 18,7 g de grasa y 19,2 g de proteína) y Sustacal, otro suplemento similar ya validado (55 % de carbohidratos, 21 % de grasa y 24 % de proteína).12 Sin embargo, las correlaciones entre el AUC-pc y el pico de péptido C a los 90 minutos o péptido C en ayunas utilizando el Nutrial I, no difieren de lo reportado por otros autores para Sustacal.12) Por tanto podemos asumir que ambos suplementos son equivalentes para ser utilizados en la PTCM en diabéticos tipo 1 y esto refuerza la validez de nuestros resultados.
Implicaciones: La PTCM generalmente se realiza en ensayos de intervención en personas con diabetes tipo 1. La viabilidad de usar un solo análisis de sangre que mide el péptido C a los 90 minutos en lugar de múltiples muestras tiene un beneficio práctico tanto para el paciente como para el médico.12 Algunos investigadores sugieren utilizar una extracción a los 90 minutos en lugar del péptido C en ayunas durante la PTCM para evaluar la función de las células β.12 En cambio, nosotros proponemos tomar dos muestras para evaluar la función de las células β, una en ayunas y la otra a los 90 minutos post estimulación con Nutrial I durante la PTCM. De esta forma, podemos calcular el área bajo la línea de esas dos muestras, además de utilizar los resultados del péptido C en ayunas y a los 90 minutos. En términos prácticos, esto significaría menos muestras de sangre (dos en comparación de las cinco en una PTCM estándar), una menor duración requerida para que el paciente permanezca en las instalaciones de investigación (90 minutos en comparación con 120 minutos), y un costo reducido para ejecutar el estudio y analizar las muestras.12
Conclusiones
En conclusión, el empleo del Nutrial I en la PTCM fue útil en la evaluación de la función de las células β en DM1dr. Los valores bajos de glucemia en ayunas durante la PTCM son marcadores indirectos de una función residual de células β más conservada en los DM1dr.
Estos resultados tendrán implicaciones importantes en la investigación, para el diseño de ensayos clínicos, pues permitirá poder seleccionar individuos con reserva funcional de las células β y desde el punto de vista clínico, ayudaría a discriminar el tipo de diabetes en sujetos con sospecha de no haber sido correctamente asignados a un tipo particular de diabetes.