Introducción
En la hiperplasia adrenal congénita (HAC) el aumento de los niveles de andrógenos suprarrenales en los pacientes no tratados o mal controlados, puede alterar el inicio y/o la progresión puberal, y en la edad adulta, determinar una disfunción gonadal y una disminución de la fertilidad.1
La Organización Mundial de la Salud (OMS) definió la pubertad como un período de transición entre la infancia y la edad adulta, durante la cual se desarrollan las características sexuales secundarias, hay un crecimiento rápido que termina con la fusión de las epífisis óseas y la obtención de la talla final, y culmina el proceso con el logro de la capacidad de fertilidad y reproducción.2
Algunos autores3‚4) reportan que la edad de la menarquia está retrasada en comparación con los controles y que existe un pequeño grupo de mujeres que no la presentan por ser incapaces de frenar los niveles elevados de progesterona, incluso a pesar de tener frenados los niveles de 17hidroxiprogesterona (17OHP).
En algunas mujeres existe un menor desarrollo de la glándula mamaria que estaría en relación con un exceso de andrógenos. También se especula si este exceso de andrógenos‚ desde la etapa fetal‚ podría inhibir el desarrollo y la proliferación del disco glandular embrionario. Esta situación produciría un escaso desarrollo mamario durante la adolescencia.5
Al llegar a la pubertad las irregularidades menstruales son frecuentes y pueden alcanzar hasta el 70 % en las pacientes.6 Aquellas mal controladas pueden presentar hirsutismo, oligomenorrea, amenorrea, menorragia, acné y una constelación de signos y síntomas propios del síndrome de ovarios poliquísticos (SOP). Otras consecuencias del hiperandrogenismo son la aparición de calvicie androgénica, distribución androide del panículo adiposo y de la masa muscular y clitoromegalia.6
Con los elementos antes expuestos nos trazamos como objetivo describir las características puberales de pacientes con HAC asignadas como femeninas, e identificar si existe asociación entre elementos relacionados con la enfermedad y el inicio y progresión puberales.
La identificación de las alteraciones puberales y su manejo adecuado desde etapas tempranas como la niñez y la adolescencia, redundará en un mejor pronóstico reproductivo, mayor adaptación social y psicológica.
Métodos
Se realizó un estudio descriptivo transversal que incluyó a pacientes con diagnóstico de hiperplasia adrenal congénita por déficit de 21hidroxilasa y asignación femenina, atendidas en consultas de Endocrinología pediátrica desde enero de 2000 hasta mayo de 2019.
Todas las pacientes fueron vistas en su consulta de seguimiento de Endocrinología, donde se le realizó la evaluación clínica y bioquímica. Se tuvo en cuenta la edad al diagnóstico e inicio del tratamiento sustitutivo, la forma clínica, las características de los genitales externos, se especificaron los grados de virilización de los genitales, los estadios de Tanner para vello sexual y el desarrollo mamario‚7) se especificó el volumen mamario categorizado como normales,8 pequeñas o gigantomastia y en cada caso la edad de inicio de la pubarquia y la telarquia. La edad de la menarquia, las características de los ciclos menstruales, la frecuencia, duración‚ el volumen del sangrado9) (normal o menorragia) y la presencia de dismenorrea. Además‚ se exploraron las manifestaciones de hiperandrogenismo: acné10 (ligero‚ moderado y severo), hirsutismo,11 distribución androide de la grasa corporal6 y clitoromegalia.8
En cuanto a las determinaciones hormonales para evaluar el grado de control, se tuvieron en cuenta los niveles de testosterona, de los cuales se calculó su promedio anual y se realizó extracción de sangre para 17 OHP por el sistema ultramicroanalítico (SUMA), expresada en nmol/mL.12)
Análisis estadístico
Se determinaron distribuciones de frecuencia de las variables cualitativas y media y desviación estándar (o mediana y rango, según correspondió) de las cuantitativas. Se exploró la asociación entre las variables cuantitativas: edad al diagnóstico, edad de inicio del tratamiento, tiempo de tratamiento, dosis diaria de esteroide y dosis de esteroide según superficie corporal y la edad de inicio del vello pubiano y edad de inicio de la telarquia‚ edad de la menarquia, frecuencia del sangrado menstrual y duración del sangrado. Se utilizó el coeficiente de correlación de Pearson (o Spearman, según correspondió).
Se compararon los valores promedio (o medianas, según correspondió) de las variables cuantitativas relacionadas con la pubertad, tales como las categorías de las variables cualitativas relacionadas con la HAC, por medio de la utilización de la prueba t de Student o ANOVA (o las análogas no paramétricas Mann-Whitney o Kruskal-Wallis, respectivamente), según se comparen dos o más grupos. En todos los casos se consideró un nivel de significación estadístico de p= 0.05.
Desde la concepción de la investigación se tuvieron en cuenta los aspectos éticos. Se elaboró un formulario de consentimiento informado dirigido a las niñas, adolescentes, adultas y padres o tutores de niñas y adolescentes, los que fueron leídos y firmados previo a los procedimientos y a la aprobación del comité de ética de la investigación para llevar a cabo el estudio.
Resultados
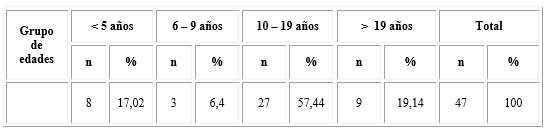
Fueron estudiadas 47 pacientes con diagnóstico de HAC y asignación femenina, con un promedio de edad de 14,76 ± 7,04 años. La composición según grupos de edades se observa a continuación (Tabla 1).
El antecedente familiar de primera línea más relevante fue el hirsutismo en un 25,5 % de los casos, seguido de la infertilidad en un 12,8 %, HAC en un 10,6 %, abortos espontáneos en el 6,4 %, y presencia de genitales atípicos al momento del nacimiento en el 4,3 %. Un familiar refirió una muerte neonatal de etiología no precisada y solo en una familia se constató historia de consanguinidad.
Predominaron las formas clínicas clásicas en 25 pacientes (53,19 %), 11 (23,40 %) presentaron formas virilizantes simples, 14 perdedoras de sal (29,78 %) y 22 (46,80 %) formas no clásicas.
Las 14 pacientes diagnosticadas de la forma “perdedora de sal” (PS), tuvieron una edad media de diagnóstico de 13 ± 16 días‚ de inicio de tratamiento 0,15 ± 0,18 años y una dosis media de 24,5 ± 11,8 mg diarios, lo que se correspondió con 18,8 ± 5,7 mg/ m2sc/ día.
En el grupo de virilizantes simples (VS), las 11 pacientes se diagnosticaron en la primera infancia, 0,5 ± 0,8 años con edad de inicio del tratamiento entre 0,8 ± 1,4 años, donde se comprobaron grados variables de virilización neonatal con una dosis media diaria de 23,6 ± 11,5 mg (19,3 ± 8,067 mg/m2sc/ día).
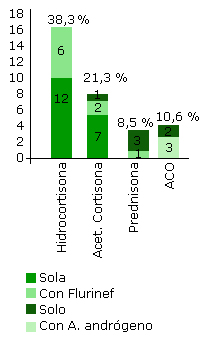
En 22 casos, se estableció como presentación la forma no clásica (NC), la edad media al diagnóstico fue de 12,6 años, con edad de inicio del tratamiento de 11,9 ± 5,4 años‚ y con una dosis promedio de 11,5 ± 7,8 mg (11,1 ± 2,1 mg/m2sc/ día). El tratamiento utilizado según forma de presentación y manifestaciones clínicas se expone en la siguiente figura.
Inicio y progresión puberales
El inicio del vello pubiano estuvo comprendido entre 1 y 8 años de edad, lo que se correspondió con una edad promedio de 7,78 ± 3,2 años. La edad de comienzo de la telarquia resultó en una media de 10,09 ± 2,4 años y la menarquia se presentó a una edad promedio de 12,2 ± 2,3 años. Se observan las especificidades según forma clínica (Tabla 2).
Tabla 2- Inicio de la pubertad según formas clínicas de presentación
| Edad ( años) | Perdedora de sal | Virilizante simple | No clásica | p |
|---|---|---|---|---|
| Inicio de vello pubiano | 7,08 ± 3,5 | 7,5 ± 4,1 | 8,2 ± 2,9 | 0,583 |
| Inicio de la telarquia | 10,2 ± 3,5 | 11,0 ± 1,6 | 9,8 ± 2,1 | 0,539 |
| Menarquia | 12,7 ± 3,2 | 14,5 ± 0,7 | 11,6 ± 1,5 | 0,154 |
Kruskal-Wallis T
El tiempo transcurrido entre el primer signo de desarrollo puberal y la aparición de la menarquia osciló entre 3,4 años para la FNC, 5,6 años para la PS y 7,0 años para aquellas pacientes con formas VS.
Se puede observar la distribución atendiendo al estadio de desarrollo puberal actual, según Tanner (Tabla 3).
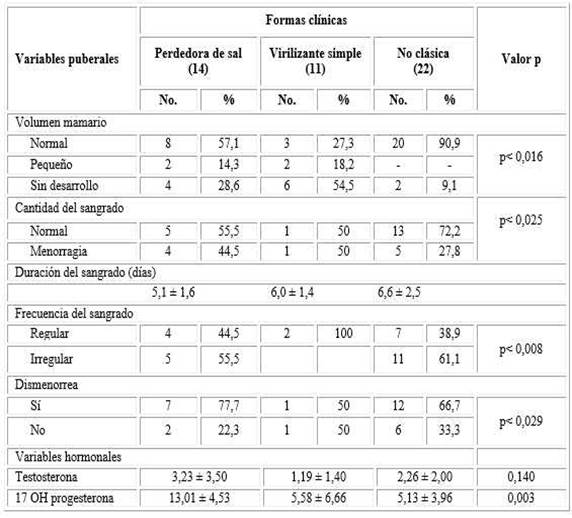
En relación con el volumen mamario, el mayor porcentaje fue normal con 30 pacientes (63,8 %), 4 pacientes (8,5 %) presentaron mamas pequeñas, no hubo ningún caso con gigantomastia y el resto de las pacientes no había iniciado el desarrollo mamario. La distribución según forma clínica se evidencia en la tabla 4. (X2, p= 0,017).
De las 29 pacientes que ya habían menstruado 16 (55,2 %) presentaban ciclos menstruales irregulares. El mayor porcentaje correspondió a la forma no clásica.
La duración del sangrado no mostró diferencias con significación estadística (p= 0,238) entre las formas clínicas. En relación a la cantidad de sangrado se clasificó como normal en 19 pacientes y en 10 restantes como menorragia. Los datos relacionados también se pueden evidenciar en la tabla 4 (X2, p= 0,025). Refirieron dismenorrea 20 (42,5 %) y 12 (60 %) como el mayor grupo perteneciente a la forma no clásica. (X2, p= 0,030).
Cuando analizamos las manifestaciones clínicas de acuerdo con las formas de presentación se pudo obtener que el hiperandrogenismo clínico era evidente en 33 de las pacientes estudiadas (70,2 %). Predominó el hirsutismo en 32 pacientes (68,08 %), seguido de la hipertrofia de clítoris 14 (29,8 %), el acné estuvo presente en 10 (21,3 %) y en 2 (4,2 %) se constató un desarrollo de la musculatura tipo androide. Se observan estas características según la severidad de presentación y la forma clínica (Tabla 5).
Al analizar los aspectos que se relacionaron con el inicio puberal y el estadio de desarrollo sexual actual se obtuvo que la edad de inicio del vello pubiano guardó estrecha relación con la edad al diagnóstico (p= 0,009) y con la dosis de esteroide utilizada, calculada en mg/día (p= 0,002). En tanto el estadio de Tanner actual del vello pubiano tuvo relación con la edad al diagnóstico (p= 0,000) y la edad de comienzo del tratamiento (p= 0,011).
De igual manera hubo una relación significativa entre el estadio de Tanner mamario actual, la edad al diagnóstico (p= 0,000) y la edad de inicio del tratamiento (p= 0,019), no así con la dosis empleada. Esta última estuvo relacionada con la edad de la menarquia (p= 0,046) y a menor edad de iniciado el tratamiento mayor duración del sangrado menstrual (-0,539; p= 0,021).
Discusión
La HAC es una enfermedad que ha ganado en visibilidad con la implementación de los programas de pesquisa neonatales. Se considera entre las más frecuentes de las afecciones que produce genitales atípicos.13) Las metas del tratamiento en los pacientes con HAC incluyen asegurar una velocidad de crecimiento lineal adecuado y un inicio y progresión puberal normales. Para las adolescentes y adultas se añaden además la necesidad de la regularización de los ciclos menstruales, la prevención y/o progresión del hirsutismo y la preservación de la fertilidad.
Los esquemas terapéuticos de las pacientes con esta condición se establecen teniendo en cuenta el déficit enzimático, las manifestaciones clínicas, los propósitos o metas a lograr, los deseos del paciente en particular, entre otros aspectos. Por consiguiente, se consideran personalizados. El esquema más usado en las pacientes del presente estudio fue la hidrocortisona, seguido del acetato de cortisona y luego prednisona en todos los casos solos o asociados a fludrocortisona. En algunas pacientes se requirió un antiandrógeno y en las FNC el empleo de tabletas anticonceptivas orales fue necesario para controlar las irregularidades menstruales.
En la mayoría de los pacientes estos esquemas terapéuticos lograron obtener niveles aceptables de testosterona y con ello frenar el hiperandrogenismo derivado de esta enfermedad. Existe literatura que apoya el uso de la hidrocortisona a dosis media de 17,58 mg/m2sc/día, en los primeros 5 años de vida y en la forma clásica de la enfermedad, es recomendada, por su resultado favorable en términos de crecimiento.13
En el presente estudio los resultados son similares solo que la dosis promedio utilizada fue algo más alta que la referida; pero dentro del rango de las recomendadas por las guías publicadas13 el pasado año para el manejo de los pacientes con esta condición.
Estos resultados son congruentes con lo descrito por Carvajal y otros.14) y Espinosa y otros.15 En las formas no clásicas las indicaciones terapéuticas aparecen en función de los síntomas predominantes y la edad. Si el diagnóstico se presenta en una niña que tiene una alta talla o adrenarquia precoz, el tratamiento sustitutivo con hidrocortisona está indicado para frenar el hiperandrogenismo, causa de un siempre nefasto adelanto de la edad ósea que compromete el pronóstico de la talla final.
Las formas no clásicas de manifestación relativamente precoz son ciertamente más graves que las mostradas en la edad adulta. Sin embargo, estos niños no presentan pérdida salina asociada, por lo que no hay indicación alguna de tratamiento mineralocorticoideo.13,14,15
La hidrocortisona y el acetato de cortisona son los glucocorticoides de preferencia en edades pediátricas, porque se consideran relativamente débiles y de acción más breve, lo cual facilita, cambios pequeños en el incremento de dosis.(9 )
Si la enfermedad no se inicia hasta el período peripuberal, la situación es del todo diferente. En la niña puede verse una mejoría espectacular de los síntomas de hiperandrogenismo con el tratamiento glucocorticoideo sustitutivo. Por el contrario, si el signo principal es el hirsutismo, el tratamiento con glucocorticoides se revela a menudo decepcionante en el plano clínico, aun cuando normalice el perfil biológico. La utilización de un antiandrógeno (asociado o no con la estrogenoterapia) ofrece mejores resultados, lo que coincidió con lo empleado en las pacientes de la muestra estudiada.10
La pubarquia precoz caracterizó el inicio puberal, aunque la telarquia y la menarquia se presentaron a la edad esperada en la población aparentemente sana. La pubarquia precoz es considerada un signo en muchos casos fisiológico, sin embargo, puede anunciar una enfermedad subyacente. Es conocido que cerca del 7 % de los pacientes que asisten a consulta con adrenarquia precoz corresponden a HAC en su forma no clásica.
Espinosa y otros15 encontraron un predominio de la pubarquia precoz (71,4 %) en un estudio en pacientes con esta forma clínica, realizado durante el período 1998-2008. En el presente estudio solo 4 de las 22 pacientes con diagnóstico de la FNC lo refirieron, siendo en todos los casos el motivo de consulta.
Sancho Rodríguez y otros16 encontraron en un estudio realizado en pacientes con pubarquia precoz sin ningún otro padecimiento y otro grupo con HAC NC que la edad de aparición del vello pubiano en estos últimos fue igualmente inferior a la población de origen (7,1 ± 1,6 años).
La edad de la menarquia en igual estudio fue de 11,8 ±1,1 años, edad que se correspondió con la hallada en nuestro estudio para las pacientes con HAC NC. En particular en el grupo de la forma VS mostró una edad superior, incluso cuando se compara con la PS y con la población cubana. Este resultado resulta paradójico para los autores, ya que este grupo mostró los valores más bajos de andrógenos, la explicación pudiera encontrase en los factores genéticos relacionados con la menarquia materna y el resto de las mujeres de la familia.
Cuando se analiza el tiempo transcurrido desde el inicio puberal hasta la menarquia‚ llama la atención que. aunque en las formas PS y NC transcurre entre 3 y 5 años, considerado adecuado para la población general, en el caso de las formas VS la media transcurrió en alrededor de 7 años, cifra que pudiera considerarse como prolongada o retardada. Igualmente, la presencia de factores genéticos en familiares de 1ra y 2da línea pudieran justificar este resultado.
Sánchez17 y otros en estudio español realizado en 38 pacientes con HAC describió que al momento del diagnóstico o durante la evolución de la enfermedad la pubarquia precoz se presentó en un 85,7 %, seguido del acné en un 33,3%, el hirsutismo en un 28,5 %, la oligomenorrea (22,7 %) y por último la clitoromegalia en el 13,7 % de las pacientes. La edad media de inicio de la pubertad y la menarquia fueron de 9 años ± 1,26 y 11,5 años ± 1,06 respectivamente. Lo encontrado en nuestro estudio coincide en cuanto a la sintomatología,17) pero no en la frecuencia de presentación, ya que el signo que primó fue el hirsutismo, seguido de la clitoromegalia y el acné.
Al realizar un estudio multicéntrico con 220 mujeres con D21OH-NC, la presentación clínica variaba con la edad de la paciente, sugiriendo la naturaleza progresiva del trastorno. En un alto porcentaje las pacientes menores de 10 años se presentaron con pubarquia precoz; clitoromegalia y acné, en orden de frecuencia. En adolescentes y adultas jóvenes, por su parte, los signos de presentación fueron: hirsutismo en el 59 %, oligomenorrea en el 54 %, acné en el 33 %, infertilidad en el 13 %, clitoromegalia en el 10 %, alopecia en el 8 % y amenorrea primaria en el 4 %.17
Nuestra evidencia revela cifras muy parecidas en cuanto a los signos clínicos de presentación, aunque no se encontró ningún caso con calvicie androgénica ni amenorrea primaria. De las 47 pacientes estudiadas un alto porcentaje tenía algún signo de hiperandrogenismo clínico. Sobre el acné se han realizado estudios en los que queda manifiesta la relación entre el acné tardío y el acné resistente a tratamiento tópico y sistémico con la presencia de HAC. Un estudio realizado entre los años 2004 y 2009 en Grecia,18 con 123 mujeres de origen y nacionalidad griega que consultaron por acné, hirsutismo, irregularidades menstruales y obesidad; demostró que la causa más común de acné durante la etapa peripuberal fue debido a hiperandrogenismo de otras etiologías. El acné tendió a disminuir en la vida adulta, mientras que las pacientes en las que se diagnosticó HAC se presentaron con acné persistente hasta la adultez. Por tales motivos, concluyeron que pacientes con acné tardío deben tamizarse por formas clásicas o no clásicas de HAC.19
En nuestra experiencia 8 de las 23 pacientes con diagnóstico de HAC NC presentaron acné entre moderado y severo, resultado que se apoya por lo antes expuesto en la literatura.
Al analizar el volumen mamario, aunque hay autores5 que describen una alta frecuencia de mamas pequeñas debido al poco desarrollo del disco glandular mamario, en la muestra estudiada la mayoría mostró mamas de tamaño normal, lo que se justifica porque un alto porcentaje de las pacientes asignadas femeninas mostraron niveles de andrógenos circulantes considerados normales.
Los trastornos menstruales fueron frecuentes en las pacientes estudiadas, el más prevalente fue la oligomenorrea.6 No hubo diferencias en relación con el volumen del sangrado, la duración y la presencia de dismenorrea; lo que coincide con otros autores.6,15,19)
El síndrome de ovarios poliquísticos (SOP) es, al igual que la HAC NC, una alteración endocrina caracterizada por hiperandrogenismo y disfunción ovárica. Hasta antes del año 2003, el SOP y esta entidad podían sobreponerse, reportándose incluso la presencia de MOP en 36 % de las mujeres con esta forma clínica.14,15,20
A partir de los criterios de Rotterdam establecidos en el 2003 el diagnóstico de SOP debe excluir la presencia de HAC NC y otras patologías endocrinas. Sin embargo, existen muchas similitudes clínicas y bioquímicas entre las dos entidades. Además, se han descrito 4 fenotipos que pueden ser resultado del SOP, pero en las adolescentes es preciso cumplir con los criterios clínicos, bioquímicos e imagenológicos. Por consiguiente, la búsqueda de morfología de ovarios poliquísticos (MOP) y la determinación de andrógenos es imprescindible para la confirmación diagnóstica. Cuando estos elementos se acompañan de valores de 17 OH Progesterona elevados, ya sea basal o posterior a estimulación con ACTH el diagnóstico de HAC se hace evidente. De manera inversa también tiene valor, en adolescentes con el diagnóstico de esta entidad ya establecido, la presencia de MOP es consecuencia del hiperandrogenismo ovárico. En las pacientes estudiadas más de la mitad mostró dicho patrón, resultado que concuerda con otros autores.21
En la muestra estudiada solo pudimos evaluar, en términos hormonales relacionados con la enfermedad, la testosterona y la 17 OH progesterona. Los valores obtenidos concuerdan con lo referido en la literatura, identificando ambas cifras como predictoras de una pubarquia precoz en aquellas pacientes que aún no presentaban esta característica de inicio de desarrollo puberal.
Armengaud y otros20 en un estudio con población pediátrica con pubarquia precoz identificó 3 predictores plasmáticos basales fuertemente asociados a D21OH-NC: un valor de 17OHP superior a 2 ng/ml, de androstendiona superior a 0,95 ng/ml y de testosterona por encima de 0,15 ng/ml (el valor predictivo de los 2 últimos no ha sido determinado estadísticamente).
Luego de la descripción detallada de la pubertad, se analizaron otros aspectos propios de la enfermedad que pudieron estar relacionados con las características puberales encontradas.
Las edades de presentación de los caracteres sexuales secundarios, en especial el vello pubiano, se relacionó de manera positiva con la edad de diagnóstico y de inicio del tratamiento. A menor dosis de esteroides empleada fue más temprana la menarquia, pudiera estar relacionado con niveles discretamente más elevados de andrógenos y con ello una aceleración de la maduración esquelética.
Conclusiones
En las pacientes estudiadas la pubertad tuvo una duración variable y se caracterizó por un inicio precoz de la pubarquia, seguido de telarquia y menarquia a las edades consideradas adecuadas para la población de origen.
Las irregularidades menstruales estuvieron presentes en un alto porcentaje de las pacientes, acompañadas de morfología de ovarios poliquísticos. No fueron frecuentes las alteraciones del volumen ni la duración del sangrado menstrual.
El diagnóstico oportuno y el ajuste cuidadoso del esquema esteroideo, constituyen pilares importantes en el inicio y progresión puberales, y en la consecución de ciclos ovulatorios regulares que aseguren desde la adolescencia, un inicio y desarrollo puberales normales y en edades reproductivas, la optimización de la fertilidad.